
Badanie ogólne moczu
Analityka ogólna i techniki pobierania materia
łu
Katedra Analityki Medycznej
Zak
ład Chemii Klinicznej
Iwona Bil-Lula
Ilościowa i półilościowa ocena osadu moczu.
Automatyzacja badania ogólnego moczu.
Ćwiczenie IV

ZASADA LICZENIA NA KOMORZE B
ϋRKERA
KOMORA
G
łębokość - 0,1 mm
Powierzchnia- 9 mm
2
Obj
ętość - 0,9 mm
3
d
ługość boku liczona pomiędzy
środkowymi liniami, lub zewnętrzną
potrójna lini
ą jednego boku i
wewn
ętrzną potrójną linię drugiego
boku.
SIATKA
9 du
żych kwadratów, oddzielonych od
siebie potrójn
ą linią;
1 du
ży kwadrat- powierzchnia – 1 mm
2
1 du
ży kwadrat zawiera 16 małych
1 ma
ły kwadrat :boki 0,2 mm x 0,2 mm
12 prostok
ątów o bokach 0,2 mm x
0,05 mm.
W celu ilo
ściowej oceny osadu moczu wg
Addisa nale
ży policzyć erytrocyty i
leukocyty na 15 ma
łych kwadratach
równomiernie roz
łożonych na siatce
(0,6 mm
2
) i wa
łeczki na 6 dużych
kwadratach (6 mm
2
).
W modyfikacji Hamburgera policzy
ć
erytrocyty, leukocyty i wa
łeczki na
powierzchni 1 mm
2
tzn. 1 du
żego
kwadrata.
Regu
ła 2 boków
Liczenie krwinek le
żących w polu liczonym i niedotykających linii siatki oraz krwinki dotykające linie 2 przyległych boków
(zarówno od strony wewn
ętrznej jak i zewnętrznej linii). Nie liczy się krwinek dotykających dwóch pozostałych boków.
BADANIE ILO
ŚCIOWE SKŁADNIKÓW OSADU
MOCZU
Ocena sk
ładników komórkowych i wałeczków w jednostce objętości lub czasu.
Wskazane w przypadkach w
ątpliwych klinicznie i w przewlekłych procesach
chorobowych dróg moczowych (ocena dynamiki procesu). Nie oznacza si
ę już rutynowo.
PRÓBA ADDISA
Zbiórka 12h moczu (ograniczona poda
ż płynów w dniu poprzedzającym badanie)
Mocz dok
ładnie wymieszać, zmierzyć objętość, przenieść do próbówki stożkowej objętość
odpowiadaj
ącą 12 min (1/60 porcji moczu);
Próbk
ę odwirować (400xg, 5 min)
P
łyn znad osadu odciągnąć pipetką, pozostawiając 0,5 ml
Osad wymiesza
ć z płynem (jednolita zawiesina)
Nape
łnić komorę Bürkera
Policzy
ć Ery i Leu (powierzchnia 0,6 mm
2
- 15 ma
łych kwadratów)
Policzy
ć wałeczki (powierzchnia 6 mm
2
- 6 du
żych kwadratów)
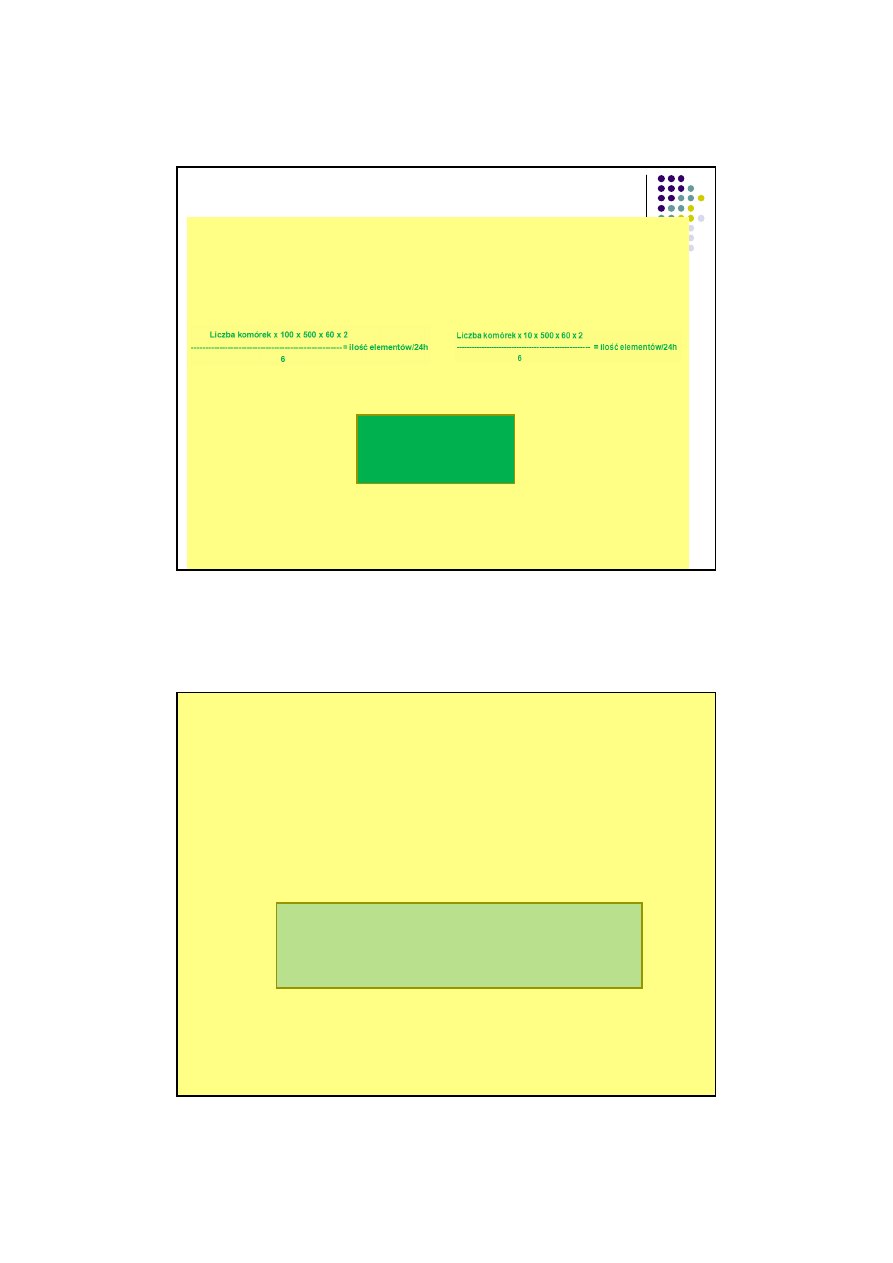
BADANIE ILO
ŚCIOWE SKŁADNIKÓW OSADU MOCZU
LICZBA ADDISA
(ilo
ść elementów wydalanych w jednostce czasu, 24h)
na podst. komory Burkera:
Liczba erytrocytów i leukocytów: Liczba wa
łeczków:
A x 10
6
A x 10
5
B
łąd: 7-15% (bardzo duży)
Odró
żnienie leukocytów od nabłonka nerkowego jest bardzo trudne, dlatego pod nazwą leukocyty
podaje si
ę łącznie leukocyty i nabłonki !!!
Badanie mo
żna przeprowadzić nas innej komorze np. Fucha-Rosentala (inne przeliczenia)
WARTO
ŚCI PRAWIDŁOWE
Ery<2 mln/24h
Leu (nab
łonki)<5 mln/24h
Wa
łeczki szkliste<10tyś/24h
Badanie ilo
ściowe składników osadu moczu
MODYFIKACJA HAMBURGERA:
(mocz do badania powinien mie
ć odczyn kwaśny, gęstość wzgl. 1,015 g/cm
3
,
bez z
łogów moczanów bezpostaciowych)
1)
Opró
żnić pęcherz moczowy (nie przyjmować płynów przez 12 h).
2)
Dokona
ć zbiórki 3 h moczu przedpołudniowego
3)
Mocz wymiesza
ć i zmierzyć objętość
4)
10 ml moczu odwirowa
ć (5 min, 400 x g)
5)
Usun
ąć supernatant pozostawiając 1 ml płynu
6)
Nape
łnić komorę jednolitą zawiesiną (komora Bϋrkera)
7)
Policzy
ć Ery, Leu, wałeczki w objętości 1 mm
3
WARTO
ŚCI PRAWIDŁOWE
Erytrocyty <1500/min (mikroskop
świetlny),
<3000/min (mikroskop k-f)
Leukocyty (nab
łonki)< 3000/min
A x 100 x Obj
ętość 3 h
Ilo
ść elementów/min= -----------------------------------------
180
AUTOMATYCZNA ANALIZA OSADU
MOCZU
Systemy automatycznej analizy próbek moczu stanowi
ą podstawowe narzędzie
rutynowej oceny próbek moczu w laboratoriach;
ZLETY
WADY
Lepsza powtarzalność i większa dokładność
wyników w
porównaniu z badaniem manualnym;
Krótszy czas analizy (większa przepustowość
lab.)
Mniejsza liczba personelu;
Standaryzacja badania;
Wysoki ko
ść utrzymania odpowiedniej jakości
badania;
Wysoki koszt aparatury
Analizatory automatyczne
Cyfrowa analiza obrazów mikroskopowych
Technika cytometrii przep
ływowej
Cyfrowa analiza obrazów
mikroskopowych
Mocz niewirowany
Wyniki wyra
żane jako liczba elementów w jednostce objętości lub w
polu widzenia (HPF/LPF)
Zalety:
Lepsza precyzja i znacznie mniejszy czas badania w porównaniu do
metod manualnych
Wady:
Brak mo
żliwości oceny elementów osadu w przypadku próbek o
du
żej zawartości drożdży, wałeczków, el. upostaciowionych lub
nieupostaciowionych
KONIECZNO
ŚĆ POTWIERDZENIA WYNIKU ZA POMOCĄ MANUALNEGO BADANIA
MIKROSKOPOWEGO!!!
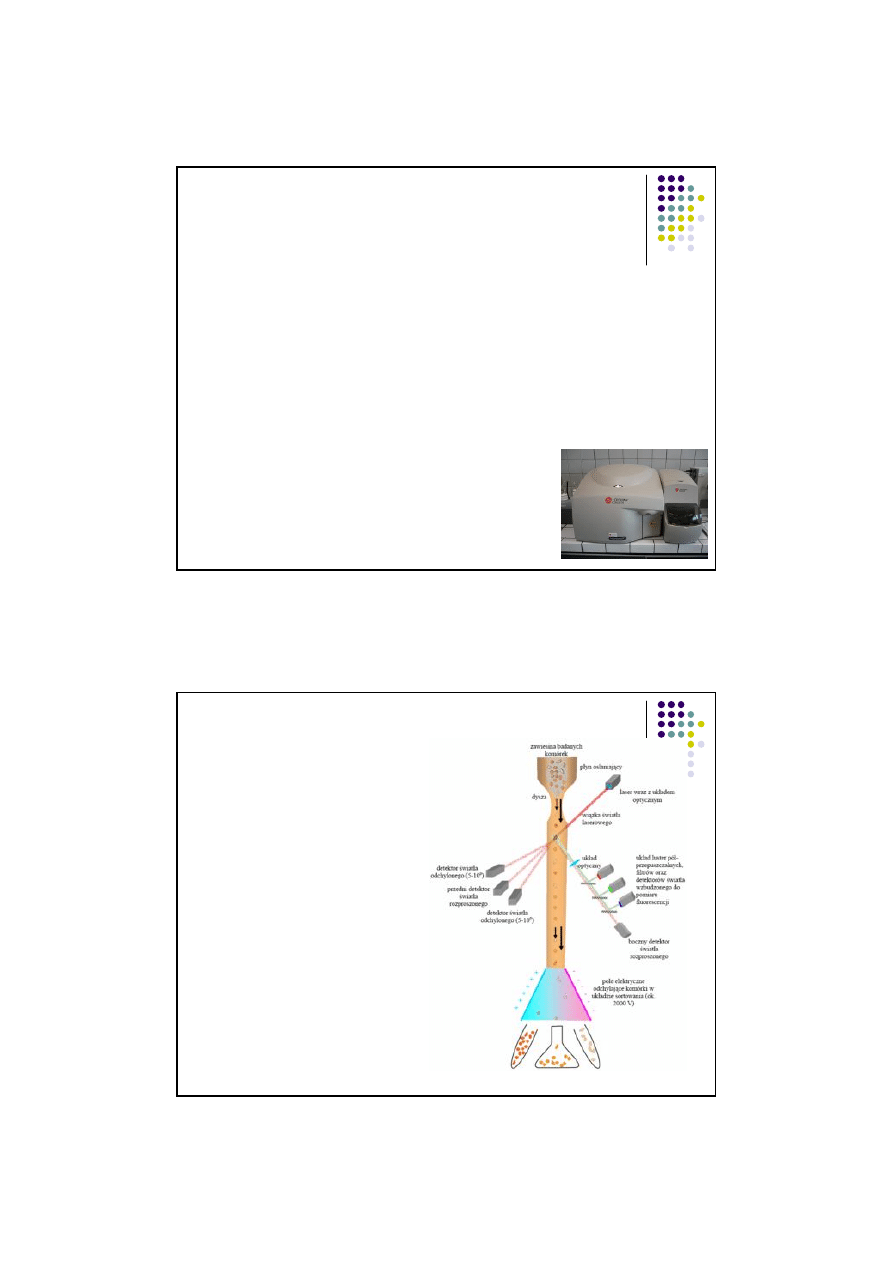
Cyfrowa analiza obrazów
mikroskopowych
►Składniki moczu są fotografowane w
p
łaskiej komorze przepływowej, która
ukierunkowuje i hamuje cz
ąsteczki
hemodynamicznie w p
łaszczyźnie
ogniskowej objektywu mikroskopu.
►Cyfrowa obróbka obrazu pozwala na
uchwycenie I analiz
ę 500 elementów próbki.
►Automatyczna klasyfikacja elementów
odbywa si
ę na podstawie: struktury,
kontrastu, wielko
ści i kształtu.
► Automatyczna fluorescencyjna
cytometria przep
ływowa, oparta na
technologii lasera diodowego w
po
łączeniu z hydrodynamicznym
ogniskowaniem.
► FS (rozmiar) i SS (powierzchnia,
z
łożoność wewnętrzna ) jest wykrywane
przez fotodiod
ę/.
► Intensywność fluorescencji informuje o
zawarto
ści kwasów nukleinowych.
► kolorowe skategramy, wartości liczbowe
(el/obj
ętość lub pw)
► Analiza mikroskopowa osadu moczu
► wirowanie moczu w kuwetce
prowadzi do utworzenia
pojedynczej warstwy
elementów w jednej p
łaszczyźnie
(tzw. monolayer)
►5-20 obrazy cyfrowe pod różnym
k
ątem w kuwetce
► automatyczne rozpoznanie i
klasyfikacja elementow na 14
grup
► wyniki pólilościowe

Cyfrowa analiza obrazów
mikroskopowych
porównanie analizatorów
IRIS iQ 200 Spirit
Sysmex UF 1000i
SediMax
Identyfikacja
elementów
Przepustowo
ść
Obj
ętość próbki
RBC, WBC, bakterie, wa
łeczki,
wa
łeczki hialinowe, kryształy, nabłonki
(p
łaskie i okrągłe), drożdże, zlepy
leukocytów, plemniki,
śluz
101/h
2 ml
RBC, WBC, nab
łonki,
wa
łeczki szkliste, wałeczki
patologiczne, bakterie,
dro
żdże, krysztaŁy,
plemniki,
śluz
80-100/h
4 lub 1 ml (modu
ł manualny)
RBC, WBC, wa
łeczki
hialinowe, wa
łeczki
patologiczne (10 typów),
nab
łonki, komórki
nienab
łonkowe, bakterie,
dro
żdże, śluz, plemniki,
paso
żyty, kryształy
80/h
0,2 ml
Cyfrowa analiza obrazów mikroskopowych-
porównanie badania manualnego i
automatycznego
ANALIZA AUTOMATYCZNA ANALIZA MANUALNA
*
Na podstawie kwestionariusz w 250 laboratoriach rutynowych w Wielkiej Brytanii [15].
Cytometria przep
ływowa
mocz
świeży, nie wirowany
próbki rozcie
ńczone i wybarwione fluorescencyjnie:
-
pomara
ńczowy barwnik fenantrynowy
(j
ądra komórkowe)
-
zielony barwnik karbocyjanowy
(b
łony komórkowe, jądrowe, mitochondria)
obj
ętość elementu morfotycznego (pomiar impedancji)
zabarwienie i zdolno
ść pochłaniania barwników (pomiar fluorescencji)
wielko
ść i kształt elementów morfotycznych oraz ich ziarnistości, jąder,
wtr
ętów (pomiar rozproszenia światła argonowego)
Cytometria przep
ływowa
Pozwala ró
żnicować:
-
erytrocyty
-
leukocyty (neutrofile)
-
nab
łonek płaski
-
nab
łonki okrągłe
-
wa
łeczki ziarniste
-
wa
łeczki szkliste
-
bakterie
-
dro
żdże
-
moczany
-
szczawiany
-
fosforany
-
itp..
Dostarcza informacji o :
-
dysmorfii erytrocytów
-
przewodno
ści moczu przed
rozcie
ńczeniem („osmolalność”)
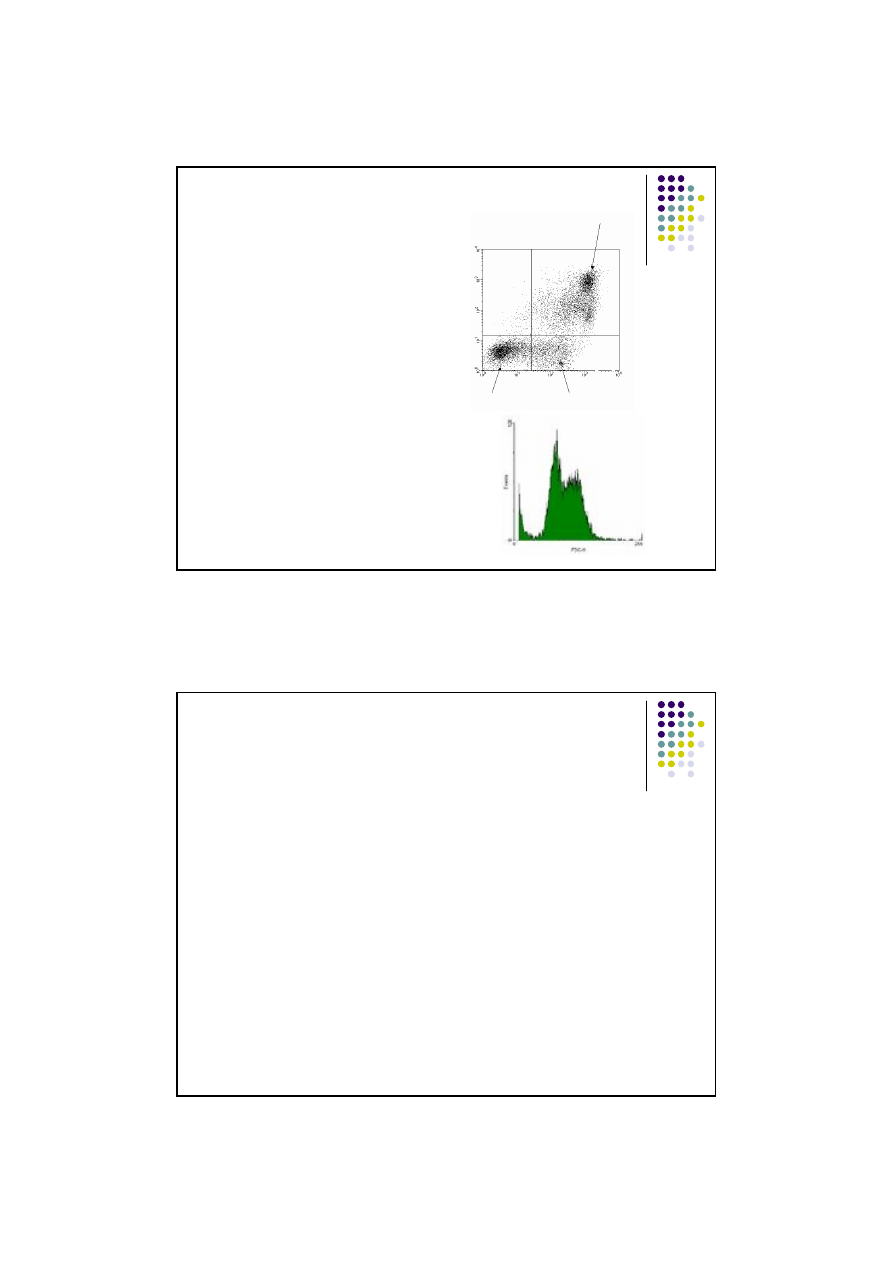
Cytometria przep
ływowa
Wyniki w µl/wpw
skategramy i histogramy
materia
ły kontrolne
krótki czas badania
dobra powtarzalno
ść ,
dok
ładność, liniowość
ró
żnicowanie erytrocyturii
k
łębuszkowej i
pozak
łębuszkowej
OGRANICZENIA:
- ograniczenia techniczne zwi
ązane z
elementami atypowymi;
- ograniczenia zwi
ązane z obecnością
elementów > 40 000/
μl (obniżona dokładność)
- interferencja plemników, bakterii, kom.
dro
żdżopodobnych (liczenie leukocytów i
erytrocytów)
Pi
śmiennistwo
1.
Althof S, Kindler J. Atlas osadu moczu. Techniki badawcze i interpretacja wyników. Mantur M
(red.). Sapota, Wroc
ław, 2005.
2.
Ćwiklińska A, Parra MC, Kortas-Stempak B i wsp. Rutynowe badanie osadu moczu- możliwość
poprawy jako
ści wyników poprzez wdrożenie standaryzowanej procedury badania. Diagnostyka
Laboratoryjna. 2009, 45 (3),219-229.
3.
NCCLM. Urinalysis and collection, transportation and preservation of urine specimens. Approved
guideline. 2nd edition. GP-16A2. 2001.
4.
SIMERVILLE JA, WILLIAM MD et al. Urinalysis: A Comprehensive Review. Am Fam Physician
2005;71:1153-62.
5.
Fogazzi GB. The urinary sediment. An integrated view. 3-rd edition. Elsevier, Italy, 2010.
6.
a
7.
Solnica B., Gernand W. Automatyzacja badania osadu moczu. Nefrol. Dial. Pol. 2007, 11, 26-29
8.
Pawelski S, Maj S. Normy i diagnostyka chorób wewn
ętrznych. PZWL, 1993.
9.
Tomaszewski J. Diagnostyka laboratoryjna, PZWL, 1997.
10.
Uropean urinalysis guidelines. ECLM. Scand J Clin lab Invest, 2000, 60: 1-96.
11.
Wojtysiak-Duma B. Mocz jako materia
ł do badan laboratoryjnych. Diagnosta Laboratoryjny, 2011,
22:12-13.
12.
Brunzel NA. Diagnostyka laboratoryjna. Nerka i badania laboratoryjne moczu. Elsevier U&P,
Wroc
ław, 2010
13.
Dembi
ńska-Kieć A. Naskalski P.
14.
NHS. Automated urine sreening systems. Evaluation report. CEP 10031. NHS, 2010.
Wyszukiwarka
Podobne podstrony:
Badanie ogólne moczu ćw I
MATERIALY DO WYKLADU CZ IV id Nieznany
chemia kliniczna cw 1 2011 id Nieznany
GW Redukcje graw (sem IV) id 1 Nieznany
Badanie ogólne moczu
BADANIE OGÓLNE MOCZU
GW Zjawiska plywowe (sem IV) id Nieznany
Badanie ogólne moczu
Pracownia Fizyki KFS Cw 15 id 3 Nieznany
Badania ogólne moczu, Ratownicto Medyczne, medyczne czynności ratunkowe, Badania laboratoryjne
cwiczenie-5-Badanie-ogolne-moczu-2, Nauka, Analityka
Prelekcja z badania ogólnego moczu by dr Francuz 2009
Badania ogólne moczu, interpretacja [tabela]
Interpretacja podstawowych badankrwi i badania ogólnego moczu, Szkoła, III rok, interna głównie ''P
Interpretacja podstawowych badań krwi i badania ogólnego moczu
automatyka zadania cw 1 cz 1 id Nieznany
więcej podobnych podstron