
EKOFIZJOLOGIA MIKROORGANIZMÓW WODNYCH
1
D
D
Y
Y
N
N
A
A
M
M
I
I
K
K
A
A
W
W
Y
Y
B
B
R
R
A
A
N
N
Y
Y
C
C
H
H
P
P
R
R
O
O
C
C
E
E
S
S
Ó
Ó
W
W
M
M
I
I
K
K
R
R
O
O
B
B
I
I
O
O
L
L
O
O
G
G
I
I
C
C
Z
Z
N
N
Y
Y
C
C
H
H
I
I
W
W
Ł
Ł
A
A
Ś
Ś
C
C
I
I
W
W
O
O
Ś
Ś
C
C
I
I
F
F
I
I
Z
Z
Y
Y
K
K
O
O
-
-
C
C
H
H
E
E
M
M
I
I
C
C
Z
Z
N
N
Y
Y
C
C
H
H
W
W
O
O
D
D
Y
Y
W
W
J
J
E
E
Z
Z
I
I
O
O
R
R
Z
Z
E
E
M
M
I
I
K
K
O
O
Ł
Ł
A
A
J
J
S
S
K
K
I
I
M
M
Z
Z
M
M
I
I
A
A
N
N
Y
Y
P
P
R
R
Z
Z
E
E
S
S
T
T
R
R
Z
Z
E
E
N
N
N
N
E
E
I
I
C
C
Z
Z
A
A
S
S
O
O
W
W
E
E
I
I
I
I
I
I
.
.
A
A
k
k
t
t
y
y
w
w
n
n
o
o
ś
ś
ć
ć
e
e
n
n
z
z
y
y
m
m
a
a
t
t
y
y
c
c
z
z
n
n
a
a
m
m
i
i
k
k
r
r
o
o
p
p
l
l
a
a
n
n
k
k
t
t
o
o
n
n
u
u
Ć
Ć
W
W
I
I
C
C
Z
Z
E
E
N
N
I
I
A
A
Mikołajki: 10 – 20 czerwiec 2007

2
EKOFIZJOLOGIA MIKROORGANIZMÓW WODNYCH
D
D
Y
Y
N
N
A
A
M
M
I
I
K
K
A
A
W
W
Y
Y
B
B
R
R
A
A
N
N
Y
Y
C
C
H
H
P
P
R
R
O
O
C
C
E
E
S
S
Ó
Ó
W
W
M
M
I
I
K
K
R
R
O
O
B
B
I
I
O
O
L
L
O
O
G
G
I
I
C
C
Z
Z
N
N
Y
Y
C
C
H
H
I
I
W
W
Ł
Ł
A
A
Ś
Ś
C
C
I
I
W
W
O
O
Ś
Ś
C
C
I
I
F
F
I
I
Z
Z
Y
Y
K
K
O
O
-
-
C
C
H
H
E
E
M
M
I
I
C
C
Z
Z
N
N
Y
Y
C
C
H
H
W
W
O
O
D
D
Y
Y
W
W
J
J
E
E
Z
Z
I
I
O
O
R
R
Z
Z
E
E
M
M
I
I
K
K
O
O
Ł
Ł
A
A
J
J
S
S
K
K
I
I
M
M
Z
Z
M
M
I
I
A
A
N
N
Y
Y
P
P
R
R
Z
Z
E
E
S
S
T
T
R
R
Z
Z
E
E
N
N
N
N
E
E
I
I
C
C
Z
Z
A
A
S
S
O
O
W
W
E
E
A
A
k
k
t
t
y
y
w
w
n
n
o
o
ś
ś
ć
ć
e
e
n
n
z
z
y
y
m
m
a
a
t
t
y
y
c
c
z
z
n
n
a
a
m
m
i
i
k
k
r
r
o
o
p
p
l
l
a
a
n
n
k
k
t
t
o
o
n
n
u
u
N
N
i
i
n
n
i
i
e
e
j
j
s
s
z
z
y
y
p
p
r
r
o
o
g
g
r
r
a
a
m
m
i
i
o
o
p
p
i
i
s
s
m
m
e
e
t
t
o
o
d
d
o
o
p
p
r
r
a
a
c
c
o
o
w
w
a
a
l
l
i
i
:
:
D
D
r
r
h
h
a
a
b
b
.
.
W
W
a
a
l
l
d
d
e
e
m
m
a
a
r
r
S
S
i
i
u
u
d
d
a
a
P
P
r
r
o
o
f
f
.
.
d
d
r
r
h
h
a
a
b
b
.
.
R
R
y
y
s
s
z
z
a
a
r
r
d
d
J
J
.
.
C
C
h
h
r
r
ó
ó
s
s
t
t
Prowadzący
ćwiczenia:
Prowadzący ćwiczenia:
Dr hab. Waldemar Siuda
Zakład Ekologii Mikroorganizmów
Instytut Mikrobiologii, Uniwersytet Warszawski
Warszawa 2007
3
W
W
p
p
r
r
o
o
w
w
a
a
d
d
z
z
e
e
n
n
i
i
e
e
Jezioro Mikołajskie jest środkową częścią kilkudziesięciokilometrowej rynny jeziorowej,
ciągnącej się z południa na północ, leży na obrzeżach Puszczy Piskiej, w sąsiedztwie Mazurskiego
Parku Krajobrazowego.
Mikołajskie od południa łączy się z Bełdanami, od południowego wschodu przez cieśninę
przy Dybowskim Rogu ze Śniardwami, północną granicą jeziora są mosty w Mikołajkach – za nimi
jezioro Tałty. Na plosie jeziora położone są trzy małe wyspy – dwie na pograniczu z Bełdanami,
trzecia (sztuczna, usypana w latach trzydziestych ub. stulecia) u północnych krańców zbiornika.
Linia brzegowa miernie rozwinięta, brzegi przeważnie wysokie i strome, zachodnie
zalesione (Puszcza Piska), północne i część wschodnich zajmują zabudowania Mikołajek, dalej ku
południowi brzegi wschodnie sa niskie, bezleśne, miejscami podmokłe, z łąkami i polami.
Roślinność jeziorowa dosyć skąpa. Makrofity
wynurzone, reprezentowa-ne przez trzcinę,
porastają wąskim, poprzerywanym pasem brzegi
zachodnie i południową część wschodnich.
Makrofity zanurzone również ubogie, choć
urozmaicone: moczarka, wywłócznik, rogatek,
ramienice, rdestnice, tworzą większe skupiska u
wschodnich brzegów.
Jezioro Mikołajskie
Gmina
Mikołajki
Dorzecze
Pisa – Narew - Wisła
Wysokość npm
116,1 m
Powierzchnia jeziora
497,7 ha
Powierzchnia wysp
1,3 ha
Głębokość maksymalna
25,9 m
Głębokość średnia
11,2 m
Długość maksymalna
5,75 km
Szerokość maksymalna
1,6 km
Długość linii
brzegowej
15,1 km
Jezioro Mikołajskie, przed laty sielawowe, obecnie
silnie zeutrofizowane. W pogłowiu ryb dominują
leszcze, sandacze, szczupaki, okonie, niewiele
węgorzy.
Na
północno-wschodnim i zachodnim brzegu jeziora Mikołajskiego położone jest miasto
Mikołajki (ok. 5,500 mieszkańców), obecnie centrum wypoczynku, żeglarstwa i sportów wodnych
na szlaku Wielkich Jezior Mazurskich, którego szczególnie dynamiczny rozwój i rozbudowa
nastąpiły w latach 90-tych ub. stulecia.
Ścieki komunalne z miasta Mikołajki podlegają procesowi oczyszczania metodą osadu
czynnego w dwustopniowej oczyszczalni biologicznej. W wyniku oczyszczania ze ścieków
usuwane są przede wszystkim zanieczyszczenia organiczne w procesie biologicznego utlenienia,
którego produktami końcowymi jest wiele związków mineralnych (m.in. eutrofogenne biogeny
azotu i fosforu). Ścieki oczyszczone odprowadzane są z oczyszczalni do zatoki w południowej
części jeziora Tałty. Zgodnie z kierunkiem przepływu wody południowej części Wielkich Jezior
Mazurskich (północ − południe) ścieki oczyszczone z zatoki jeziora Tałty przemieszczać się mogą
do północnej części jeziora Mikołajskiego i dalej wzdłuż wschodniego jego brzegu w kierunku
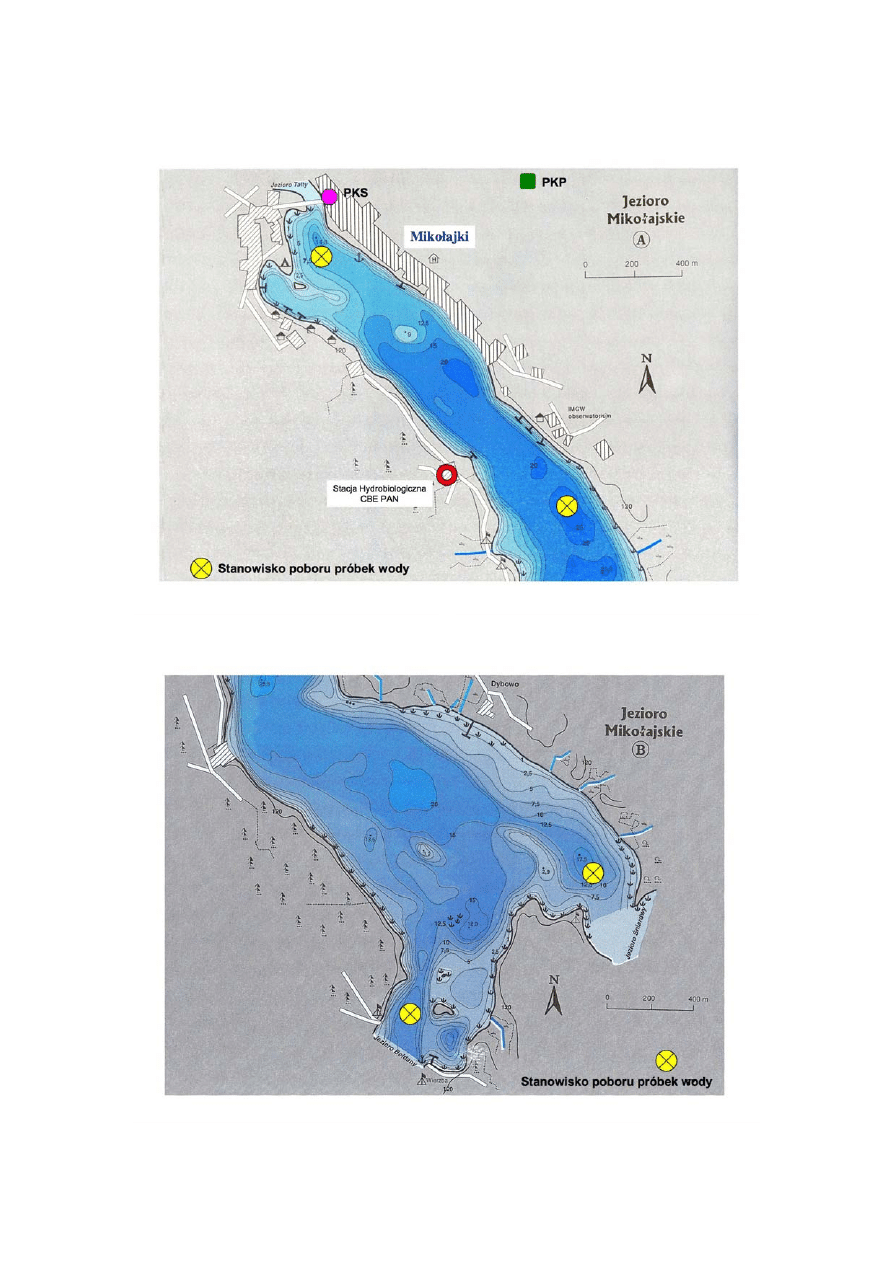
jeziora Śniardwy (Rys. 1 A, B).
4
P
P
l
l
a
a
n
n
y
y
j
j
e
e
z
z
i
i
o
o
r
r
a
a
i
i
m
m
i
i
a
a
s
s
t
t
a
a
Rys. 1 A. Północna połowa jeziora Mikołajskiego
Rys. 1 B. Południowa połowa jeziora Mikołajskiego
Stacja Hydrobiologiczna
CBE PAN
5

6
C
C
e
e
l
l
ć
ć
w
w
i
i
c
c
z
z
e
e
ń
ń
Celem ćwiczeń jest zbadanie dynamiki różnorodności zmian przestrzennych
(horyzontalnych, wertykalnych) i czasowych wybranych właściwości mikrobiologicznych
(fitoplankton, bakterioplankton, heterotroficzne nanowiciowce) i parametrów fizyczno-
chemicznych środowiska wodnego jeziora Mikołajskiego.
W celu zbadania
dynamiki i różnorodności zmian horyzontalnych
próbki wody
powierzchniowej pobrane zostaną z 4 stanowisk z jeziora:
1. stanowisko − północna część jeziora, dopływ wód z jeziora Tałty
2. stanowisko − jez. Mikołajskie, ploso, część centralna jeziora
3. stanowisko − jez. Mikołajskie, wypływ do jeziora Śniardwy
4. stanowisko − jez. Mikołajskie, wypływ do jeziora Bełdany
Wertykalna dynamika zmian zmian i różnorodność:
próbki wody pobrane zostaną w
miejscu o największej głębokości jeziora (głęboczek) w centralnej jego części z trzech warstw
kolumny wody:
1. warstwa fotyczna
2. górna warstwa profundalu
3. warstwa wody przydennej (1 m nad dnem)
Dynamika zmian czasowych:
próbki wody pobrane zostaną w miejscu największej
głębokości jeziora (głęboczek) z dwóch warstw kolumny wody: warstwa powierzchniowa (0-1 m)
oraz przydenna (1 m nad dnem) o różnej porze doby:
1. godz. 6:00
2. godz. 12:00
3. godz. 18:00
We wszystkich pobranych próbkach wody oznaczone zostanie szereg analiz ilościowych i
jakościowych głównych komponentów tworzących mikrobiocenozy jeziorne, zmierzone zostaną
także wybrane procesy aktywności enzymatycznej. Ponadto bezpośrednio w jeziorze określone
zostaną wartości wybranych parametrów fizyko-chemicznych wody in situ (tlen, temperatura,
przewodnictwo elektrochemiczne, pH, mętność wody, autofluorescencja, natężenie światła,
zawartość chlorofilu
a
).
Na
zakończenie zajęć eksperymentalnych poszczególne zespoły badawcze przedstawią (w
formie prezentacji komputerowej Power-Point) wyniki pomiarów i analiz próbek wody, podadzą
ich interpretację wraz z przedstawieniem wniosków finalnych i podsumowaniem literaturowym.

7
P
P
l
l
a
a
n
n
z
z
a
a
j
j
ę
ę
ć
ć
G
G
G
R
R
R
U
U
U
P
P
P
A
A
A
1
1
1
Czerwiec (10 − 15)
Treść zajęć
Niedziela
15
00
− 19
00
− przyjazd, zakwaterowanie
19
30
− zebranie informacyjne
Poniedziałek
9
00
− 13
00
− zajęcia
15
00
> zajęcia
Wtorek
9
00
− 13
00
− zajęcia
15
00
> zajęcia
Środa
9
00
− 13
00
− zajęcia
15
00
> zajęcia
Czwartek
9
00
− 13
00
− zajęcia
15
00
>
opracowanie wyników,
przygotowanie seminarium
Piątek
9
00
− 11
00
−
SEMINARIUM
11
00
− 12
00
− wyjazd ze Stacji
Każdego dnia pomiędzy 13
00
− 15
00
− przerwa obiadowa
8
P
P
l
l
a
a
n
n
z
z
a
a
j
j
ę
ę
ć
ć
G
G
G
R
R
R
U
U
U
P
P
P
A
A
A
2
2
2
Czerwiec (15 − 20)
Treść zajęć
Piątek
15
00
− 19
00
− przyjazd, zakwaterowanie
19
30
− zebranie informacyjne
Sobota
9
00
− 13
00
− zajęcia
15
00
> zajęcia
Niedziela
9
00
− 13
00
− zajęcia
15
00
> zajęcia
Poniedziałek
9
00
− 13
00
− zajęcia
15
00
> zajęcia
Wtorek
9
00
− 13
00
− zajęcia
15
00
>
opracowanie wyników,
przygotowanie seminarium
Środa
9
00
− 11
00
−
SEMINARIUM
11
00
− 12
00
− wyjazd ze Stacji
Każdego dnia pomiędzy 13
00
− 15
00
− przerwa obiadowa

9
Aktywność enzymatyczna
mikroplanktonu
Uwagi ogólne
Aktywność ektoenzymów (m. inn. fosfatazy alkalicznej, aminopeptydazy,
β- i
α-glukozydazy, N-acetylo-glukozaminazy),
enzymów pozakomórkowych (extracellular
enzymes) oraz niektórych enzymów wewnątrzkomórkowych (m. inn. esterazy i
ureazy) jest, obok szybkości produkcji pierwotnej i wtórnej oraz tempa respiracji,
jednym z podstawowych parametrów charakteryzujących aktywność metaboliczną
mikroplanktonu.
Eksperymentalne określenie aktywności enzymu w wodzie polega na dodaniu
do badanej próbki jednego ze standardowych substratów enzymatycznych i pomiarze
tempa przyrostu w niej stężenia barwnego lub fluoryzującego produktu reakcji
uwalnianego przez badany enzym. Jednakże ze względu na dużą zmienność
fizykochemicznych i biologicznych naturalnych środowisk wodnych, ilości i jakości
enzymów wytwarzanych przez mikroorganizmy wodne, a także na nie zawsze
określone podobieństwo substratu standardowego do substratów naturalnych pomiar
rzeczywistej aktywności określonego enzymu in situ jest niezwykle trudny a czasem
wręcz niewykonalny. Dlatego też w badaniach ekofizjologicznych rutynowo określa
się przede wszystkim tzw. potencjalną aktywność maksymalną enzymu (V
max
).
Wartość ta charakteryzuje maksymalną aktywność enzymu w badanej próbce wody
w określonych warunkach pomiaru i przy całkowitym wysyceniu substratem
dodanym do badanej próbki centrum aktywnych enzymu.
Stężenie substratu wysycające badany enzym w badanej próbce wody jest
zwykle nieznane. Jego doświadczalne wyznaczenie, a przynajmniej oszacowanie, jest
warunkiem koniecznym dla ustalenia prawidłowych warunków pomiaru V
max
.
Zarówno ilość i jakość enzymu jak również pula jego naturalnych substratów

10
podlegają w środowiskach wodnych ciąłym i dynamicznym zmianom. Dlatego też
stężenie substratu konieczne do wysycenia badanego enzymu w próbkach pobranych
z różnych środowisk rzadko bywa podobne. W krańcowych przypadkach, może
wahać się ono nawet o rząd wielkości. W praktyce więc zbyt mała (niewysycająca)
ilość substratu dodanego do badanych próbek przed pomiarem zaniża w sposób
istotny wartość V
max
, zaś duży jego nadmiar może czasami znacząco hamować
aktywność niektórych enzymów.
Dokładne doświadczalne wyznaczenie stężenia standardowego substratu
wysycającego badany enzym umożliwia procedura opisana w rozdziale “Kinetyka
reakcji enzymatycznej”.
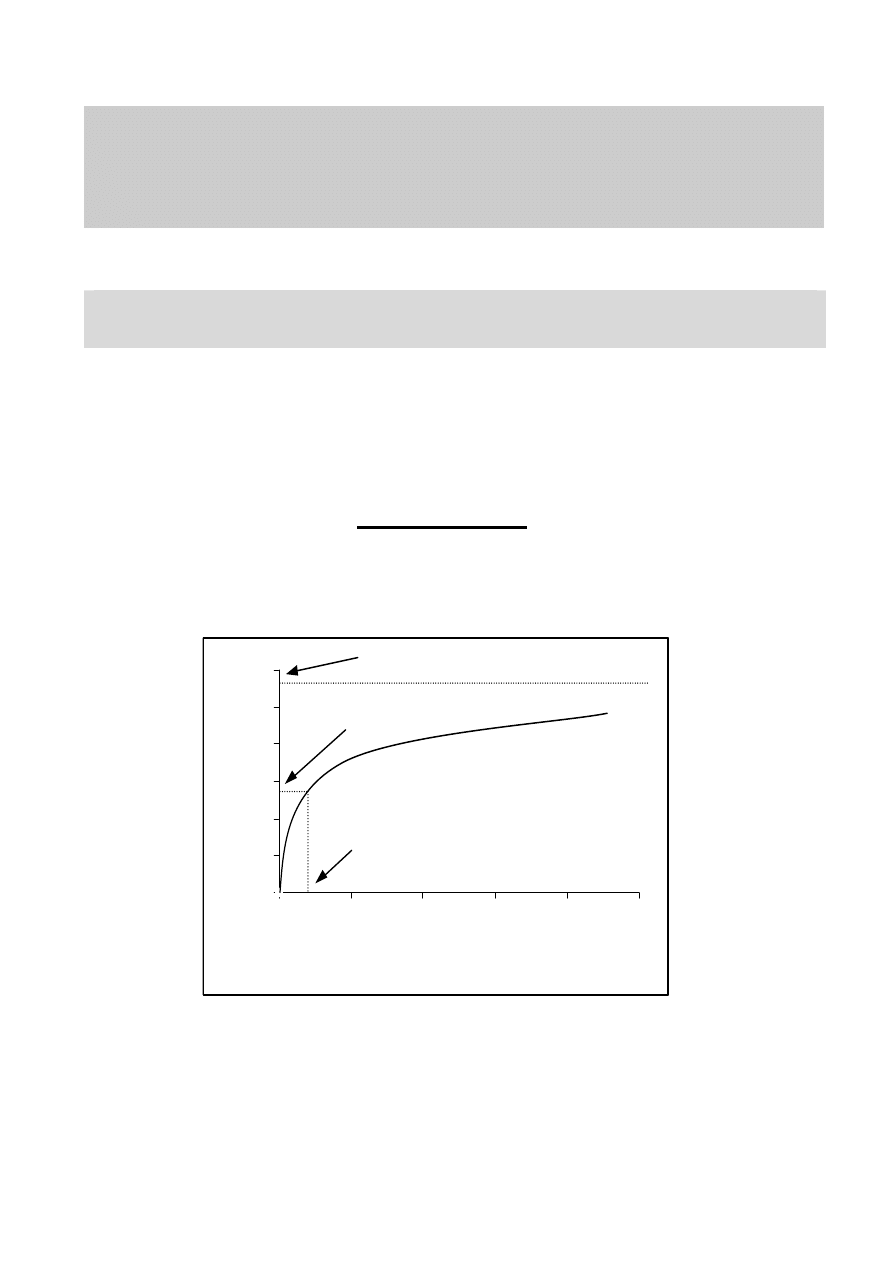
Kinetyka reakcji enzymatycznej
Uwagi ogólne
Zasada pomiaru
Szybkość rozkładu enzymatycznego substratów przez większość enzymów
hydrolitycznych (np. fosfatazy, aminopeptydazy, itp) opisuje równanie Michaelis’a-
Menten:
Vmax x [S]
V =
Km + [S]
Zależność opisaną wzorem obrazuje wykres przedstawiony na Rys. 1.
0
10
20
30
40
50
60
0
50
100
150
200
250
[s] (µmol/L)
v
(
nm
ol
/L/
godz
)
1/2 Vmax
Vmax
Km
Rys. 1. Zależność szybkości reakcji enzymatycznej od stężenia substratu.
v =
szybkość reakcji
11

12
V
max
= szybkość maksymalna reakcji zachodząca kiedy wszystkie centra
aktywne enzymu zostały wysycone substratem. V
max
zależy of ilości i
aktywności enzymu w badanych próbkach.
K
m
= stężenie substratu, przy którym zachodzi połowiczna szybkość
maksymalna reakcji (1/2 V
max
). K
m
charakteryzuje powinowactwo
enzymu do substratu (im mniejsza wartośc tym większe
powinowactwo). K
m
nie zależy od ilości badanego enzymu w próbce;
na jego wartość może wpływać szereg warunków fizykochemicznych
środowiska reakcji enzymatycznej (np. obecność stymulatorów i/lub
inhibitorów enzymu)
[S] = stężenie substratu enzymatycznego
Parametry charakteryzujące powyższe równanie wylicza się na podstawie określonej
eksperymentalnie zależności szybkości reakcji enzymatycznej (v) od stężenia
substratu [S] dodanego do badanych próbek.

13
Aktywność L-Leucyno-Aminopeptydazy
Zasada oznaczania
Aktywność L-leucyno-aminopeptydazy może zostać określona z wykorzystaniem
sztucznego substratu L-leucyny-7-amido-4-metylkumaryny (LAMK), którego
hydroliza przez aminopeptydazę prowadzi do uwolnienia silnie fluorescencyjnego
rodnika 7-amino-metylkumaryny (AMK). Fluorescencję mierzy się przy ekscytacji
380 nm i emisji 440 nm.
L-Leucyno-7-amido-4-metylkumaryna + AMP => L-leucyna + 7-amino-metylkumaryna
(silnie fluorescencyjna)
Odczynniki
1.
2.
3.
Substrat: L-Leucyna-7-amido-4-metylkumaryna (LAMK; m.cz. 324.8)
Produkt reakcji: 7-amino-metylkumaryna (AMK; m.cz. 175.2)
Eter glikolu etylenowego (Cellosolve)
Przygotowanie odczynników i roztworów
1. Standard 10 nM AMK
Rozpuścić 17.52 mg AMK w 10 ml Cellosolve.
2. Roztwór substratu LAMK
Odważyć 16.240 mg L-leucyno-7-amido-4-metylkumaryny i w kolbce 25 ml
rozpuścić w alkoholu etylowym, dopełnić do kreski. 1 ml tak przyrządzonego
roztworu zawiera 2 µM substratu. Po dodaniu 0.1ml tego roztworu do 3.9 ml
próbki finalna koncentracja będzie 50 µM.

14
Oznaczenie
Kalibracja
Roztwory kalibracyjne sporządza się dodając do 3.9 ml wody destylowanej 0.1 ml
odpowiedniego stężenia AMK w eterze glikolu etylenowego (Cellosolve) tak aby
ostatecznie uzyskać stężenia 0.5, 1.0, 2.5, 5, 10, 20, 50, 100, 200 nM. Roztwór
wyjściowy 2 mM.
Próbki wody
Należy przygotować serię 7-9 probówek i napełnić je 3.9 ml badanej wody. Przy
spektrofluorymetrze, z timerem w ręku, dodawać do kolejnych probówek po 0.1 ml
kolejnych stężeń (LAMK) tak aby uzyskać ostateczne stężenia substratu w próbkach
wynosiły 0.25, 0.5, 1.0, 2.0, 3.0, 5.0, 7.5, 10.0, 12.5, 15.0 µM. Po dodaniu
substratu natychmiast wymieszać i mierzyć fluorescencję (ekscytacja 336, emisja
444 nm) w czasie T
0
(Fp). Po 20 - 90 min. inkubacji w ciemności, z timerem w ręku
mierzyć fluorescencję próbek ponownie (Fb). Wyniki podać jako przyrost stężenia
AMK/godz.
Blank
Blank stanowi fluorescencja AMK (Fb) w badanych próbkach wody, w czasie T
0
inkubacji.
Obliczenia
Aktywność aminopeptydazy przy określonym stężeniu substratu (v)wyliczyć wg

wzoru:
F
p
F
b
a, b
t
= fluorescencja próbki badanej po inkubacji
= fluorescencja próbki badanej w czasie T
0
inkubacji
= współczynniki równania regresji liniowej fluorescencji r-rów
kalibracyjnych
AMP (nmol/l/godz) =
[(Fp – Fb) – b ] x 60
a x t
= czas inkubacji (min)
Ponieważ zależność szybkości reakcji enzymatycznej od stężenia substratu w
badanych próbkach wody ma charakter funkcji hiperboli, aby wyliczyć V
max
i K
m
analizuje się równanie regresji nieliniowej zależności v od [S] stosując odpowiedni
program komputerowy (np. Enzfitter, Biosoft). Na podstawie parametrów (V
max
i K
m
)
charakteryzujących kinetykę enzymatycznej hydrolizy badanych związków
organicznych wylicza się czas potrzebny do całkowitego ich rozkładu w próbkach
wody, tzw. "turnover time" (T
t
):
T
t
= K
m
/V
max
Parametry kinetyczne hydrolizy LAMK przez aminopeptydazę (K
m
+S
n
oraz V
max
)
mogą zostać określone np. metodą „direct plot” z użyciem programu
komputerowego Enzpack (Biosoft, UK).
15

Aktywność alkalicznej fosfatazy (APA)
Zasada oznaczenia
Fosfataza alkaliczna (APA; fosfohydrolaza monoestrów fosforowych; E.C. 3.1.3.1.)
reagując z susbtratem sztucznym fosforanem 4-metylumbelliferonu (MUFP)
powoduje jego hydrolizę enzymatyczną uwolniając do środowiska reakcji silnie
fluorescencyjny rodnik (7-metylumbelliferon), którego fluorescencjê mierzy się
fluorometrycznie (ekscytacja 365 nm, emisja 460 nm) w środowisku alkalicznym (pH
= 10,2).
APA
4-metylumbelliferyl-PO
4
3-
+ H
2
O 4-metylumbelliferon + PO
4
3-
(nie fluorescencyjny) H
2
0 (silnie fluorescencyjny)
Odczynniki
1. Substrat: 4-metylumbelliferyl-PO
4
3-
(MUFP; m.cz. 300.1)
2. Produkt reakcji: 4-metylumbelliferon (MUF; m.cz. 194.2)
3. Eter glikolu etylenowego (Cellosolve)
Przygotowanie odczynników i roztworów
1. Roztwór substratu 0,4 mM MUFP
16

17
Rozpuścić 24 mg MUFP w 1-2 ml Cellosolve, po całkowitym rozpuszczeniu
roztwór uzupełnić woda destylowaną do objętości końcowej 20 ml.
Uzyskany roztwór rozcieńczyć 10x wodą destylowaną. 1ml tak uzyskanego r-ru
„roboczego” zawiera 0,4 µmol MUFP, i po dodaniu 0.1 ml tegoż roztworu do
badanej próbki finalne stężenie MUFP w badanej próbce będzie 10.0 µM.
Przygotowany roztwór roboczy, rozcieńczony wodą dejonizowaną użyć do
sporządzenia pozostałych roztworów „roboczych” substratu.
2. Standard 20 µM MUF
Rozpuścić 19.4 mg MUF w 10 ml Cellosolve. Rozcieńczyć 5 00x (100x a
nastepnie 5x) wodą dejonizowaną. 1 ml tak przygotowanego roztworu zawiera 20
µmol MUF.
Oznaczenie
Kalibracja
Roztwory kalibracyjne sporządza się dodając do 3.9 ml wody destylowanej 0.1 ml
odpowiedniego stężenia rozcieńczonego woda destylowaną standardu MUF tak, aby
ostatecznie uzyskać stężenia 0.5, 1.0, 2.5, 5, 10, 20, 50, 100, 500 nM.
Próbki wody
Należy przygotować serię 7-9 probówek i napełnić je 3.9 ml badanej wody. Przy
spektrofluorymetrze, z timerem w ręku, każdą z probówek uzupełnić 0.1 ml
kolejnego roztworu „roboczego” MUFP tak aby ostateczne stężenia substratu w
próbkach wynosiły 0.1 0.25, 0.5, 1.0, 2.0, 3.0, 5.0, 7.5, 10.0, µM.
Po dodaniu substratu każdą z próbek natychmiast wymieszać i zmierzyć
fluorescencję (ekscytacja 365, emisja 460 nm) w czasie T
0
(Fb). Po 0.30 - 60 min.
inkubacji w ciemności, z timerem w ręku mierzyć fluorescencję próbek ponownie
(F
p
). Wyniki podać jako przyrost stężenia MUF/godz.

18
Blank
Blank stanowi fluorescencja MUF (Fb) w badanych próbkach wody, w czasie T
0
inkubacji.
Obliczenia
F
p
F
b
a, b
t
= fluorescencja próbki badanej po inkubacji
= fluorescencja próbki kontrolnej po inkubacji
= współczynniki równania regresji liniowej fluorescencji r-rów
kalibracyjnych
= czas inkubacji (min)
Szybkość reakcji enzymatycznej przy określonym stęzeniu substratu (v) oraz parametry kinetyczne
hydrolizy MUFP przez APA (K
m
+S
n
,V
max
oraz T
t
) określić analogicznie jak w przypadku AMP.
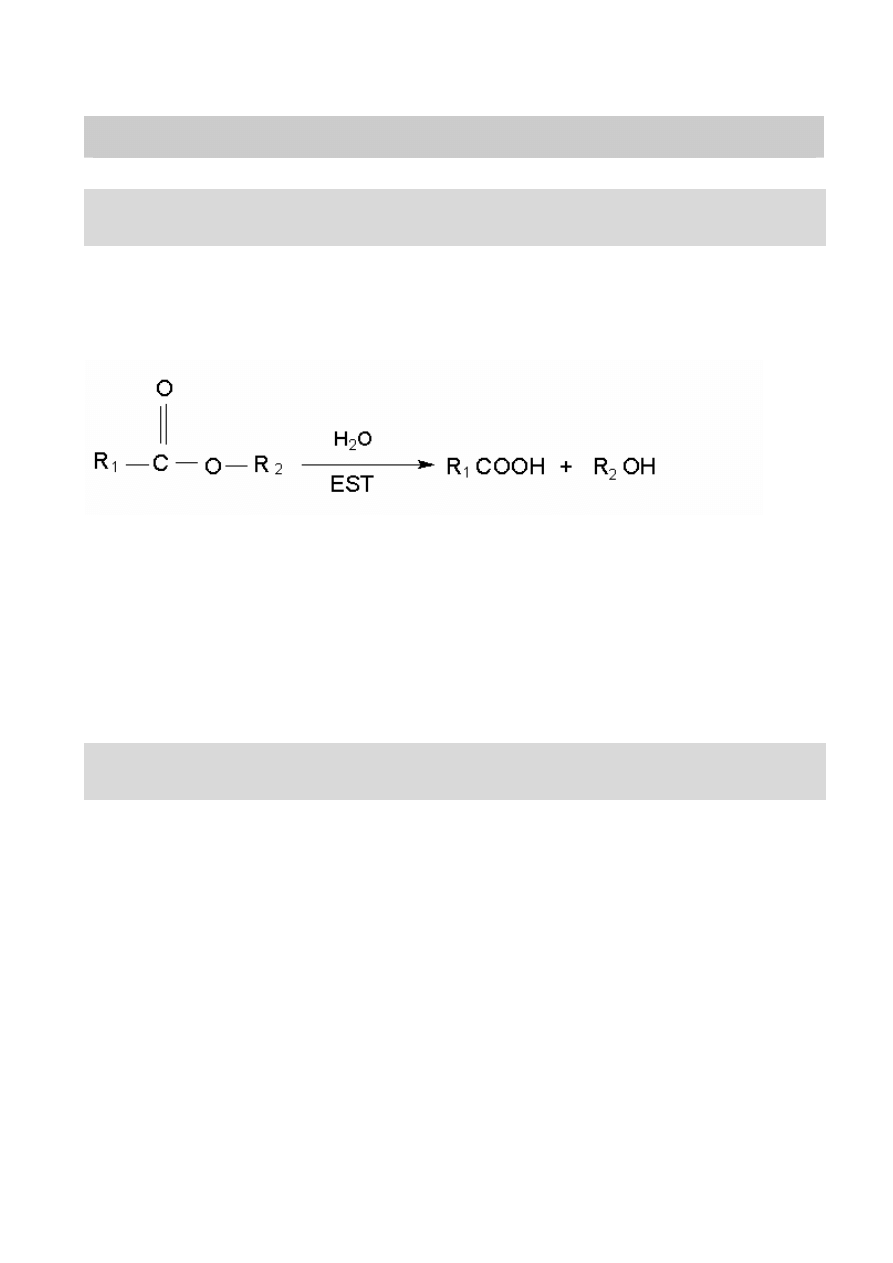
Aktywność esteraz (EST)
Zasada oznaczenia
Ektoenzymy typu esteraz to grupa niespecyficznych enzymów hydrolizujących
wiązanie estrowe w szeregu zwiazków organicznych
reagując z susbtratem sztucznym dwuoctanem fluoresceiny (FDA) powoduje jego
hydrolizę enzymatyczną uwolniając do środowiska reakcji silnie fluorescencyjną
fluoresceinę, której fluorescencję mierzy się fluorometrycznie (ekscytacja 365 nm,
emisja 460 nm) w środowisku obojetnym (pH = 7,2).
Odczynniki
1. Substrat: dwuoctan fluoresceiny (FDA; m.cz. 416.38)
2. Produkt reakcji: fluoresceina (m.cz. 332.31)
3. 0.2 M roztwór Tris (m.cz.121.14)
0.2 M HCl (m. Cz. 36,5)
4.
5. Bufor Tris HCl 0.2 M, pH=7,2
Aceton
6.
19

20
Przygotowanie odczynników i roztworów
1. Roztwór substratu 0,6 mM FDA
Rozpuścić 24,98 mg FDA w 10m1 acetonu, po całkowitym rozpuszczeniu
uzyskany roztwór rozcieńczyć 10x acetonem aby uzyskać r-r „roboczy” FDA o
stęzeniu 0.6 mM. Po dodaniu 0.1 ml tegoż roztworu „roboczego” do 3,9 ml próbki
uzyskamy stęzenie finalne FDA w próbce 15.0 µM.Przygotowany roztwór
roboczy, rozcieńczony acetonem użyć do sporządzenia pozostałych roztworów
„roboczych” substratu.
2. Standard 4 mM fluoresceiny
Rozpuścić 26.6 mg fluoresceiny w 20 ml acetonu. Rozcieńczyć 200x (100x a
nastepnie 2x) acetonem. 1 ml tak przygotowanego roztworu zawiera 20 µmol
fluoresceiny.
3. Bufor Tris HCl 0.2 M
Do 50 ml 0.2M roztworu Tris dodać, w 100 ml kolbce, 44,2 ml 0.2M HCl. Po
dopełnieniu wodą do 100 ml otrzymuje się bufor o stęzeniu 0,1 M i pH 7,2.
Oznaczenie
Kalibracja
Roztwory kalibracyjne sporządza się dodając do 3.8 ml wody destylowanej 0,1 ml
1M buforu Tris HCl oraz 0.1 ml odpowiedniego stężenia rozcieńczonego acetonem
standardu fluoresceiny tak, aby ostatecznie uzyskać stężenia 0.5, 1.0, 2.5, 5, 10, 20,
50, 100, 500 nM.
Próbki wody
Należy przygotować serię 7-9 probówek i napełnić je 3.8 ml badanej wody.
Wszystkie próbki uzupełnic 0.1ml buforu TrisHCl (pH 7.2) Przy
spektrofluorymetrze, z timerem w ręku, dodawać do kolejnych probówek po 0.1 ml

21
kolejnych stężeń substratu (FDA) tak aby jego ostateczne stężenia w próbkach
wynosiły 0.25, 0.5, 1.0, 2.0, 3.0, 5.0, 7.5, 10.0, 12.5, 15.0 µM. W czasie T
0,
natychmiast po dodaniu substratu, próbki wymieszać i zmierzyć ich fluorescencję
(ekscytacja 489, emisja 510 nm). Po 20 - 90 min. inkubacji w ciemności, z timerem w
ręku mierzyć fluorescencję próbek ponownie. Wyniki podać jako przyrost stężenia
fluoresceiny/godz.
Blank
Blank stanowi fluorescencja (Fb) mierzona w badanych próbkach wody, w czasie T
0
inkubacji.
Obliczenia
F
p
F
b
a, b
t
= fluorescencja próbki badanej po inkubacji
= fluorescencja próbki kontrolnej po inkubacji
= współczynniki równania regresji liniowej fluorescencji r-rów
kalibracyjnych
= czas inkubacji (min)
Document Outline
- Długość linii brzegowej
- Uwagi ogólne
Wyszukiwarka
Podobne podstrony:
Instrukcja biologia Aktywnosc enzymatyczna
ĆWICZENIE 3 aktywność enzymatyczna
Instrukcja biologia, Aktywnosc enzymatyczna
Aktywność enzymatyczna mikroflory gleby
IG.6 - Oznaczanie aktywności enzymatycznej metaloproteinaz komórkowych, Genetyka, Inżynieria genetyc
(), biologia, sprawozdanie aktywność enzymatyczna
12. Inhibitory aktywności enzymatycznej, Lekarski WLK SUM, lekarski, biochemia, enzymy
aktywność enzymatyczna bakterii
spr 2 Aktywność enzymatyczna, biologia
instrukcja biologia aktywnosc enzymatyczna wersja1
,biologia L, aktywność enzymatyczna
Instrukcja biologia Aktywnosc enzymatyczna
Wzrost i aktywnosc enzymatyczna drozdzy w mleku
Aktywność enzymatyczna gleb pożarzysk wielkoobszarowych w zróżnicowanych warunkach siedliskowych i p
Oznaczanie aktywności katalazy i wyznaczanie szybkości początkowej reakcji enzymatycznejx
więcej podobnych podstron