
UNIWERSYTET WARMIŃSKO – MAZURSKI W OLSZTYNIE
PODYPLOMOWE STUDIA Z BIOLOGII
Cykl Komórkowy
Anna Król
Praca z biologii komórki
dr Katarzyna Głowacka
Gdynia – Olsztyn 2007

2
Spis treści
1. Cykl komórkowy ….............................................................3
2. Mitoza …............................................................................5
3. Regulacja cyklu komórkowego ….......................................5
4. Kinazy białkowe zależne od cyklin są regulowane
nagromadzaniem i rozpadem cyklin …....................................7
5. Cykl komórkowy może zostać zatrzymany w G
1
przez
białkowe inhibitory Cdk …..................................................8
6. Komórki mogą zdemontować swój układ kontroli i
opuścić cykl komórkowy …...................................................9
7. Proliferacja komórek zależy od sygnałów z innych
komórek …..........................................................................9
8. Komórki zwierzęce mają zaprogramowane
ograniczenie liczby podziałów ..........................................10
9. Komórki zwierzęce potrzebują sygnałów od innych
komórek, by uniknąć programowanej śmierci komórki …10
10. Programowana śmierć komórki zachodzi z
udziałem śródkomórkowej kaskady proteaz …...............11
11. Bibliografia …................................................................13
3
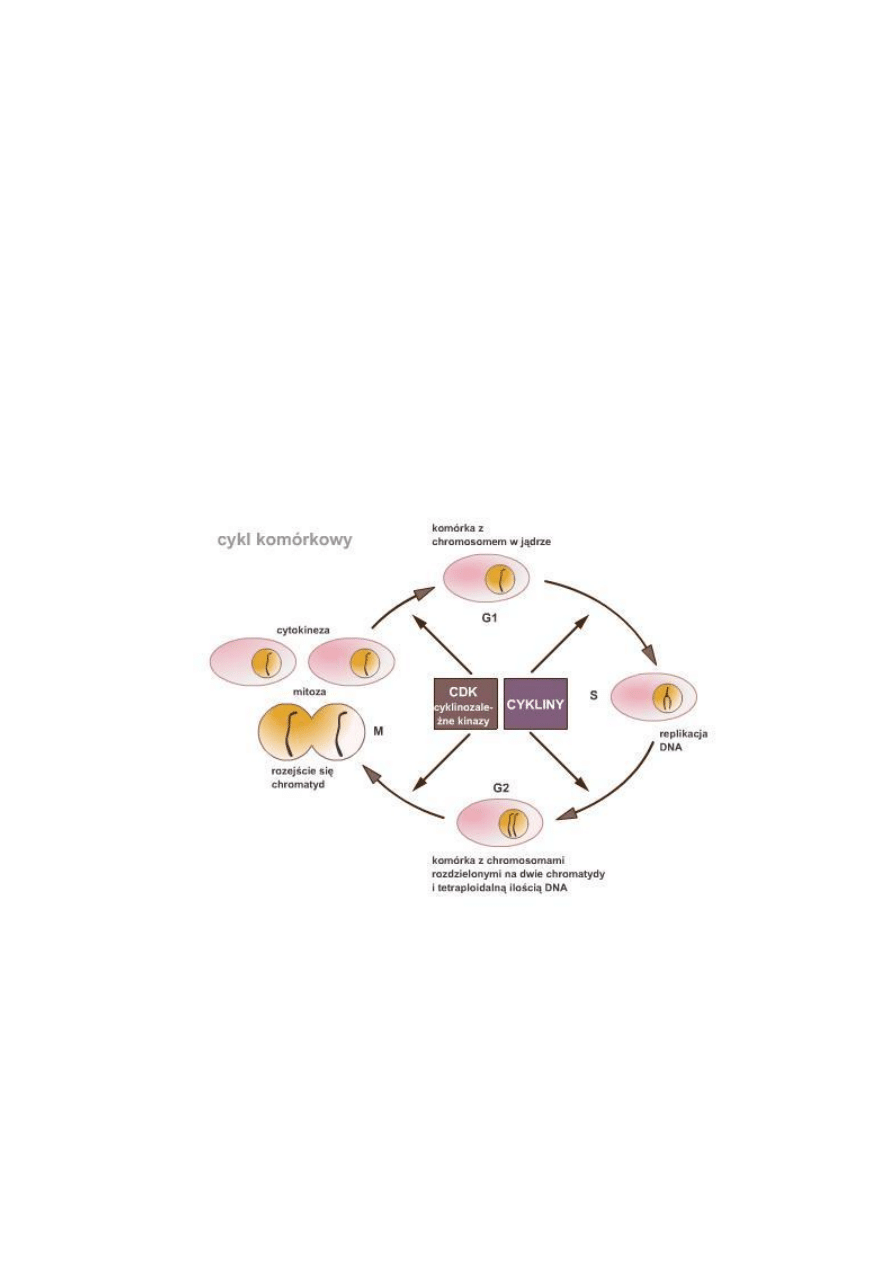
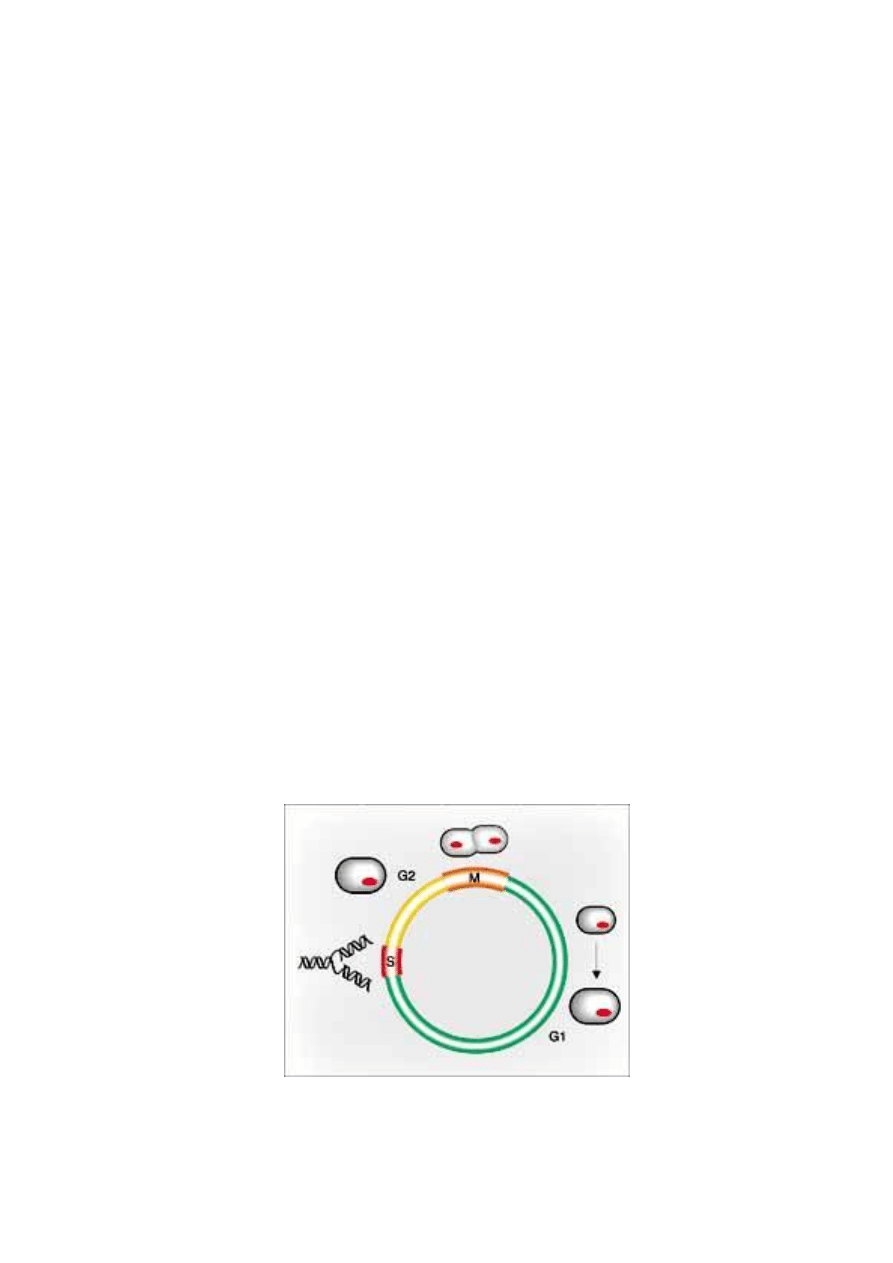
1. Cykl komórkowy
Cykl komórkowy to szereg zmian biofizycznych i biochemicznych komórki
zachodzących między końcem jednego i końcem następnego podziału. Składa się on z
interfazy, czyli okresu między podziałami, oraz samego podziału, czyli mitozy lub
mejozy. W interfazie zachodzi podwojenie materiału genetycznego, zaś w czasie
mitozy podwojony materiał genetyczny jest rozdzielany w równych częściach do
dwóch komórek potomnych. W interfazie cyklu komórkowego wyróżnia się fazę G
1
-
między końcem mitozy a rozpoczęciem syntezy DNA, fazę S - syntezy DNA, oraz fazę
G
2
- między końcem syntezy DNA a początkiem mitozy. W większości komórek roślin
i zwierząt występuje pełny cykl tj. typu G
1
+S+G
2
+M, jednak u części komórek może
on być skrócony, i tak w komórkach szybko proliferujących, rosnących w intrefazie
np. nici spermatogeniczne w plemniach ramienic brak jest fazy G1, cykl typu
S+G
2
+M. Zaś w kom. szybko proliferujących bez wzrostu kom. np. pierwsze
podziały zygoty u ssaków, występuje cykl typu S+M.
FAZA G
1
- jest okresem życia komórki od końca mitozy do rozpoczęcia syntezy
DNA. Komórki wchodzące w tą fazę są 2-krotnie mniejsze niż kom. matka. Czas
trwania tej fazy jest najbardziej zmienny i wynosi od kilku do kilkunastu godzin. Faza
ta charakteryzuje się intensywnymi procesami anabolicznymi, znacznym stopniem
wymian chemicznych z otoczeniem oraz wzrostem innych przejawów aktywności jak
ruchliwość, pinocytoza, transport przez błony itp., co prowadzi do wzrostu masy i
objętości komórki. Ponadto zachodzą procesy związane z przygotowaniem do
replikacji DNA tj. synteza prekursorów DNA oraz enzymów replikacyjnych.
4
We wczesnej fazie G
1
komórka osiąga punkt restrykcyjny R i jeśli go przekroczy,
wówczas podejmie syntezę DNA i zakończy cykl podziałem. Jeśli go nie przekroczy
wchodzi w fazę spoczynkową G
0
. Mechanizm przechodzenia lub nie przez punkt R
wiąże się z syntezą, nagromadzeniem i stopniem fosforylacji białek niestabilnych tzw.
białek U, które są cyklinami.
FAZA S - przed każdym podziałem ilość DNA przypadająca na jądro podwaja
się, dokonuje się to w ograniczonym czasie interfazy zwanym fazą syntezy (S). W
fazie S ulega replikacji niemal cały jądrowy DNA -tzw. programowana synteza
DNA - według sposobu semikonserwatywnego tj. podwójna spirala ulega
rozdzieleniu a na każdej z jej obu nici syntetyzowana jest nowa. Istnieje też
nieprogramowana synteza DNA dotycząca niewielkich jego fragmentów (synteza
naprawcza). Jest ona następstwem uszkodzeń , mutacji nici DNA i nie jest związana z
cyklem komórkowym.
FAZA G
2
- obejmuje okres od zakończenia replikacji do rozpoczęcia mitozy i trwa
kilka godzin. W tym czasie zachodzi synteza białek wrzeciona podziałowego gł.
tubuliny oraz składników potrzebnych do odtwarzania błon otoczki jądrowej i
plazmalemmy w telofazie i cytokinezie, jak również wyznaczenie płaszczyzny
podziału (pierścień preprofazowy). Pod koniec fazy następuje uaktywnienie kinazy
fazy M.(=MPF,=czynnik przyspieszający dojrzewanie) co prowadzi do rozpoczęcia i
przeprowadzenia mitozy.
FAZA G
0
- jest stanem spoczynkowym komórki - komórki funkcjonują lecz tracą
zdolność odtwarzania materiału genetycznego i dzielenia się. Przejście w tą fazę może
nastąpić u zwierząt z G
1
,u roślin z G
1
lub G
2
. Komórki charakteryzują się obniżonym
tempem metabolizmu, mniejszą aktywnością transkrypcyjną. Czas trwania tej fazy
jest różny, od kilku dni do miesięcy i dłużej. Pod wpływem różnych bodźców komórki
z fazy G
0
mogą wchodzić w cykl komórkowy, zawsze do fazy w której nastąpiło jego
przerwanie. Im dłużej komórki pozostają w fazie G
0
, tym więcej czasu zabiera im
wejście w cykl po pobudzeniu.
5
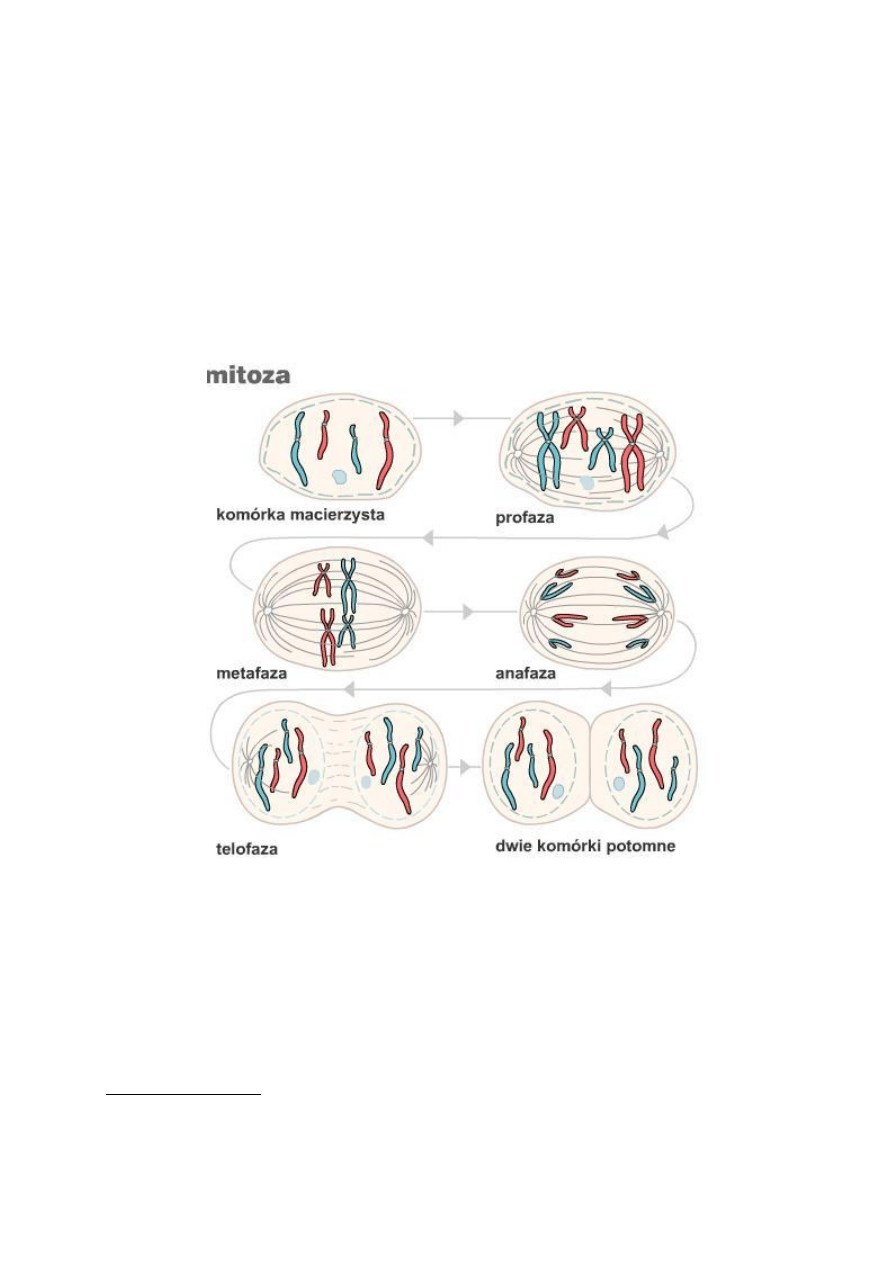
2. Mitoza
Dzieli się ją na kariokinezę i cytokinezę. W kariokinezie dzielonej na profazę,
metafazę, anafazę i telofazę zachodzi kondensacja chromatyny, wytworzenie
chromosomów, ich podział na chromatydy i przemieszczenie chromatyd do 2
potomnych komórek. Towarzyszy temu zanik jąderek, otoczki jądrowej oraz
wytworzenie aparatu mitotycznego a następnie odbudowa jądra. W cytokinezie
następuje podział cytoplazmy.
3. Regulacja cyklu komórkowego
Odbywa się przez uruchamianie kaskadowych reakcji fosforylacji i defosforylacji
białek. Fosforylacja (przeniesienie grupy fosforanowej z ATP na odpowiednią resztę
aminokwasową białka docelowego) jest katalizowana przez różnorodne kinazy
białkowe, a defosforylacja przez fosfatazy. Substratami kinaz białkowych są różne
białka jądra i cytoplazmy, a najczęściej fosforylowanymi aminokwasami tych białek są
tyrozyna i treonina. Fosforylacja (i defosforylacja) jest jednym z najczęściej używanych
przez komórkę sposobów zmiany aktywności białek.

6
Kinazy białkowe układu kontroli cyklu komórkowego są obecne w komórkach
dzielących się podczas całego cyklu. Są jednak aktywowane tylko w odpowiednim
okresie cyklu, po czym szybko tracą aktywność. Stąd aktywność każdej z tych kinaz
cyklicznie zwiększa się i zmniejsza.
Aktywność kinaz białkowych zależy to od innego zestawu białek układu kontroli —
od cyklin. Cykliny same nie mają aktywności enzymatycznej, ale muszą się przyłączyć
do kinaz cyklu komórkowego, zanim kinazy te mogą zyskać aktywność enzymatyczną.
Stąd kinazy układu kontroli cyklu komórkowego są nazywane kinazami białkowymi
zależnymi od cyklin (Cdk - ang. cyclin-dpendent protein kinases). Nazwa cyklin
pochodzi stąd, że przeciwnie niż poziom Cdk, ich stężenie zmienia się cyklicznie w
cyklu komórkowym.
Cykliny występują w komórkach jako cykliny A i B oraz C, D i E. W czasie cyklu
komórkowego cykliny A, C, D i E są syntetyzowane de novo i ich stężenie w komórce
rośnie w miarę upływu cyklu, zaś cyklina B jest syntetyzowana w fazie G
2
.
Maksymalne stężenie cyklin występuje w metafazie/ anafazie mitozy, po czym ulega
ono obniżeniu na skutek trawienia ich przez proteazy.
Aktywacja kinaz zachodzi w dwóch krytycznych przedziałach czasowych
(punktach kontrolnych) cyklu komórkowego: pod koniec fazy G
2
(co prowadzi do
przejścia G
2
® M , tj. zapoczątkowanie mitozy) oraz w fazie G
1
(co prowadzi do
przejścia G
1
® S , tj. zapoczątkowanie syntezy DNA). Każdy rodzaj kompleksu
cyklina-Cdk działa na różny zestaw białek docelowych w komórce
Stężenie różnych typów cyklin zwiększa się, a potem gwałtownie maleje na skutek
degradacji na drodze ubikwitynacji w określonym czasie cyklu komórkowego. Wzrost
stężenia każdego typu cykliny wspomaga aktywację jej partnerskiej Cdk, a nagły jego
spadek przywraca tę Cdk do stanu nieaktywnego. Powolne gromadzenie się cyklin, aż
do krytycznego poziomu, jest jednym ze sposobów pomiaru odstępów czasu między
jednym etapem cyklu a następnym w układzie kontroli cyklu komórkowego.
Przejście z późnej fazy G
2
do M. dokonuje się przez aktywację kinazy fazy M,
znanej jako czynnik wywołujący dojrzewanie (MPF - maturation promoting
factor). Jest ona heterodimerem białkowym składającym się z białka o masie 34 kD i
białka o masie 45 kD (cyklina). W kompleksie tym białko p34 jest kinazą
fosforylującą reszty seryny i treoniny wielu białek a cyklina (białko p34) nadaje
aktywnemu kompleksowi powinowactwo do odpowiedniego substratu (białka, które
ma być ufosforylowane).
Kinaza fazy M powstaje w fazie G
2
w wyniku utworzenia kompleksu p34 z
głównie z B. Kinaza MPF fosforyluje wiele kluczowych białek, zmieniając ich
właściwości, np: rozpad otoczki jądrowej zachodzi przez w wyniku fosforylacji i
demontażu biegnących pod otoczką jądrową filamentów laminy, podobnie fosforyluje
białka towarzyszące mikrotubulom, co zmienia właściwości mikrotubul tak, że tworzą
wrzeciono podziałowe, fosforyluje również histon H1 co powoduje kondensację
chromosomów.
7
Regulacja fazy S odbywa się przez kontrolę przechodzenia komórki G
1
® S
oraz przez kontrolę zakończenia syntezy DNA. Przypuszcza się, że białko p34 może
łączyć się w fazie G
1
głównie z cykliną A, D lub E, dając kompleks kinazy podobny do
kinazy fazy M, nazywany kinazą fazy S. Aktywność takiej kinazy prowadzi komórki
przez punkt startowy = restrykcyjny (w późnej fazie G
1
). Półokres trwania
cyklin G
1
wynosi zaledwie ok. 15 min., co odpowiada klasie białek niestabilnych (białek
U), które znane są od dawna i których nagromadzenie w komórce jest warunkiem
przejścia G
1
® S.
4. Kinazy białkowe zależne od cyklin są regulowane
nagromadzaniem i rozpadem cyklin
Regulacja stężenia cyklin ma ważny udział w synchronizacji zjawisk cyklu
komórkowego. Na przykład, synteza składnika MPF — cykliny B, zaczyna się
bezpośrednio po podziale i trwa stale podczas interfazy. Cyklina gromadzi się, stąd jej
stężenie stopniowo zwiększa się i określa chwilę rozpoczęcia mitozy; jego późniejsze
gwałtowne zmniejszenie się rozpoczyna wyjście z mitozy. Nagły spadek stężenia
cykliny podczas mitozy jest spowodowany szybkim zniszczeniem cykliny w układzie
proteolitycznym zależnym od ubikwityny. Wiele cząsteczek ubikwityny jest
kowalencyjnie dołączonych do każdej cząsteczki cykliny, co kieruje ją do degradacji w
proteosomach. Ta ubikwitynacja cykliny jest pośrednim wynikiem aktywacji kinazy
MPF. Aktywacja MPF rozpoczyna proces prowadzący z opóźnieniem do ubikwitynacji
i degradacji cyklin, co z kolei wyłącza kinazę.

8
5. Cykl komórkowy może zostać zatrzymany w G
1
przez
białkowe inhibitory Cdk
Układ kontroli cyklu komórkowego włącza zdarzenia cyklu w określonej kolejności.
Na przykład, włącza mitozę tylko wtedy, gdy cały DNA został zreplikowany oraz
pozwala komórce podzielić się na dwie dopiero po zakończeniu mitozy. Jeżeli jeden z
etapów zostaje opóźniony, układ kontroli opóźnia aktywację następnych etapów tak,
że ich sekwencja zostaje zachowana. Na przykład, ta właściwość samoregulacji układu
kontroli zapewnia, że jeżeli synteza DNA zostaje zatrzymana z jakiegoś powodu w
fazie S, to komórka nie wejdzie w fazę M z DNA zreplikowanym tylko w połowie.
Większość mechanizmów molekularnych odpowiedzialnych za zahamowanie biegu
cyklu komórkowego w punktach kontrolnych jest słabo poznanych. W niektórych
przypadkach są za to odpowiedzialne swoiste białkowe inhibitory Cdk; blokują
one powstawanie bądź aktywność jednego albo kilku kompleksów cyklina-Cdk. Jeden
z lepiej poznanych punktów kontrolnych zatrzymuje cykl komórkowy w G1 po
uszkodzeniu DNA, co zapobiega replikacji przez komórkę uszkodzonego DNA.
Uszkodzenie DNA powoduje nie poznanym dotąd mechanizmem zwiększenie
stężenia i aktywności białka regulatorowego genów, nazwanego białkiem p53.
Zaktywowane białko p53 zwiększa transkrypcję genu kodującego białkowy inhibitor
Cdk, nazywanego p21. To zwiększa stężenie białka p21, które wiąże się z kompleksami
cyklina-Cdk fazy S, odpowiedzialnymi za wprowadzenie komórki do fazy S i blokuje
ich działanie. Zatrzymanie cyklu komórkowego w G1 daje komórce czas na reperację
uszkodzonego DNA, zanim zostanie on zreplikowany. Gdy brak jest białka p53 albo
jest ono nieaktywne, zachodzi nieograniczona replikacja uszkodzonego DNA, co
zwiększa częstość mutacji i możliwości pojawienia się komórek nowotworowych.
Mutacje genu p53, które pozwalają dzielić się komórkom z uszkodzonym DNA,
stanowią ważny element w rozwoju większości nowotworów u człowieka.

9
6. Komórki mogą zdemontować swój układ kontroli i
opuścić cykl komórkowy
Najbardziej radykalna dla układu kontroli cyklu komórkowego jest decyzja o
zatrzymaniu podziałów w ogóle. Jest to inna sytuacja niż przerwa powodująca
chwilowe opóźnienie w środku cyklu i ma specjalne znaczenie w organizmie
wielokomórkowym. U człowieka np. komórki nerwowe i komórki mięśni
szkieletowych powinny przetrwać przez całe życie organizmu bez podziałów; wchodzą
one w zmodyfikowaną fazę G
1
nazywaną G
0
. W G
0
układ kontroli cyklu komórkowego
jest częściowo zdemontowany, ponieważ brak w komórce wielu cyklin i Cdk. Pewne typy
komórek, np. komórki wątroby, prawidłowo dzielą się raz albo dwa razy w roku,
natomiast pewne komórki nabłonkowe jelita dzielą się dwa bądź więcej razy dziennie,
by stale odnawiać wyściółkę jelit. Większość naszych komórek mieści się między tymi
skrajnościami: mogą się dzielić, gdy zajdzie taka potrzeba, ale zwykle dzielą się
rzadko.
Wydaje się ogólną regułą, że komórki ssaków dzielą się tylko wtedy, gdy są
pobudzane sygnałami dochodzącymi z innych komórek. Pozbawione tych sygnałów
zatrzymują cykl komórkowy w punkcie kontrolnym fazy G
1
, i wchodzą w stan G
0
.
Komórki mogą pozostawać w G
0
przez dni, tygodnie, a nawet lata, zanim się ponownie
podzielą. Stąd zmienność częstości podziałów komórek zależy od czasu, jaki komórki
pozostają w G
0
albo G
1
; gdy jednak komórka przejdzie punkt kontrolny G
1
, reszta
cyklu komórkowego przebiega szybko, u ssaków typowo w ciągu 12-24 godzin.
7. Proliferacja komórek zależy od sygnałów z innych
komórek
Organizmy jednokomórkowe takie jak bakterie i drożdże mają tendencję, by rosnąć
i dzielić się tak szybko, jak to jest możliwe. Szybkość podziałów zależy głównie od
dostępności substancji odżywczych w środowisku. Natomiast komórki organizmu
wielokomórkowego są wyspecjalizowanymi członkami wysoce zorganizowanej
społeczności, a ich proliferacja musi być kontrolowana. Pojedyncza komórka dzieli się
tylko wtedy, gdy nowa komórka jest potrzebna organizmowi — ze względu na jego
wzrost albo żeby zastąpić utraconą komórkę. Tak więc do proliferacji komórki
zwierzęcej nie wystarczą substancje odżywcze. Musi ona jeszcze otrzymać pobudzający
sygnał chemiczny od innych komórek, zwykle od sąsiadów. Takie działanie pozwala
uniknąć użycia mechanizmów hamowania śródkomórkowego, które ograniczałoby
wzrost komórki i blokowało przebieg cyklu komórkowego.
Ważnym przykładem hamowania podziałów komórki jest białko retinoblastoma (Rb),
Wiąże się ono z określonymi białkami regulującymi geny, zapobiegając pobudzeniu
transkrypcji genów koniecznych do podziałów. Na przykład zewnątrzkomórkowe
sygnały, czynniki wzrostu (takie jak: płytkowy czynnik wzrostu, epidermalny czynnik
wzrostu,
czynnik
wzrostu
fibroblastów,
czynnik
wzrostu
hepatocytów,
erytropoetyna) pobudzają proliferację odpowiednich komórek. Między innymi
powodują aktywację kompleksów cyklina-Cdk fazy G1, fosforylują one białko Rb
zmieniając jego konformację tak, że uwalnia ono związane przez siebie czynniki
transkrypcyjne - wtedy białka te mogą aktywować geny konieczne do przebiegu
podziałów komórki.

10
8. Komórki zwierzęce mają zaprogramowane ograniczenie
liczby podziałów
Nawet w obecności czynników wzrostu prawidłowe komórki zwierzęce w
hodowli nie kontynuują wzrostu bez końca. Te typy komórek, które utrzymują
zdolność do podziałów przez całe życie zwierzęcia, gdy pozostają w jego organizmie,
zwykle przestają się dzielić po określonej liczbie podziałów w hodowli. Na przykład
fibroblasty pobrane z płodu ludzkiego zanim przestaną się dzielić, przechodzą ok. 80
podziałów nawet wtedy, gdy mają wystarczająco dużo pożywienia, czynników
wzrostu i miejsca do podziałów. Te zdolności komórek są jednak różne w zależności
od wieku osoby, od której pobrano komórki. Fibroblasty pobrane od dorosłej 40-
letniej osoby zatrzymują podziały już po ok. 40 cyklach.
Zjawisko to nazywamy starzeniem się komórki odpowiednio do starzenia się
całego organizmu. Jednak ta analogia nie jest pewna. Ponieważ w hodowli fibroblasty
zarodka myszy przestają się namnażać po 30 podziałach, jest możliwe, że starzenie się
komórki może pomagać w wyznaczeniu wielkości ciała. Przypuszcza się, że mysz jest
dlatego mniejsza niż my, gdyż jej komórki stają się niewrażliwe na pobudzenie
czynnikami wzrostu już po mniejszej liczbie cykli podziałowych.
9. Komórki zwierzęce potrzebują sygnałów od innych komórek,
by uniknąć programowanej śmierci komórki
Komórki zwierzęce potrzebują sygnałów od innych komórek nie tylko do
proliferacji, lecz też do przeżycia. Pozbawione takich czynników przeżycia komórki
aktywują śródkomórkowy program samobójczy i giną w procesie nazywanym
programowaną śmiercią komórki. Ta konieczność otrzymywania od innych
komórek sygnałów do przeżycia pomaga w utrzymaniu komórek tylko wtedy, gdy są
one potrzebne i tam, gdzie są potrzebne. W tkankach rozwijających się i dojrzałych
częstość programowanej śmierci komórek jest bardzo wysoka. Na przykład w
rozwijającym się układzie nerwowym kręgowców ponad połowa komórek nerwowych
zwykle obumiera wkrótce po ukształtowaniu się. U zdrowego człowieka w każdej
godzinie miliony komórek giną w szpiku kostnym i jelicie.
Programowana śmierć komórek może służyć różnym celom. Na przykład przez
programowaną śmierć komórek nasze ręce i stopy są rzeźbione podczas rozwoju
zarodkowego- początkowo poszczególne palce rąk i nóg są słabo wyodrębnione a
dopiero później są oddzielane, w miarę jak między nimi giną komórki. W innych przy-
padkach komórki giną, gdy struktury przez nie tworzone nie są potrzebne. Gdy
kijanka przekształca się w żabę (metamorfoza), komórki ogona giną, a ogon
niepotrzebny już żabie zanika. W jeszcze innych przypadkach śmierć komórek pomaga
w regulacji liczby komórek. Na przykład w rozwijającym się układzie nerwowym
śmierć komórek dostosowuje liczbę komórek nerwowych do liczby komórek
docelowych wymagających unerwienia. Komórki nerwowe są w zarodku wytwarzane w
nadmiarze i potem konkurują o ograniczone ilości czynników przeżycia wydzielanych
przez komórki docelowe, z którymi się kontaktują. Komórki nerwowe otrzymujące
wystarczającą ilość czynników przeżycia żyją, a inne giną.
11
W dojrzałych tkankach śmierć komórek równoważy proliferację, by zapobiec
przerostowi narządów bądź ich kurczeniu się.
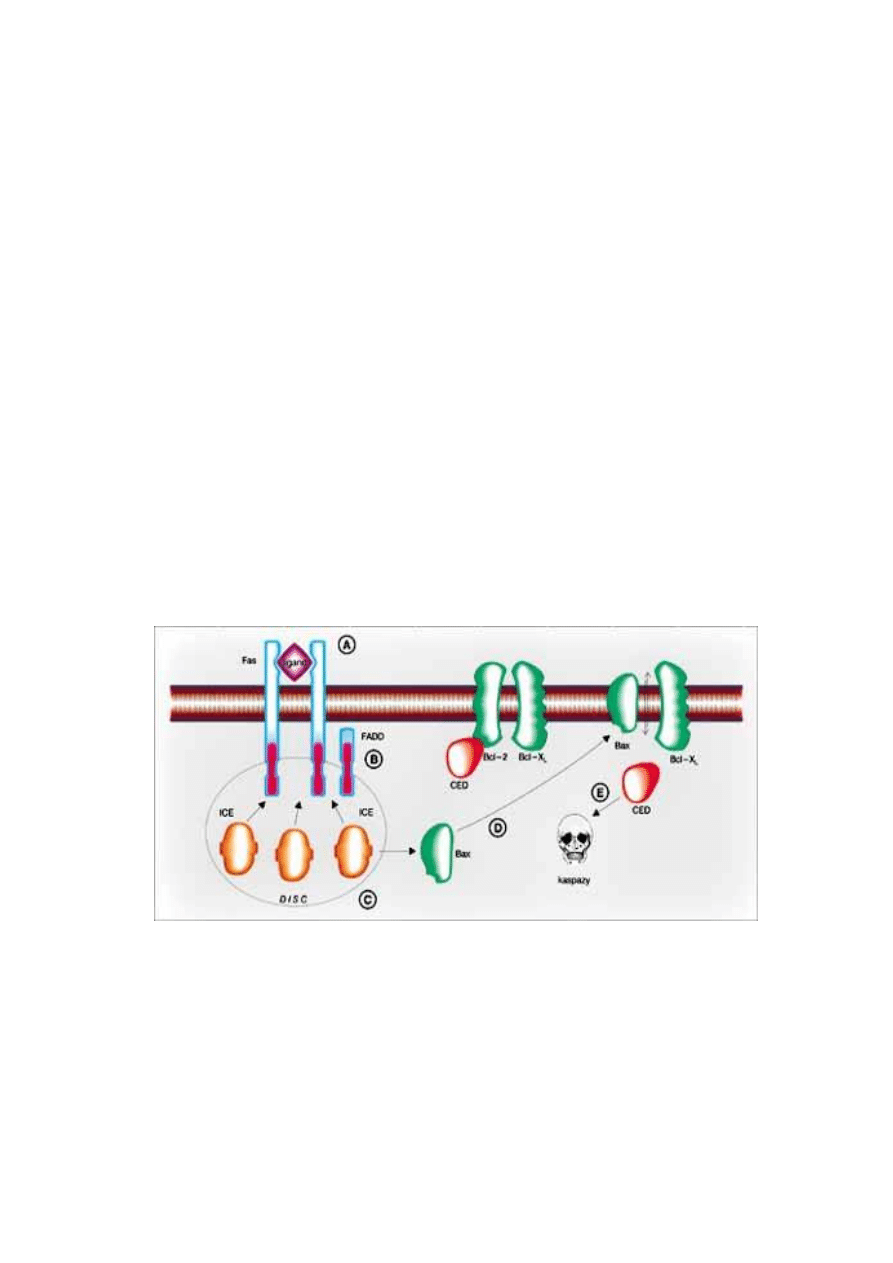
10. Programowana śmierć komórki zachodzi z udziałem
śródkomórkowej kaskady proteaz
Komórki, które giną w wyniku ostrego urazu, obrzękają i pękają, uwalniając swoją
zawartość do otoczenia komórek sąsiednich. Proces nazywany nekrozą (martwicą)
komórki, co powoduje potencjalnie uszkadzającą odpowiedź zapalną. Natomiast
komórka podlegająca śmierci programowanej umiera niezauważalnie, bez
uszczerbku dla sąsiadów.
Typowy obraz śmierci programowanej w komórkach zwierzęcych to apoptoza. W
trakcie apoptozy komórka kurczy się oddzielając się od sąsiednich komórek w tkance,
cytoszkielet podlega zniszczeniu, otoczka jądrowa rozpada się, a jądrowy DNA jest
cięty na fragmenty. Powierzchnia obumierającej komórki zmienia się - błona
komórkowa pukla się do wewnątrz, odcinając kuliste fragmenty cytoplazmy (ciałka
apoptotyczne) zawierające organelle i pocięty, skondensowany DNA jądrowy. Ciałka
są szybko fagocytowane przez sąsiednie komórki albo przez makrofagi
(wyspecjalizowane komórki fagocytujące), przez co nie następuje uwolnienie
zawartości obumierającej komórki do otoczenia.
We wszystkich komórkach zwierzęcych funkcjonuje podobny układ odpowiedzialny
za ten rodzaj kontrolowanej śmierci samobójczej. Składa on się z rodziny proteaz
(enzymów rozcinających inne białka), które same są aktywowane proteolitycznym
rozcięciem będącym odpowiedzią na sygnały indukujące programowaną śmierć
komórki. Zaktywowane proteazy rozcinają i tym sposobem aktywują inne proteazy na-
leżące do tej samej rodziny białek, co razem stanowi kaskadę proteaz wzmacniającą
efekt początkowy. Proteazy rozcinają następnie inne kluczowe białka w komórce,
zabijając ją szybko i sprawnie. Na przykład jedna z proteaz rozcina jądrowe białka
laminy powodując nieodwracalny rozpad blaszki jądrowej.

12
Układ śmierci samobójczej jest regulowany sygnałami z innych komórek. Niektóre
działają jak sygnały zabijania, aktywując mechanizm samobójstwa komórki. W ten
sposób działa hormon tarczycy w ogonie kijanki podczas metamorfozy. Inne działają
jako sygnały przeżycia, hamując samobójstwo, by utrzymać komórkę przy życiu.
W organizmie wielokomórkowym programowana śmierć komórki jest zdarzeniem
zwyczajnym, normalnym i ogólnie łagodnym. Natomiast niewłaściwa proliferacja i
przeżywanie zbędnych komórek stanowią rzeczywiste niebezpieczeństwo – prowadzą
do powstania nowotworów.

13
Bibliografia:
1. Sanak Marek, Regulacja cyklu komórkowego i różnicowania,
opublikowano w Medycyna Praktyczna 1998/07.
2.
http://portalwiedzy.onet.pl/52990,,,,cykl_komorkowy,haslo.html
3.
http://www.biologia.pl/slowniczek/cykl_komorkowy.php3
4. Encyklopedia PWN
5. Jolanta Saczko, Maciej Zabel, Małgorzata Daczewska, Ocena stopnia
proliferacji ludzkich keratynocytów hodowanych w różnych
stężeniach Ca 2+, Żródło: W: Konferencja: Czynniki wzrostowe i
6. Karolina Nowak, Witold Kędzia, Rola kinaz zależnych od cyklin (Cdk)
w regulacji cyklu życiowego komórki prawidłowej i nowotworowej.
7. Krzysztof Osmola, Krystyna Adamska, Leszek Lewandowski, Analiza
faz cyklu komórkowego i apoptozy w komórkach raka
płaskonabłonkowego jamy ustnej, Źródło: Pozn. Stom. 2002 T. 29 s.
19-24 tab. bibliogr. streszcz. summ.
Wyszukiwarka
Podobne podstrony:
CYKL KOMÓRKOWY, biologia komórki
BIOLOGIA KOMORKI 2 id 87836 Nieznany
CYKL KOMORKOWY, Biotechnologia i, Rok I, Biologia komórki, Biologia komorki materialy
cykl komorkowy i starzenie, Biologia Komórki
BIOLOGIA KOMORKI 03 id 87812 Nieznany
Cykl komórkowy, STUDIA, biologia komórki
jak sklonowano myszy, biologia komórki
kontrola cyklu komorkowego i smierc komorki, BIOLOGIA UJ LATA I-III, ROK II, semestr I, biologia kom
ćwiczenie 2 pomiary, Biologia Komórki, Prezentacje, 2011 lato
Wykład piąty biologia komórki
Test biol kom, biologia komórki(3)
MITOCHONDRIA, biologia komórki
EgzaminBiologia 2013, Edukacja (UMCS Lublin), Biologia Komórki (UMCS), Egzamin
jądro interfazowe, STUDIA, biologia komórki
BIOL.KOM pytania chyba Witaliński, biologia uj, biologia II, biologia komorki, egz
więcej podobnych podstron