http://www.chemia.sos.pl
- 1 -
1.
Przemiana
α polega na wyrzuceniu z jądra atomu jądra helu
4
2
He , natomiast w przemianie
β
-
z jądra zostaje wyrzucony
elektron, który powstaje w wyniku rozpadu neutronu: n → p + e. W równaniach jądrowych reakcji suma liczb masowych A lewej
strony równania reakcji musi być równa sumie liczb masowych prawej strony równania reakcji, oraz i suma liczb atomowych Z
lewej strony równania reakcji musi się równać sumie liczb atomowych prawej strony równania reakcji:
235
A
4
0
92
Z
2
1
U
X 2 He
e
−
→
+
+
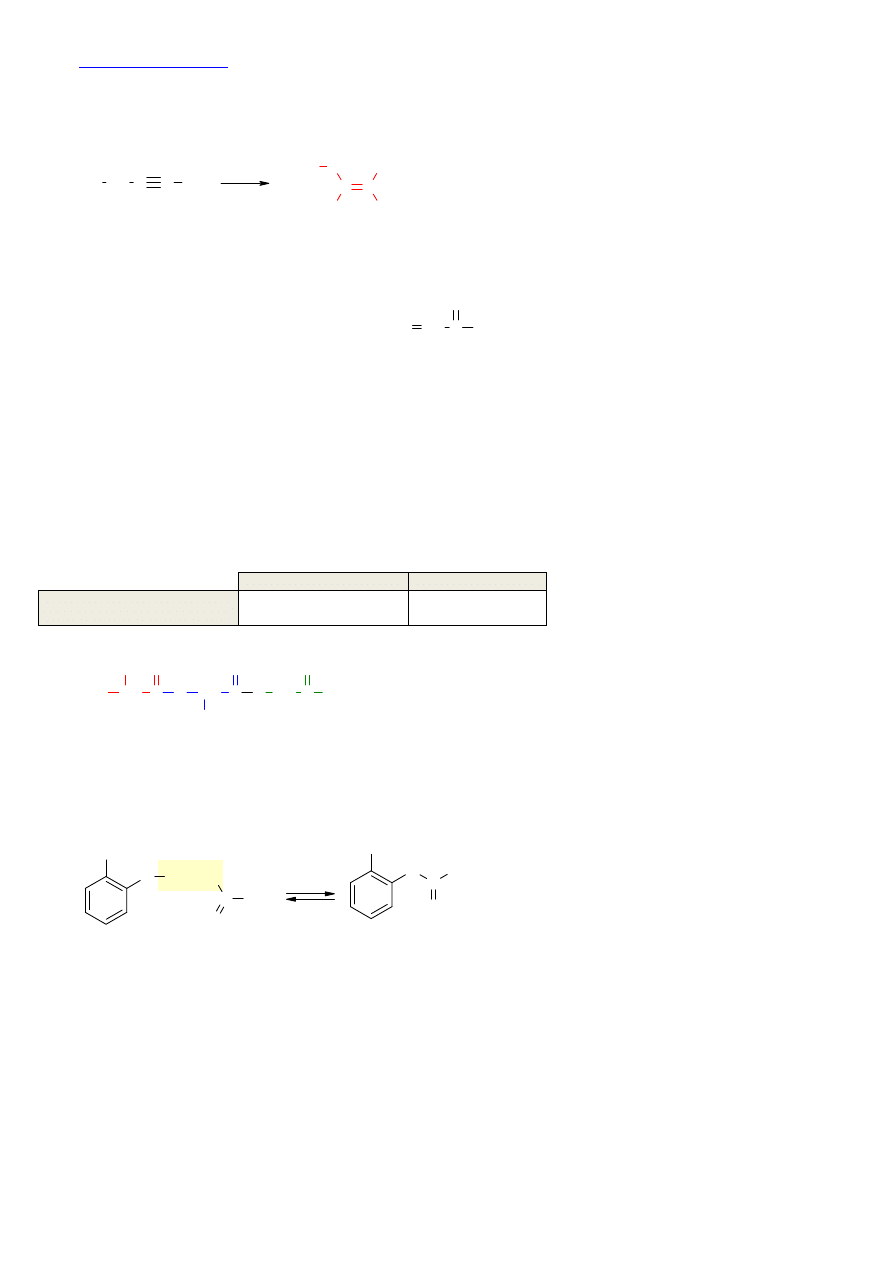
Z: 92=Z+2
.
2-1, czyli Z=
89
; A: 235=2
.
4+0, czyli A=
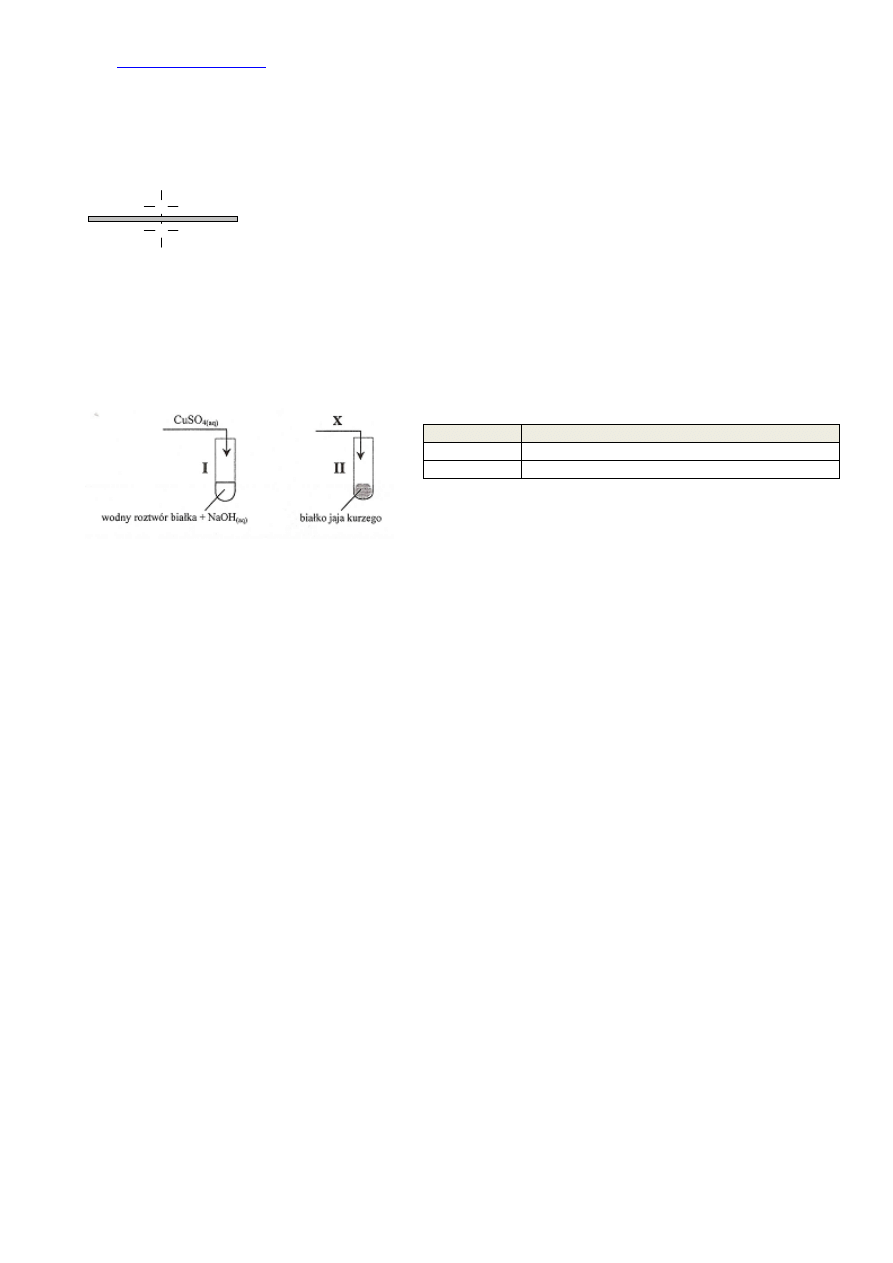
227
Z układu okresowego pierwiastków możemy odczytać, że powstałym pierwiastkiem jest aktyn, zawierający w jądrze 89
protonów, oraz 227-89=138 neutronów (liczba masowa równa jest sumie protonów i neutronów w jądrze (liczbie nukleonów).
2.
Izotopy mają identyczną liczbę atomową (liczbę protonów w jądrze), a różnią się liczbą neutronów (liczbą masową). Z
układu okresowego pierwiastków możemy odczytać, że liczba atomowa Z dla miedzi wynosi
Z=29
. Liczby masowe izotopów
miedzi wynoszą więc A
1
=34+29=
63
, oraz A
2
=36+29=
65
.
Masa atomowa jest średnią ważoną liczb masowych:
1
1
2
2
n
n
c % M
c % M
.......c %M
M
100%
⋅
+
⋅
+
=
(gdzie c
i
% oznacza zawartość
izotopu, a M
i
masę atomową izotopu). Podstawiając dane do wzoru na masę atomową miedzi otrzymamy:
72,7% 63u (100 72,7)% 65u
M
100%
63,546u
⋅
+
−
⋅
=
=
3.
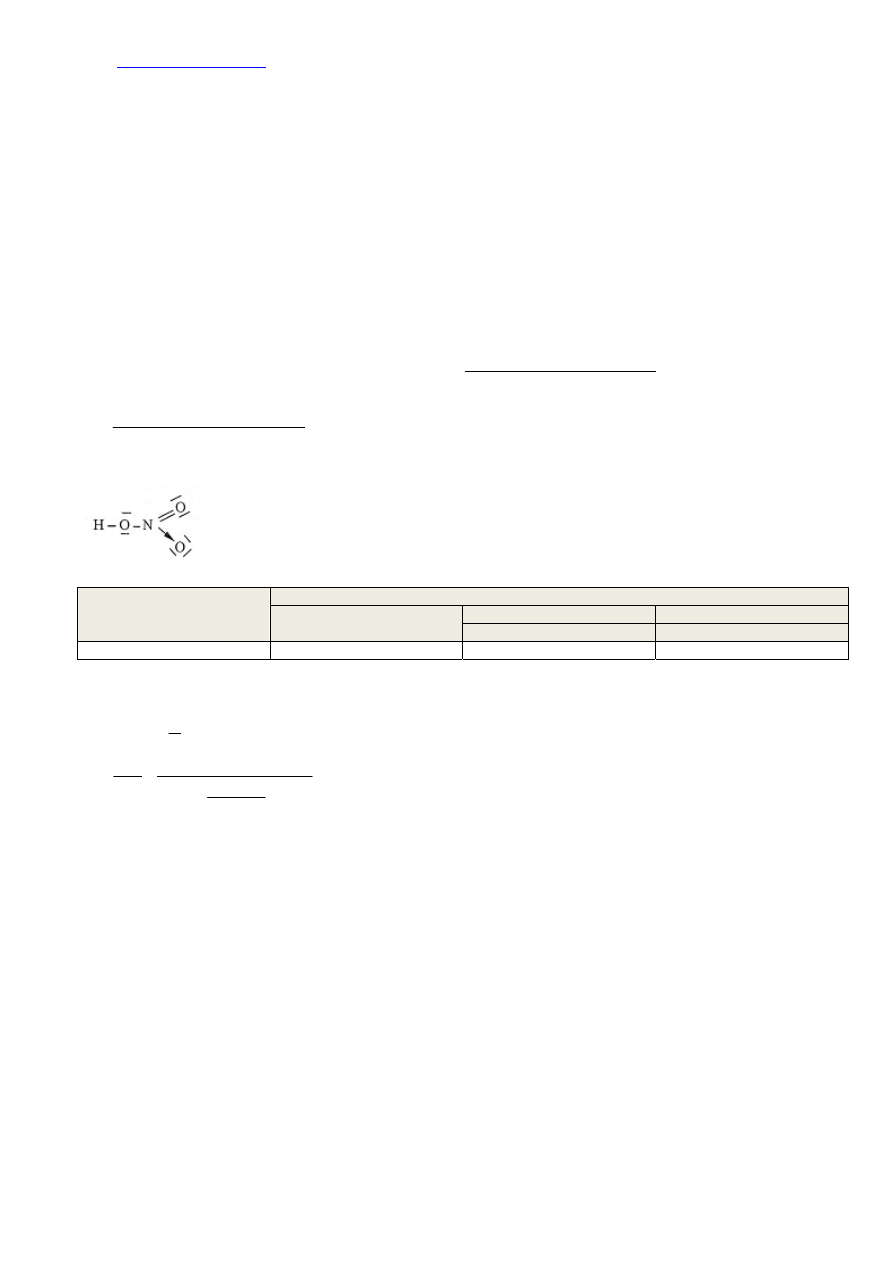
Wiązanie kowalencyjne niespolaryzowane łączy atomy o podobnej elektroujemności. W przypadku
kwasu azotowego(V) pomiędzy atomem tlenu i azotu, oraz tlenu i wodoru istnieje zbyt duża różnica
elektroujemności, by wiązanie pomiędzy tymi atomami było niespolaryzowane. Musimy również
pamiętać, że wiązanie koordynacyjne jest odmianą wiązania kowalencyjnego (zaznacza się je za
pomocą strzałki). Aby policzyć wiązania kowalencyjne wystarczy policzyć wszystkie kreski łączące
atomy (wraz ze strzałką obrazującą wiązanie koordynacyjne).
Typ wiązania
Kowalencyjne
niespolaryzowane
spolaryzowane
ogółem
w tym koordynacyjne
Liczba wiązań 0 5 1
4.
W podanych warunkach tlenek węgla(IV) jest gazem i skorzystamy z równania Clapeyrona pV=nRT lub po podstawieniu
n=m/M:
m
pV
RT
M
=
. Przekształcając wzór Clapeyrona względem m i podstawiając dane otrzymamy:
3
3
pVM
1500hPa 4dm 44g / mol
m
RT
hPa dm
83,14h
300K
K mol
10,58g
⋅
⋅
=
=
=
⋅
⋅
⋅
(jednostką stałej gazowej jest hPa
.
dm
3.
K
-1.
mol
-1
, nie musimy więc przeliczać
hPa na Pa, ani objętości na m
3
).
5.
Pierwiastek A jest metalem lekkim, srebrzystym, kowalnym. Bardzo dobrze przewodzi ciepło i prąd elektryczny. Jest
składnikiem lekkich stopów, np. elektronu, stosowanego do wyrobu części samolotów. Znajduje też zastosowanie do
produkcji opakowań i folii. Jego minerał o nazwie korund jest bardzo twardy i ma dute znaczenie techniczne. Barwne
odmiany korundu to rubiny i szafiry.
Pierwiastek B jest ciałem stałym, twardym i kruchym. Zalicza się go do półprzewodników. Stosowany jest do
produkcji stopów z żelazem, a także tranzystorów i ogniw fotoelektrycznych. Należy do grupy pierwiastków najczęściej
występujących w skorupie ziemskiej. Jego najważniejszy związek występujący w przyrodzie w bardzo dużych ilościach to
kwarc.
Wyszczególnione właściwości pierwiastków A i B jednoznacznie wskazują, że mowa jest o
glinie
i
krzemie
.
6.
Wodorosole powstają w reakcji kwasu wieloporotonowego z zasadą, przy nadmiarze kwasu, w reakcji soli z
bezwodnikiem kwasowym w obecności wody (co sprowadza się do reakcji soli z kwasem). Natomiast hydroksosole powstają w
reakcji wielowodorotlenowej zasady z kwasem (odpowiednikiem jest reakcja tlenku metalu z kwasem, lub tlenku metalu z
bezwodnikiem kwasowym i wodą), przy nadmiarze zasady, lub w reakcji soli z zasadą.
Reakcja NaOH z H
2
SO
4
przebieaga wg równania reakcji: 2NaOH + H
2
SO
4
→ Na
2
SO
4
+ 2H
2
O. Nadmiar kwasu zapewnimy
http://www.chemia.sos.pl
- 2 -
dodając cząsteczkę kwasu do powyższego równania:
2NaOH + 2H
2
SO
4
→ 2NaHSO
4
+ 2H
2
O, po podzieleniu stronami przez 2 (skróceniu przez 2) otrzymamy poszukiwane
równanie reakcji:
NaOH + H
2
SO
4
→ NaHSO
4
+ H
2
O
Węglan hydroksomiedzi(II):
Węglan miedzi(II) powstaje w reakcji tlenku miedzi(II) i CO
2
: CuO + CO
2
→ CuCO
3
. Nadmiar zasady uzyskamy z tlenku
miedzi(II) i wody (co prawda tlenek miedzi(II) nie reaguje z wodą, ale obecność wody jest konieczna dla stechiometrii):
CuCO
3
+ CuO + H
2
O → (CuOH)
2
CO
3
. Łącząc obydwa równania reakcji otrzymamy:
2CuO + H
2
O + CO
2
→ (CuOH)
2
CO
3
7.
Usunięcie twardości przemijającej polega na usunięciu wodorowęglanu wapnia, Ca(HCO
3
)
2
, z wody (dokładnie na
usunięciu jonów wapniowych). Pierwszy sposób polega na wykorzystaniu rozkładu tego związku pod wpływem temperatury:
Ca(HCO
3
)
2
temp.
CaCO
3
+ H
2
O + CO
2
I.
Drugi sposób polega na dodaniu do wody zawierającej wodorowęglan wapnia wodorotlenku wapnia. Wodorowęglan
wapnia powstaje w reakcji nadmiaru kwasu węglowego z Ca(OH)
2
. Niekorzystny stosunek kwasu węglowego do wodorotlenku
wapnia możemy zmienić dodając wodorotlenek wapnia, który w reakcji z wodorowęglanem wapnia daje węglan wapnia,
nierozpuszczalny w wodzie i wypadający z niej w postaci osadu:
II. Ca(HCO
3
)
2
+ Ca(OH)
2
→ 2CaCO
3
↓ + 2H
2
O
8.
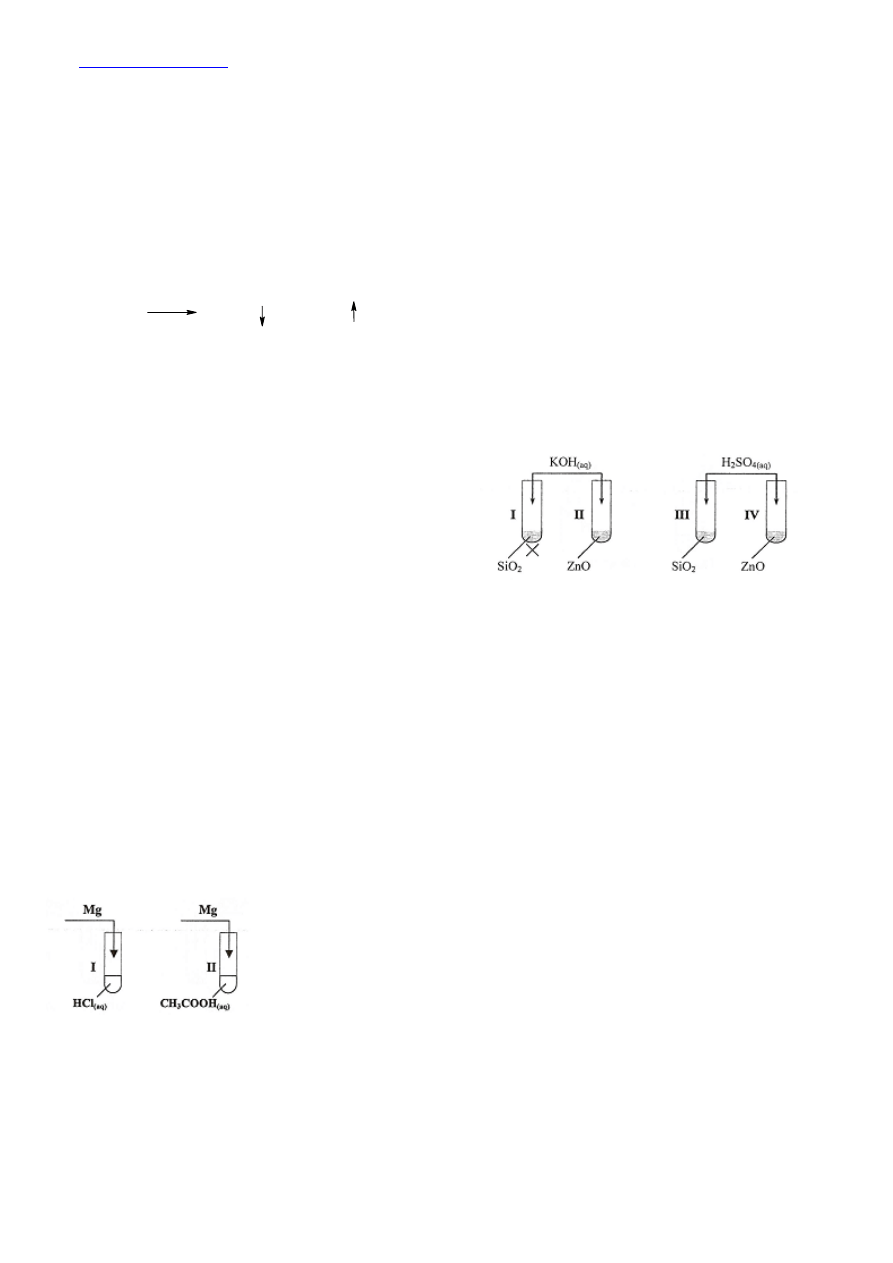
Tlenek krzemu jest tlenkiem niemetalu, ma więc właściwości
kwasowe, natomiast tlenek cynku jest tlenkiem metalu, ma więc
właściwości zasadowe. Tlenek cynku ma również właściwości
kwasowe (mówimy, że jest amfoteryczny). Dlatego spodziewamy się
reakcji w probówce I, II, oraz IV
Reakcje przebiegały w probówkach o numerach I, II i IV
Charakter chemiczny tlenku SiO
2
: kwasowy
Charakter chemiczny tlenku ZnO: amfoteryczny
9.
K
2
S jest solą słabego kwasu siarkowodorowego i mocnej zasady, natomiast K
2
SO
4
jest solą mocnego kwasu i mocnej
zasady. W podanym zestawie odczynników znajduje się mocny kwas H
2
SO
4
. Mocny kwas zawsze wypiera słaby kwas z
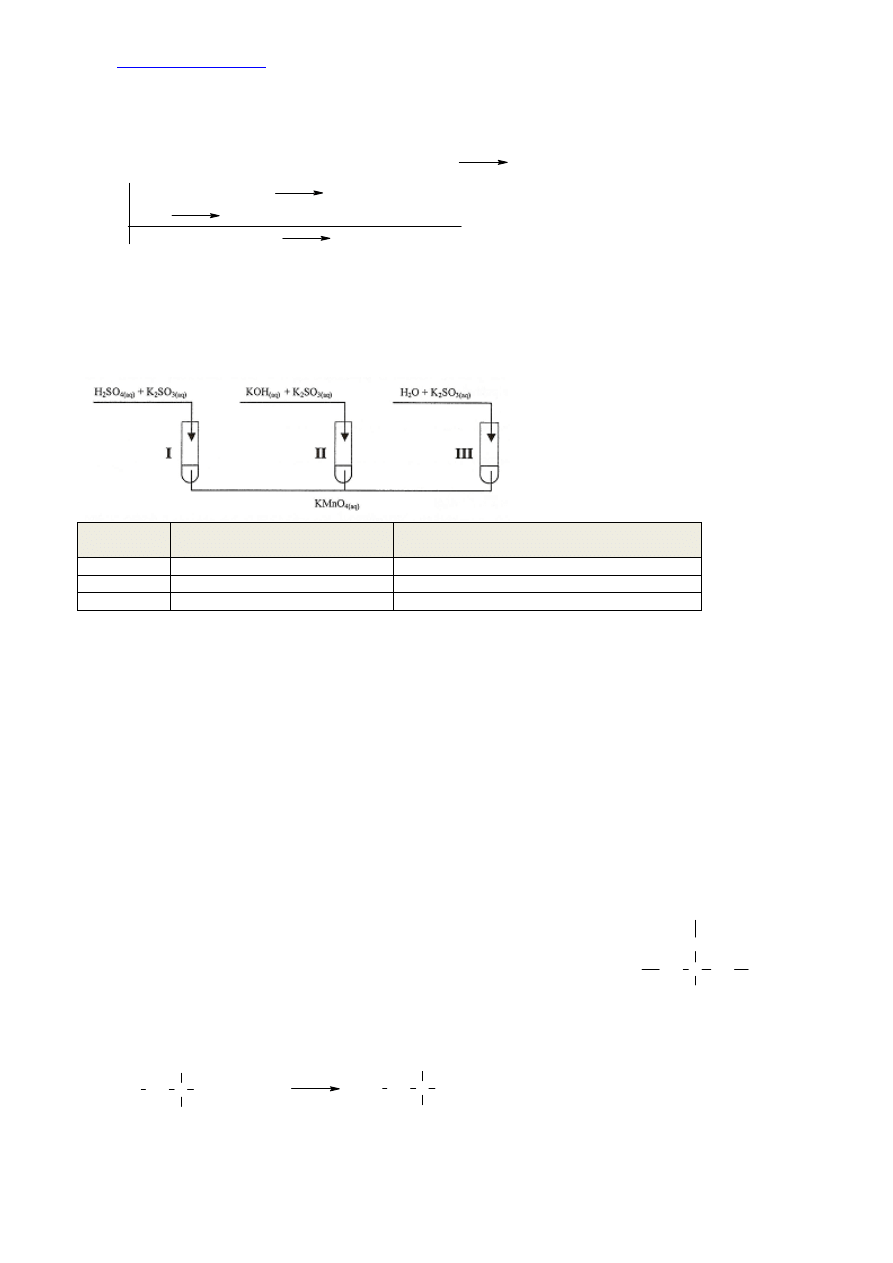
roztworu jego soli. Do identyfikacji tych związków zastosujemy więc kwas siarkowy(VI).
Wzór i nazwa odczynnika: H
2
SO
4
– kwas siarkowy(VI)
Obserwacje na podstawie których dokonano obserwacji:
K
2
S: po dodaniu kwasu siarkowego(VI) z probówki ulatniał się gaz o zapachu zgniłych jaj
K
2
SO
4
: po dodaniu kwasu siarkowego(VI) nie zaobserwowano żadnych zmian.
10.
K
2
S + H
2
SO
4
→ H
2
S↑ + K
2
SO
4
K
2
SO
4
+ H
2
SO
4
→ reakcja nie zachodzi.
11.
W doświadczeniu chcemy porównać moc kwasu solnego z kwasem octowym na
podstawie szybkości reakcji tych kwasów z magnezem. Chcąc porównać szybkości
reakcji (przez pomiar np. czasu przereagowania próbki magnezu z kwasami) musimy
zapewnić identyczne warunki
Informacja dotycząca magnezu: w obydwu próbkach muszą być identyczne ilości
wagowe magnezu, oraz próbki magnezu powinny mieć takie samo rozdrobnienie
Informacja dotycząca kwasów: kwasy powinny mieć takie samo stężenie molowe
(oczywiście, że kwas o większym stężeniu może reagować szybciej)
http://www.chemia.sos.pl
- 3 -
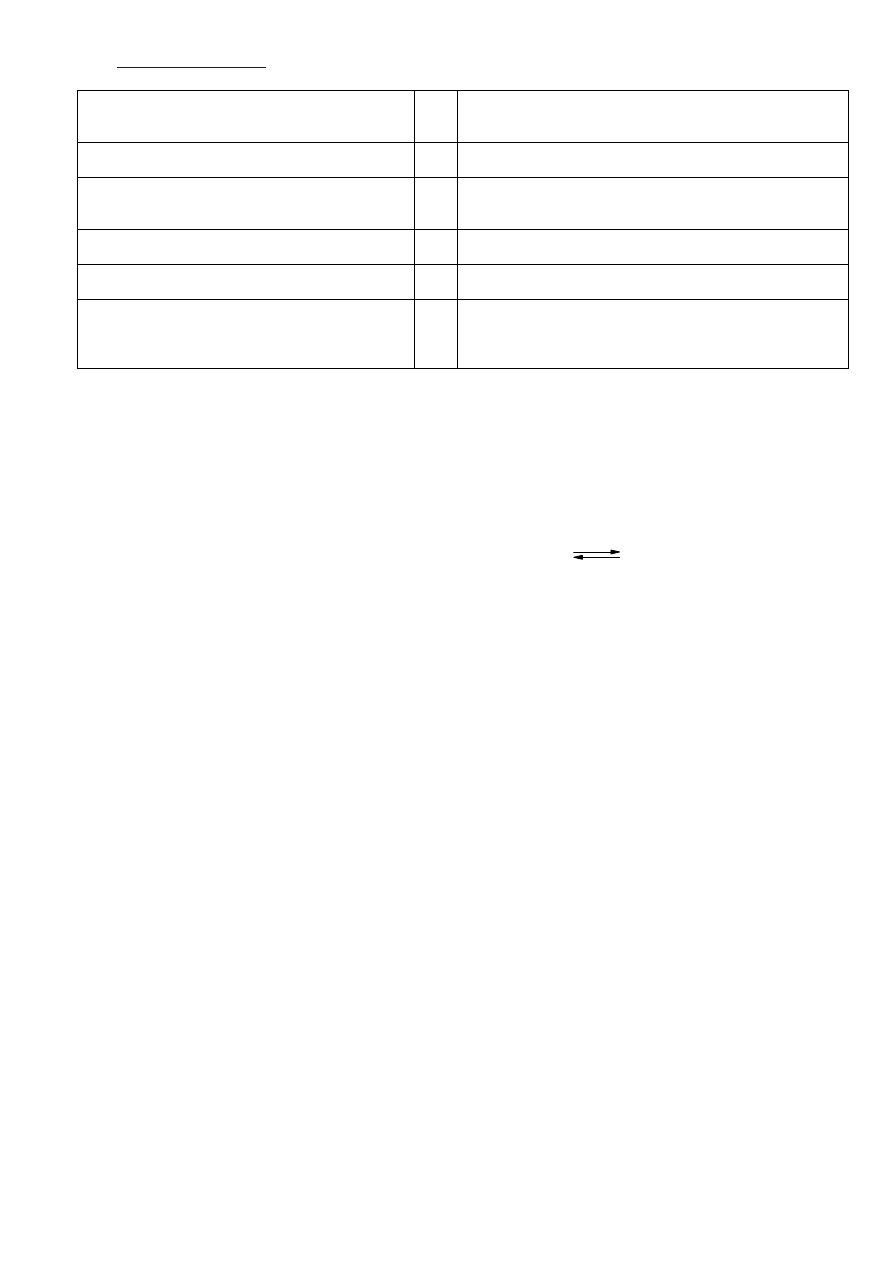
12.
1. W obu probówkach wydziela się gaz.
P
Kwas solny i octowy nie są kwasami utleniającymi i w reakcji z
metalem tworzy się sól i wodór. Z probówek wydziela się
zatem wodór (gaz)
2. W probówce I roztwór zmienia barwę. F
Sole magnezu są bezbarwne, więc roztwór nie może zmienić
barwy
3. W probówce I magnez rozpuszcza się szybciej.
P
Kwas solny jest mocniejszym kwasem od kwasu octowego,
szybciej więc reaguje z magnezem i w probówce z kwasem
solnym magnez roztworzy się szybciej
4. W obu probówkach roztwór zmienia barwę. F
Sole magnezu są bezbarwne, więc roztwory nie mogą zmienić
barwy
5. W probówce II magnez rozpuszcza się szybciej.
F
Kwas octowy jest słabszym kwasem od kwasu solnego i nie
może szybciej reagować z magnezem
6. W probówce II gaz wydziela się mniej intensywnie.
P
Jeżeli kwas octowy jest słabszym kwasem od kwasu solnego,
wolniej reaguje z magnezem, to intensywność wydzielania się
wodoru, która jest miarą szybkości reakcji z magnezem, jest
mniejsza.
Chcąc wyciągnąć wnioski dotyczące porównania mocy tych kwasów będziemy opierać się na obserwacjach nr 3 i nr 6
13.
Tlenek azotu(IV) o barwie brunatnej ulega częściowej dimeryzacji, tworząc bezbarwny N
2
O
4
. Jeżeli ochłodzenie próbki
zawierającej NO
2
powoduje odbarwienie się jej, to oznacza, że w próbce po ochłodzeniu znajduje się N
2
O
4
. Stan równowagi po
ochłodzeniu próbki przesunięty jest w kierunku tworzenia się N
2
O
4
.
Ochłodzenie próbki powoduje wzrost stężenia N
2
O
4
w układzie, natomiast podwyższenie temperatury powoduje
zmniejszenie się stężenia N
2
O
4
w układzie, a wzrost stężenia NO
2
.
14.
Dimeryzacji tlenku azotu(IV) przebiega zgodnie z równaniem reakcji
2NO
2(g)
N
2
O
4(g)
. Z równania reakcji
widzimy, że dimeryzacja przebiega ze zmniejszeniem ciśnienia, ponieważ z 2V po dimeryzacji otrzymujemy 1V. Stosując
regułę przekory (reguła Le Chateliera Brauna) możemy uzupełnić zdania:
1. Naciskając tłok naczynia, sprężamy gaz. Objętość gazu zmniejsza się, a zawartość naczynia odbarwia się (reguła
przekory).
2. Zmieniając położenie tłoka rozprężamy gaz – ciśnienie w naczyniu zmniejsza się. Objętość gazu zwiększa się, a
zawartość naczynia przyjmuje brunatne zabarwienie (reguła przekory).
Zwiększenie ciśnienia w układzie powoduje wzrost ilości N
2
O
4
.
15.
20cm
3
roztworu o gęstości 1,02g/cm
3
ma masę (d=m/V) m
1rozt
=dV=20cm
3.
1,02g/cm
3
=
20,4g
. W roztworze tym znajduje się
(c%=100%
.
m
s
/m
rozt
) m
1s
=c%
.
m
1rozt
/100%=3%
.
20,4g/100%=
0,612g
chlorku sodu.
80cm
3
roztworu o d=1,18g/cm
3
ma masę m
2rozt
=dV=80cm
3.
1,18g/cm
3
=
94,4g
. W roztworze tym znajduje się
m
2s
=c%
.
m
2rozt
/100%=24%
.
94,4g/199%=
22,656g
substancji rozpuszczonej (NaCl). Po zmieszaniu roztworów masa
otrzymanego roztworu m
rozt
=m
1rozt
+m
2rozt
=20,4g+94,4g=
114,8g
. Masa substancji rozpuszczonej w otrzymanym roztworze
m
s
=m
1s
+m
2s
=0,612g+22,656g=
23,268g
. Podstawiając otrzymane dane do wzoru na stężenie procentowe otrzymamy:
c%=100%
.
m
s
/m
rozt
=100%
.
23,268g/114,8g=
20,27%
.
Po zmieszaniu roztworów otrzymamy roztwór 20,27%.
16.
Jeżeli w 150cm
3
znajduje się 25mg jonów Cl
-
, to
w 1000cm
3
badanej wody znajduje się x mg jonów Cl
-
, czyli x=1000cm
3.
25mg/150cm
3
=
166,7mg
jonów chlorkowych.
W badanej wodzie stężenie jonów chlorkowych jest mniejsze od 250mg, a więc woda ta nadaje się do spożycia.
17.
pH definiowane jest jako pH=-log[H
+
] lub pH=-log[H
3
O
+
], czyli im roztwór jest bardziej kwasowy (większe stężenie jonów
wodorowych) to pH jest mniejsze. Największe stężenie jonów wodorowych będzie więc w soku żołądkowym (największy
charakter kwasowy), a najmniejsze stężenie jonów wodorowych będzie w soku trzustkowym.
Wzrost charakteru kwasowego: 2, 3, 4, 1

http://www.chemia.sos.pl
- 4 -
18.
Według teorii Brønsteda kwasem jest drobina, która może odłączyć proton, natomiast zasada może przyjąć proton od
kwasu. H
3
PO
4
jest kwasem, odłącza proton w procesie dysocjacji: H
3
PO
4
+ H
2
O
H
2
PO
4
-
+ H
3
O
+
. Podobnie drobiny
H
3
O
+
, H
2
PO
4
-
, oraz HPO
4
2-
zaliczamy do kwasów, ponieważ mogą oddać proton zasadzie:
H
3
O
+
+ H
2
O
H
2
O + H
3
O
+
H
2
PO
4
+
+ H
2
O
HPO
4
2-
+ H
3
O
+
HPO
4
2-
+ H
2
O
PO
4
3-
+ H
3
O
+
Jony wodorofosforanowe(V), diwodorofosforanowe(V), oraz fosforanowe(V) są zasadami ponieważ mogą przyłączyć
proton od kwasu H
3
O
+
:
HPO
4
2-
+ H
3
O
+
HPO
4
2-
+ H
2
O
H
2
PO
4
+
+ H
3
O
+
H
3
PO
4
+ H
2
O
PO
4
3-
+ H
3
O
+
HPO
4
2-
+ H
2
O
Jednakże tylko jony fosforanowe PO
4
3-
według teorii Brønsteda mogą pełnić rolę wyłącznie zasady.
19.
Tylko metale, które w szeregu napięciowym leżą przed wodorem ( w szeregu elektrochemicznym potencjał Me/Me
n+
mają
mniejszy od 0) mogą wypierać z roztworu kwasu wodór. Oznacza to, że metale leżące w szeregu napięciowym za wodorem nie
reagują z kwasami beztlenowymi. Miedź w szeregu napięciowym leży za wodorem (potencjał elektrochemiczny Cu/Cu
2+
E=+),34V), nie może więc reagować z kwasem solnym. Z kwasem solny będzie reagować jedynie tlenek miedzi(II).
Równanie jonowe zawiera jedynie jony, które ulegają reakcji. Aby je napisać musimy zapisać w postaci jonowej wszystkie
substancje, które ulegają dysocjacji po stronie substratów i produktów, a następnie zredukować wyrazy podobne:
CuO + 2HCl → CuCl
2
+ H
2
O
Tlenek miedzi(II) nie ulega dysocjacji, kwas solny jest mocnym kwasem, dysocjuje na jony wodorowe i chlorkowe, chlorek
miedzi(II) jest solą dobrze rozpuszczalną i ulega dysocjacji na jony miedzi(II) i jony chlorkowe, woda ulega dysocjacji tylko w
bardzo niewielkim stopniu:
CuO + 2H
+
+ 2Cl
-
→ Cu
2+
+ 2Cl
-
+ H
2
O po redukcji wyrazów podobnych otrzymamy poszukiwane równanie jonowe:
CuO + 2H
+
→ Cu
2+
+ H
2
O
20.
Z równania reakcji wynika, że w przesączu znajdują się jony miedzi(II), Cu
2+
, jony chlorkowe, Cl
-
. Z informacji wynika, że
pozostał jeszcze nieprzereagowany kwas solny (który był użyty w nadmiarze), czyli w roztworze znajdą się dodatkowo jony H
+
i
Cl
-
.
21.
Azotan potasu jest solą pochodzącą od mocnego kwasu azotowego(V) i mocnej zasady potasowej KOH. Wodny roztwór
takiej soli ma odczyn obojętny i nie może zakwasić gleby. Natomiast siarczan(VI) amonu, (NH
4
)
2
SO
4
, jest solą pochodzącą
od mocnego kwasu siakrowego(VI) i słabej zasady amonowej NH
3
.
H
2
O. W wodzie ulega hydrolizie kwasowej, powodując
zakwaszenie roztworu. Pisząc równanie hydrolizy możemy posłużyć się teorią kwasów i zasad Brønsteda. Siarczan amonu w
wodzie ulega dysocjacji:
(NH
4
)
2
SO
4
→ 2NH
4
+
+ SO
4
2-
Jony siarczanowe(VI) pochodzą od mocnego kwasu, a więc są bardzo słabą zasadą. Natomiast jony amonowe pochodzą od
słabej zasady (jest to sprzężony kwas ze słabą zasadą), a więc mają charakter kwasu:
NH
4
+
+ H
2
O
NH
3
+ H
3
O
+
22.
Sumaryczne, jonowe równanie reakcji otrzymamy sumując stronami cząstkowe, jonowe równania reakcji:
2NH
4
+
+ 3O
2
→ 2NO
2
-
+ 4H
+
+ 2H
2
O
2NO
2
-
+ O
2
→ 2NO
3
-
Suma:
2NH
4
+
+ 3O
2
+ 2NO
2
-
+ O
2
→ 2NO
2
-
+ 4H
+
+ 2H
2
O + 2NO
3
-
po redukcji wyrazów podobnych otrzymamy:
2NH
4
+
+ 4O
2
→ 4H
+
+ 2H
2
O + 2NO
3
-
http://www.chemia.sos.pl
- 5 -
23.
Uzgodnienie równania reakcji metodą bilansu elektronowego polega na znalezieniu atomów, które zmieniły swój stopień
utlenienia i rozpisaniu równań połówkowych z udziałem tych atomów (w równaniach połówkowych atomy muszą znajdować się
w takiej formie w jakiej istnieją w rzeczywistości):
Cr
2
O
7
2-
+ Zn + H
+
Cr
3+
+ Zn
2+
+ H
2
O
+VI
0
Cr
2
O
7
2-
+ 6e + 14H
+
2Cr
3+
+ 7H
2
O
Zn
Zn
2+
+ 2e
3
1
Cr
2
O
7
2-
+ 14H
+
+ 3Zn
2Cr
3+
+ 7H
2
O + 3Zn
2+
Uzgadniając równania połówkowe reakcji możemy dodawać jony wodorowe by związać atomy tlenu (jeżeli środowisko
reakcji jest kwasowe). Po zbilansowaniu równań połówkowych uzgadniamy ilości elektronów w każdym równaniu, a następnie
dodajemy je stronami. Po zredukowaniu wyrazów podobnych otrzymujemy zbilansowane równanie reakcji.
Rolę utleniacza w powyższej reakcji pełni Cr
2
O
7
2-
(utleniacz zmniejsza swój stopień utlenienia), natomiast rolę reduktora
w tej reakcji pełni Zn.
24.
Manganian(VII) potasu w zależności od środowiska
redukuje się do:
Mn
2+
w środowisku kwaśnym
MnO
2
w środowisku obojętnym
MnO
4
2-
w środowisku alkalicznym
Łatwo zapamiętać przechodząc od środowiska
kwaśnego przez obojętne do alkalicznego, stopień
utlenienia manganu zmienia się od II, przez IV do VI.
Numer
probówki
Wzór związku manganu
Nazwa związku manganu
I MnSO
4
siarczan(VI)
manganu(II)
II MnO
2
tlenek
manganu(IV)
III K
2
MnO
4
manganian(VI)
potasu
25.
Na podstawie analizy przebiegu opisanego doświadczenia można stwierdzić, że im niższe jest pH roztworu, w którym
zachodzi redukcja manganianów(VII) (niższe pH oznacza bardziej kwaśny roztwór), tym niższy stopień utlenienia osiąga
mangan w wyniku tej redukcji.
26.
Bez względu czy mamy do czynienia z elektrolizą, czy z ogniwem, na anodzie zawsze zachodzi reakcja utleniania. W
reakcji: 2Zn + O
2
+ 2H
2
O → 2Zn(OH)
2
cynk ulega utlenieniu, anodą jest więc cynk, a żelazo (gwóźdź stalowy) jest katodą.
27.
W opisanym procesie cynk utlenia się, natomiast tlen ulega redukcji. Pisząc równania reakcji elektrodowych musimy
pamiętać, że ilość elektronów oddawana na anodzie musi się równać ilości elektronów pobieranych na katodzie:
(A): 2Zn → Zn
2+
+ 4e
(K) O
2
+ 2H
2
O + 4e → 4OH
-
28.
Rzędowość alkoholi określamy na podstawie rzędowości atomu węgla połączonego
z grupą hydroksylową. W podanym przykładzie grupa hydroksylowa musi być połączona
z III-rzędowym atomem węgla, czyli atomem węgla, który połączony jest z 3 innymi
atomami węgla:
CH
2
C
CH
2
CH
2
OH
Otrzymany alkohol musi mieć 5 atomów węgla, więc do powyższego wzoru musimy dołączyć 1 atom węgla, a do
pozostałych wolnych wartościowości dołączyć atomy wodoru. Poszukiwanym alkoholem jest więc 2-metylobutan-2-ol. Alkohol
ten może powstać jedynie z 2-chloro-2-metylobutanu:
CH
3
CH
2
C
CH
3
Cl
CH
3
CH
3
CH
2
C
CH
3
OH
CH
3
+ KOH
H
2
O
+ KCl
http://www.chemia.sos.pl
- 6 -
29.
Z treści zadania wynika, że redukcja alkinów (węglowodorów z wiązaniem potrójnym) sodem w amoniaku prowadzi do
trans
-alkenu. Jeżeli redukcji poddajemy pent-2-yn, to powinniśmy otrzymać trans-pent-2-en. Przedrostek trans- oznacza, że
podstawniki znajdują się po przeciwnej stronie płaszczyzny przechodzącej przez atomy węgla związane wiązaniem
podwójnym:
CH
3
CH
2
C
C CH
3
C C
CH
2
H
CH
3
H
CH
3
Na/NH
3
30.
Grupą funkcyjną aldehydów jest grupa –CHO, natomiast dla ketonów –CO-. Ketonem, będącego izomerem podanego
aldehydu jest keton mający identyczną liczbę atomów węgla i wodoru co wyjściowy aldehyd:
C CH
3
O
CH
C
H
2
31.
Alkohole polihydroksylowe (zawierające więcej niż 1 grupę hydroksylową w cząsteczce) wykrywane są za pomocą
wodorotlenku miedzi(II). Wodorotlenek miedzi(II) w postaci niebieskiej galarety, w obecności alkoholu polihydroksylowego
roztwarza się (rozpuszcza się). Z alkoholem wielowodorotlenowym tworzy on kompleks barwy szafirowej.
Wzory i nazwy odczynników: siarczan(VI) miedzi(II), CuSO
4
, wodorotlenek sodu,
NaOH: CuSO
4
+ 2NaOH → Cu(OH)
2
+ Na
2
SO
4
Obserwacje: Galaretowaty, niebieski roztwór rozpuszcza się dając szafirowy, klarowny roztwór.
32.
Jeżeli alanina posiada wolną grupę aminową, to musi łączyć się z seryną grupą karboksylową. Glicyna ma wolną grupę
karboksylową, więc musi łączyć się z seryną grupą aminową. Seryna więc połączona jest zarówno grupą aminową jak i
karboksylową.
Grupa karboksylowa
Grupa aminowa
Symbole aminokwasów
Ala, Ser
Ser, Gly
Do podobnych wniosków dojdziemy rozrysowując wzór grupowy tripeptydu. Wzór tripetydu Ala-Ser-Gly możemy
przedstawić w postaci:
N
H
2
CH
C
H
3
C
O
N
H
CH
CH
2
OH
C
O
N
H
CH
2
C
O
OH
33.
Po prawdzie fenole (a w kwasie salicylowym grupa OH związana jest z pierścieniem aromatycznym) nie tworzą z
kwasami karboksylowymi estrów (aspirynę możemy uważać za ester). Kwas karboksylowy jest zbyt słabym odczynnikiem
acylującym. Do tego celu używa się silniejszych środków acylujących, takich jak bezwodnik octowy. Jednakże jeżeli już musimy
napisać równanie reakcji (papier jest cierpliwy i wszystko zniesie), to równanie reakcji przyjmie postać:
COOH
O H
C CH
3
O
H
O
COOH
O
C
CH
3
O
+
H
+
Δ
+ H
2
O
34.
Pytanie jest dla mnie niezrozumiałe. Mam wrażenie, że jest zapisane po polskiemu. Chodzi zapewnie o klasę związku.
Kwas salicylowy zaliczany jest do hydroksykwasów (hydroksykwasów aromatycznych).
http://www.chemia.sos.pl
- 7 -
35.
Warunkiem by związek był czynny optycznie (występowała izomeria optyczna) jest brak elementów symetrii takich jak
płaszczyzna symetrii, oraz środek symetrii (nie może być również osi inwersyjnych, ale ten warunek wykracza poza program
szkoły średniej). Warunkiem wystarczającym przy jednym atomie asymetrycznym jest obecność czterech różnych
podstawników przy tym atomie węgla. W przypadku podanego wzoru kwasu winowego można łatwo odnaleźć płaszczyznę
symetrii:
C
H
OH
C
H
OH
COOH
COOH
Podany izomer kwasu winowego nie jest optycznie czynny.
Ten izomer nazywany jest kwasem mezo-winowym.
36.
Reakcjami charakterystycznymi na obecność białka jest reakcja biuretowa oraz reakcja ksantoproteinowa. Reakcja
biuretowa polega no ogrzewaniu alkalicznego roztworu białka z wodorotlenkiem miedzi. W obecności białka jasnoniebieski
wodorotlenek miedzi kompleksowany jest przez biuret i zmienia barwę na granatową (wpadającą we fiolet).
Reakcja ksantoproteinowa polega na potraktowaniu białka stężonym kwasem azotowym(V). W obecności kwasu białko
zabarwia się na kolor żółty. (potraktowanie zabarwionego na żółto białka stężonym roztworem amoniaku powoduje zmianę
barwy na pomarańczową).
Nr probówki
Obserwacje
I
zmiana barwy na intensywnie granatową
II białko ścina się i zabarwia na kolor żółty.
Do probówki nr II dodano stężony kwas azotowy HNO
3
.
Wyszukiwarka
Podobne podstrony:
2 Próbna matura 2008 poz rozszerz odp
2 Próbna matura 2008 poz rozszerz odp
1 Próbna matura 2008 poz post odp
2 Próbna matura 2008 poz rozszerz
1 Próbna matura 2008 poz post odp
1 Próbna matura 2008 poz post
MATEMATYKA (rozszerzony) probna 2008, PROBNA MATURA GRU2007 Matematyka PR odp
MATEMATYKA (podstawowy)probna 2008 PROBNA MATURA GRU2007 Matematyka PP odp
Matura 2008 Niemiecki rozszerzony cz2 odp
Odpowiedzi Test przed probna matura 2008 Arkusz PR Wos
PROBNA MATURA GRU2007 Chemia PP odp
Odpowiedzi Test przed probna matura 2008 Arkusz PP Matematyka
Matura 2008 Włoski rozszerzony cz1
więcej podobnych podstron