
Marian Kuczek
Niesterydowe leki przeciwzapalne
Department of Experimental and Molecular Biology
University of Opole, Kominka 4, 45-035 Opole, Poland
Opole - 2007

1. Salicylany
W 1971 roku został opisany mechanizm działania przeciwzapalnego aspiryny i zasadniczo ten
mechanizm jest powszechnie znany [1]. Aspiryna, podobnie jak wszystkie estry kwasu octowego łatwo ulega
hydrolizie przez mało swoiste hydrolazy, z przewodu pokarmowego wchłaniany jest zarówno kwas
salicylowy jak i niezhydrolizowana aspiryna, również w wyniku transacylazowej aktywności lipaz powstają
estry kwasu salicylowego z kwasami tłuszczowymi. Do organizmu dostaje się zarówno kwas salicylowy jak
i mieszanina jego estrów.
Działanie aspiryny odkryte zostało pod koniec 19 wieku podczas poszukiwania leków
przeciwzapalnych na drodze modyfikacji znanego z medycyny ludowej kwasu salicylowego. Należy zwrócić
uwagę na to, że aspiryna zasadniczo ma podobne działanie do kwasu salicylowego, działa jednak w znacznie
mniejszych dawkach i znacznie słabiej drażni błony śluzowe niż ww. kwas salicylowy. Działanie kwasu
salicylowego, jako naparu z liści wierzby, znane jest od czasu Hippocratesa. W 1987 roku, chemik
zatrudniony w firmie Bayer Feliks Hoffman, przekazał kwas acetylosalicylowy Fredrichowi Bayerowi jako
ewentualne lekarstwo na artretyzm jego ojca. Do sprzedaży pod nazwą aspiryna został wprowadzony w 1899
roku.
Synteza prostaglandyn, leukotrienów i tromboksanów.
W wyniku działania hormonów stanu zapalnego na błony komórkowe uaktywniana jest fosfolipaza
(właściwie fosfolipazy, lecz ograniczmy się tylko do prostego przypadku fosfolipazy A
2
). Fosfolipaza
hydrolizuje fosfolipidy i fosfatydyloinozytole uwalniając z nich nienasycone kwasy tłuszczowe oraz
częściowo zhydrolizowany fosfolipid. Nienasycony kwas tłuszczowy, zwykle kwas arachidonowy,
rozważany jest dogmatycznie jedynie jako prekursor ww. hormonów tkankowych stanu zapalnego, lecz
działa też jako detergent, bowiem w środowisku zbliżonym do obojętnego tworzy mydło i ono jest głównym
czynnikiem lizującym błony komórkowe czyli dwuwarstwę fosfolipidową. Zjawisko znane jest od dawna
i przypisuje się je monoacylofosfatydylom zwanym "lizolecytynami". W wyniku tak rozwijającego się dalej
stanu zapalnego dochodzi do rozłożenia mikrosomów, w tym tzw. peroksysomów. Z peroksysomów
wydostaje się woda utleniona i enzymy biorące udział w jej zarówno wytwarzaniu jak i rozkładzie,
mianowicie peroksydazy. Peroksydazy, zasadniczo dwie grupy białek, hemoproteidy i selenoperoksydazy,
katalizują mało swoiście jonorodnikowy rozkład nadtlenku wodoru. Peroksydazy nazywane są zależnie od
produktu końcowego jaki był analizowany lub substratu jaki został użyty w badaniach. Są to:
lipooksygenazy, endonadtlenkowa syntaza prostaglandynowa, syntaza prostacyklinowa, syntaza
tromboksanów itp. W wyniku reakcji nadtlenków i jonorodników nadtlenkowych, ponadtlenkowych itp. z
podwójnymi wiązaniami nienasyconego kwasu tłuszczowego (dogmatycznie arachidonowego). Powstaje
dosyć złożona mieszanina kwasów zawierających ugrupowania hydroksynadtlenkowe, epoksynadtlenkowe,
epoksydowe, ketonowe, alkoholowe. Skutkiem dalszych reakcji i rekombinacji jonorodników, złożona
mieszanina stabilizuje się na względnie trwałych produktach zawierających podstawione grupami
alkoholowymi lub tlenem (ketonowe) alicykliczne pierścienie pięcioczłonowe, zwie się je prostaglandyny,
podstawione pierścienie piranowe - tromboksany, produkty reakcji epoksydów z cysteiną i glutationem
- leukotrieny. Związki te mają znaczenie jako hormony tkankowe stanu zapalnego. Powodują skurcze mięśni
gładkich (dychawica, poronienia, rozwolnienia), pobudzają receptory czuciowe (ból), działanie pirogenne
(gorączka). Jeżeli człowieka z rozległym stanem zapalnym napoi się roztworem salicylanu sodowego, kwas
salicylowy wchłonie się razem z kwasami tłuszczowymi i razem z nimi rozejdzie się po organizmie
a znaczna jego część znajdzie się zaadsorbowana w błonach komórkowych. Wbudowany w błony
komórkowe kwas salicylowy jest dobrym reduktorem i jako fenol łatwo wchodzi w reakcje podstawienia
elektrofilowego, czyli jest odczynnikiem nukleofilowym, wychwytuje zarówno jonorodniki jak i reaguje
z nadtlenkami - z jonem oksoniowym. Reaguje z nadtlenkiem wodoru i nadtlenkami organicznymi redukując
je do wody lub alkoholi, sam ulega utlenieniu do pochodnej chinonu, która tracąc CO
2
daje zamiast trującego
benzochinonu, małoreaktywny i dobrze rozpuszcalny związek - utleniony hydroksyhydro-chinon. Kwas
salicylowy, będąc konkurencyjnym substratem dla peroksydaz lub też reagując z substratem (nadtlenkiem)
jest inhibitorem syntezy trzech wyżej wymienionych grup hormonów stanu zapalnego.
Problem jednak w tym, że inhibitora konkurencyjnego trzeba dużo by zahamować reakcję, wypicie tak
dużej ilości roztworu salicylanu sodowego drażni śluzówkę żołądka i pacjent dostaje krwawych wymiotów.
Krwawe wymioty wywołują często histerię, a ta pogorszenie samopoczucia pacjenta. Te niepożądane
komplikacje udaje się częściowo ominąć aplikując choremu zamiast kwasu salicylowego, zacetylowany

kwas salicylowy czyli aspirynę. Aspiryna tylko częściowo ulega hydrolizie w jelitach, krwawienia
z jelit nie widać, bo erytrocyty są strawione i zabarwiają kał na czarno. Strawioną krew w kale można
wykryć się u prawie wszystkich ludzi przewlekle zażywających salicylany. Krew niestrawiona
wskazuje na krwawienie z odbytnicy, czyli na stan zapalny odbytnicy. Zjawisko teraz pospolite,
przyczyny zostaną opisane przy okazji agonistów histaminy, lub znacznie groźniejsze, nowotwory
odbytnicy. Przypuszczalnie to właśnie chęć pozbycia się przerażonych i uciążliwych pacjentów
zaważyła na dopuszczeniu przez PZH do sprzedaży tak niehigienicznych urządzeń sanitarnych jakie
teraz wyłącznie są sprzedawane.
Tylko takie działanie, czyli zbliżone do kwasu salicylowego, aspiryny było uważane za jedyny
mechanizm jej działania i takie też przetrwało w literaturze podręcznikowej. W 1968 roku Bloch
odkrył zjawisko trucia bakterii kwasami tłuszczowymi z potrójnym wiązaniem, czyli acetylenowymi
analogami nienasyconych kwasów tłuszczowych. Związki tego typu, podobne do naturalnych
substratów enzymów ale zawierające ugrupowanie, które w wyniku naturalnego oddziaływania
substratu z enzymem ulega przemianie w ugrupowanie reaktywne, reagujące natychmiast
z jakimkolwiek odczynnikiem nukleofilowym, nazwał substratami samobójczymi enzymów, gdyż to
zazwyczaj białko enzymu reaguje z tymże "uaktywnionym substratem". Tenże Bloch zaproponował
zupełnie nowe wówczas podejście do zagadnienia planowania syntezy leków. Dzięki koncepcji
Blocha udało się wyjaśnić mechanizm działania zarówno silnych trucizn jak i wielu leków, wyjaśnić
mechanizmy działania związków zwanych antagonistami i agonistami (neuromediatorów
i hormonów). Aspiryna była jednym z pierwszych leków, którego mechanizm wyjaśniono w oparciu
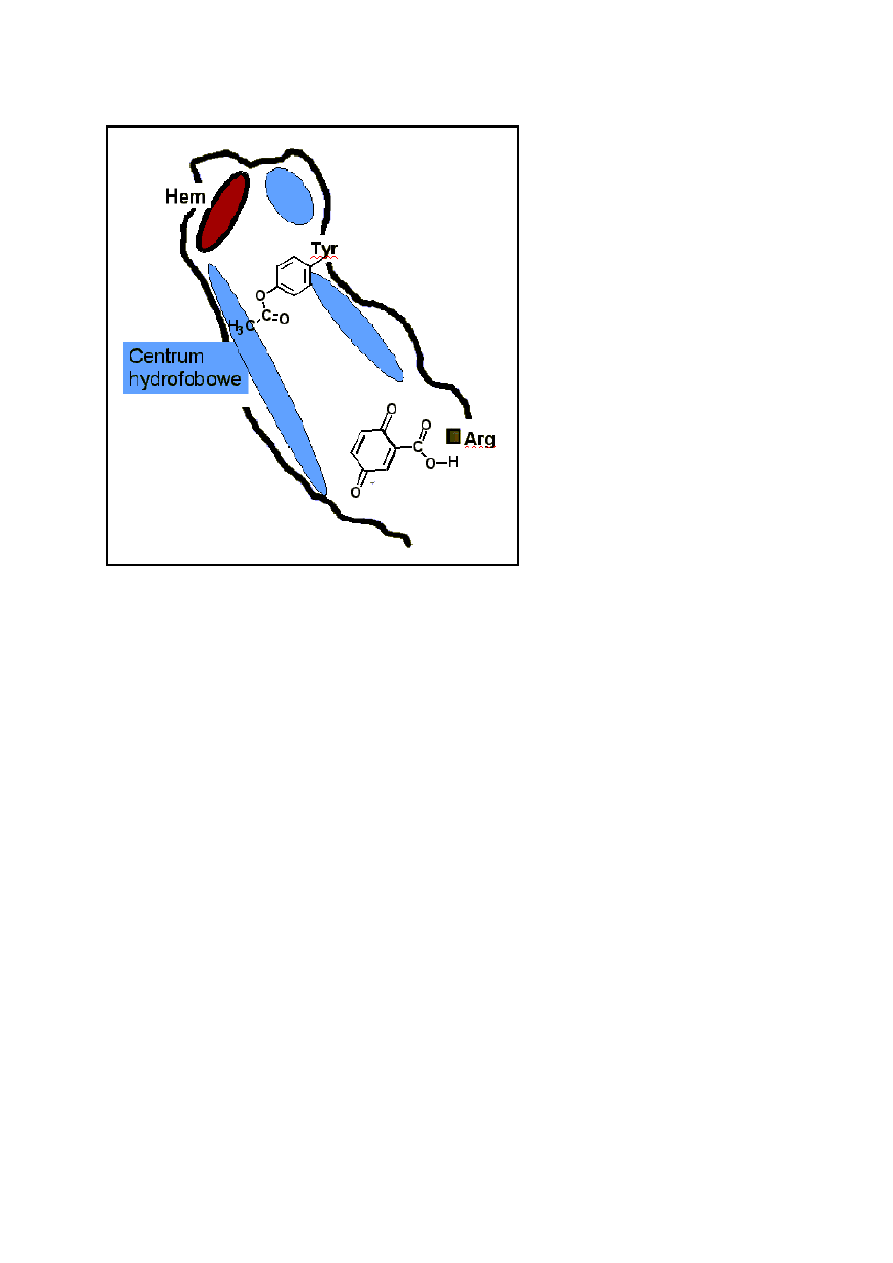
o koncepcję Blocha. Po prostu, w wyniku przyłączenia tlenu do pierścienia fenylowego kwasu
acetylosalicylowego, odrywa się kation acetylowy, który natychmiast acetyluje histydynę przy
hemowej grupie peroksydazy i inaktywuje ją. Acetyluje także i inne grupy funkcyjne, co właśnie dla
wygody zaznaczono na rysunku. Ta prosta reakcja wyjaśnia dlaczego do przeciwzapalnego
i immunosupresyjnego działania wystarcza kilkakrotnie mniejsza dawka aspiryny niż kwasu
salicylowego.
W Polsce aspiryna nosi nazwę polopiryny, jest to ten sam związek i ma tą samą wadę co
aspiryna, mianowicie jest tani i mało toksyczny, czyli sprzedaż jego jest mało opłacalna.
Wykorzystano zatem bardzo rzadko spotykane zjawisko uczulenia na aspirynę. Zjawisko to zostało
odkryte w krajach, w których występuje wyjątkowe zagęszczenie lekomanów gdyż bywa tylko po
zjedzeniu kilku gramów kwasu acetylosalicylowego w przeciągu doby, nie obserwuje się tego we
większości krajów europejskich. Po kilkakrotnym zjedzeniu kilku gramów tego związku, może
wystąpić uczulenie na aspirynę (bywa haptenem) i liza erytrocytów z zaadsorbowaną w ich błonach
aspiryną. Zaproponowano zatem zastąpienie aspiryny N-acetylo-4-aminofenolem (para-acetamol) lub
jego eterową pochodną 4-etoksy-N-acetyloanilidem (fenacetyna). Oba związki są niezmiernie
toksyczne, uszkadzają dosyć swoiście nerki, nazywa się to nerka fenacetylowa. Schorzenie
powszechnie obserwowane jest w USA gdyż przeciętny Amerykanin może przeżyć tylko 7 g / 24 h
fenacetyny lub p-acetamolu, mniejsze dawki ulegają detoksykacji. Na związki tego typu szczególnie
wrażliwe są dzieci i koty. Dla dziecka i kota często wystarcza jedna tabletka praacetamolu by
wywołać mocznicę i śpiączkę. Tym sposobem wracając do leków wynalezionych w 19 stuleciu na
drodze modyfikacji acetanilidu zapobiega się nagromadzaniu w populacji osobników z przewlekłymi
stanami zapalnymi, ale nie jest to jedyny i nie najważniejszy sposób ratowania dochodów towarzystw
ubezpieczeniowych.
Salicylanom przypisywane jest działanie antysklerotyczne. Biorąc pod uwagę, że są to leki
przeciwzapalne, wykazują działanie antybakteryjne, grzybobójcze i też spotyka się opinie, że
przeciwwirusowe, a przyczyną powstawania złogów cholesterolu w naczyniach jest przewlekły stan
zapalny tych naczyń, opinię tę należy uznać za słuszną. Natomiast rozszerzanie tego na rozpuszczanie
złogów cholesterolu, sprzyjanie wydalaniu kwasu moczowego, to podobnie jak Inne pochodne kwasu
salicylowego obszernie omówił dr Henryk S. Różański na swoich stronach internetowych [2].
Niewiele można dodać do tego ogromnego dzieła, może dwie uwagi. Estry kwasu salicylowego
(salicylan metylu i etylu), aldehyd salicylowy, podobnie jak wiele innych estrów kwasów
aromatycznych i aldehydów aromatycznych charakteryzują się intensywnym zapachem. Doskonale
odstraszają i trują pajęczaki. Wydaje się, że najlepszym z nich jest aldehyd anyżowy. Są całkowicie
bezpieczne dla takich dużych zwierzątek jak ludzie, zdychają od nich zwierzątka obywające się bez

wody, roztocza. Trudno powiedzieć, czy to naciski lobby farmaceutów i lekarzy, podyktowane
bezwzględnym dążeniem do zysku, czy to po prostu, dano małpie brzytwę do ręki, czy to ideologia
eugenizmu. W czasach, gdy wywołano katastrofę ekologiczną trując owady, niszę ekologiczną
wypełniły roztocza, to co jest główną przyczyną chorób alergicznych, wektorem chlamydii i
patogennych grzybów, pod bzdurnym, fałszywym pretekstem walki z narkomanią oraz rakiem,
wprowadzono zakaz sprzedaży tych związków. Można to kupić, razem z fenolami
wielowodorotlenowymi pod nazwą diegieć, ale za kosmiczną cenę. Druga uwaga dotyczy saligeniny,
alkohol salicylowy, związek nietrwały, silnie reaktywny i raczej niebezpieczny.
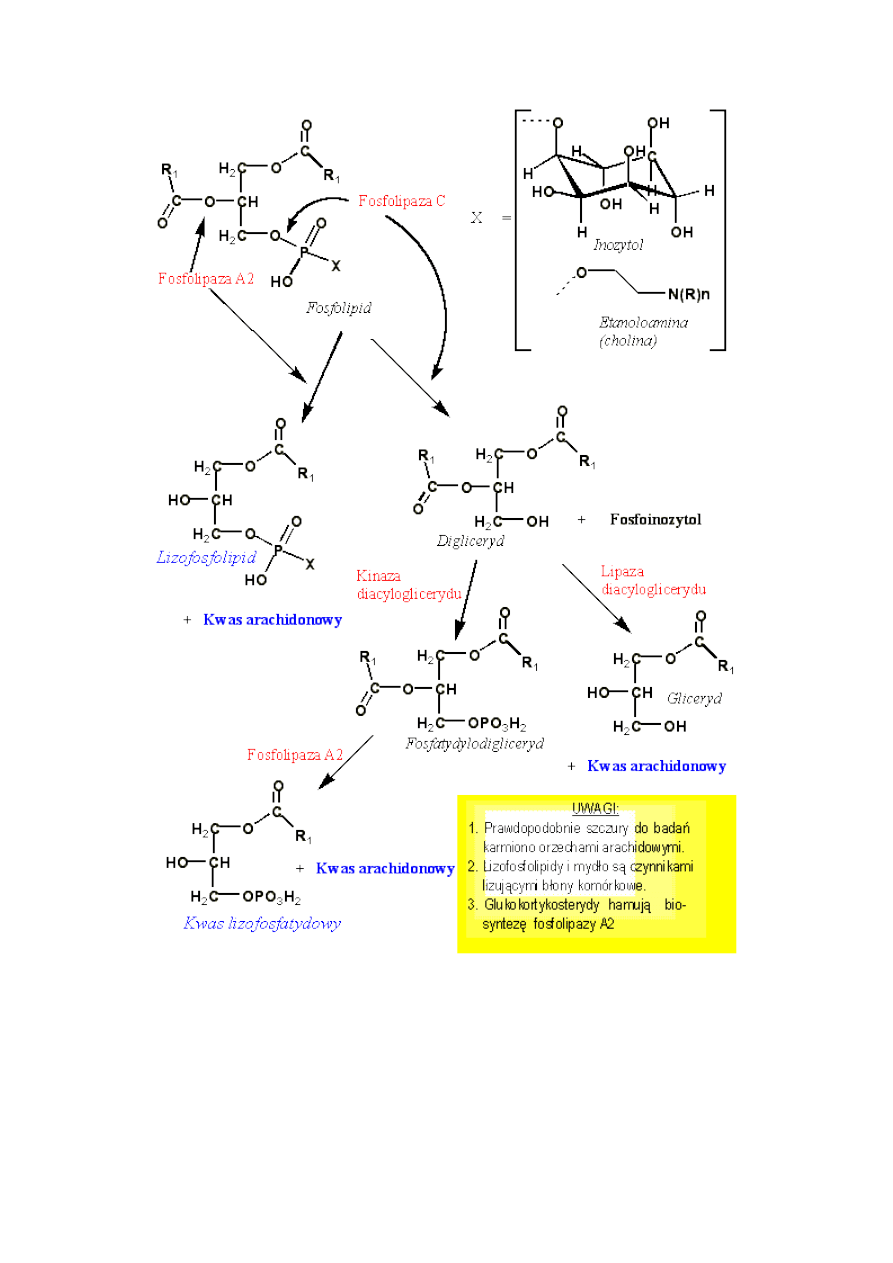
Reakcje powstawania prekursora prostaglandyn, tomboksaniów i leukotrienów.
Badania były prowadzone w latach sześćdziesiątych, wtedy też założono ogromne uprawy orzechów
arachidowych w Afryce, olej z tych orzechów był stosowany do produkcji margaryny. Po odkryciu
aflatoksyn, wytwarzanych przez występujący tam często Aspergillus flavus, trochę przycichło z tymi
arachidami. Niniejszym sugeruje się tutaj zachowanie krytycyzmu w sprawie prezentowanych wiadomości
i opinii.
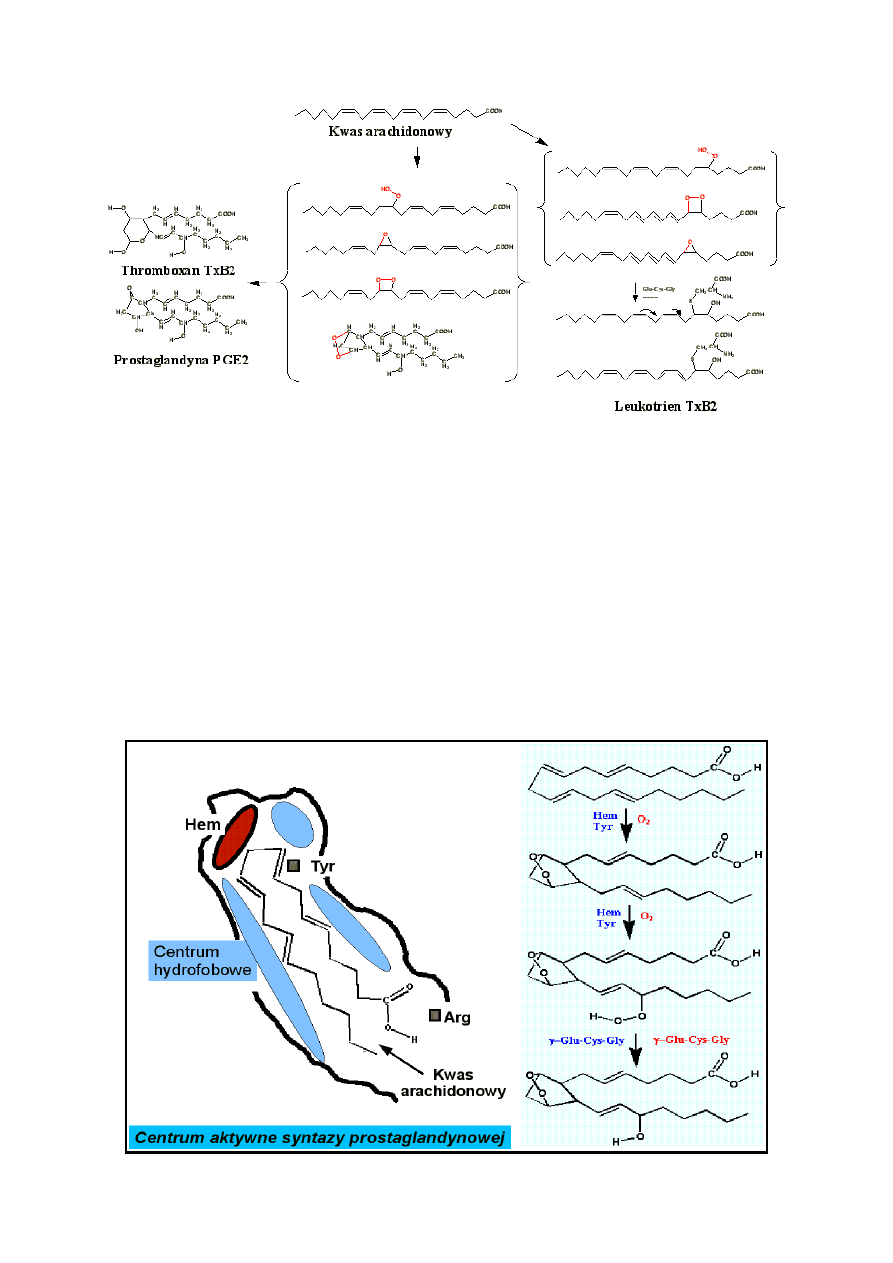
Zazwyczaj jako miejsce i mechanizm działania prostaglandyn podawane jest indukcja i rozszerzanie stanu
zapalnego. Odpowiedź zwięzła i konkretna wydaje się być prosta jeżeli zważyć, że wszystkie pośrednio
powstające związki są wysoce reaktywne, działają wszędzie, wszystko niszczą. Razem z lizofosfolipidami
i mydłem lizują błony komórkowe. Zależnie od drobnych zmian w otoczeniu, czasem wydaje się,
że aktywują a czasem, że hamują enzymy błonowe (cyklazę adenylową). Tego typu reakcje, zaliczane do
reakcji oscylacyjnych, są wyjątkowo wrażliwe na "warunki początkowe", w przypadku drobnych zmian
w składzie roztworu mogą prowadzić do zupełnie różnych stanów końcowych. Szerzej wyjaśnia to teoria
chaosu i katastrof. Występuje tutaj sprzężenie zwrotne dodatnie, prostaglandyna katalizuje swoje
wytwarzanie. Regulacja, właściwe zatrzymanie reakcji autokatalitycznej, jest bardzo łatwa do
uszkodzenia. Znacznie trudniej jest naprawić niż coś zepsuć, czyli ingerencja w układ immunologiczny jest
bardzo niebezpieczna.
Podobnie jak z oleju powstaje pokost, prostaglandyny, tomboksany, leukotrieny, powstają z nienasyconych
kwasów tłuszczowych. Co z nich powstanie zależy, tak jak dla reakcji łańcuchowych, od przypadku i od
dostępnych w roztworze odczynników nukleofilowych. Często używane jest nazewnictwo typowe dla reakcji
rodnikowych. W tym jednak przypadku, w roztworze wodnym, mechanizm reakcji jest raczej jonowy.
Reaktywne wiązania typu epoksydów i nadtlenków zaznaczono kolorem czerwonym.
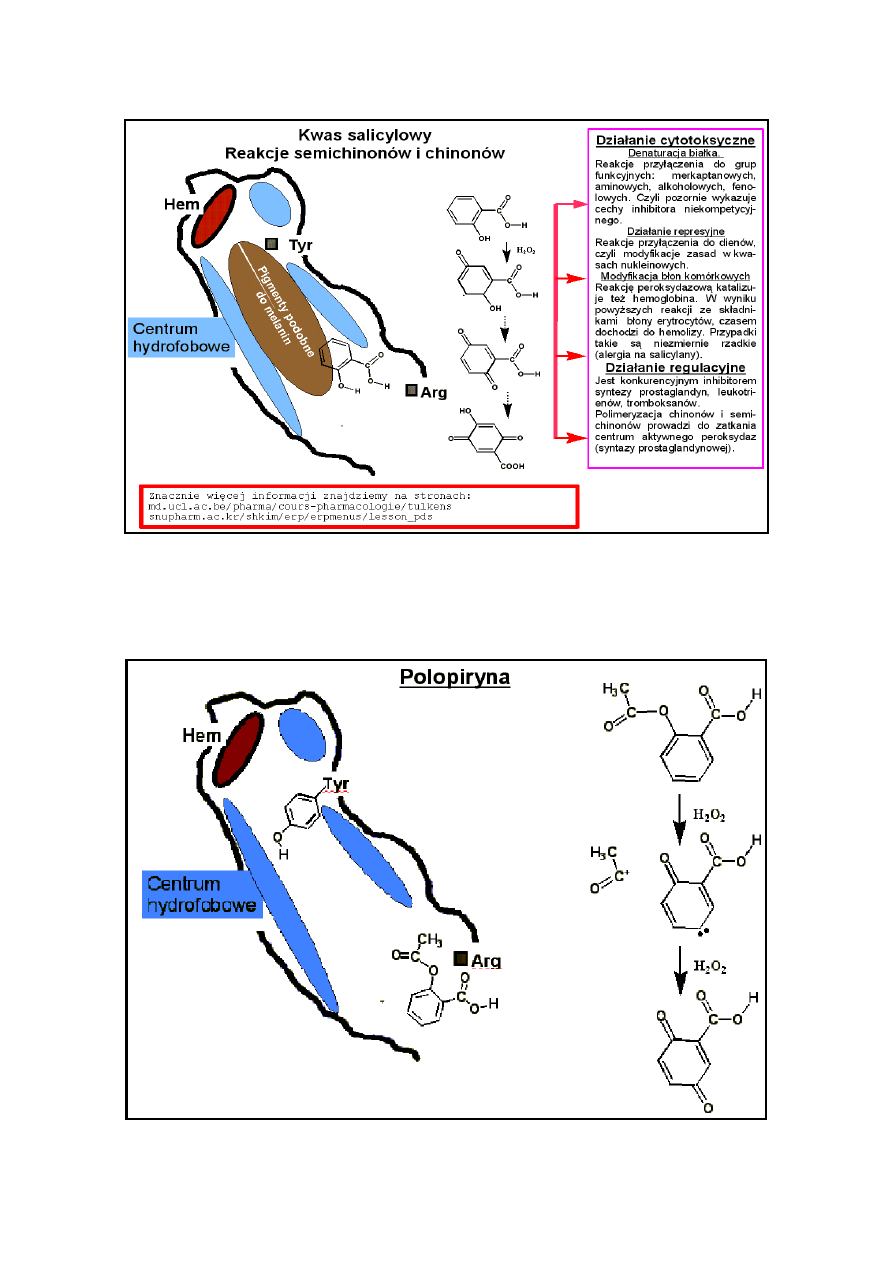
Działanie cytotoksyczne kwasu salicylowego w wyniku reakcji wymienionych na rysunku jest możliwe, niemniej
można mieć wątpliwości czy obserwuje się takie działanie przy stosowaniu dawek salicylanu mniejszych niż
ogólnie toksyczne. Jako silny kwas i raczej hydrofilowy jest zbyt łatwo, tak jak produkty jego metabolizmu,
wydalany. Ma działanie antyseptyczne i możliwe że z tego powodu zmniejsza nieco limfocytozę.
1. J.R. Vane. 1971. Inhibition of Prostaglandin Synthesis as a mechanism of action for aspirine like - drugs. Nat.
New Biol. 231 (25) 232-5.
2. H. St. Różański: www.luskiewnik.strefa.pl
Aspiryna, podobnie do wielu innych
pochodnych kwasu salicylowego, jest
stosunkowo łagodnym i bezpiecznym
lekiem przeciwzapalnym. Produkowana
jest w wielu krajach pod różnymi
nazwami. W Polsce była produkowana
od dawna pod nazwą aspiryna. Po 1960
roku, przypuszczalnie ze względu na
zastrzeżenie nazwy przez firmę Bayer,
zmieniono nazwę na polopiryna. Jest
niezwykle słabo toksyczna. W dawkach
powyżej 5 g/dobę wykazuje łagodne
działanie immunosupresyjne.
Wyszukiwarka
Podobne podstrony:
Konspekt1 Niesteroidowe leki przeciwzapalne
Niesteroidoew leki przeciwzapalne 24,10,2012
Niesteroidowe leki przeciwzapalne (2)
NLPZ, Niesterydowe leki przeciwzapalne
NLPZ, Niesterydowe leki przeciwzapalne
Niesteroidowe leki przeciwzapalne w leczeniu RZS2
Niesteroidowe leki przeciwzapalne
NIESTEROIDOWE LEKI PRZECIWZAPALNE
FARMAKOLOGIA, 24 Niesterydowe leki przeciwzapalne
NIESTEROIDOWE LEKI PRZECIWZAPALNE, farmakologia
Niesterydowe leki przeciwzapalne konspekt
Niesteroidowe leki przeciwzapalne (NLPZ) dr Bielecka
Niesterydowe leki przeciwbólowe, PIELĘGNIARSTWO, anestezjologia i pielęgniarstwo anestezjologiczne,
niesterydowe leki przeciwzaplne
Niesteroidowe leki przeciwzapal Nieznany
Niesterydowe leki przeciwzapalne (4), PIELĘGNIARSTWO, anestezjologia i pielęgniarstwo anestezjologic
Niesteroidowe leki przeciwzapalne, Farmakologia
Niesteroidowe leki przeciwzapalne, 3 rok stoma, farma, I kolo F
więcej podobnych podstron