
PRZEMIANY ENERGETYCZNE
dr in
ż
. Andrzej Wawszczak
andrzej.wawszczak@p.lodz.pl

PODSTAWOWE POJ
Ę
CIA
układ jednostek SI:
– jednostki podstawowe (
m
,
kg
,
mol
,
s
,
K
,
A
,
cd
);
– jednostki pochodne (
N
,
Pa
,
J
,
W
);
wielokrotno
ś
ci –
M
mega,
k
kilo,
m
mili ... ,
.
.
.

PODSTAWOWE WIELKO
Ś
CI FIZYCZNE STOSOWANE W TERMODYNAMICE
wielko
ść
fizyczna
–
warto
ść
liczbowa
i
jednostka miary
– np.
12
kg
,
15
m
,
34
s
.
masa
–
1
kg
, kilogram, (
G
lub
m
),
siła
–
1
N
=
1
kg·m/s
2
, niuton, (
F
),
ilo
ść
substancji
–
1
mol
, mol, (
n
),
temperatura
–
1
K
(bezwzgl
ę
dna), kelwin, (
T
=
t
+
273,15
) lub
1
ºC
, stopie
ń
celcjusza, (
t
=
T
–
273,15
),
ci
ś
nienie
–
1
Pa
, paskal, (
p
),
obj
ę
to
ść
–
1
m
3
, metr sze
ś
cienny, (
V
),
obj
ę
to
ść
w warunkach normalnych
–
1
m
n
3
, normalny metr sze
ś
cienny, (
V
n
)
– jest to obj
ę
to
ść
gazu najcz
ęś
ciej przy:
t
=
0
°
C
,
p
=
101325
Pa
,
– jest to obj
ę
to
ść
gazu najcz
ęś
ciej przy:
t
=
0
°
C
,
p
=
101325
Pa
,
energia
–
1
J
, = 1
N·m
, d
ż
ul, (
E
),
1
kWh
=
3600
kJ
, kilowatogodzina,
praca
–
1
J
, d
ż
ul, (
L
),
ciepło
–
1
J
, d
ż
ul, (
Q
),
strumie
ń
masy
–
1
kg/s
, kilogram na sekund
ę
, (
G
lub
m
),
strumie
ń
obj
ę
to
ś
ci
–
1
m
3
/s
, metr sze
ś
cienny na sekund
ę
, (
V
),
moc
(
strumie
ń
energii
) –
1
W
=
1
J/s
, wat, (
P
=
E
),
wielko
ś
ci fizyczne wła
ś
ciwe
oznaczane mał
ą
liter
ą
– odniesione do masy –
v
,
u
,
s
,
i
,
q
... ,
– odniesione do mola – (
Mv
), (
Mu
), (
Ms
), (
Mi
), (
Mq
).
.
.
.
.

równanie bilansu substancji:
G
d
=
∆
G
u
+ G
w
G
d
- masa substancji doprowadzonej do układu
G
w
- masa substancji wyprowadzonej z układu
∆
G
u
- przyrost masy substancji w układzie,
∆
G
u
= G
d
- G
w
analogicznie:
n
d
=
∆
n
u
+ n
w
V
nd
=
∆
V
nu
+ V
nw
warunek ci
ą
gło
ś
ci strugi w przewodzie (kanale):
ρρρρ
⋅⋅⋅⋅
⋅⋅⋅⋅
====
w
A
G
&
v
G
G
w
A
V
⋅⋅⋅⋅
====
ρρρρ
====
⋅⋅⋅⋅
====
&
&
warunek ci
ą
gło
ś
ci strugi w przewodzie (kanale):
gdzie: A – pole powierzchni przekroju kanału [ m
2
],
ρ
– g
ę
sto
ść
, [ kg/m
3
]
v – obj
ę
to
ść
wła
ś
ciwa, [ m
3
/kg ]

TERMICZNE RÓWNANIE STANU GAZÓW DOSKONAŁYCH I PÓŁDOSKONAŁYCH
Ogólna posta
ć
termicznego rownania stanu:
F(p,T,v)=0
Gaz doskonały
– umowny gaz, ktorego drobiny nie przyci
ą
gaj
ą
si
ę
wzajemnie, s
ą
niesko
ń
czenie małe i sztywne (brak drga
ń
wewn
ą
trz drobin).
Gaz półdoskonały
– ró
ż
ni si
ę
od doskonałego tym,
ż
e atomy w drobinach powi
ą
zane s
ą
spr
ęż
y
ś
cie, wyst
ę
puj
ą
drgania wewn
ą
trz drobin.
Wi
ę
kszo
ść
gazów wyst
ę
puj
ą
cych w urz
ą
dzeniach cieplnych traktowa
ć
mo
ż
na jako
doskonałe lub półdoskonałe (za wyj
ą
tkiem gazow pod wysokim ci
ś
nieniem i pary – np.
pary wodnej – do obliczania parametrow tych czynnikow nale
ż
y stosowa
ć
rownania
stanu gazow rzeczywistych, wykresy (wykresy parowe) lub tablice (tablice parowe)).
Dla dowolnej ilo
ś
ci gazu doskonałego lub półdoskonałego zale
ż
no
ść
opisuj
ą
c
ą
stan
czynnika w sposób wystarczaj
ą
cy wyra
ż
a równanie stanu Clapeyrona:
czynnika w sposób wystarczaj
ą
cy wyra
ż
a równanie stanu Clapeyrona:
p · V = G · R · T
lub dla obj
ę
to
ś
ci wła
ś
ciwej:
p · v = R · T
p · V = n · (MR) · T
(MR) = 8,314 kJ/(kmol·K) – uniwersalna stała gazowa,
M – masa molowa, kg/kmol, liczbowo masa molowa jest równa masie atomowej,
G – masa substancji, kg,
n – ilo
ść
substancji, kmol,
V – obj
ę
to
ść
substancji, m
3
.
Przeliczenie na warunki normalne:
[ V ] = [ m
3
]
[ p ] = [ Pa ]
[ T ] = [ K ]
T
p
V
10
696
,
2
T
p
V
101325
15
.
273
T
T
p
p
V
V
3
n
n
n
⋅⋅⋅⋅
⋅⋅⋅⋅
⋅⋅⋅⋅
====
⋅⋅⋅⋅
⋅⋅⋅⋅
====
⋅⋅⋅⋅
⋅⋅⋅⋅
====
−−−−

PIERWSZA ZASADA TERMODYNAMIKI
Sposoby doprowadzania energii do układu:
praca mechaniczna
,
ciepło
.
CIEPŁO DOPROWADZONE DO UKŁADU (
∆
Q
)
JEST RÓWNE SUMIE PRZYROSTU ENERGII WEWN
Ę
TRZNEJ UKŁADU (
∆
U
)
ORAZ PRACY WYKONANEJ PRZEZ TEN UKŁAD (
∆
L
).
∆
Q =
∆
U +
∆
L
lub dla wielko
ś
ci wła
ś
ciwych
∆
q =
∆
u +
∆
l
∆
q =
∆
u +
∆
l
ENTALPIA
I = U + p · V
lub dla wielko
ś
ci wła
ś
ciwych
i = u + p · v
[ Q ] = [ U ] = [ L ] = [ I ] = [ J ] lub [ kJ ],
[ V ] = [ m
3
]
[ p ] = [ Pa ]
[ q ] = [ u ] = [ l ] = [ i ] = [ J/kg ] lub [ kJ/kg ],
[ v ] = [ m
3
/kg ]
U
jest energi
ą
wewn
ę
trzn
ą
układu natomiast (
p · V
) to t.zw. praca przetłaczania.
Pierwsz
ą
zasad
ę
termodynamiki mo
ż
na równie
ż
zapisa
ć
wykorzystuj
ą
c entalpi
ę
:
∆
Q =
∆
I - V ·
∆
p
lub dla wielko
ś
ci wła
ś
ciwych
∆
q =
∆
i - v ·
∆
p

CIEPŁO WŁA
Ś
CIWE
(pojemno
ść
cieplna)
Ilo
ść
ciepła potrzebna do podniesienia temperatury 1 kg ciała o
∆
t mo
ż
na wyrazi
ć
wzorem:
∆
q = c ·
∆
t
gdzie:
c - współczynnik proporcjonalno
ś
ci zale
ż
ny od cieplnych wła
ś
ciwo
ś
ci ciała,
nazywamy ciepłem wła
ś
ciwym, [ c ] = [ kJ/(kg·K) ].
Wielko
ść
ta zale
ż
y nie tylko od rodzaju ciała i zakresu temperatur, w którym ciało jest
ogrzewane lub ochładzane. Dla gazów ciepło wła
ś
ciwe mo
ż
e mie
ć
wiele warto
ś
ci,
zale
ż
nie od sposobu doprowadzania ciepła.
W termodynamice szczególne znaczenie ma ciepło wła
ś
ciwe je
ż
eli doprowadzi si
ę
ciepło do czynnika termodynamicznego przy stałej obj
ę
to
ś
ci (c = c
v
) oraz przy stałym
ci
ś
nieniu (c = c
p
).
Dla gazów doskonałych ró
ż
nica ciepła wła
ś
ciwego przy stałym ci
ś
nieniu i przy stałej
obj
ę
to
ś
ci jest wielko
ś
ci
ą
stał
ą
i równ
ą
indywidualnej stałej gazowej R:
c
p
- c
v
= R
oraz wykładnik adiabaty:
v
p
c
c
====
κκκκ
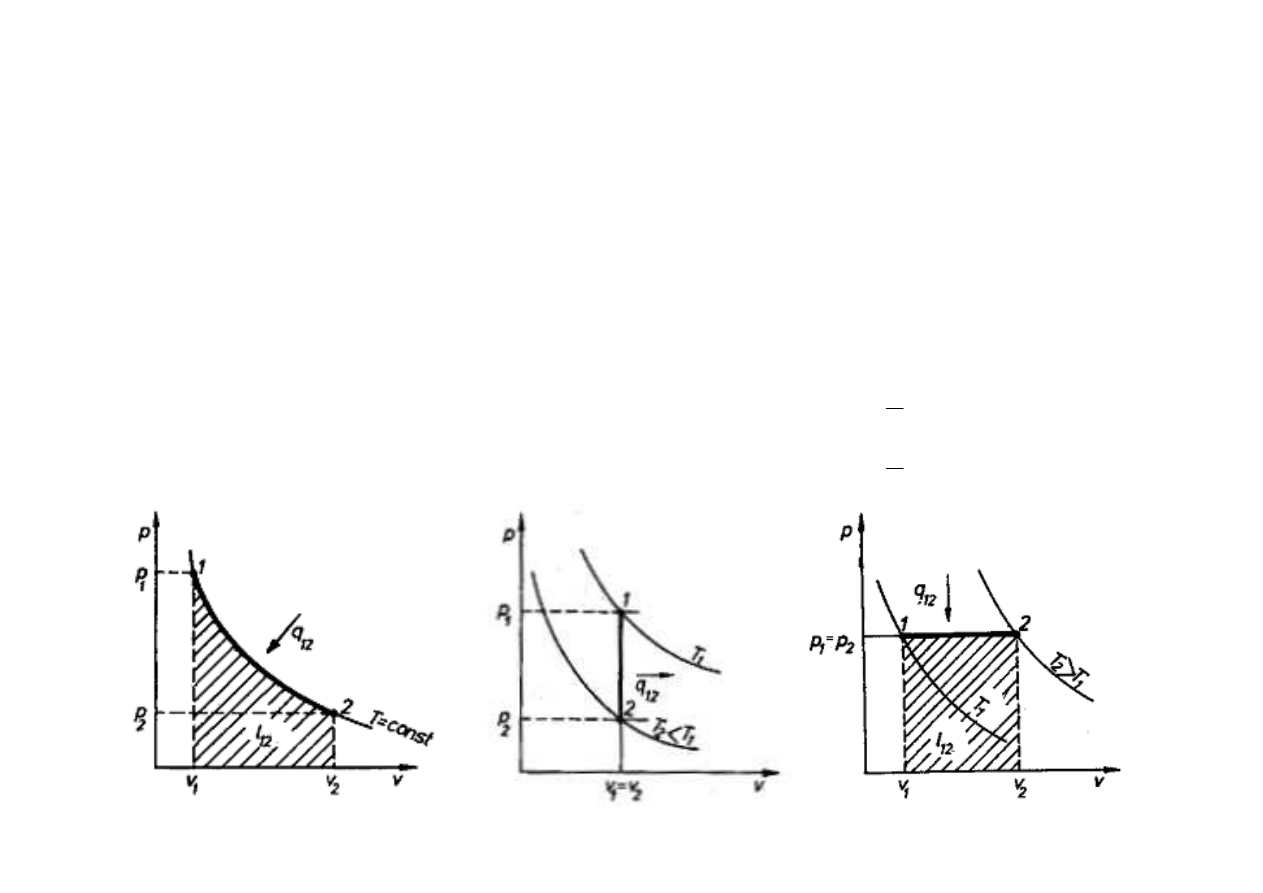
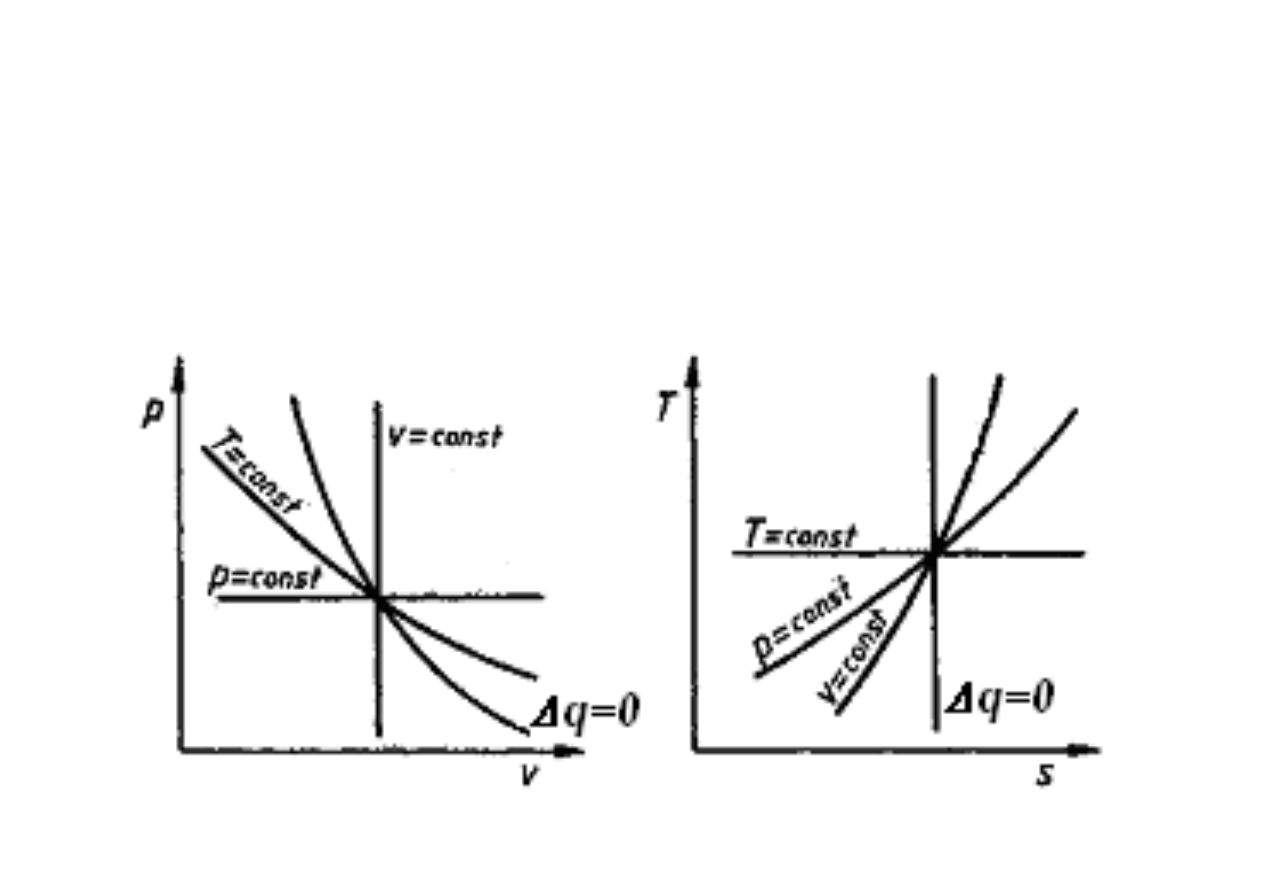
PRZEMIANY TERMODYNAMICZNE
układ (p-v)
Je
ż
eli w prostok
ą
tnym układzie współrz
ę
dnych na osi odci
ę
tych odło
ż
y si
ę
obj
ę
to
ść
1 kg ciała podlegaj
ą
cego przemianie, a na osi rz
ę
dnych odpowiadaj
ą
ce tej obj
ę
to
ś
ci
wła
ś
ciwej
v
ci
ś
nienie
p
tej przemiany, to ka
ż
demu stanowi ciała odpowiada pewien
punkt. Podczas przemiany termodynamicznej, czyli podczas zmian stanu układu,
punkty te utworz
ą
lini
ę
, tzw.
krzyw
ą
przemiany
.
przemiana izotermiczna
(przy stałej temperaturze) – T = const:
p · v = const
przemiana izochoryczna
(przy stałej obj
ę
to
ś
ci) – v = const:
const
T
p
====
v
przemiana izobaryczna
(przy stałym ci
ś
nieniu) – p = const:
const
T
v
====
IZOTERMA
IZOCHORA
IZOBARA
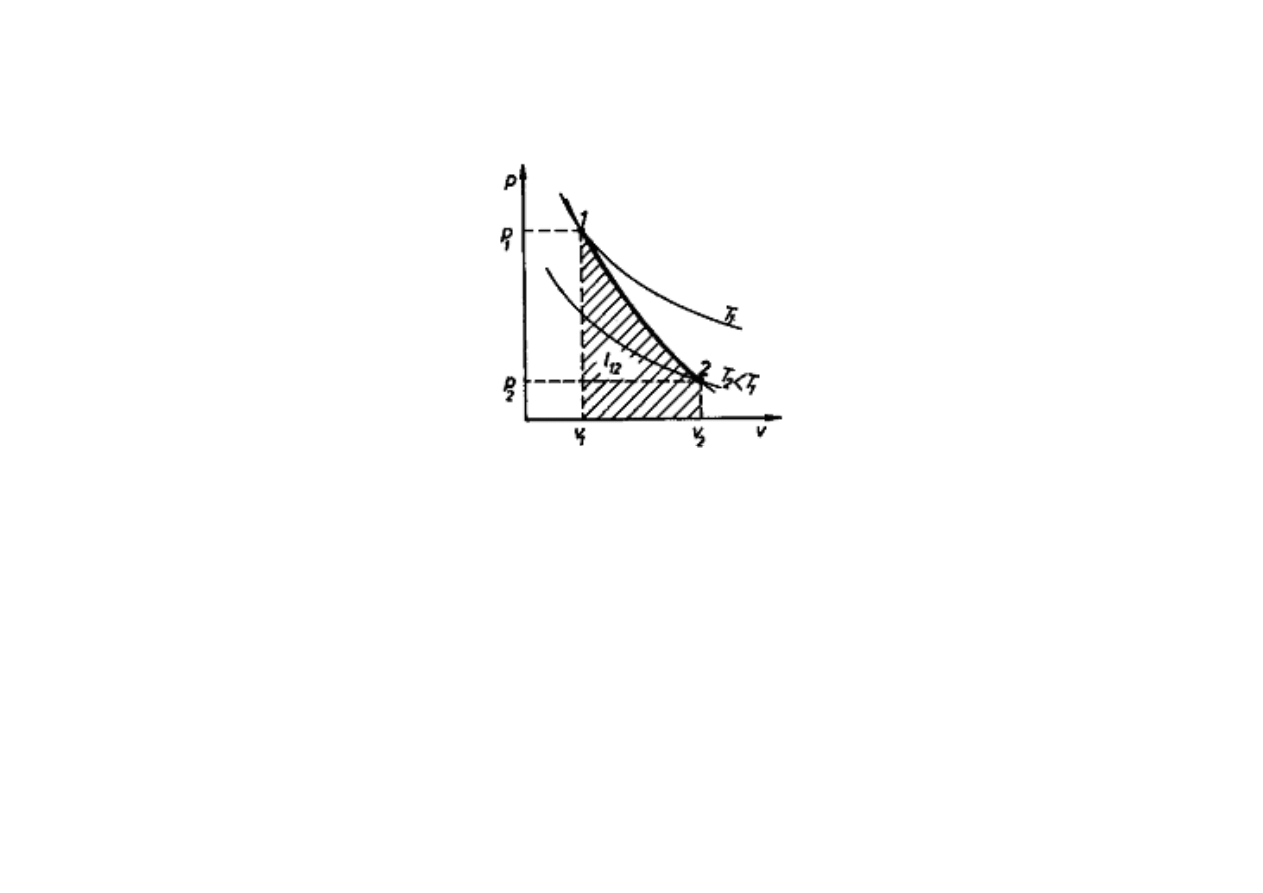
przemiana adiabatyczna
(bez wymiany ciepła) –
∆
q = 0:
p · v
κ
= const
ADIABATA
Przemiana odbywaj
ą
ca si
ę
bez wymiany ciepła z otoczeniem nosi nazw
ę
adiabatycznej, a krzywa przedstawiaj
ą
ca t
ę
przemian
ę
nazywa si
ę
adiabat
ą
.
Dla adiabaty praca techniczna równa si
ę
ró
ż
nicy entalpii na pocz
ą
tku i ko
ń
cu
przemiany:
l
12
= i
1
– i
2
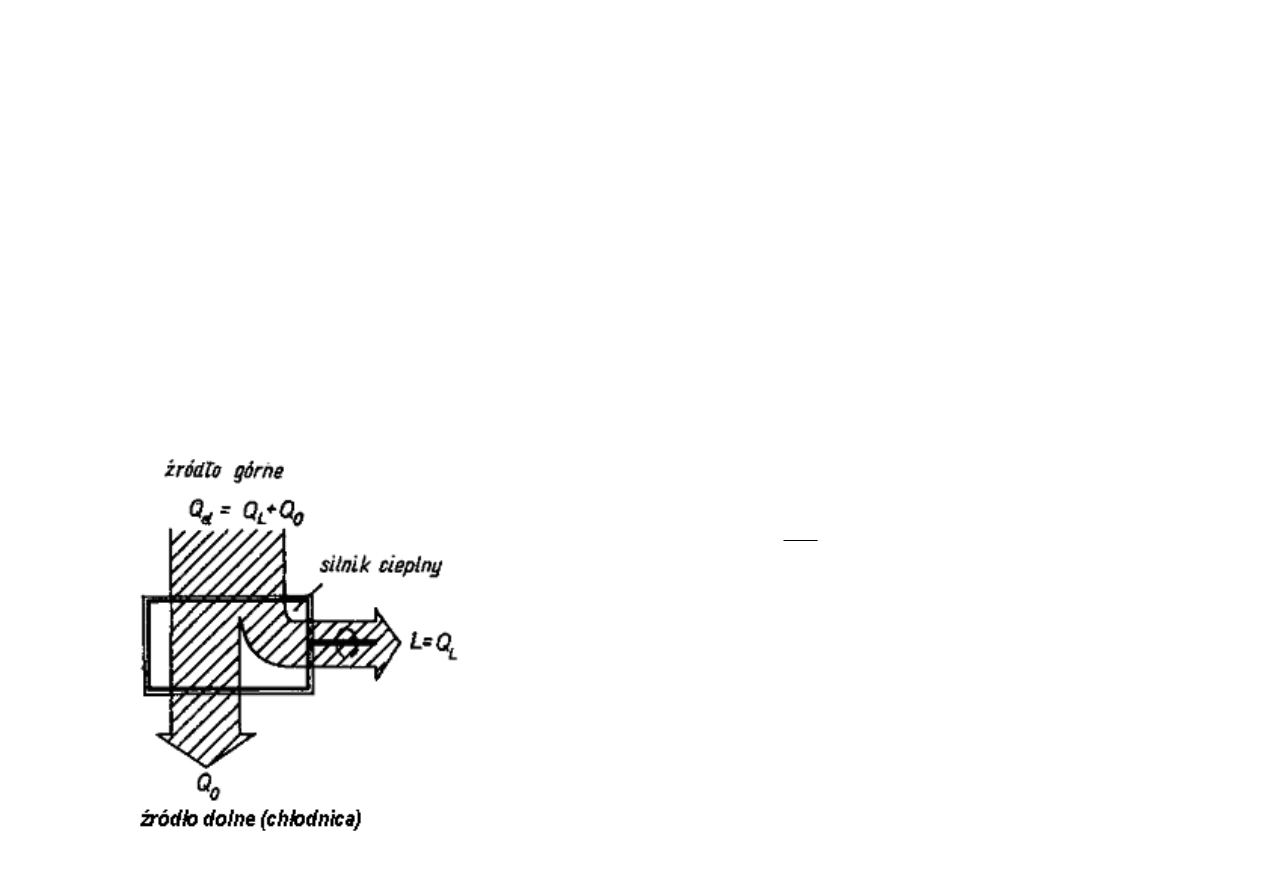
DRUGA ZASADA TERMODYNAMIKI
SILNIK CIEPLNY
Silnik cieplny
jest to układ, który w pewnych warunkach mo
ż
e zamienia
ć
ciepło na
prac
ę
. Czynnik termodynamiczny podczas odbywaj
ą
cych si
ę
przemian czerpie ciepło ze
ź
ródła gor
ą
cego (górnego) o wy
ż
szej temperaturze T
1
(np. palenisko, komora spalania,
itp.), dzi
ę
ki czemu rozpr
ęż
a si
ę
(zwi
ę
ksza swoj
ą
obj
ę
to
ść
) i nast
ę
pnie oddaje ciepło do
ź
ródła zimnego (dolnego) o ni
ż
szej temperaturze T
2
(np. skraplacz lub otaczaj
ą
ca
atmosfera), wobec czego kurczy si
ę
i mo
ż
e wróci
ć
do stanu pierwotnego, wykonuj
ą
c
obieg zamkni
ę
ty
. Miar
ą
jako
ś
ci silnika b
ę
dzie stosunek wykonanej pracy zewn
ę
trznej L
do dostarczonego ciepła Q
d
, nazywany
sprawno
ś
ci
ą
silnika cieplnego
(
η
):
d
d
Q
L
====
ηηηη
Pierwsza zasada termodynamiki mówi,
ż
e zu
ż
ywaj
ą
c
pewn
ą
ilo
ść
ciepła jeste
ś
my w stanie otrzyma
ć
prac
ę
i odwrotnie, zu
ż
ywaj
ą
c prac
ę
– wywi
ą
zujemy
ciepło. Zjawiska te, odwrotne wzgl
ę
dem siebie,
ró
ż
ni
ą
si
ę
jednak bardzo istotnie mi
ę
dzy sob
ą
.

Je
ż
eli pewien zasób pracy mechanicznej L, z zachowaniem wszelkich ostro
ż
no
ś
ci
maj
ą
cych na celu unikni
ę
cie rozproszenia si
ę
ciepła w formie przewodzenia,
promieniowania itp., da si
ę
zamieni
ć
całkowicie na ciepło i ilo
ś
ciowo otrzymamy Q
d
= L
ciepła, to zjawisko odwrotne odbywa si
ę
w nieco odmiennych warunkach. Mianowicie,
je
ż
eli w jakim
ś
układzie cieplnym zachodz
ą
specjalne warunki termodynamiczne
umo
ż
liwiaj
ą
ce w ogóle zamian
ę
ciepła na prac
ę
, co nie zawsze ma miejsce, to zu
ż
ywaj
ą
c
Q
d
= Q
L
+ Q
O
ciepła mo
ż
na zamieni
ć
na prac
ę
, mimo wszelkich zabiegów i stara
ń
,
zaledwie cz
ęść
tej ilo
ś
ci, a mianowicie Q
L
, otrzymuj
ą
c jedynie L = Q
L
pracy. Reszta, to
jest Q
O
, jest dla tej zamiany stracona – pozostaje wprawdzie w formie ciepła, ale nie
daj
ą
cego si
ę
ju
ż
w tym układzie przetworzy
ć
na prac
ę
. To spostrze
ż
enie nie obala
pierwszej zasady termodynamiki, równowa
ż
no
ść
pracy i ciepła sw
ą
moc utrzymuje, gdy
ż
przy przemianie ciepła na prac
ę
zniknie w układzie dokładnie tyle ciepła, ile otrzymanej
zostało pracy, ale jednocze
ś
nie cz
ęść
ciepła, nie zamieniwszy si
ę
w prac
ę
, ujdzie do
ź
ródła dolnego jako ciepło z obni
ż
on
ą
temperatur
ą
(gazy wydechowe, spaliny, para
wylotowa, skropliny itd.). Tak wi
ę
c chc
ą
c otrzyma
ć
drog
ą
przemiany termodynamicznej
pewn
ą
ilo
ść
pracy L, trzeba doprowadzi
ć
nie tylko równowa
ż
n
ą
temu ilo
ść
ciepła Q
L
= L,
ale poza tym jeszcze ilo
ść
Q
O
, to znaczy nale
ż
y doprowadzi
ć
Q
d
= Q
L
+ Q
O
cho
ć
ilo
ść
ciepła Q
O
nie bierze udziału w przemianie ciepła na prac
ę
.

Niemo
ż
liwa jest wi
ę
c praca silnika cieplnego przy jednym tylko
ź
ródle ciepła. Silnik taki
pozwalałby przetwarza
ć
dowolne ilo
ś
ci ciepła na równowa
ż
ne mu i praktycznie
nieograniczone ilo
ś
ci energii mechanicznej, cho
ć
by z ciepła otoczenia, w ogóle ze
ź
ródeł
ciepła bez spadku temperatury, byłoby to tzw perpetum mobile drugiego rodzaju.
Silnik taki nie wytwarzałby pracy z niczego, zatem mo
ż
liwo
ść
jego istnienia nie przeczy
pierwszej zasadzie termodynamiki, przeczy natomiast drugiej zasadzie termodynamiki.
Istnieje kilka równowa
ż
nych sformułowa
ń
drugiej zasady termodynamiki. M. Planck
Istnieje kilka równowa
ż
nych sformułowa
ń
drugiej zasady termodynamiki. M. Planck
głosił:
Jest niemo
ż
liwe skonstruowanie periodycznie działaj
ą
cej maszyny, której
działanie polegałoby tylko na podnoszeniu ci
ęż
arów i równoczesnym ochładzaniu
ź
ródła
ciepła
. R. Clausius twierdził natomiast:
Ciepło nie mo
ż
e samorzutni przej
ść
od ciała o
temperaturze ni
ż
szej do ciała o temperaturze wy
ż
szej.
Przez samorzutny przebieg
zjawiska rozumie si
ę
tu taki przebieg, któremu nie towarzysz
ą
ż
adne zmiany w ciałach
otaczaj
ą
cych rozpatrywany układ.
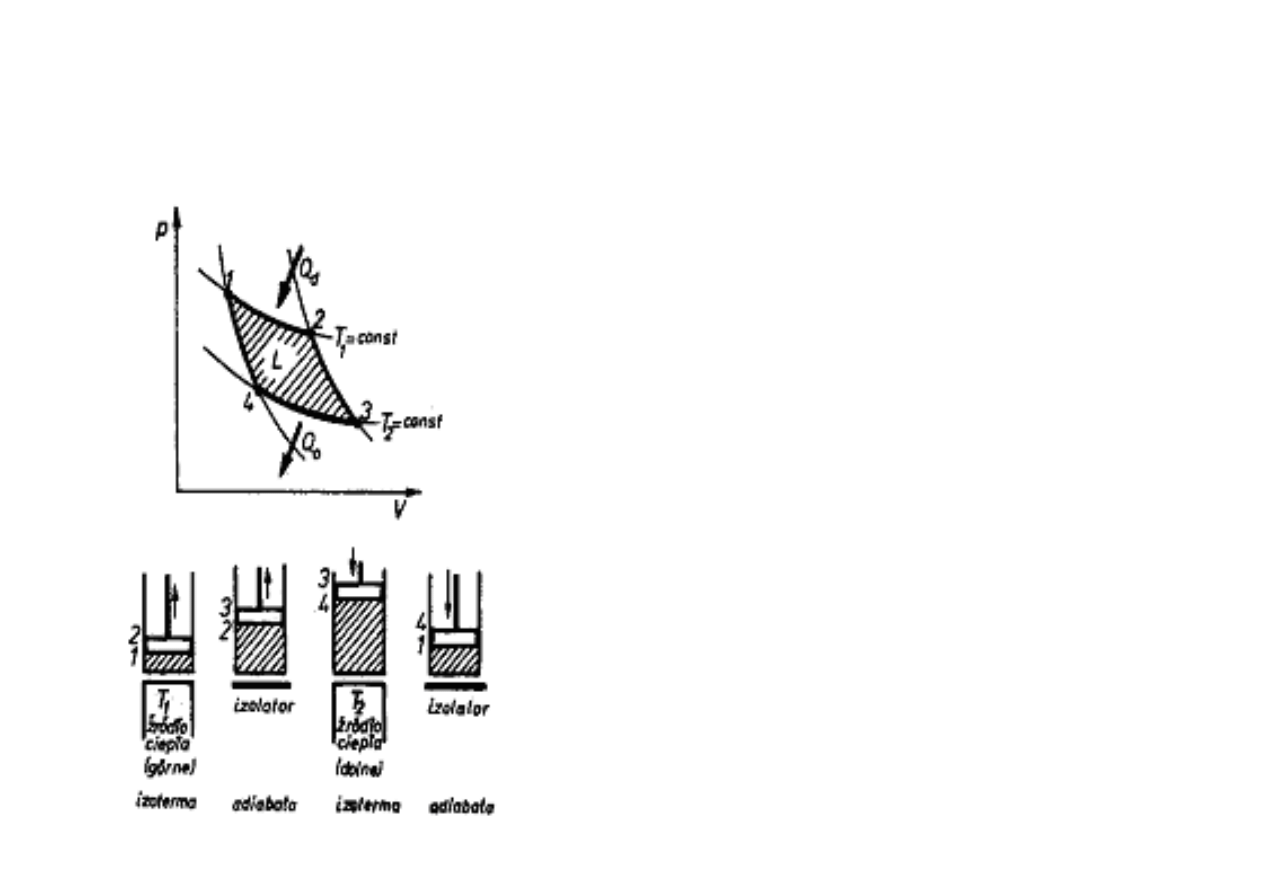
OBIEG CARNOTA
W 1824 roku francuski in
ż
ynier S. Carnot prz
ę
dstawił obieg termodynamiczny
teoretyczny, który słu
ż
y j
ą
ko obieg porównawczy dla wszystkich obiegów
rzeczywistych.
Obieg Carnota składa si
ę
z dwóch izoterm i dwóch
adiabat. Czynnik pobiera ciepło Q
d
z górnego
ź
ródła
w stałej temperaturze T
1
(izotermicznie). Z chwil
ą
odci
ę
cia dopływu ciepła (punkt 2) czynnik rozpr
ęż
a
si
ę
dalej, ale ju
ż
bez doprowadzenia ciepła, czyli
adiabatycznie, a
ż
do stanu 3, kiedy uzyska
temperatur
ę
dolnego
ź
ródła ciepła T
2
. Teraz oddaje
ciepło Q
O
izotermicznie, a
ż
do stanu 4, sk
ą
d dzi
ę
ki
spr
ęż
eniu adiabatycznemu, zostanie doprowadzony
spr
ęż
eniu adiabatycznemu, zostanie doprowadzony
do stanu pierwotnego 1. Mo
ż
na udowodni
ć
,
ż
e obieg
Carnota jest obiegiem odwracalnym. Praca L
wykonana przy takim obiegu wyrazi si
ę
na wykresie
(p-v) polem 1-2-3-4.

Sprawno
ść
obiegu b
ę
dzie wyra
ż
ała si
ę
zale
ż
no
ś
ci
ą
:
d
O
d
O
d
d
C
Q
Q
1
Q
Q
Q
Q
L
−−−−
====
−−−−
====
====
ηηηη
1
2
1
2
1
C
T
T
1
T
T
T
−−−−
====
−−−−
====
ηηηη
Jest to maksymalna sprawno
ść
, jak
ą
mo
ż
na osi
ą
gn
ąć
w obiegu termodynamicznym
realizowanym w zakresie mi
ę
dzy temperatur
ą
górnego
ź
ródła T
1
i dolnego
ź
ródła T
2
.
Sprawno
ść
ta jest tym wi
ę
ksza, im mniejszy jest stosunek T /T , tzn. im wy
ż
sza jest
Sprawno
ść
ta jest tym wi
ę
ksza, im mniejszy jest stosunek T
1
/T
2
, tzn. im wy
ż
sza jest
temperatura górnego
ź
ródła ciepła i jednocze
ś
nie im ni
ż
sza jest temperatura dolnego
ź
ródła ciepła (chłodnicy).
Przykładowo:
Temperatura górnego
ź
ródła (kocioł parowy) t
1
= 400ºC ( T
1
= 673 K ), temperatura
dolnego
ź
ródła (otoczenie) t
2
= 20ºC ( T
2
= 293 K ) to
η
C
= 0.565 .
Temperatura górnego
ź
ródła (geotermia) t
1
= 80ºC ( T
1
= 353 K ), temperatura dolnego
ź
ródła (otoczenie) t
2
= 20ºC ( T
2
= 293 K ) to
η
C
= 0.17 .

Z wzoru na sprawno
ć
η
C
obiegu Carnota wynika równo
ść
:
czyli tzw. ciepło zredukowane:
W odwracalnej (idealnej) przemianie termodynamicznej ciepło zredukowane
zale
ż
y tylko od skrajnych stanów czynnika, nie zale
ż
y od „drogi” przemiany.
Dla bardzo małych ilo
ś
ci przekazywanego ciepła:
Pewn
ą
miar
ą
nieodwracalno
ś
ci przemian (wszystkie przemiany rzeczywiste) jest
parametr termodynamiczny
entropia
S, którego zmian
ę
mo
ż
na opisa
ć
1
2
d
O
T
T
Q
Q
====
1
d
2
O
T
Q
T
Q
====
1
d
2
O
T
Q
T
Q
∆∆∆∆
====
∆∆∆∆
parametr termodynamiczny
entropia
S, którego zmian
ę
mo
ż
na opisa
ć
zale
ż
no
ś
ci
ą
:
oraz dla wielko
ś
ci wła
ś
ciwych:
Jednostka entropii:
[ S ] = [ kJ/K ]
Jednostka entropii wła
ś
ciwej:
[ s ] = [ kJ/(kg·K) ]
T
Q
S
∆∆∆∆
====
∆∆∆∆
T
q
s
∆∆∆∆
====
∆∆∆∆

Poj
ę
cie entropii daje mo
ż
liwo
ść
okre
ś
lenia kierunku przebiegu wszelkich zjawisk
przyrody, obejmuj
ą
cych dostateczn
ą
liczb
ę
cz
ą
stek materii. Mo
ż
na łatwo udowodni
ć
,
ż
e suma przyrostów entropii wszystkich ciał uczestnicz
ą
cych w zjawisku
odwracalnym jest równa zeru, natomiast suma entropii wszystkich ciał
uczestnicz
ą
cych w zjawisku nieodwracalnym, stale zwi
ę
ksza si
ę
w czasie trwania
zjawiska.
Uwzgl
ę
dniaj
ą
c równania opisuj
ą
ce pierwsz
ą
zasad
ę
termodynamiki, mo
ż
na do
wyra
ż
enia opisuj
ą
cego zmian
ę
entropii wprowadzi
ć
parametry stanu czynnika.
Otrzymuje si
ę
wówczas dwa równania ró
ż
niczkowe zupełne, słuszne dla wszelkich
przemian, zarówno odwracalnych jak i nieodwracalnych. Równania te to tzw.
przemian, zarówno odwracalnych jak i nieodwracalnych. Równania te to tzw.
to
ż
samo
ś
ci termodynamiczne
:
T
p
v
i
s
T
v
p
u
s
∆∆∆∆
⋅⋅⋅⋅
−−−−
∆∆∆∆
====
∆∆∆∆
∆∆∆∆
⋅⋅⋅⋅
++++
∆∆∆∆
====
∆∆∆∆
PRZEMIANY TERMODYNAMICZNE
układ (T-s)
Je
ż
eli w prostok
ą
tnym układzie współrz
ę
dnych na osi odci
ę
tych odło
ż
y si
ę
entropi
ę
1 kg ciała podlegaj
ą
cego przemianie, a na osi rz
ę
dnych odpowiadaj
ą
ce tej entropii
wła
ś
ciwej s ci
ś
nienie p tej przemiany, to ka
ż
demu stanowi ciała odpowiada pewien
punkt. Podczas przemiany termodynamicznej, czyli podczas zmian stanu, punkty te
utworz
ą
lini
ę
, tzw. krzyw
ą
przemiany.

PARA WODNA
Praktyczne wykorzystanie i techniczna realizacja w elektrowni parowej procesu
przetwarzania ciepła na energi
ę
mechaniczn
ą
wymaga znajomo
ś
ci podstawowych
wła
ś
ciwo
ś
ci czynnika roboczego, tj. wody i pary wodnej. Wła
ś
ciwo
ś
ci te s
ą
okre
ś
lone
przez podstawowe parametry termodynamiczne:
• ci
ś
nienie p,
• temperatur
ę
T lub t,
• obj
ę
to
ść
V lub obj
ę
to
ść
wła
ś
ciw
ą
v.
W analizach teoretycznych i w praktycznych obliczeniach technicznych bardzo s
ą
przydatne jeszcze dwa parametry termodynamiczne:
przydatne jeszcze dwa parametry termodynamiczne:
• entalpia I lub entalpia wła
ś
ciwa i,
• entropia S lub entropia wła
ś
ciwa s.
Entalpia wła
ś
ciwa jest ilo
ś
ci
ą
ciepła niezb
ę
dn
ą
do doprowadzenia 1 kg czynnika od
punktu pocz
ą
tkowego przemiany do pewnego punktu ko
ń
cowego przy p = const.
Entropia nie ma interpretacji fizycznej, wprowadzenie jej jako poj
ę
cia o charakterze
matematycznym pozwala m.in. na przedstawienie obiegów termodynamicznych za
pomoc
ą
przejrzystych i wygodnych w u
ż
ytkowaniu wykresów. Powszechnie u
ż
ywane
terminy: entalpia i entropia odnosz
ą
si
ę
najcz
ęś
ciej do entalpii i entropii wła
ś
ciwej
(dla 1 kg czynnika).

Dla gazów rzeczywistych, w tym pary wodnej, równania stanu maj
ą
w zapisie
matematycznym znacznie bardziej skomplikowan
ą
posta
ć
ni
ż
równanie stanu dla
gazów doskonałych (Clapeyrona). Do oblicze
ń
praktycznych i potrzeb kontroli pracy
elektrowni parowych stosowa
ć
mo
ż
na tablice pary wodnej lub opracowane na ich
podstawie wykresy. Istniej
ą
równie
ż
stosunkowo łatwo dost
ę
pne w Internecie programy
typu „kalkulator termodynamiczny” lub t.zw. biblioteki rozszerzaj
ą
ce mo
ż
liwo
ś
ci innych
typu „kalkulator termodynamiczny” lub t.zw. biblioteki rozszerzaj
ą
ce mo
ż
liwo
ś
ci innych
programów obliczeniowych, takich jak np. Excel.
Przy analizie zjawisk termodynamicznych zwi
ą
zanych z par
ą
wodn
ą
jako czynnikiem
roboczym powszechne zastosowanie znalazły wykresy T-s (temperatura-entropia) i i-s
(entalpia-entropia). Wykres T-s pary wodnej umo
ż
liwia przedstawienie na nim, w postaci
pewnego konturu, obiegu cieplnego elektrowni.
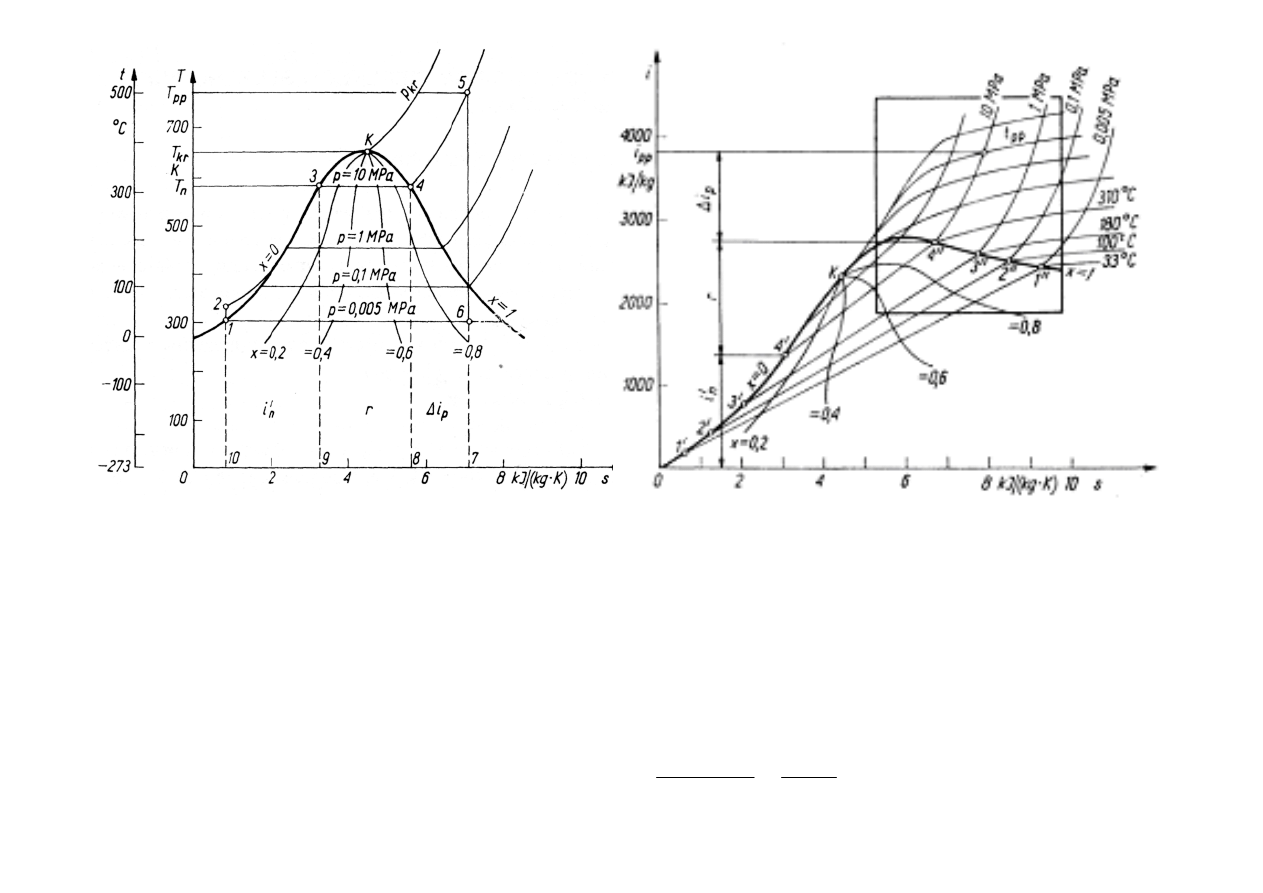
Punkt K na krzywej granicznej odpowiada
parametrom krytycznym
pary wodnej,
okre
ś
laj
ą
cym stan fizyczny, w którym ciecz staje si
ę
, bez doprowadzenia ciepła, par
ą
such
ą
nasycon
ą
. Parametry tego stanu dla cieczy i pary suchej s
ą
takie same:
p
kr
= 22,064 MPa, T
kr
= 647,096 K (t
kr
= 373,946), v
kr
= 3,106 dm
3
/kg,
ρρρρ
kr
= 0.322 kg/dm
3
,
i
kr
= 2084,26 kJ/kg, s
kr
= 4,40696 kJ/(kg·K), ciepło parowania r = 0.
Na lewo od punktu krytycznego znajduje si
ę
linia x=0, wody w stanie nasycenia, na
prawo linia x=1, pary suchej nasyconej. Mi
ę
dzy tymi liniami jest obszar pary nasyconej
wilgotnej z liniami x o stałej wilgotno
ś
ci:
i
i
i
i
m
m
m
x
x
p
w
p
′′′′
−−−−
′′′′′′′′
′′′′
−−−−
====
++++
====
Natomiast ciepło parowania r = i”- i’ .
Wykres T-s dla wody
Wykres i-s dla wody
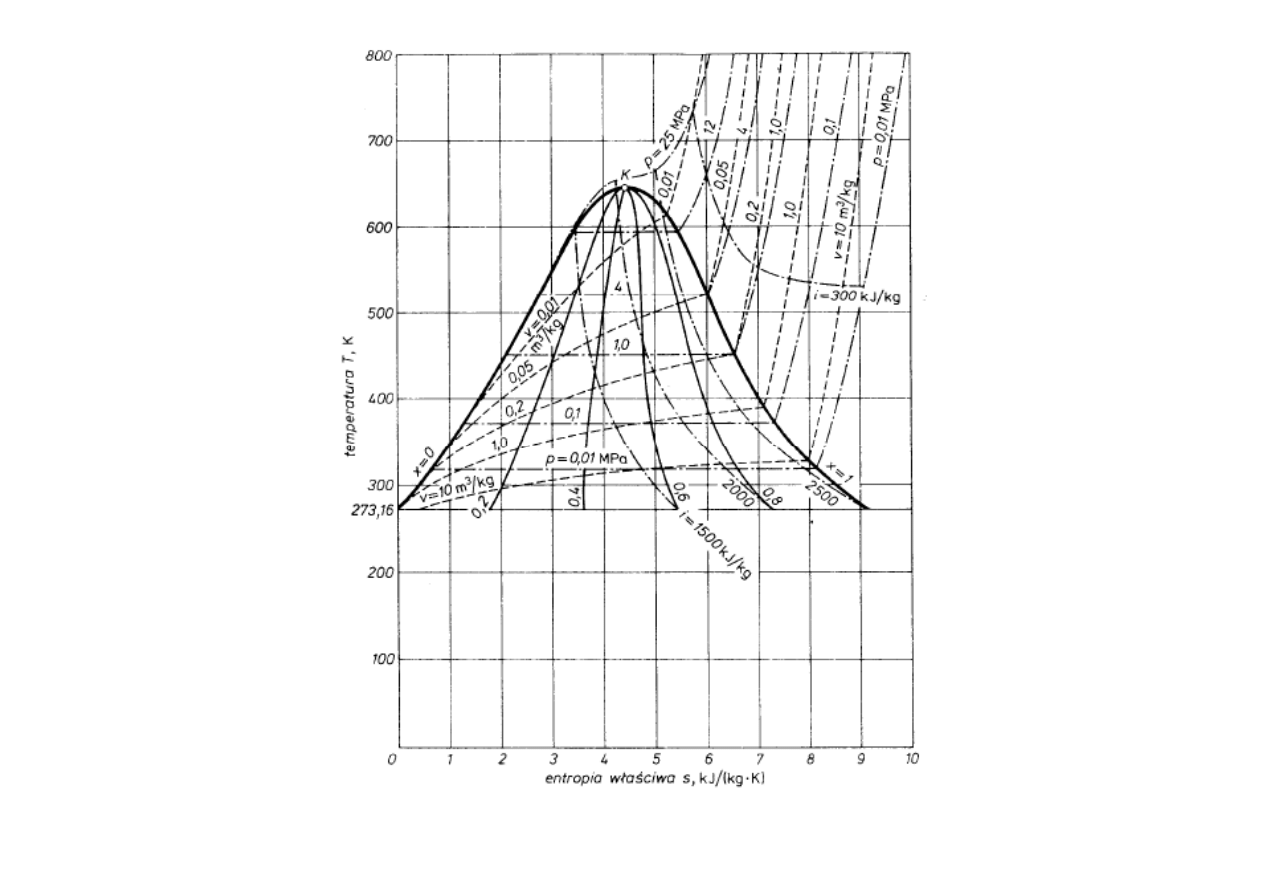
Wykres T-s pary wodnej
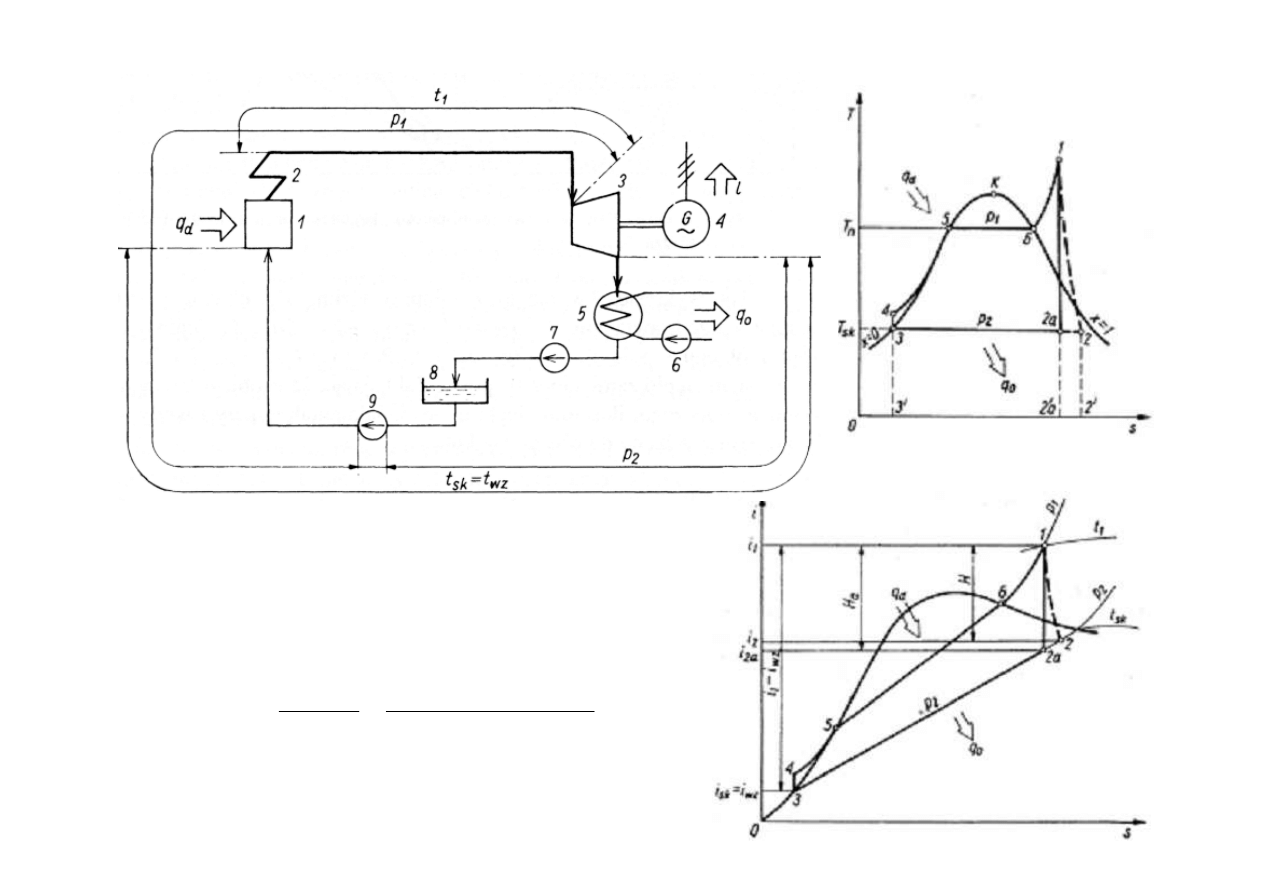
OBIEG CIEPLNY ELEKTROWNI PAROWEJ
1 - kocioł; 2 - przegrzewacz pary; 3 - turbina;
4 - pr
ą
dnica (generator); 5 - skraplacz; 6 - pompa
wody chłodz
ą
cej; 7 - pompa skroplin; 8 - zbiornik
wody zasilaj
ą
cej; 9 - pompa wody zasilaj
ą
cej.
Sprawno
ść
teoretyczna obiegu Rankine’a:
(i
wz
- i
sk
) – praca na pompowanie wody do kotła.
((((
)))) ((((
))))
wz
1
sk
wz
a
2
1
d
o
d
t
i
i
i
i
i
i
q
q
q
−−−−
−−−−
−−−−
−−−−
====
−−−−
====
ηηηη
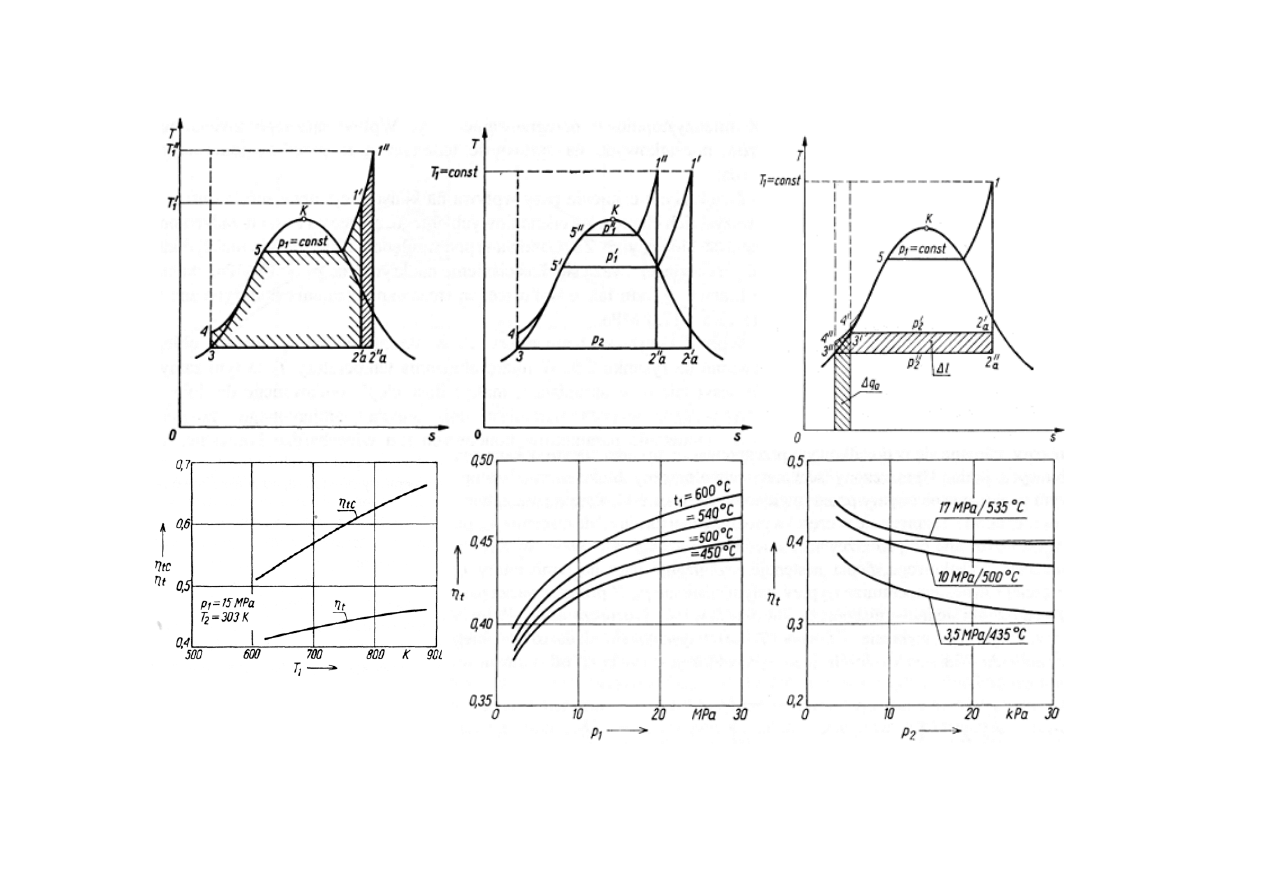
ZWI
Ę
KSZENIE SPRAWNO
Ś
CI OBIEGU CIEPLNEGO
ELEKTROWNI KONDENSACYJNEJ
zwi
ę
kszenie temperatury T
1
przed turbin
ą
zwi
ę
kszenie ci
ś
nienia p
1
przed turbin
ą
zmniejszenie temperatury T
2
(ci
ś
nienia p
2
)
w skraplaczu turbiny
η
tc
– sprawno
ść
obiegu Carnota
η
t
– sprawno
ść
obiegu Rankine’a
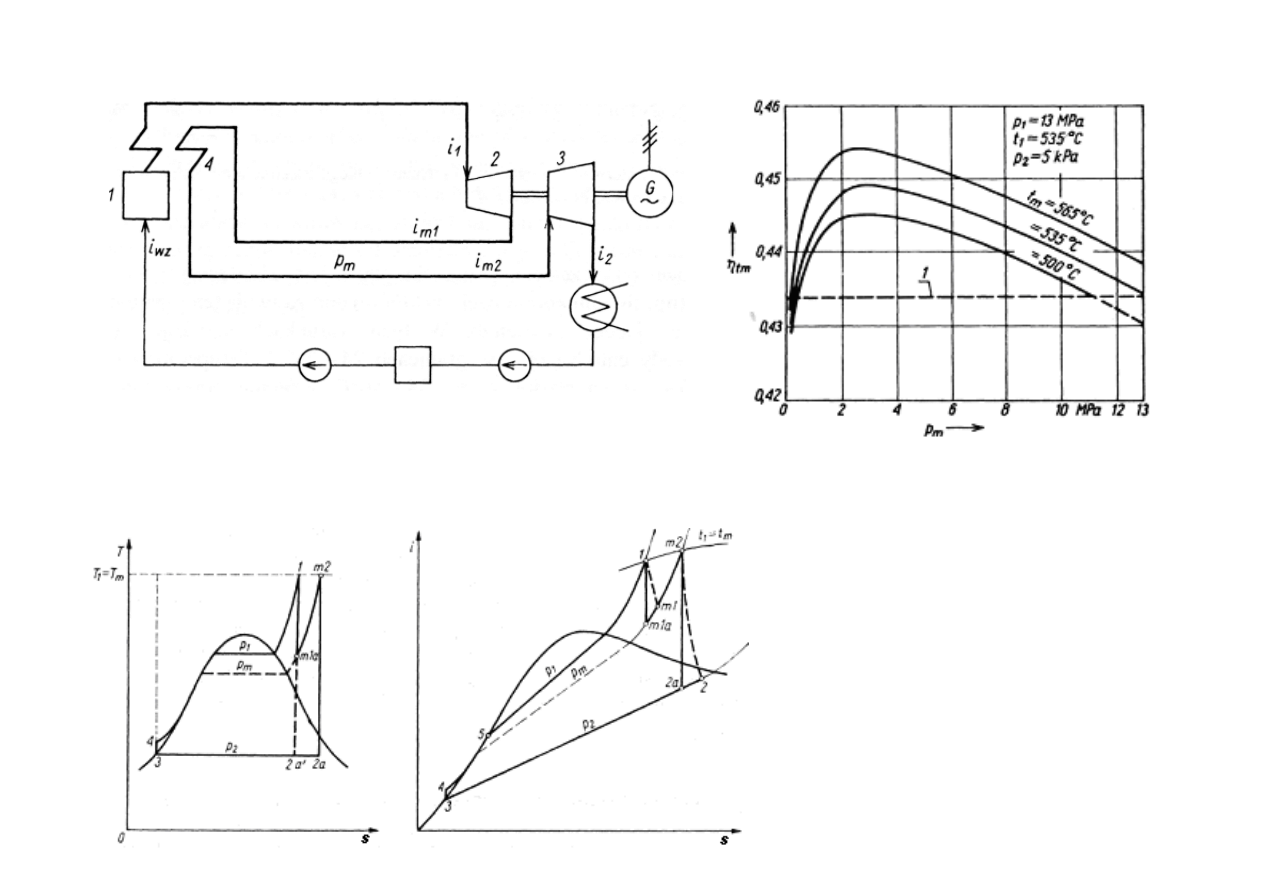
MI
Ę
DZYSTOPNIOWY PRZEGRZEW
Schemat obiegu cieplnego elektrowni z
mi
ę
dzystopniowym przegrzewaniem pary: 1 - kocioł;
mi
ę
dzystopniowym przegrzewaniem pary: 1 - kocioł;
2 - cz
ęść
wysokopr
ęż
na turbiny; 3 ~ cz
ęść
niskopr
ęż
na
turbiny; 4 - mi
ę
dzystopniowy przegrzewacz pary
Zale
ż
no
ść
sprawno
ś
ci teoretycznej
obiegu z mi
ę
dzystopniowym
przegrzewaniem pary od ci
ś
nienia
p
m
przy ró
ż
nych warto
ś
ciach
temperatury t
m
1 - sprawno
ść
teoretyczna bez
przegrzewania mi
ę
dzystopniowego
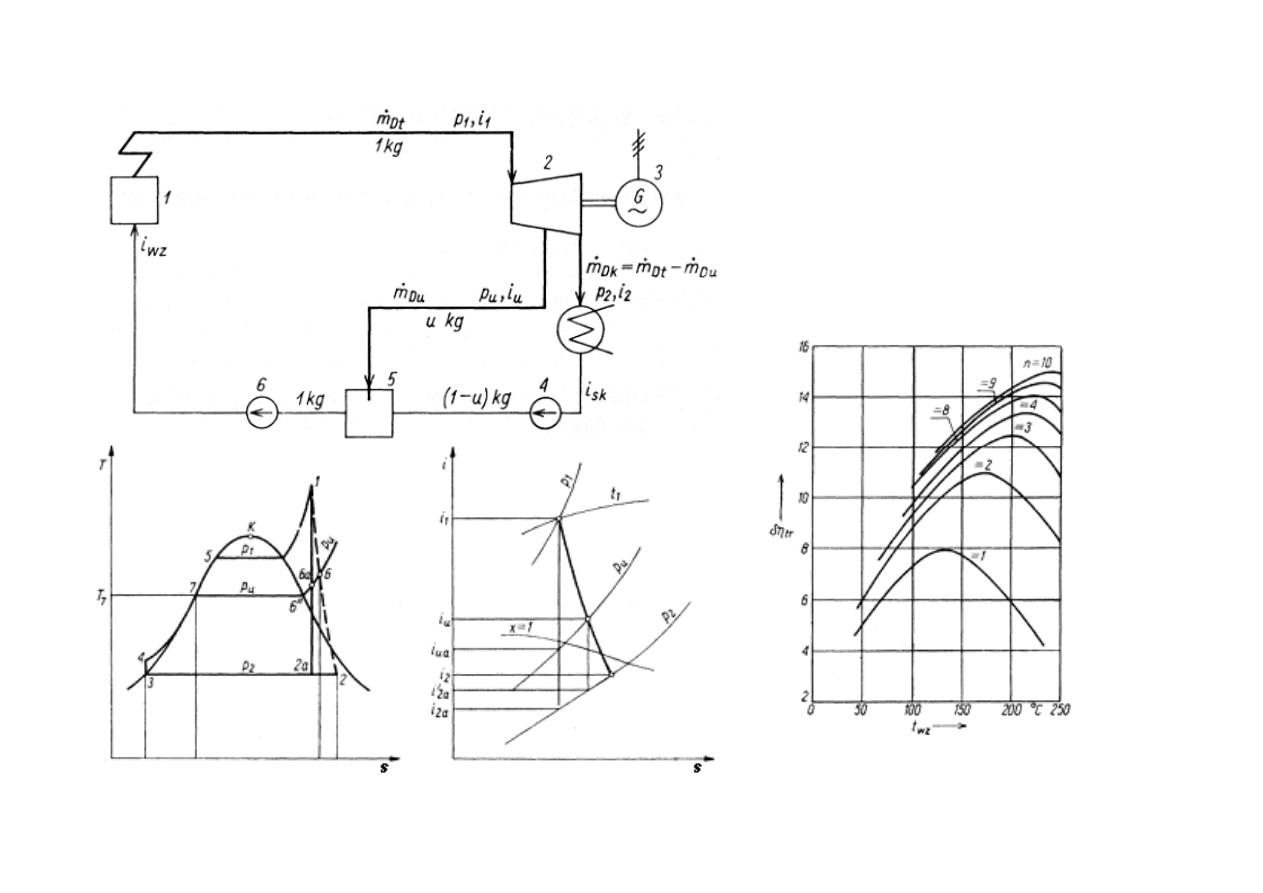
REGENERACYJNY PODGRZEW WODY ZASILAJ
Ą
CEJ
Schemat obiegu cieplnego
elektrowni z jednostopniowym
regeneracyjnym podgrzewaniem
wody zasilaj
ą
cej
1- kocioł; 2 - turbina; 3 - pr
ą
dnica;
4 - pompa skroplin;
5 - podgrzewacz mieszankowy;
6 - pompa wody zasilaj
ą
cej
obieg Rankine’a
rozpr
ęż
anie w turbinie
Wzgl
ę
dny przyrost sprawno
ś
ci obiegu
w zale
ż
no
ś
ci od liczby podgrzewaczy
regeneracyjnych n, twz – temperatura
wody zasilaj
ą
cej kocioł.
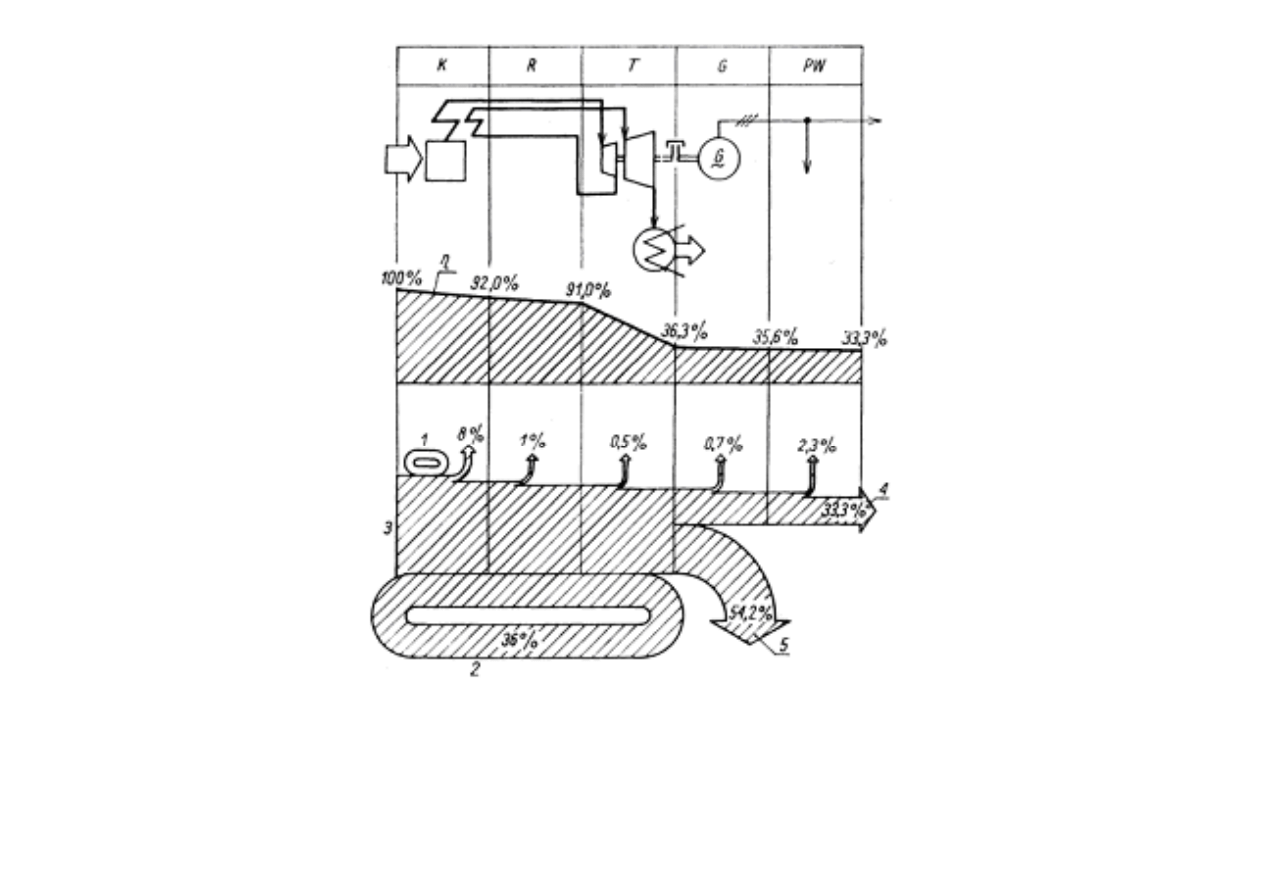
Przykładowy zmiany sprawno
ś
ci przemiany energii i bilans energetyczny strumieniowy
(Sankeya) elektrowni parowej kondensacyjnej na umiarkowane parametry pary
K - kocioł; R - ruroci
ą
gi; T— turbina; G — pr
ą
dnica; PW - potrzeby własne;
1
podgrzewacz powietrza; 2 - regeneracyjne podgrzewanie wody zasilaj
ą
cej;
3 - energia chemiczna paliwa; 4 - energia u
ż
yteczna netto; 5 - straty w skraplaczu
KOGENERACJA
ENERGIA
PALIWA
ENERGIA
ELEKTRYCZNA
CIEPŁO
STRATA
URZ
Ą
DZENIE
PRZETWARZAJ
Ą
CE
CIEPŁO
Koszt produkcji u
ż
ytecznego produktu ubocznego nale
ż
y oceni
ć
na podstawie
kosztów mo
ż
liwych do unikni
ę
cia w całym procesie produkcji dzi
ę
ki zastosowaniu
tego produktu ubocznego w procesie kogeneracji. Wytworzenie tego produktu
ubocznego zast
ę
puje produkowanie go w wyspecjalizowanym procesie. Na
przykład, wykorzystanie elektryczno
ś
ci z elektrociepłowni zast
ę
puje cz
ęść
energii
elektrycznej produkowanej w elektrowniach. Ponadto, istnieje ju
ż
czysto
ekonomiczna zasada podziału kosztów w procesach kogeneracji, jest to tak zwana
zasada unikania wydatków
.

OBIEGI CIEPLNE ELEKTROCIEPŁOWNI
Mała sprawno
ść
obiegów kondensacyjnych jest wynikiem przede wszystkim
odprowadzania du
ż
ych ilo
ś
ci ciepła z wod
ą
chłodz
ą
c
ą
skraplacz. Ciepło to ze wzgl
ę
du
na stosunkowo nisk
ą
temperatur
ę
no
ś
nika (25
÷
38)
°
C ma niezwykle ograniczone
mo
ż
liwo
ś
ci zastosowania, poniewa
ż
do celów grzewczych s
ą
wymagane temperatury
mo
ż
liwo
ś
ci zastosowania, poniewa
ż
do celów grzewczych s
ą
wymagane temperatury
(70
÷
150)
°
C, a do celów technologicznych w zakładach przemysłowych jeszcze wy
ż
sze.
Aby dostosowa
ć
parametry pary wylotowej z
turbiny do potrzeb odbiorców ciepła, ogranicza si
ę
rozpr
ęż
anie pary w turbinie, podwy
ż
szaj
ą
c tym
samym ko
ń
cowe ci
ś
nienie pary. W ten sposób
turbozespół kondensacyjny przekształca si
ę
w
przeciwpr
ęż
ny, a ze strumienia pary rozpr
ęż
aj
ą
cego
si
ę
w turbinie od ci
ś
nienia pocz
ą
tkowego p
1
do
ci
ś
nienia ko
ń
cowego, tzw. przeciwci
ś
nienia p
2
= p
p
,
cz
ęść
energii odpowiada-j
ą
ca spadkowi entalpii
H
p
= i
1
- i
p
jest zamieniona na energi
ę
elektryczn
ą
, a
pozostała cz
ęść
H
q
= i
p
- i
q
(i
q
- entalpia skroplin z pary wylotowej o ci
ś
nieniu
p
p
) mo
ż
e by
ć
całkowicie wykorzystana do celów
grzewczych. Jest to najprostszy obieg
grzewczych. Jest to najprostszy obieg
ciepłowniczy realizuj
ą
cy skojarzone wytwarzanie
energii elektrycznej i ciepła.
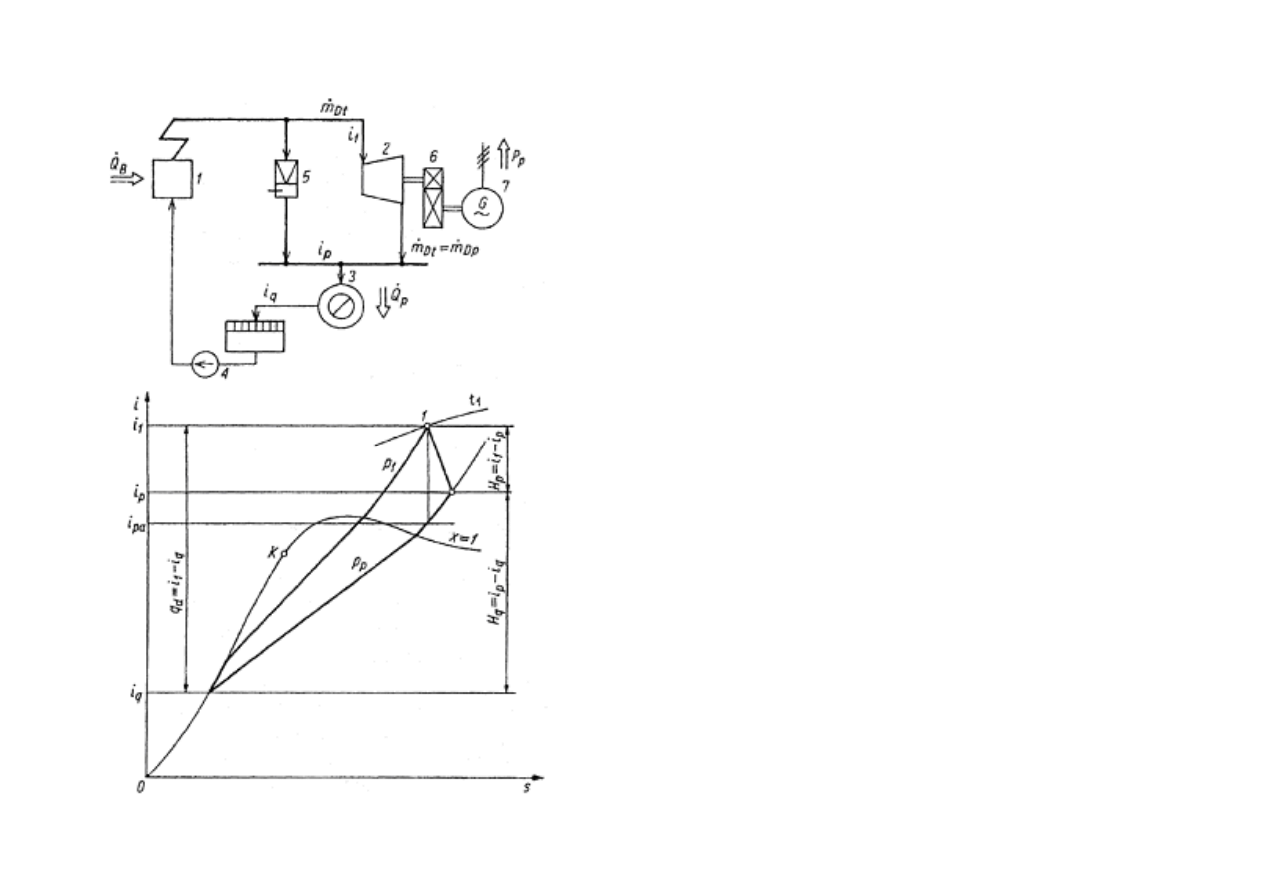
W układzie z turbin
ą
przeciwpr
ęż
n
ą
, strumie
ń
pary
m
Dt
= m
Dp
, o parametrach p
1
, t
1
i entalpii i
1
, rozpr
ęż
a
si
ę
w turbinie przeciwpr
ęż
nej 2 do ci
ś
nienia p
p
.
Nast
ę
pnie jest kierowany do odbiorników ciepła 3,
gdzie oddaje ciepło skraplania, po czym jest
tłoczony w postaci skroplin przez pomp
ę
4 do
kotła 1. Wyst
ę
puj
ą
ca w układzie stacja redukcyjno-
schładzaj
ą
ca 5 stanowi rezerw
ę
zasilania
odbiorców ciepła w przypadku odstawienia turbiny
lub jej uzupełnienie (tzw. szczytowe
ź
ródło ciepła).
Ś
cisłe powi
ą
zanie wytwarzanej mocy elektrycznej z nat
ęż
eniem poboru pary do celów
ciepłowniczych jest wad
ą
turbiny przeciwpr
ęż
nej. Nie ma jej układ z turbin
ą
upustowo-
kondensacyjn
ą
, w którym cz
ęść
strumienia pary jest pobierana z tzw. upustu
regulowanego przy ci
ś
nieniu wymaganym przez odbiorniki ciepła, pozostała za
ś
cz
ęść
strumienia rozpr
ęż
a si
ę
do ci
ś
nienia panuj
ą
cego w skraplaczu turbiny. Najcz
ęś
ciej
stosuje si
ę
turbiny z jednym, rzadziej z dwoma upustami pary o ró
ż
nych ci
ś
nieniach,
w przypadku szczególnym liczba upustów mo
ż
e by
ć
wi
ę
ksza. Je
ż
eli z wylotu turbiny
upustowej jest pobierana równie
ż
para do celów ciepłowniczych, to turbina taka nosi
wówczas nazw
ę
turbiny upustowo-przeciwpr
ęż
nej.
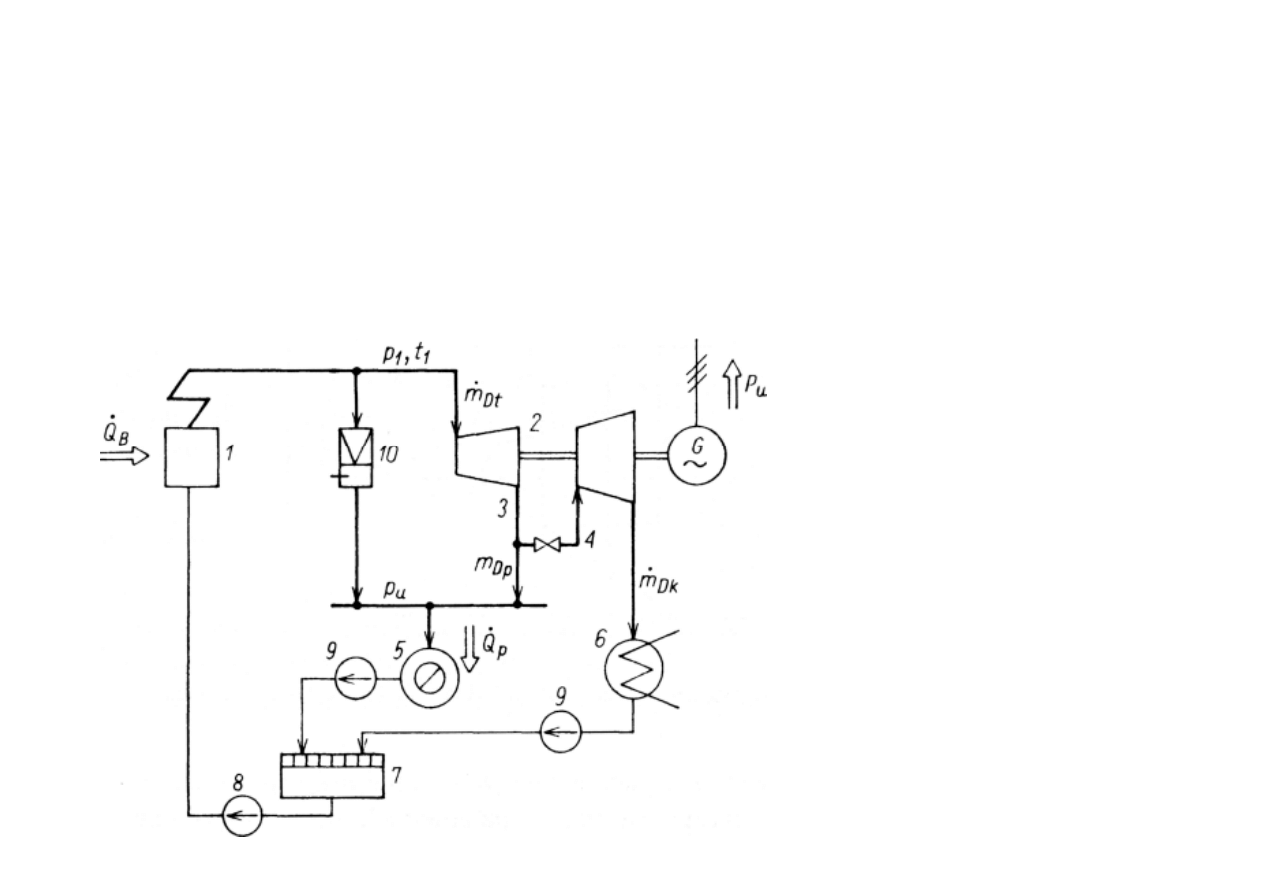
Schemat obiegu ciepłowniczego
z turbin
ą
upustowo-kondensacyjn
ą
:
1 - kocioł; 2 - turbina; 3 - upust;
4 - zawór mi
ę
dzy cz
ęś
ci
ą
wysoko-
i niskopr
ęż
n
ą
turbiny; 5 - odbiornik
ciepła; 6 - skraplacz; 7 - zbiornik
skroplin; 8 - pompa wody zasilaj
ą
cej
kocioł; 9 - pompy skroplin;
10 - stacja redukcyjno-schładzaj
ą
ca.

Charakterystycznym wska
ź
nikiem cieplno-elektrycznym elektrociepłowni, okre
ś
laj
ą
cym
stosunek energii elektrycznej wytworzonej w obiegu do ciepła odprowadzonego do
odbiorników z wylotu lub upustu turbiny, jest tzw. wska
ź
nik skojarzenia:
p
p
Q
E
====
σσσσ
gdzie:
E
p
- energia elektryczna wytworzona przez strumie
ń
pary przeciwpr
ęż
nej lub
upustowej w okre
ś
lonym czasie, kWh; Q
p
- ciepło odprowadzone z turbiny
do odbiorników w tym samym czasie, GJ.
Warto
ść
wska
ź
nika skojarzenia zale
ż
y od parametrów pocz
ą
tkowych oraz parametrów
pary odbieranej do celów ciepłowniczych, a tak
ż
e od układu technologicznego
elektrociepłowni i zawiera si
ę
w granicach od ok. 30 kWh/GJ (0,11 MW
c
/MW
t
) - dla
turbin przeciwpr
ęż
nych na małe parametry pocz
ą
tkowe i stosunkowo du
ż
e parametry
ko
ń
cowe) do ok. 150 kWh/GJ (0,55 MW
c
/MW
t
) - dla bloku ciepłowniczego BC-100.
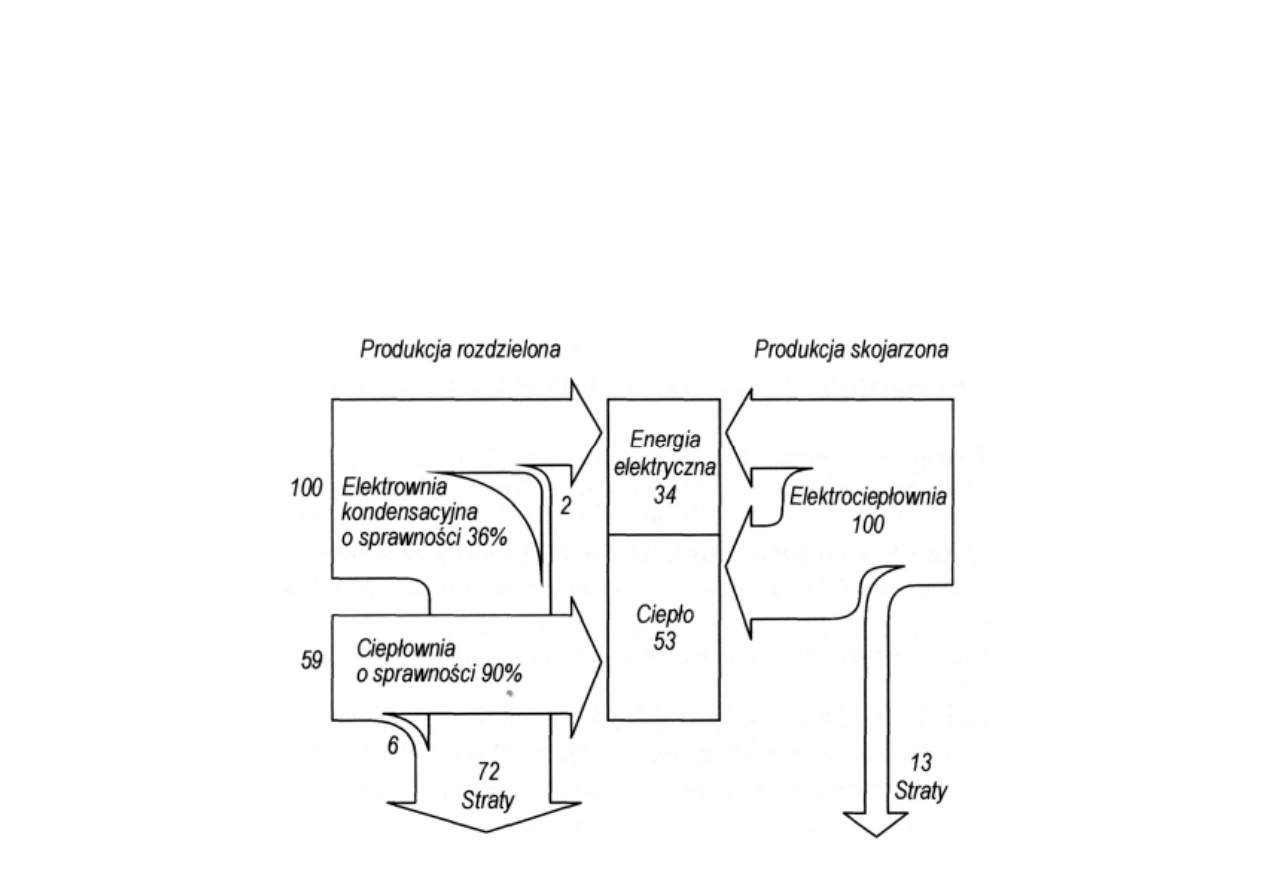
Głównym efektem ekonomicznym skojarzonego wytwarzania energii elektrycznej i ciepła
w elektrociepłowni jest oszcz
ę
dno
ść
paliwa w stosunku do układu niezale
ż
nego
(rozdzielonego) wytwarzania obu postaci energii, składaj
ą
cego si
ę
z zast
ę
pczej
elektrowni kondensacyjnej i zast
ę
pczej ciepłowni (kotłowni). Dla tych samych strumieni
oddawanych energii (odpowiednio 34 jednostki energii elektrycznej i 53 jednostki ciepła)
w układzie rozdzielonym nale
ż
y zu
ż
y
ć
159 jednostek energii chemicznej paliwa, czyli o 59
jednostek wi
ę
cej ni
ż
w elektrociepłowni. Sprawno
ść
ogólna procesu skojarzonego
wynosi w przedstawionym przykładzie 87%, a procesów rozdzielonych 54,7%.
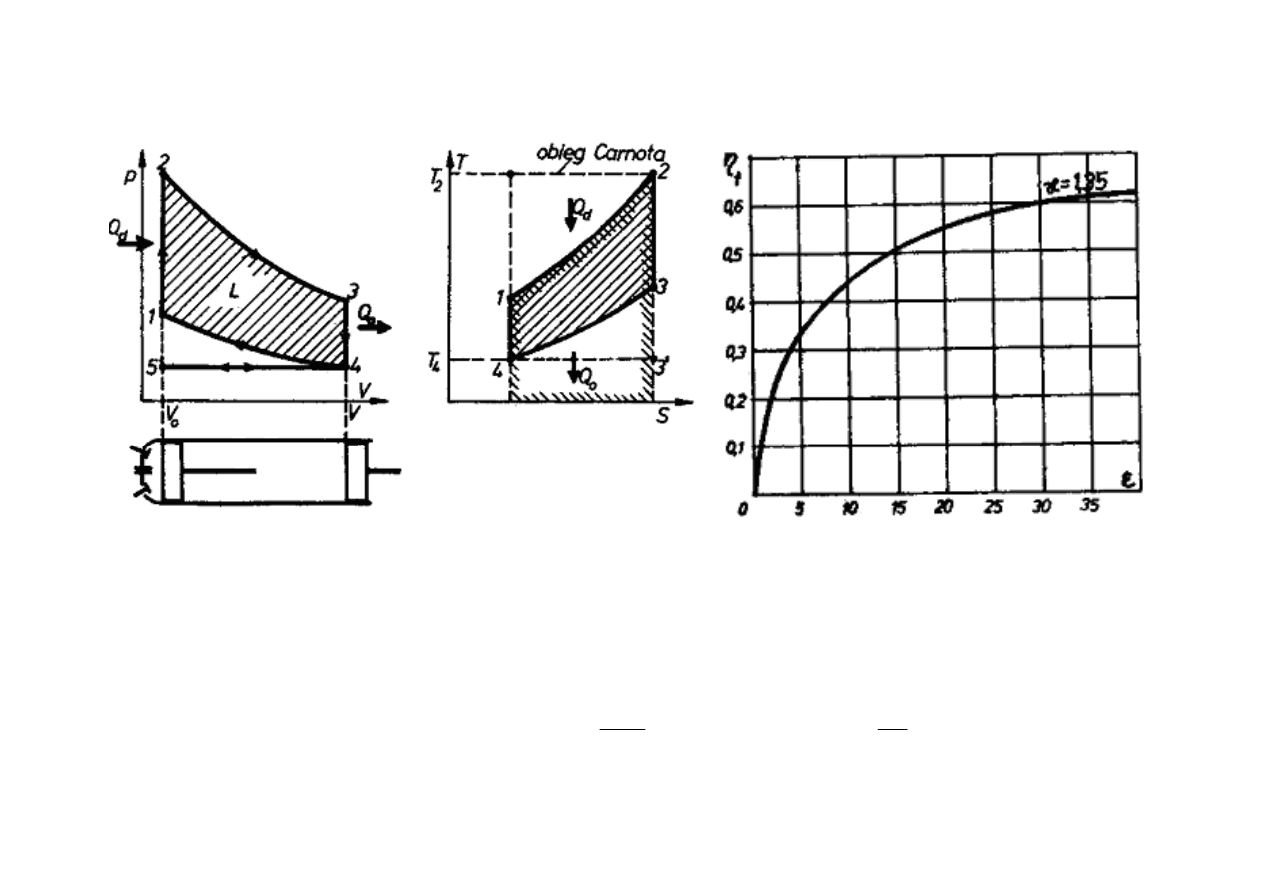
SILNIK SPALINOWY
Ś
REDNIOPR
ĘŻ
NY
z zapłonem iskrowym (Otto)
W silnikach spalinowych czynnikiem roboczym s
ą
spaliny wytwarzane wewn
ą
trz
samego silnika w wyniku spalania paliwa. Obieg Otto, jest obiegiem porównawczym
(teoretycznym) silnika spalinowego tłokowego z zapłonem iskrowym.
Sprawno
ść
teoretyczna obiegu Otto
η
t
zale
ż
y od stopnia spr
ęż
ania
ε
:
κ
– wykładnik adiabaty
1
t
1
1
−−−−
κκκκ
εεεε
−−−−
====
ηηηη
0
V
V
====
εεεε
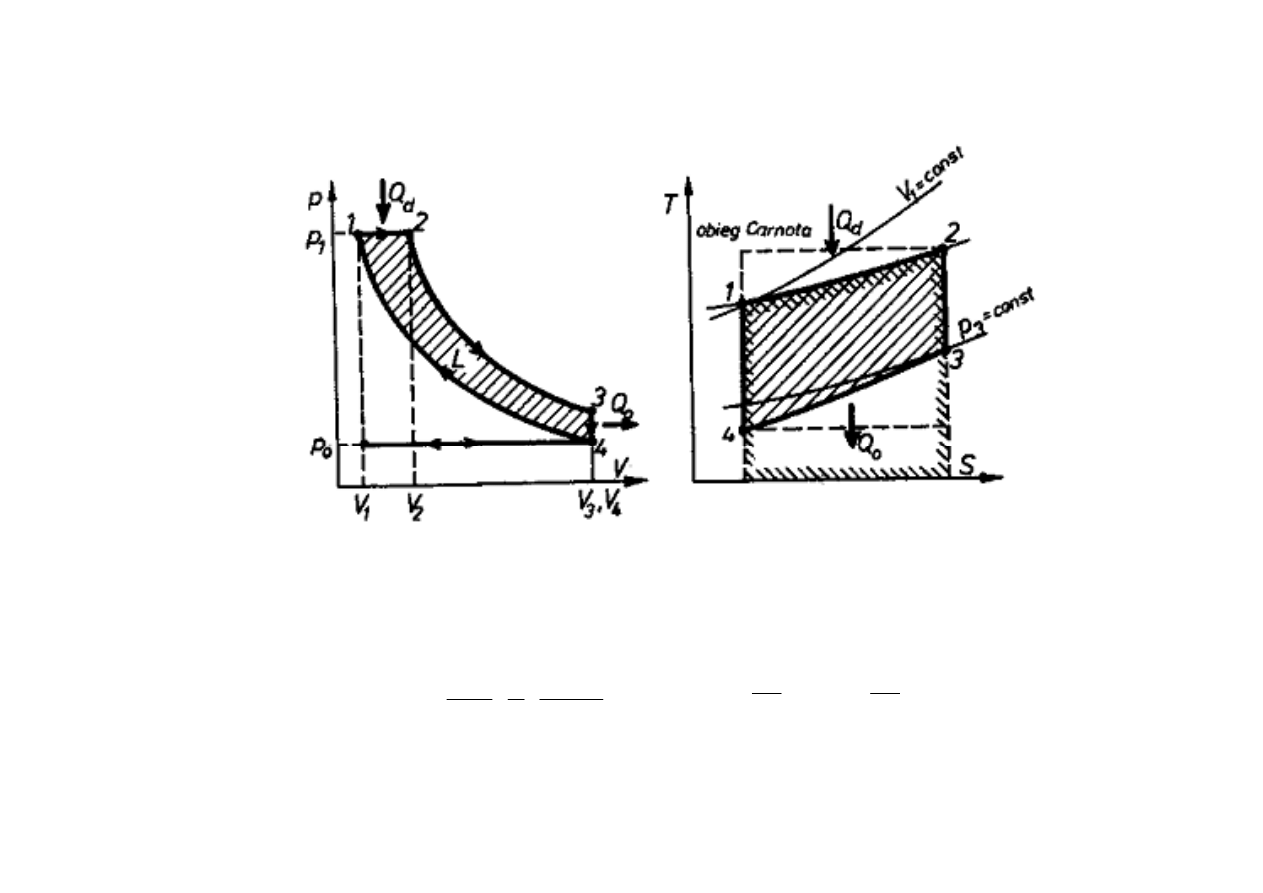
SILNIK SPALINOWY WYSOKOPR
ĘŻ
NY
z samoczynnym zapłonem (Diesela)
Obieg Diesela jest obiegiem porównawczym dla silnika wysokopr
ęż
nego z
samoczynnym zapłonem. Do powietrza, które w wyniku spr
ęż
onia do bardzo wysokiego
ci
ś
nienia, posiada wysok
ą
temperatur
ę
, jest wtryskiwane paliwo, które ulega
samozapłonowi. Sprawno
ść
teoretyczna obiegu Diesela
η
t
zale
ż
y od stopnia spr
ęż
ania
ε
:
1
1
1
1
1
1
t
−−−−
ϕϕϕϕ
−−−−
ϕϕϕϕ
⋅⋅⋅⋅
κκκκ
⋅⋅⋅⋅
εεεε
−−−−
====
ηηηη
κκκκ
−−−−
κκκκ
1
2
1
3
V
V
,
V
V
====
ϕϕϕϕ
====
εεεε
W silnikach Diesela osi
ą
ga si
ę
sprawno
ść
η
t
= (0,52
÷
0,64) i s
ą
to najwy
ż
sze sprawno
ś
ci
spo
ś
ród wszystkich typów spalinowych silników cieplnych.
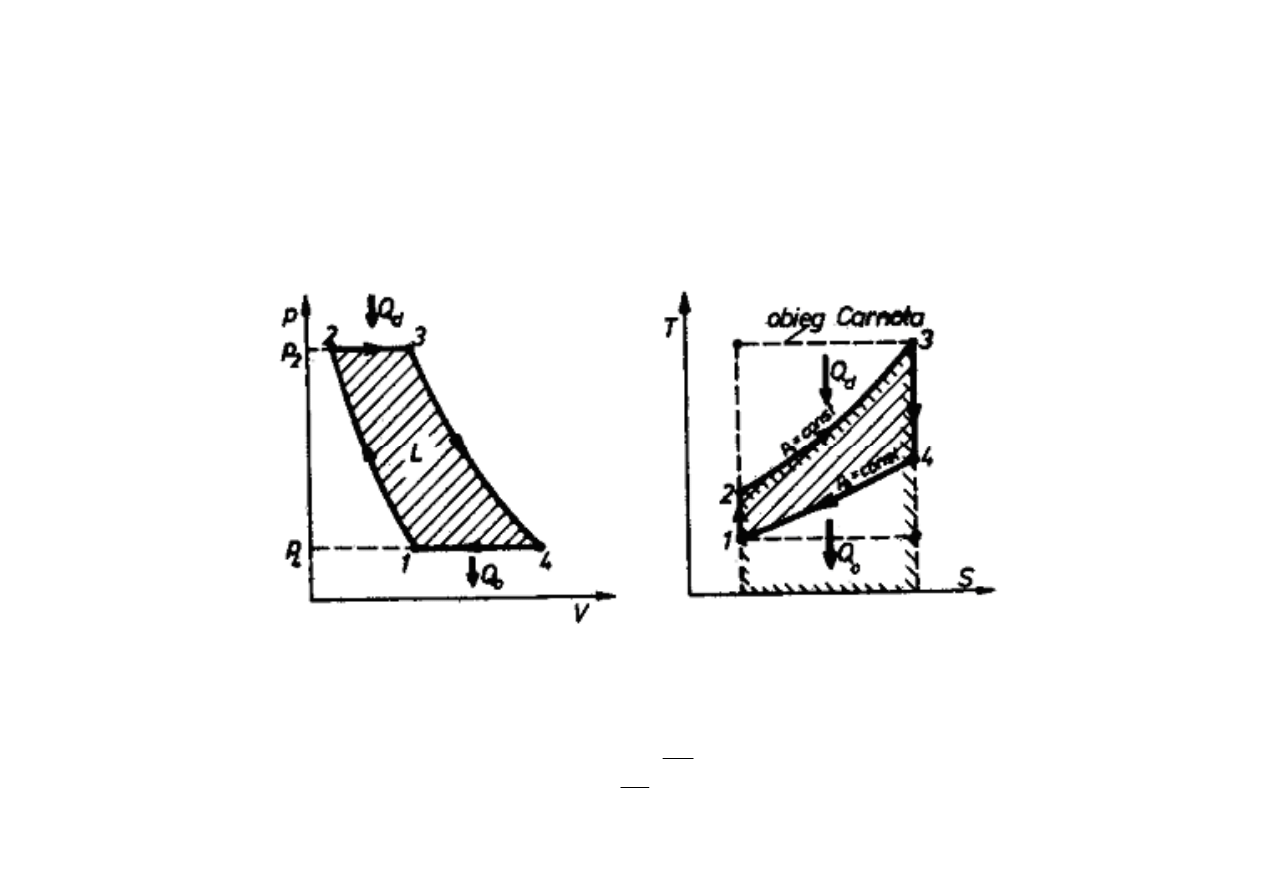
OBIEGI Z TURBINAMI GAZOWYMI
Ze wzgl
ę
du na posuwisto-zwrotny ruch tłoka pr
ę
dko
ść
obrotowa silników tłokowych
jest tym mniejsza, im wi
ę
ksza jest moc silnika. Konsekwencj
ą
tego jest du
ż
y ci
ęż
ar
jednostkowy silnika i ograniczona moc maksymalna. Powoduje to stopniowe
wypieranie silników tłokowych przez silniki turbinowe w zakresie du
ż
ych mocy. Obiegi
porównawcze tego typu silników wywodz
ą
si
ę
z obiegu Joule’a.
Sprawno
ść
teoretyczna obiegu Joule’a
η
t
zale
ż
y od stosunku ci
ś
nie
ń
, przy których
doprowadza (p
2
) i odprowadza si
ę
(p
1
) ciepło:
κκκκ
−−−−
κκκκ
−−−−
====
ηηηη
1
2
1
t
p
p
1
Istotn
ą
wad
ą
silników turbogazowych jest konieczno
ść
stosowania spr
ęż
arki
zu
ż
ywaj
ą
cej znaczn
ą
cz
ęść
mocy turbiny. Aby uzyska
ć
moc zespołu wynosz
ą
c
ą
10 MW, nale
ż
y zainstalowa
ć
turbin
ę
o mocy około 40 MW, z czego około 30 MW
zu
ż
ywa spr
ęż
arka. Ta cecha silników turbogazowych przyczynia si
ę
do zwi
ę
kszenia
nakładów inwestycyjnych i ograniczenia maksymalnej mocy jednego agregatu. Wady
tej nie ma elektrownia parowa, w której tylko nieznaczna cz
ęść
mocy wytworzonej w
turbozespole zostaje zu
ż
yta do nap
ę
dy pompy wody zasilaj
ą
cej i innych urz
ą
dze
ń
pomocniczych.
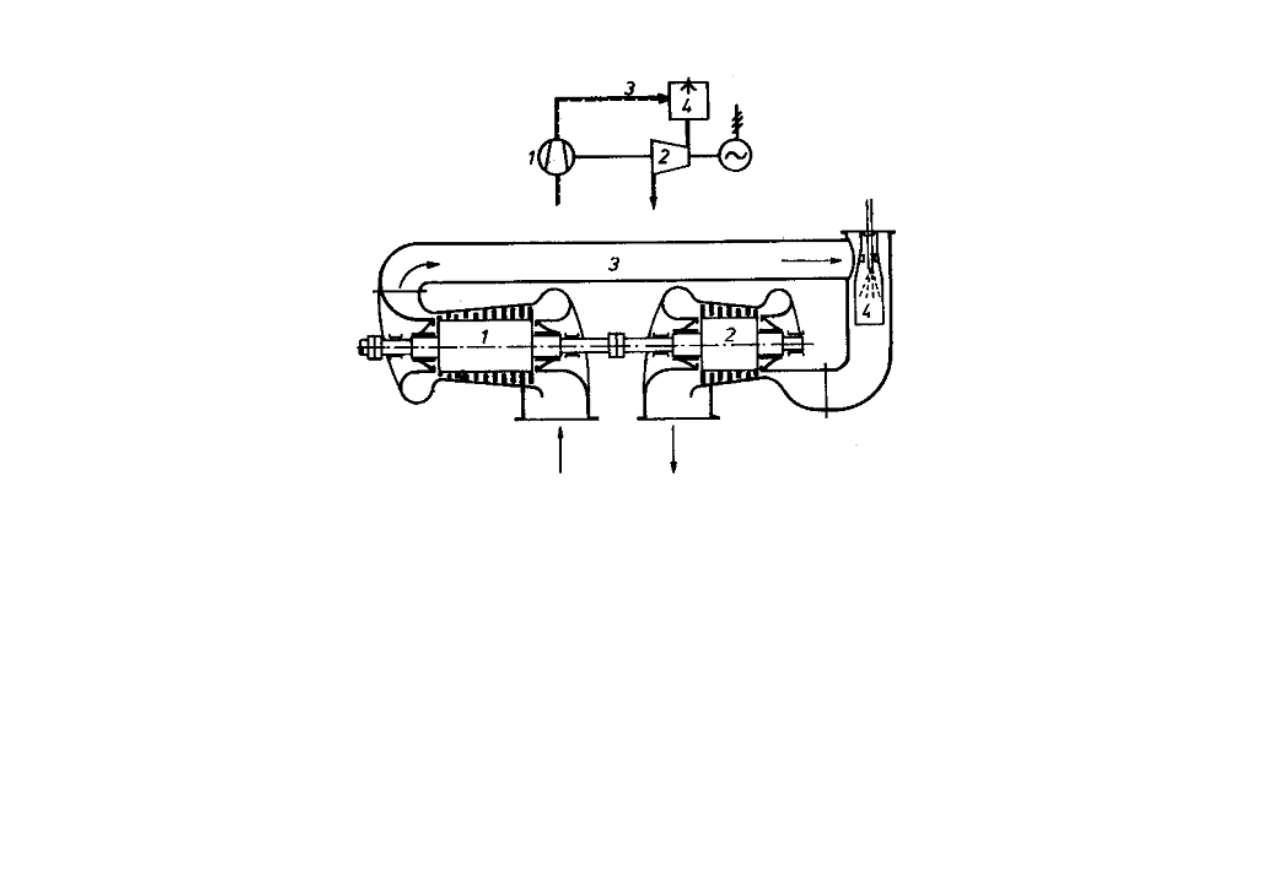
1 - spr
ęż
arka powietrza, 2 - turbina gazowa, 3 - doprowadzenie powietrza do komory
spalania, 4 - komora spalania.
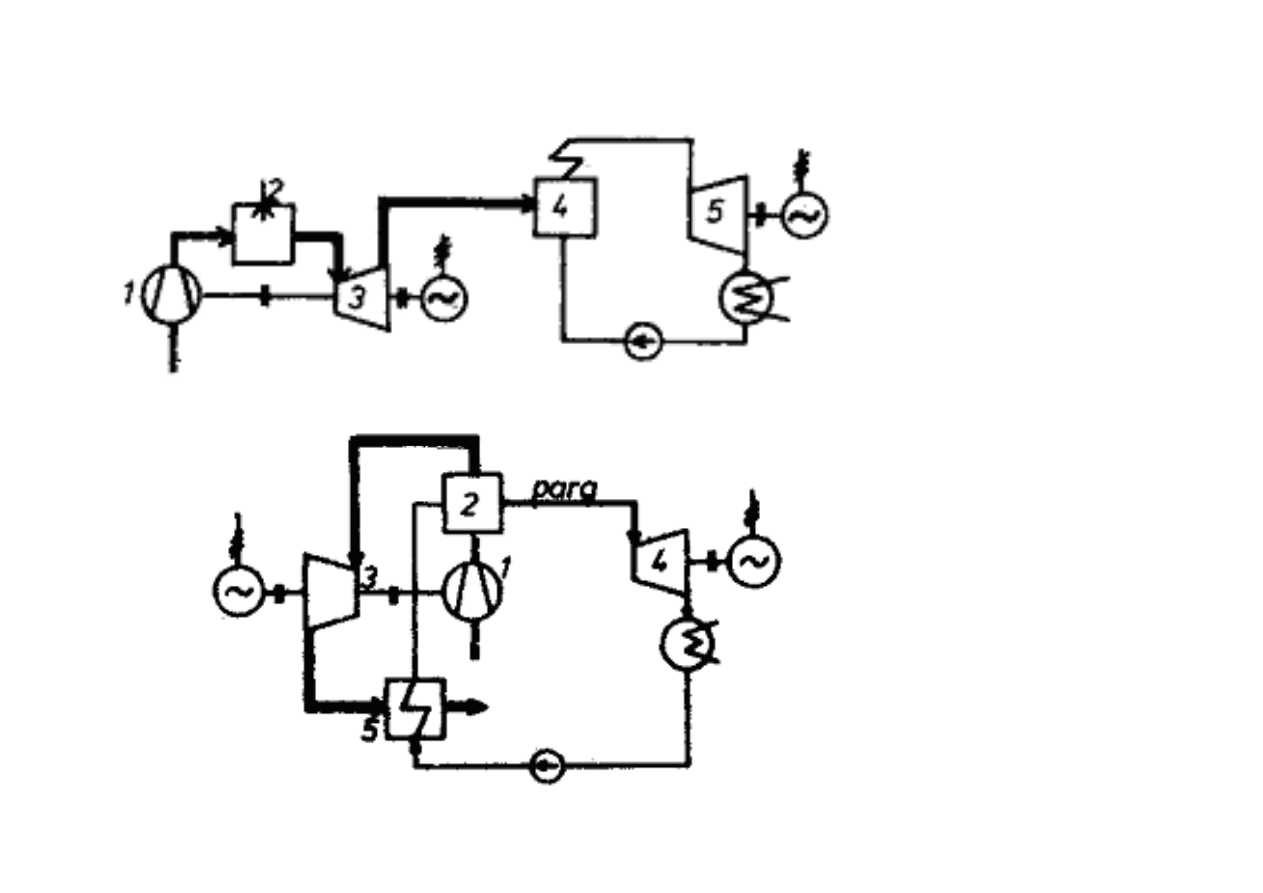
UKŁADY GAZOWO-PAROWE
1 - spr
ęż
arka,
2 - komora spalania,
3 - turbina gazowa,
4 – kocioł odzyskowy,
5 - turbina parowa
1 - spr
ęż
arka,
2 - kocioł parowy,
3 -turbina gazowa,
4 - turbina parowa,
5 - wymiennik ciepła.

EGZERGIA
Ilo
ść
energii nie jest dostatecznym miernikiem jej praktycznej przydatno
ś
ci. Ciepło
dostarczane przez czynnik grzejny jest tym cenniejsze, im wy
ż
sza jest jego temperatura.
Ciepło zawarte w otoczeniu jest ogromne lecz jest ono zupełnie nieu
ż
yteczne jako
ź
ródło
energii nap
ę
dowej procesów cieplnych.
Konieczne jest wi
ę
c wprowadzenie wielko
ś
ci charakteryzuj
ą
cej energi
ę
pod wzgl
ę
dem
jej jako
ś
ci. T
ą
wielko
ś
ci
ą
jest
Egzergia
– miara u
ż
yteczno
ś
ci energii.
Do okre
ś
lenia wielko
ś
ci egzergi nale
ż
y uwzgl
ę
dni
ć
2 zasad
ę
termodynamiki oraz wpływ
otaczaj
ą
cej przyrody na przebieg procesów realizowanych przez układy
termodynamiczne. Procesy te mog
ą
by
ć
realizowane tylko dzi
ę
ki temu,
ż
e dysponujemy
bogactwami naturalnymi, które nie s
ą
w równowadze termodynamicznej z otaczaj
ą
c
ą
przyrod
ą
.
przyrod
ą
.
Typowe bogactwa naturalne to: paliwa chemiczne, substancje zdolne do reakcji
j
ą
drowych, strumienie wody o du
ż
ej energii kinetycznej lub potencjalnej,
promieniowanie słoneczne itp. Materia traci swoj
ą
przydatno
ść
energetyczn
ą
, gdy
zostanie sprowadzona do stanu równowagi termodynamicznej z otaczaj
ą
c
ą
przyrod
ą
, z
jej składnikami nie nale
żą
cymi do bogactw naturalnych. Otaczaj
ą
ca przyroda narzuca
wi
ę
c naturalny punkt zerowy przy ocenie praktycznej przydatno
ś
ci energii. Jako miernik
tej przydatno
ś
ci przyj
ę
to maksymaln
ą
zdolno
ść
do wykonania pracy i nazwano t
ę
wielko
ść
egzergi
ą
.
Analiz
ę
egzergetyczn
ą
najwygodniej jest przeprowadzi
ć
w formie bilansu. Składnikiem
zamykaj
ą
cym bilans jest wewn
ę
trzna strata egzergii, wywołana przez przemiany
nieodwracalne.

Egzergia nie podlega prawu zachowania. W ka
ż
dym rzeczywistym (nieodwracalnym)
procesie wyst
ę
puj
ą
straty egzergii. Straty egzergii s
ą
spowodowane takimi procesami
jak; tarcie, przepływ ciepła przy sko
ń
czonej ró
ż
nicy temperatur oraz dyfuzja substancji
przy sko
ń
czonej ró
ż
nicy st
ęż
e
ń
. Szczególnie du
ż
e straty egzergii wyst
ę
puj
ą
przy
spalaniu. I wła
ś
nie w takich procesach gdzie spalanie odgrywa rol
ę
dominuj
ą
c
ą
(procesy hutnicze , procesy energetyczne i cieplne ) bardzo wa
ż
na rol
ę
pełni poj
ę
cie
egzergii .
W energetyce nale
ż
y tak realizowa
ć
procesy, aby straty egzergii były jak najmniejsze.
Im bardziej bowiem proces zbli
ż
ony jest do odwracalnego, tym mniejsze zu
ż
ycie
ś
rodków nap
ę
dowych jest potrzebne do osi
ą
gni
ę
cia zamierzonego celu.
Chc
ą
c zbada
ć
mo
ż
liwo
ś
ci poprawy jako
ś
ci procesu energetycznego nale
ż
y wyznaczy
ć
straty egzergii wyst
ę
puj
ą
ce w poszczególnych cz
ęś
ciach urz
ą
dzenia realizuj
ą
cego ten
straty egzergii wyst
ę
puj
ą
ce w poszczególnych cz
ęś
ciach urz
ą
dzenia realizuj
ą
cego ten
proces, a nast
ę
pnie poznanie przyczyn wyst
ę
powania tych strat (szczególnie tych
najwi
ę
kszych).
Zmniejszenie strat egzergii wi
ąż
e si
ę
z reguły ze zwi
ę
kszeniem nakładów
inwestycyjnych. Zmniejszenie strat egzergii w wymienniku ciepła mo
ż
na uzyska
ć
przez
zwi
ę
kszenie powierzchni wymiany ciepła (wi
ę
kszy i dro
ż
szy wymiennik). Opłacalno
ść
takiego sposobu zmniejszenia strat egzergii powinna by
ć
sprawdzona rachunkiem
ekonomicznym. Analiza egzergetyczna wyja
ś
nia mo
ż
liwo
ś
ci poprawy procesu
cieplnego, dopiero jednak analiza ekonomiczna okre
ś
li celowo
ś
ci realizacji tej poprawy.
Egzergia
– maksymalna praca, jak
ą
otwarty układ termodynamicznie mo
ż
e wykona
ć
w
otoczeniu przechodz
ą
c do stanu równowagi z otoczeniem. Otoczenie traktuje si
ę
jako
niesko
ń
czenie du
ż
y zbiornik nieu
ż
ytecznej energii i materii o stałej temperaturze. W
procesie odwrotnym mo
ż
na uzyska
ć
maksymaln
ą
energi
ę
.

Ogólne sformułowanie poj
ę
cia egzergii:
B = I + T
0
·S lub dla wielko
ś
ci wła
ś
ciwych b = i + T
0
· s
gdzie:
B, b – egzergia,
I, i – entalpia,
T – temperatura otoczenia,
S, s – entropia.
Egzergia ró
ż
nych no
ś
ników energii:
Energia elektryczna jest równowa
ż
na pracy mechanicznej, tak wi
ę
c z definicji
egzergia pr
ą
du elektrycznego równa jest energii tego pr
ą
du, czyli: B/Q = 1.
egzergia pr
ą
du elektrycznego równa jest energii tego pr
ą
du, czyli: B/Q
el
= 1.
W przypadku paliw egzergia jest w przybli
ż
eniu równa zawartej w nich energii, czyli:
B/Q
p
≈
1 , przy czym głównym składnikiem Q
p
jest ciepło spalania paliwa.
Wielkie ró
ż
nice mog
ą
wyst
ą
pi
ć
w przypadku ciepła. Egzergia zbiorników ciepła lub
strumieni ciepła jest zawsze ni
ż
sza od ich energii. Egzergia maleje w miar
ę
jak
temperatura no
ś
nika ciepła zbli
ż
a si
ę
do temperatury otoczenia.
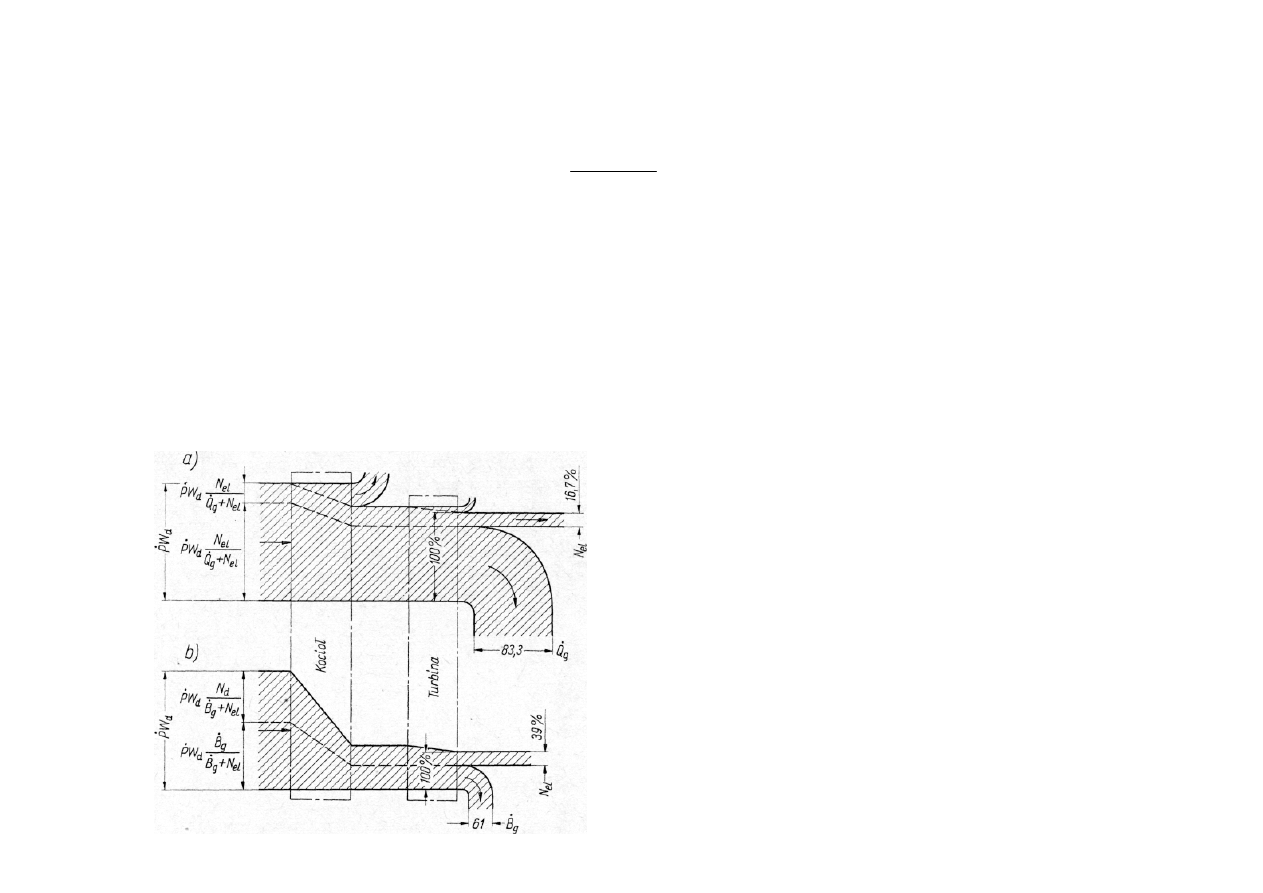
Sprawno
ść
egzergijn
ą
elektrowni cieplnej wyra
ż
a stosunek energii wyprodukowanej
przez elektrownie do egzergii chemicznej paliwa:
gdzie:
E
e
– energia elektryczna, kJ; G
B
– ilo
ść
paliwa, kg;
b
ch
– egzergia chemiczna paliwa wła
ś
ciwa, kJ/kg.
dla w
ę
gla kamiennego:
b
ch
≈
W
d
+ r·w = (1 – w) · W
s
W
d
– warto
ść
opałowa w
ę
gla, kJ/kg,
r – ciepło parowania wody, kJ/kg,
w – wilgotno
ść
w
ę
gla,
W
s
– ciepło spalania w
ę
gla, kJ/kg,
ch
B
e
b
b
G
E
⋅⋅⋅⋅
====
ηηηη
Bilans elektrociepłowni: a) energijny, b) egzergijny.
Wyszukiwarka
Podobne podstrony:
cykl przemian energetycznych
Podstawy przemian energetycznych
PRZEMIANY ENERGETYCZNE
cykl przemian energetycznych
Przemiany Energetyczne I Żródła Energii, Fotowoltaika1, Fotowoltaika
Przemiany energetyczne w maszynach
Przemiany energetyczne
Teorie mocy w obwodach prądu przemiennego, Energetyka I stopień PŚk, sem3 Energoelektronika, sem3 en
Przemiany Energetyczne I Żródła Energii, Instalacje rozproszone referat, Przegląd materiałów interne
Przemiany Energetyczne I Żródła Energii, Fotoogniwa referat, Szczególnie atrakcyjnym rozwiązaniem je
PRZEMIANY ENERGETYCZNE
Podstawy przemian energetycznych
Ćwiczenia 4 Masai skład ciała. Przemiana materii i bilans energetyczny, Medyczne, Studia pielęgniars
pyt 10,11 , Podstawowa i całkowita przemiana materii, potrzeby energetyczne człowieka, metody pomiar
więcej podobnych podstron