
______________________________________________
NOWA METODA SYNTEZY ETERÓW
AZATIOKORONOWYCH ZAWIERAJĄCYCH UKŁAD
5,5’-BI-1,2,4-TRIAZYNY I 2,2’-BIPIRYDYNY

Wykaz słów kluczowych:
Etery azatiokoronowe
5,5’-bi-1,2,4-triazyna
2,2’-bipirydyna
Reakcja dimeryzacji
Reakcja Dielsa – Aldera
3

SPIS TREŚCI
3.6. Reakcja 1,8-dibromo-3,6-dioksaoktanu (2) z tiosemikarbazydem.................................26
3.7. Reakcja 1,11-dibromo-3,6,9-trioksaundekanu (3) z tiosemikarbazydem.......................27
3.10. Synteza 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)...................30
3.11. Reakcja 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
3.12. Reakcja 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
3.13. Reakcja 1,11-bis(1,2,4-triazynylo-3-sylfanylo)-3,6,9-trioksaundekanu (9)
7

8
4.6. Reakcja 1,8-dibromo-3,6-dioksaoktanu (2) z tiosemikarbazydem.................................42
4.7. Reakcja 1,11-dibromo-3,6,9-trioksaundekanu (3) z tiosemikarbazydem.......................42
4.10. Synteza 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)...................45
4.11. Reakcja 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
4.12. Reakcja 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
4.13. Reakcja 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)
1. WSTĘP I CEL PRACY
Etery azakoronowe i azatiokoronowe stanowią grupę związków makrocyklicznych, które
zawierają oprócz atomów tlenu atomy azotu i siarki. Te ostatnie dzięki obecności wolnych par
elektronowych pełnią rolę donorów tworząc kompleksy nie tylko z metalami alkalicznymi jak
klasyczne etery koronowe, ale również z kationami metali ciężkich. Z tego względu znalazły
szerokie zastosowanie w syntezie organicznej, katalizie homo- i heterofazowej, chemii
supramolekularnej, koordynacyjnej, analitycznej jak też w elektrochemii [1].
Jedną z ważniejszych grup związków makrocyklicznych są połączenia, w których
fragmentem pierścienia makrocyklicznego jest aromatyczny układ 2,2’-bipirydyny [2],
(Rysunek 1). Ten układ biheterocykliczny stanowi jeden z najbardziej znanych ligandów
stosowanych w chemii koordynacyjnej. Wynika to z obecności dwóch atomów azotu
w sąsiadujących ze sobą pierścieniach, które wykazują dużo większą zdolność kompleksowania
metali ciężkich lub ich kationów niż metali alkalicznych. Tego typu kompleksy są interesujące
ze względu na szerokie możliwości zastosowań. Między innymi umożliwiają badania
strukturalne kompleksów o wysokich liczbach i nietypowych geometriach koordynacyjnych.
Stosuje się je także w radioimmunoterapii, w nowoczesnych metodach diagnostyki klinicznej,
tomografii, scyntygrafii i magnetycznym rezonansie jądrowym [3].
N
1
6
N
2
5
3
N
4
R
6'
N
1'
5'
N
2'
N
4'
3'
R
N
N
Rysunek
1
Rysunek
2
Dotychczas nie badano zastosowań 5,5’-bi-1,2,4-triazyny (Rysunek 2) jako
heterocyklicznego komponenta do konstrukcji związków makrocyklicznych. Układ ten ma
podobną geometrię do 2,2’-bipirydyny, jednakże obecność dodatkowych atomów azotu
w położeniu N:1 i N:2 pierścienia wywiera istotny wpływ na strukturę elektronową cząsteczki
i powoduje, że izolowany atom azotu N:4 ma inne właściwości niż atom azotu w 2,2’-
bipirydynie. Może to generować różnice w kompleksowaniu niektórych metali.
9

10
Niniejsza praca ma na celu opracowanie dogodnej drogi syntezy eterów
azatiokoronowych zawierających układ 5,5’-bi-1,2,4-triazyny, połączony poprzez atomy siarki
z łańcuchem polieterowym. Dalszym celem było przekształcenie tak otrzymanych tioeterów
do ich analogów zawierających układ skondensowanej 2,2’-bipirydyny. Metody syntezy tych
ostatnich połączeń mimo znaczącego postępu w ostatnich latach są nadal niezadowalające [4].
Obecność elektrodonorowego atomu siarki bezpośrednio połączonego z pierścieniem 1,2,4-
triazyny lub 2,2’-bipirydyny powinna wpływać korzystnie na geometrię przyłączonego łańcucha
eterowego i zwiększać właściwości kompleksujące układu [5]. Atom siarki może być również
wykorzystany w syntezie asymetrycznej ze względu na możliwość jego utlenienia do chiralnych
sulfotlenków [6].
W
części teoretycznej pracy przedstawiłem dotychczasowe metody syntezy wybranych
związków makrocyklicznych zawierających fragment heterocykliczny. W części badawczej
omówiłem wyniki przeprowadzonych badań, które doprowadziły do opracowania nowej
oryginalnej drogi syntezy eterów azatiokoronowych, w których fragmentem pierścienia
makrocyklicznego jest układ 5,5’-bi-1,2,4-triazyny lub skondensowanej 2,2’-bipirydyny.

2.
CZĘŚĆ LITERATUROWA
2.1
Wprowadzenie
Przełomem w badaniach polieterowych związków makrocyklicznych były odkrycia
Pedersena, Lehna oraz Crama. Pedersen otrzymał nową grupę związków makrocyklicznych,
które nazwał eterami koronowymi [7,8]. Lehn opisał badania nad kryptandami, które
charakteryzują się szczególnymi właściwościami przestrzennymi i zwiększonymi
właściwościami kompleksującymi [9], podczas gdy Cram otrzymał sferandy – związki zdolne
do selektywnego rozpoznawania jonów lub małych cząstek [10]. Liczba otrzymanych związków
makrocyklicznych rośnie z każdym rokiem co jest związane z ich unikalnymi właściwościami
i możliwością zastosowań w różnych dziedzinach nauki i techniki.
2.2. Wybrane metody syntezy związków makrocyklicznych
Znanych jest szereg metod syntezy związków makrocyklicznych. Najpopularniejsze
z nich to metoda wysokich rozcieńczeń oraz metoda templatowa [11,12] z licznymi
modyfikacjami. W ostatnich latach zostały one wzbogacone o metodę opartą na reakcji metatezy
[13]. Powyższe metody syntezy są przedstawione na Schematach 1-3.
+
B
-
OH
OH
X
X
O
O
duże rozcieńczenie
X – grupa opuszczająca
Schemat 1
11
X
X
X
X
X
X
Y
M
+
X
X
X
X
X
X
M
+
+
Y
X – heteroatomy
M
+
– kation metalu
Y – grupa opuszczająca
Schemat 2
katalizator
Schemat 3
2.2.1. Metoda wysokich rozcieńczeń
Prowadzenie reakcji w warunkach wysokich rozcieńczeń polega na użyciu niewielkiej
ilości reagentów i dużej ilości rozpuszczalnika. Przykładowo na jeden gram substratu stosuje się
około pięciu litrów rozpuszczalnika co wydaje się mało ekonomiczne [14]. Jeden z częściej
stosowanych wariantów metody wysokich rozcieńczeń polega na dozowaniu reagentów
w odstępach czasu do roztworów zawierających małą ilość rozpuszczalnika.
12
Powoduje to problemy przy reakcjach biegnących przez wiele godzin, gdyż wymaga stosowania
automatycznych urządzeń dozujących.
Metodę wysokich rozcieńczeń w syntezie skondensowanych związków
makrocyklicznych zaproponował Elwahy [15]. Synteza polegała na tworzeniu pierścieni
na drodze cyklokondensacji dialdehydu z odpowiednią diaminą wobec alkoholu metylowego
a następnie redukcji otrzymanych zasad Schiffa za pomocą tetrahydroboranu sodu. Reakcja
ta była prowadzona z wykorzystaniem techniki wysokich rozcieńczeń, w krótkim czasie aby
zapobiec tworzeniu się produktów ubocznych (Schemat 4). Końcowe produkty zostały
otrzymane z 31 – 34% wydajnością.
N
N
R
O
O
CHO
R
1
R
2
R
3
R
3
R
2
R
1
CHO
H
2
N
Z
NH
2
MeOH / 1h
N
N
R
O
O
R
1
R
2
R
3
R
3
R
2
R
1
N
N
Z
N
N
R
O
O
R
1
R
2
R
3
R
3
R
2
R
1
NH
NH
Z
NaBH
4
/ MeOH
R=R
1
=R
2
=R
3
=H, Z=(CH
2
)
2
R=Me, R
2
=R
3
=H, Z=(CH
2
)
3
R=R
1
=R
2
=H, R
3
=OCH
3
, Z=(CH
2
)
3
R=R
1
=R
3
=H, R
2
=OCH
3
, Z=(CH
2
)
3
duże rozcieńczenie
Schemat 4
13
Włączenie układu heterocyklicznego do pierścienia eteru koronowego nie tylko dostarcza
sztywności całej cząsteczce, ale także zwiększa jej właściwości kompleksujące. Makrocykliczne
etery z pirydyną lub innymi układami heterocyklicznymi zawierającymi atomy azotu silnie
oddziaływują z różnie naładowanymi lub obojętnymi molekułami [15,16].
Derf i współpracownicy [17] zaproponowali drogę syntezy szeregu związków
makrocyklicznych, zawierających układ biheterocykliczny złożony z pięcioczłonowych
pierścieni z wbudowanymi atomami siarki. Przedstawione na Schemacie 5 tioetery zostały
otrzymane z wydajnościami rzędu 40 – 60% techniką wysokich rozcieńczeń.
S
S
S
S
H
3
CS
SCH
3
S
S
CN
NC
I
O
I
3
CsOH
S
S
S
S
H
3
CS
SCH
3
S
S
O
O
O
1). CsOH
2). MsCl
3). LiBr
Br
OH
S
S
S
S
H
3
CS
SCH
3
S
S
Br
Br
R
NH
R
NH
S
S
S
S
H
3
CS
SCH
3
S
S
R
N
R
N
S
S
S
S
H
3
CS
SCH
3
S
S
S
S
S
SH
S
S
H
n
n
50%
R = CH
3
, 5%
R = CF
3
SO
2
, 60%
R = CH
3
lub CF
3
SO
2
n = 0, 60%
n = 1, 40%
Schemat 5
14
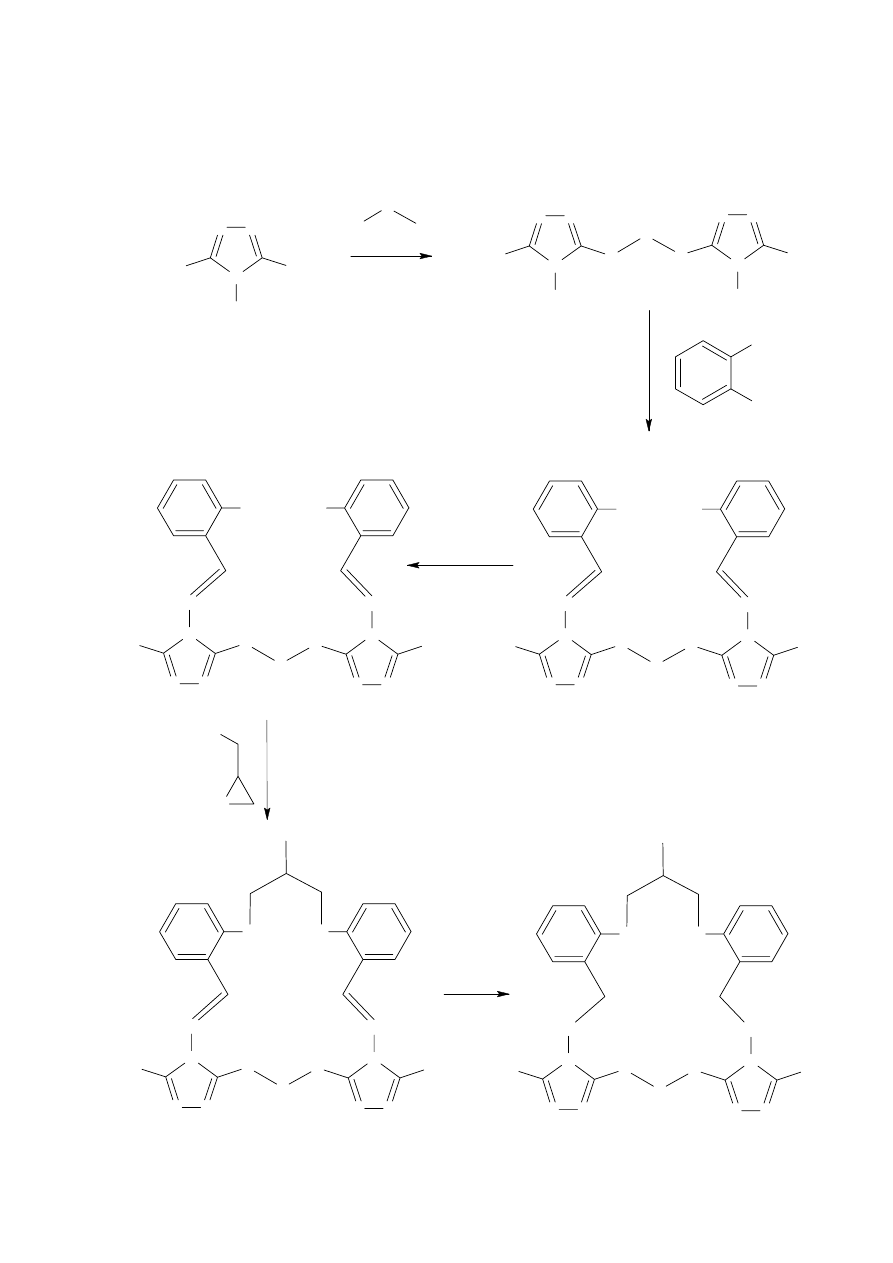
Inną drogę syntezy związków makrocyklicznych zaproponowali Abbas
i współpracownicy [16]. Badacze ci otrzymali makrocykle z wbudowanymi dwoma
pierścieniami triazolu połączonymi ze sobą poprzez łańcuch alifatyczny, zawierający na swych
końcach elektrodonorowe atomy siarki (Schemat 6).
15
N
N
N
NH
2
R
HS
Br
X
Br
S
X
S
N
N
N
NH
2
R
N
N
N
NH
2
R
OH
CHO
CH
3
COOH
O
H
OH
S
X
S
N
N
N
N
R
N
N
N
N
R
KOH / MeOH
KO
OK
S
X
S
N
N
N
N
R
N
N
N
N
R
O
Cl
H
2
O
O
O
S
X
S
N
N
N
N
R=Ph, X=(CH
2
)
3
lub (CH
2
)
4
R=PhCH
2
, X=(CH
2
)
3
lub (CH
2
)
4
N
N
N
N
R
OH
O
O
S
X
S
N
N
N
N
H
R
N
N
N
NH
R
OH
Schemat 6
R
NaBH
4
MeOH
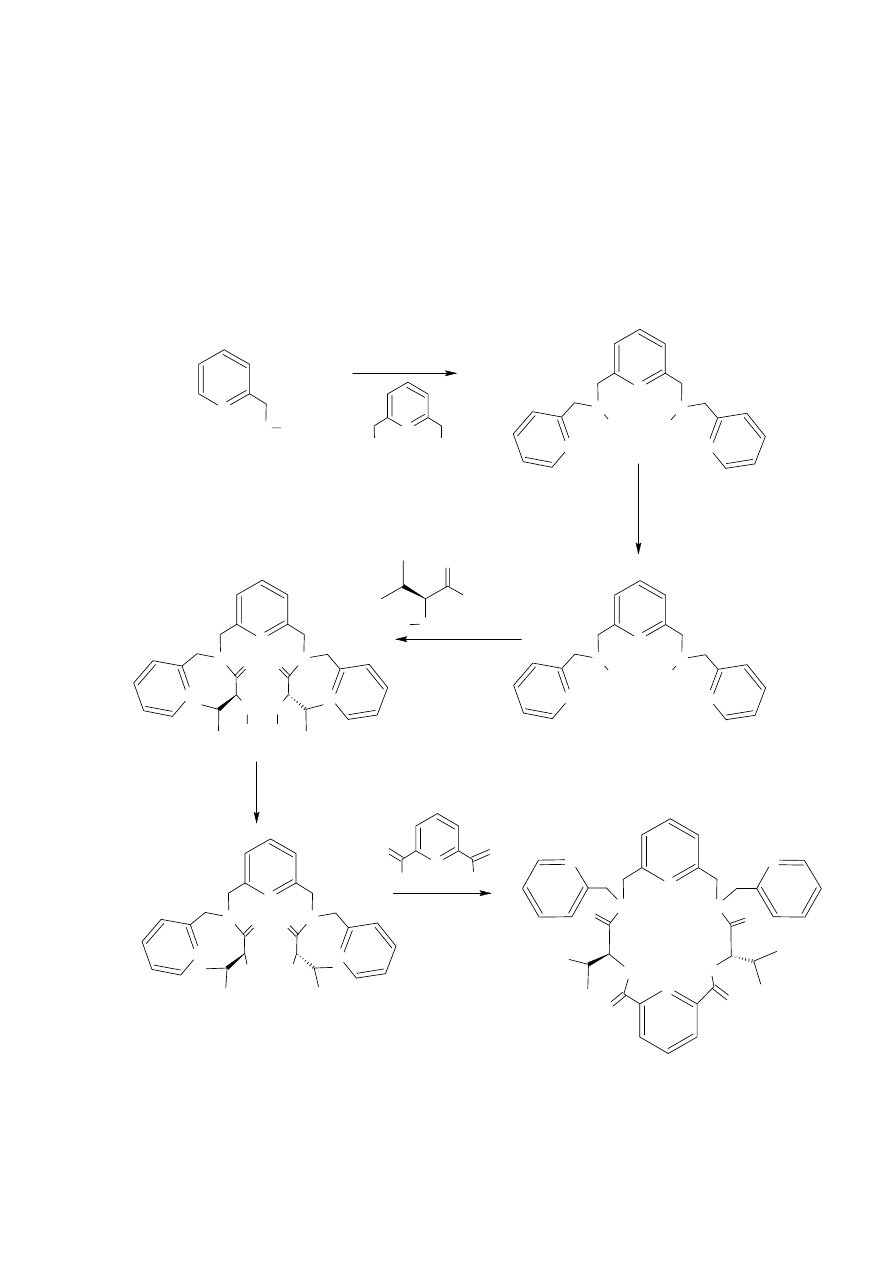
13-Hydroksyazatioetery otrzymane zostały z wydajnościami rzędu 65 – 70%. Obecna w tych
związkach grupa hydroksylowa stanowiła prekursor do dalszych syntez, między innymi
do otrzymania bardziej złożonych makrocykli.
Xiao Chen, Da-Ming Du i Wen-Ting Hua [18] otrzymali szereg chiralnych makrocykli
zawierających wbudowane pierścienie pirydyny połączone grupami amidowymi. Reakcja była
prowadzona w temperaturze pokojowej metodą wysokich rozcieńczeń (Schemat 7). Końcowe
chiralne makrocykle były otrzymane z niskimi wydajnościami rzędu 10 – 15%.
N
N
H
Ts
1. EtONa
2.
N
Br
Br
N
N
N
N
N
Ts
Ts
H
2
SO
4
110 °C
N
N
N
N
N
H
H
O
NH
OH
Z
, DCC
0 °C, CH
2
Cl
2
N
N
N
N
N
NH
O
Z
N
H
O
Z
33% HBr-HOAc
N
N
N
N
N
NH
2
O
N
H
2
O
2HBr
N
Cl
Cl
O
O
25 °C, CH
2
Cl
2
N
N
N
N
N
NH
O
N
H
O
N
O
O
Schemat 7
16
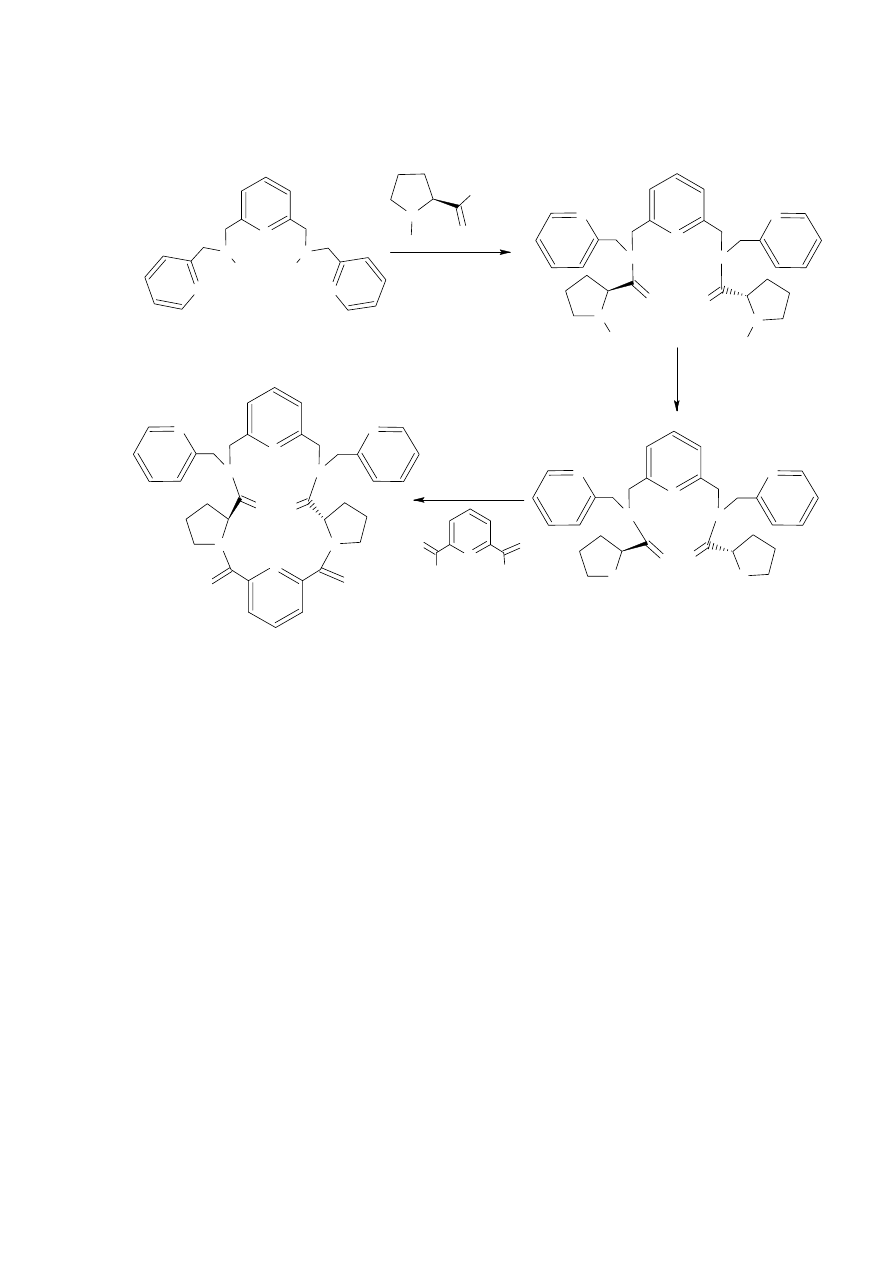
Badacze ci otrzymali również makrocykle zawierające wbudowany fragment proliny, stosując
te same warunki reakcji (Schemat 8).
N
N
N
N
N
H
H
O
N
OH
Z
, DCC
0 °C, CH
2
Cl
2
N
N
N
N
N
O
N
Z
O
N
Z
33% HBr-HOAc
N
N
N
N
N
O
NH
O
N
H
2HBr
N
Cl
Cl
O
O
25 °C, Et
3
N
N
N
N
N
N
O
N
O
N
N
O
O
Schemat 8
2.2.2. Metoda templatowa
Policykliczne etery koronowe i ich pochodne wymagają skomplikowanych procedur
syntetycznych. W celu otrzymania tego typu związków, a zwłaszcza ich części polieterowych,
często wykorzystuje się tak zwany „efekt templatowy”. Poprzez wprowadzenie kationu uzyskuje
się przejściowy kompleks utworzony przez prekursor łańcucha i jon metalu. Najczęściej stosuje
się w tym celu kationy metali lekkich, jednakże przy ich wyborze decyduje wielkość
determinowana rozmiarem luki i ułożeniem fragmentów cząsteczki odpowiedniego
makropierścienia [1,14]. Utworzenie przejściowego kompleksu zapobiega między innymi
ubocznemu powstawaniu polimerów. Formowanie pierścienia polieterowego wiąże się z utratą
entropii konformacji, spowodowaną zahamowaniem rotacji wokół pojedynczych wiązań.
Przy wielokrotnej koordynacji z jonem metalu redukcja entropii powoduje zbliżenie końców
łańcucha polieterowego do siebie i w rezultacie jego zamknięcie.
17
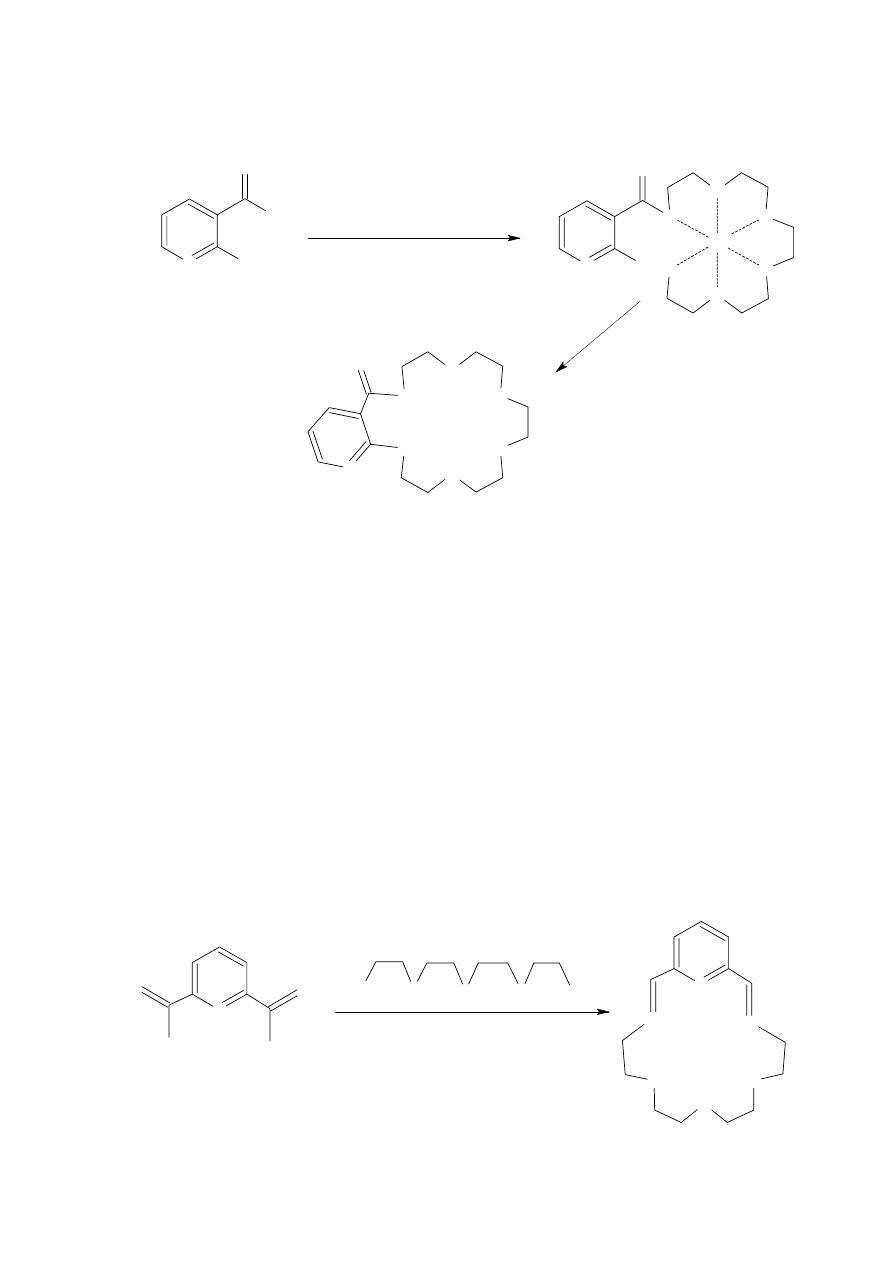
Przykładem wykorzystania efektu templatowego w procesie cyklizacji jest synteza
makrocyklu zaproponowana przez Newkoma i jego współpracowników [19], (Schemat 9).
N
Cl
Cl
O
N
Cl
O
O
O
O
O
-
O
O
M
+
M
+
-
OCH
2
(CH
2
OCH
2
)
4
CH
2
O
-
M
+
N
O
O
O
O
O
O
O
M
+
= Na
+
lub K
+
Schemat 9
Związkiem wyjściowym w tej syntezie była chloropochodna pirydyny i odpowiednia sól
dipotasowa lub disodowa glikolu pentaetylenowego. Otrzymano oczekiwany makrocykl z 30%
wydajnością w przypadku zastosowania soli sodowej. Związek ten powstaje z wydajnością 48%,
gdy reakcja była prowadzona wobec kationu potasu, pochodzącego z soli dipotasowej glikolu
jako inicjatora procesu cyklizacji.
Inną drogę syntezy, opartą na metodzie templatowej, związków makrocyklicznych
zawierających pierścień pirydyny zaproponował Fenton i współpracownicy [20]. Substratami
w syntezie azaeteru była 2,6-diformylopirydyna i 1,11-diamino-3,6,9-trioksaundekan w stosunku
molowym 1:1 (Schemat 10). Reakcja była prowadzona w obecności kationów ołowiu (II).
N
H
O
O
H
N
H
2
O
O
O
NH
2
Pb
2+
O
O
O
N
N
N
Pb
2+
2SCN
-
Schemat 10
18
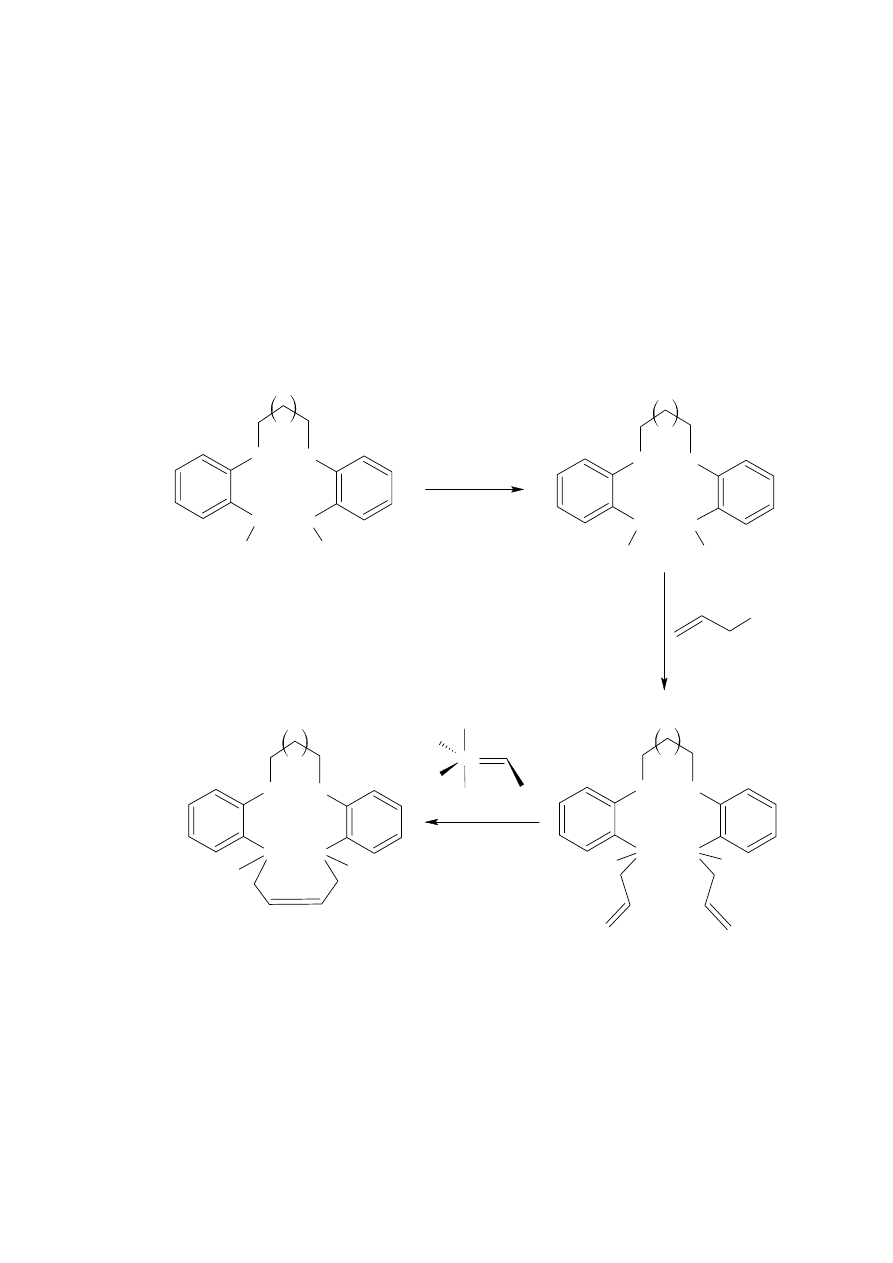
2.2.3. Reakcja metatezy
Ostatnio bardzo popularną metodą stosowaną z powodzeniem w syntezie związków
makrocyklicznych jest metoda oparta na reakcji metatezy. Umożliwia ona syntezę szeregu
cyklicznych olefin. Przebieg tej reakcji jest katalizowany przez metalokarbenowe kompleksy,
wśród których najbardziej popularnym jest rutenowy katalizator Grubbs’a. Metoda ta jest
obiecująca ze względu na wysokie wydajności otrzymywanych produktów.
Reakcja
była stosowana do otrzymania wielu rozbudowanych eterów azakoronowych
z wydajnościami rzędu 90% [21], (Schemat 11).
O
NH
Ts
O
N
H
Ts
KOH / MeOH
O
NK
Ts
O
KN
Ts
DMF
Br
O
N
Ts
O
N
Ts
Cl
Ru
PCy
3
PCy
3
Ph
Cl
CH
2
Cl
2
O
N
Ts
O
N
Ts
n
n
n
n
n = 1,2
Schemat 11
19
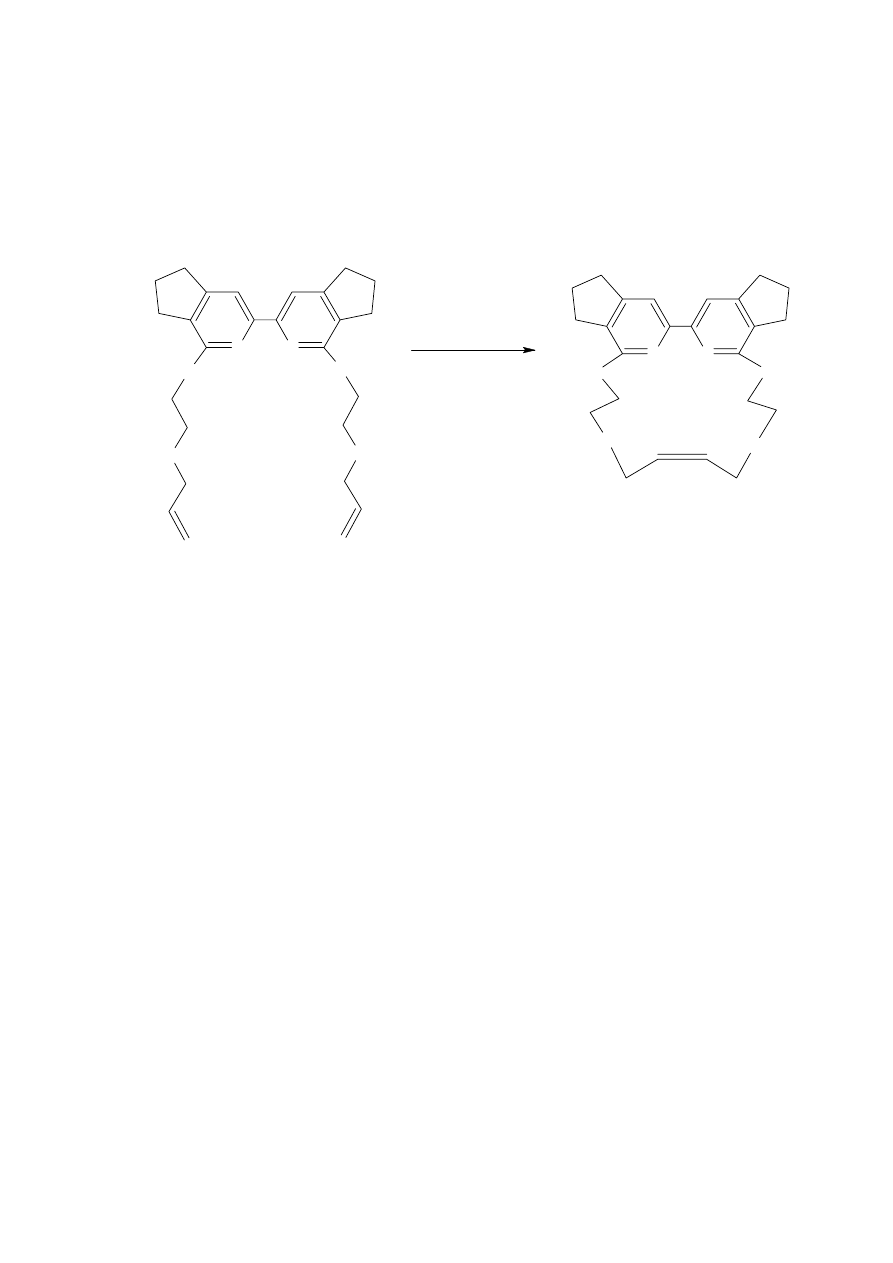
Reakcję metatezy wykorzystano do otrzymania 18 – członowych związków
makrocyklicznych syntetyzowanych w Zakładzie Chemii Organicznej Akademii Podlaskiej [4].
Oprócz pochodnej bipirydyny otrzymane makrocykle zawierały atomy siarki i tlenu
(Schemat 12). Reakcję prowadzono w odgazowanym chlorku metylenu. W celu zamknięcia
pierścienia był stosowany katalizator Grubbs’a pierwszej generacji.
N
N
S
S
O
O
N
N
S
S
O
O
kat. Grubbs'a I
Schemat 12
∗
∗
∗
Przedstawione
wyżej metody syntezy związków makrocyklicznych zawierających
fragment heterocykliczny wydają się być mało przydatne do otrzymania ich analogów
z pierścieniem 5,5’-bi-1,2,4-triazyny. Wynika to z faktu, że brak jest informacji w literaturze
odnośnie pochodnych 5,5’-bi-1,2,4-triazyny, które zawierają dobre grupy opuszczające
w położeniu C-3 i C-3’ pierścienia 1,2,4-triazyny. Próby syntezy tego typu pochodnych
z chlorem lub grupą metylosulfonylową zakończyły się niepowodzeniem [22].
20
3.
BADANIA WŁASNE
3.1. Wstęp
Klasyczne metody syntezy eterów koronowych, które zawierają układ
biheteroaromatyczny opierają się na reakcji nukleofilowego podstawienia grup odchodzących
w odpowiednich dipodstawionych pochodnych. Stosując tę metodę Newkome
i współpracownicy otrzymali szereg eterów koronowych z wbudowaną 2,2’-bipirydyną [23-25].
Reakcje nie przebiegały w sposób selektywny i prowadziły do powstania trudnych do rozdziału
mieszanin związków makrocyklicznych różniących się długością łańcucha polieterowego
i liczbą pierścieni.
Opracowując syntezę nieopisanych dotąd w literaturze tioeterów zawierających fragment
5,5’-bi-1,2,4-triazyny, zastanawiałem się nad bardziej dogodną drogą syntezy wyżej
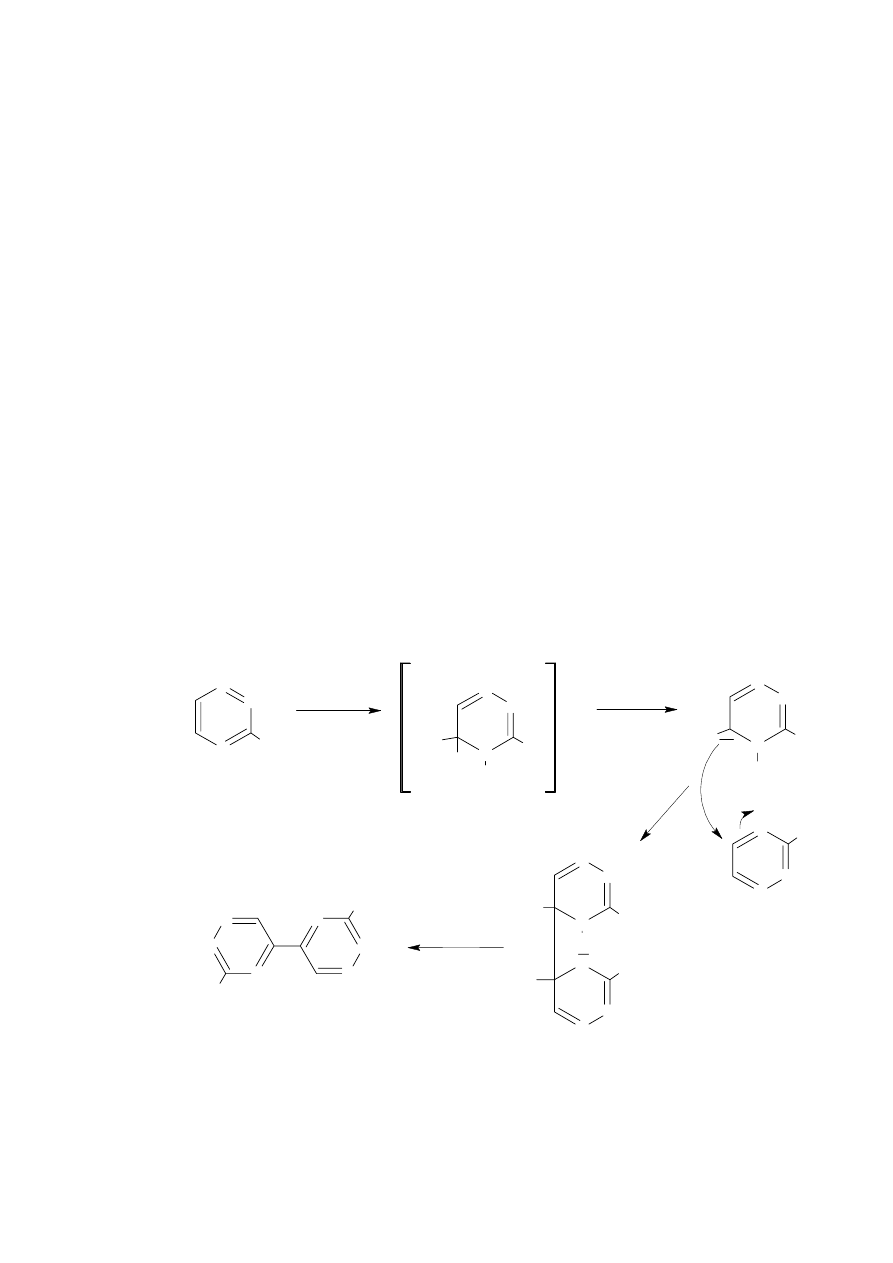
wymienionych związków makrocyklicznych. Moją uwagę zwróciła łatwa i wydajna reakcja
dimeryzacji 3-podstawionej 1,2,4-triazyny pod wpływem anionów cyjankowych [26,27].
Mechanizm dimeryzacji jest przedstawiony na Schemacie 13 i przedstawia wariant
międzycząsteczkowy tej reakcji, w której biorą udział dwie cząsteczki 1,2,4-triazyny.
N
N
N
R
N
N
N
R
N
N
N
R
NC
H
K
R = H, OCH
3
, SCH
3
N
N
N
R
NC
H
N
N
N
R
H
N
N
N
R
H
NC
N
N
N
R
N
N
N
R
KCN
H
2
O
-
HCN
utl. powietrzem
90 – 95%
Schemat 13
21
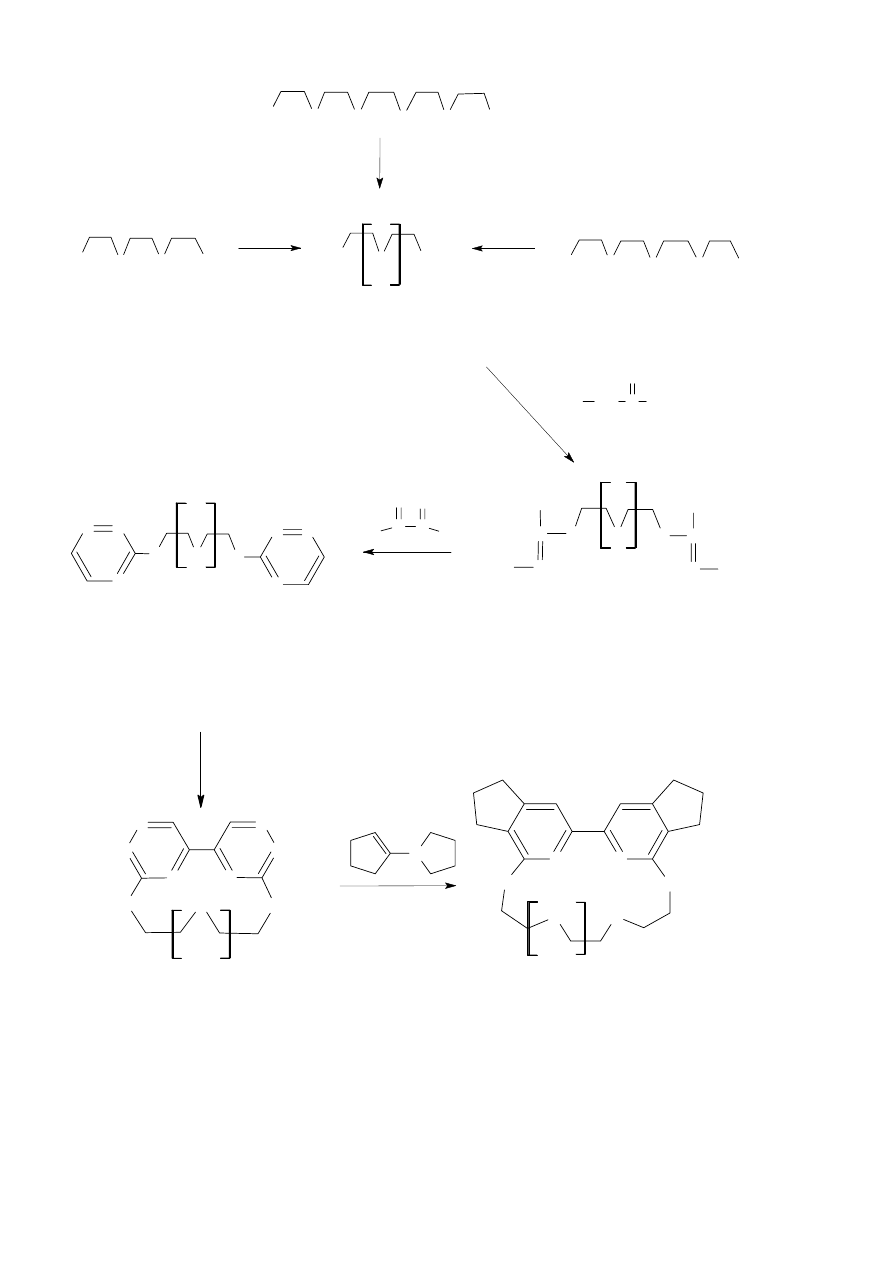
HO
O
O
O
O
OH
SOBr
2
Py
O
O
O
OH
Br
O
Br
PBr
3
Py
HO
O
O
O
OH
PPh
3
n = 1,2,3
Br
2
H
n=1
1
n=2
2
n=3
3
H
2
N
NH C NH
2
S
.
.
HBr
HBr
EtOH
Δ
S
O
S
C
N
H
2
N
NH
2
C
N
NH
2
NH
2
n=1,2,3
H C
O
C
O
H
NaHCO
3
H
2
O/MeOH
N
N
N
S
O
S
N
N
N
n=1,2,3
n=1
7
n=1
4
n=2
8
n=2
5
n=3
9
n=3
6
O
S
S
N
N
N
N
N
N
n = 1,2,3
KCN
H
2
O
N
Δ
n = 1,2
N
N
O
O
S
S
n=1
10
n=1
13
n=2
11
n=2
14
n=3
12
Schemat 14
22

Można sobie wyobrazić inny wariant – wewnątrzcząsteczkowy, w którym reakcja dimeryzacji
będzie zachodzić w obrębie tej samej cząsteczki. W przypadku pomyślnego przebiegu tego
procesu układ 5,5’-bi-1,2,4-triazyny może zostać utworzony w ostatnim etapie syntezy
związków makrocyklicznych. Dlatego wewnątrzcząsteczkową reakcję dimeryzacji postanowiłem
zastosować w syntezie eterów azatiokoronowych zawierających układ 5,5’-bi-1,2,4-triazyny.
Przebieg zaplanowanych etapów syntezy związków makrocyklicznych przedstawia
Schemat 14. W planowanej syntezie eterów azatiokoronowych 10-14 związkami wyjściowymi
były dibromopochodne glikoli polietylenowych 1-3, które otrzymałem w reakcji odpowiednich
glikoli tri-, tetra- i pentaetylenowych z bromkiem fosforu, bromem lub bromkiem tionylu,
zgodnie z procedurą opisaną w literaturze [28-30]. Otrzymane w ten sposób bromopochodne 1-3
ogrzewane z tiosemikarbazydem we wrzącym alkoholu etylowym przekształciłem
do S-alkilowych soli, pochodnych tiosemikarbazydu 4-6. W następnym etapie syntezy
otrzymane sole poddałem reakcji kondensacji z 40% glioksalem w obecności wodorowęglanu
sodu stosując jako rozpuszczalnik mieszaninę woda – alkohol metylowy. Reakcje te przebiegały
z dobrą wydajnością i prowadziły do powstania związków 7-9 zawierających dwa terminalne
pierścienie 1,2,4-triazyny, połączone poprzez atomy siarki z różnej długości łańcuchami
eterowymi. Związki te były finalnymi substratami w syntezie tioeterów 10-12 z wbudowanym
fragmentem 5,5’-bi-1,2,4-triazyny. Traktowane wodnym roztworem cyjanku potasu ulegały
wewnątrzcząsteczkowej reakcji dimeryzacji inicjowanej addycją jonów CN
-
do wiązania N
4
-C
5
w 1,2,4-triazynie. Otrzymane w ten sposób etery azatiokoronowe 11-12 stanowiły odpowiednie
substraty w syntezie ich analogów bipirydynowych 13-14. Związki te otrzymałem na drodze
reakcji Dielsa – Aldera z odwróconymi wymaganiami elektronowymi stosując jako dienofil
N-pirolidynocyklopenten.
Dokładny opis przeprowadzonych reakcji jest przedstawiony w dalszych rozdziałach
części badań własnych pracy.
23
3.2. Synteza 1,5-dibromo-3-oksapentanu (1)
24
1a
HO
O
O
O
O
OH
Br
O
O
O
O
Br
SOBr
2
Py /
Δ
Br
O
Br
1
Schemat 15
Zgodnie z przepisem preparatywnym podanym w literaturze [30] glikol pentaetylenowy
powinien ulegać reakcji bromowania w układzie bromek tionylu – pirydyna do 1,14-dibromo-
3,6,9,12-tetraoksatetradekanu 1a. Jednakże, w warunkach reakcji powstawała mieszanina
związków, z której wyodrębniłem z wydajnością 40% 1,5-dibromo-3-oksapentan 1, zbierając
frakcję wrzącą w temperaturze 56 – 60°C / 2 mmHg (literatura [31a], 92 – 93°C / 12 mmHg).
Ponadto z danych literaturowych [30] wynika, że temperatura wrzenia dla oczekiwanego
związku 1a powinna wynosić 148°C / 0.05 mmHg co znacznie odbiega od temperatury wrzenia
powstałego 1,5-dibromo-3-oksapentanu 1.
Budowę związku 1 potwierdzają widma
1
H NMR i MS jego triazynowej pochodnej 7,
otrzymanej według Schematu 21.
Zaobserwowana
degradacja
łańcucha polieterowego w glikolu pentaetylenowym podczas
reakcji bromowania w podwyższonej temperaturze ma swój precedens w innych reakcjach
glikoli polietylenowych w warunkach reakcji substytucji nukleofilowej [25,31b].
Ze
względu na wysoką cenę reagentów nie powtarzałem reakcji bromowania glikolu
pentaetylenowego. Otrzymany 1,5-dibromo-3-oksapentan wykorzystałem do dalszych syntez
opisanych w następnych rozdziałach tej części pracy.
3.3. Synteza 1,8-dibromo-3,6-dioksaoktanu (2)
HO
O
O
OH
Br
O
O
Br
PBr
3
Py
2
Schemat 16
1,8-dibromo-3,6-dioksaoktan
2 otrzymałem na drodze substytucji nukleofilowej grup
hydroksylowych w glikolu trietylenowym, stosując jako nukleofil bromek fosforu (III)
w pirydynie. Reakcję prowadziłem przez 4 godziny w temperaturze 60°C. Produkt
wyodrębniłem za pomocą destylacji próżniowej. 1,8-Dibromo-3,6-dioksaoktan 2 powstawał
z 52% wydajnością w postaci bezbarwnego oleju i wykazywał temperaturę wrzenia zgodną
z literaturową [28].
3.4. Synteza 1,11-dibromo-3,6,9-trioksaundekanu (3)
25
HO
O
O
O
OH
PPh
3
Br
O
O
O
Br
Br
2
3
Schemat
17
W celu otrzymania 1,11-dibromo-3,6,9-trioksaundekanu 3 przeprowadziłem reakcję
bromowania glikolu tetraetylenowego według metody opisanej w literaturze [29], stosując układ
brom – trifenylofosfina w suchym acetonitrylu. Reakcję prowadziłem przez 72 godziny
w temperaturze pokojowej. Wytrącony biały osad soli fosfiny odsączyłem, otrzymany roztwór
odparowałem do sucha a pomarańczową pozostałość kilkakrotnie ekstrahowałem heksanem.
Po oddestylowaniu rozpuszczalnika związek 3 otrzymałem z 76% wydajnością.
Budowę związku 3 potwierdziłem na podstawie jego widm
1
H NMR i
13
C NMR.
W widmie
1
H NMR widoczne są dwa triplety przy 3.44 ppm i 3.78 ppm pochodzące
od protonów grup metylenowych sąsiadujących odpowiednio z atomami bromu i tlenu. Multiplet
pochodzący od protonów centralnych grup metylenowych sąsiadujących z atomami tlenu
występuje w zakresie 3.61 – 3.65 ppm.
Widmo
13
C NMR wykazuje liczbę sygnałów równą połowie liczby atomów węgla
znajdujących się w związku 3 ze względu na symetrię układu.
W
widmie
1
H NMR i
13
C NMR nie stwierdziłem obecności innych sygnałów
świadczących o występowaniu nieprzereagowanego glikolu tetraetylenowego lub jego
monobromopochodnej.

3.5. Reakcja 1,5-dibromo-3-oksapentanu (1) z tiosemikarbazydem
Br
O
Br
H
2
N NH C NH
2
S
EtOH /
Δ
.
.
Br
H
Br
H
2
S
O
S
C
N
H
2
N
NH
2
C
N
NH
2
NH
2
1
4
Schemat 18
Reakcję 1,5-dibromo-3-oksapentanu 1 z tiosemikarbazydem prowadziłem
w bezwodnym alkoholu etylowym stosując dwukrotny nadmiar tiosemikarbazydu.
Reakcja przebiegała w temperaturze wrzenia rozpuszczalnika. Po 35 godzinach ogrzewania
kontrola mieszaniny reakcyjnej metodą chromatografii cienkowarstwowej (TLC) wykazała zanik
substratów i pojawienie się produktu. Rozpuszczalnik oddestylowałem na wyparce obrotowej.
Związek 4 otrzymałem z 88% wydajnością w postaci gęstego, brązowego oleju.
Budowę związku 4 potwierdziłem za pomocą widma IR, w którym stwierdziłem
obecność pasm absorpcji w zakresie 1106 – 1033 cm
-1
charakterystycznych dla wiązań C-O-C
oraz pasm przy 2960 cm
-1
– 2890 cm
-1
odpowiadających grupom metylenowym. Widoczne
są pasma w zakresie 3290 –
3163 cm
-1
charakterystyczne dla grupy aminowej.
Związek 4 był wykorzystany bez oczyszczania do dalszych syntez.
3.6. Reakcja 1,8-dibromo-3,6-dioksaoktanu (2) z tiosemikarbazydem
Br
O
O
Br
H
2
N NH C NH
2
S
EtOH /
Δ
S
O
O
C
N
H
2
N
NH
2
S
C
N
NH
2
NH
2
.
.
Br
H
Br
H
2
2
5
Schemat 19
Reakcję 1,8-dibromo-3,6-dioksaoktanu 2 z tiosemikarbazydem prowadziłem
w warunkach analogicznych dla związku 4 (patrz paragraf 3.5.). Czas reakcji określiłem metodą
TLC. Po 16 godzinach przerwałem proces. Po oziębieniu mieszaniny wypada jasnoróżowy osad
soli 5. Związek 5 powstawał z 90% wydajnością.
26
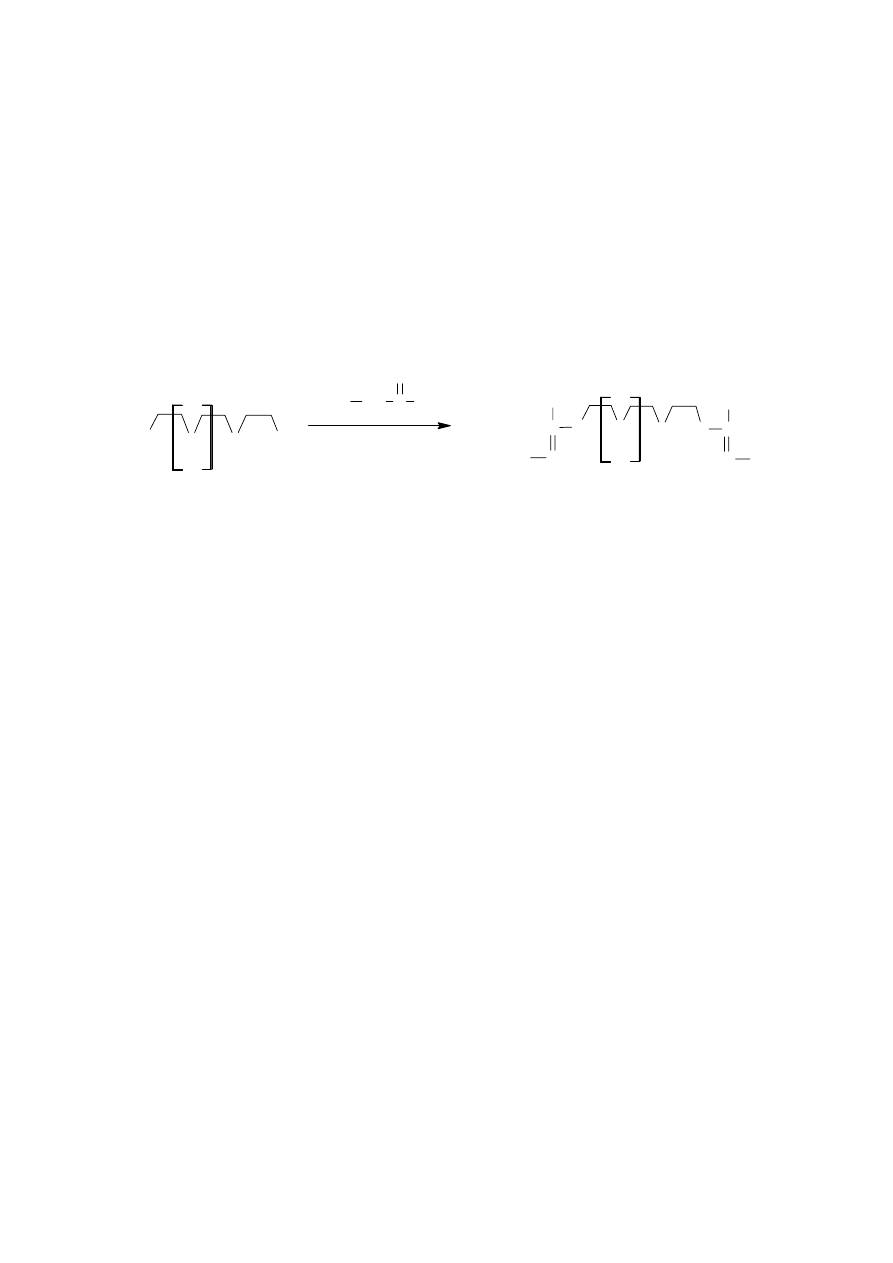
Budowę otrzymanej soli analizowałem za pomocą widma IR, w którym stwierdziłem
obecność pasm absorpcji w zakresie 1166 – 1021 cm
-1
charakterystycznych dla wiązań C-O-C
oraz w zakresie 2965 – 2928 cm
-1
odpowiadających grupom metylenowym. W przedziale 3347
–
3248 cm
-1
widoczne jest szerokie pasmo absorpcji, które można przypisać grupie aminowej.
Związek 5 był wykorzystany bez oczyszczania do dalszych syntez.
3.7. Reakcja 1,11-dibromo-3,6,9-trioksaundekanu (3) z tiosemikarbazydem
Br
O
O
Br
H
2
N NH C NH
2
S
EtOH /
Δ
S
O
O
C
N
H
2
N
NH
2
S
C
N
NH
2
NH
2
.
.
Br
H
Br
H
n = 2
n = 2
2
3
6
Schemat 20
Reakcję 1,11-dibromo-3,6,9-trioksaundekanu 3 z tiosemikarbazydem prowadziłem
w identycznych warunkach jak dla związków 4 i 5 (reakcje opisane w paragrafach 3.5. i 3.6.).
Czas reakcji określiłem metodą TLC. Po 25 godzinach przerwałem proces
a rozpuszczalnik oddestylowałem na wyparce obrotowej. Związek 6 otrzymałem z 89%
wydajnością w postaci gęstego, brązowego oleju.
Budowę związku 6 potwierdziłem za pomocą jego widma IR. W widmie widoczne
są pasma absorpcji w zakresie 1170 – 1035 cm
-1
charakterystyczne dla wiązań C-O-C oraz
pasma przy 2960 – 2920 cm
-1
odpowiadające grupom metylenowym. W zakresie 3347 –
3246
cm
-1
występują pasma charakterystyczne dla grupy aminowej.
Związek 6 był wykorzystany bez oczyszczania do dalszych syntez.
27
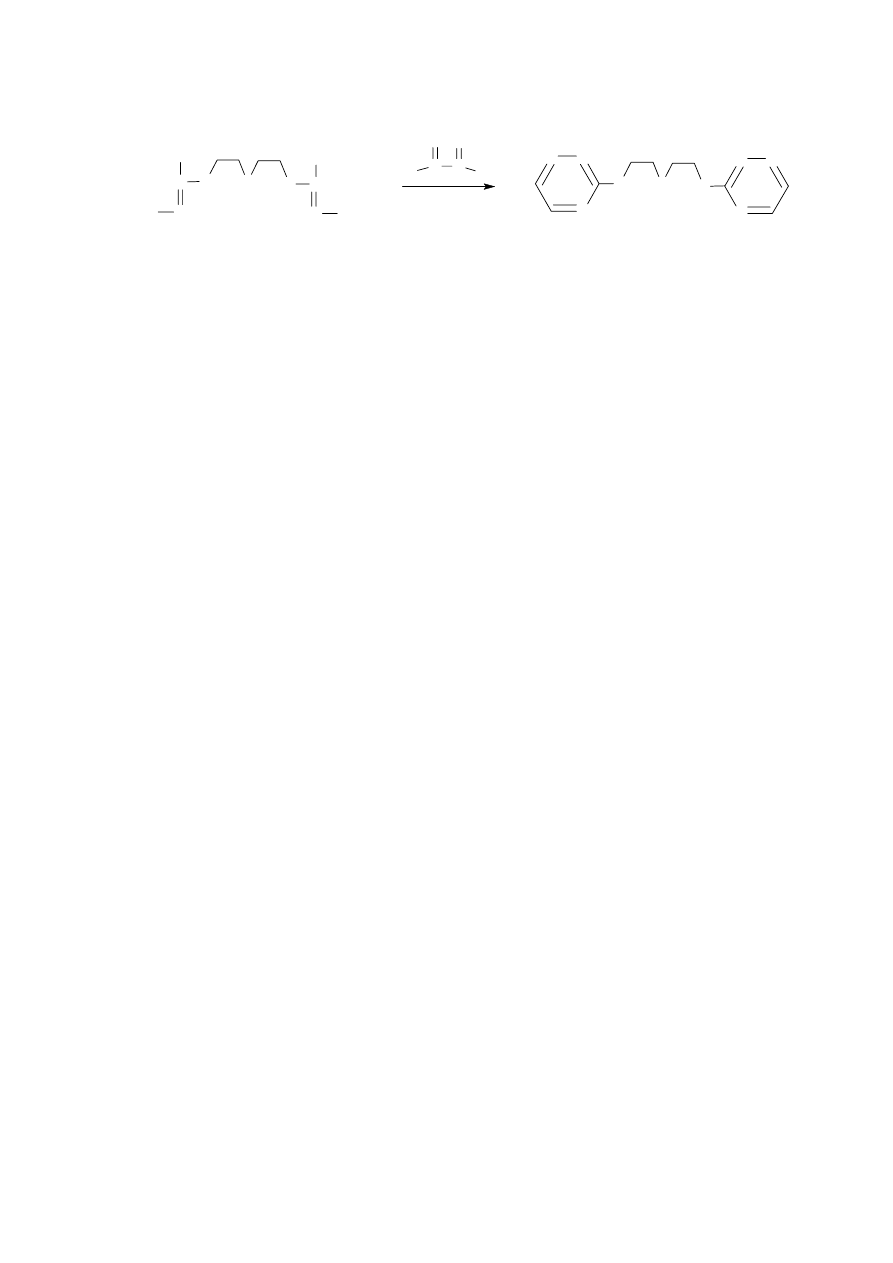
3.8. Synteza 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
28
Br
H
H
4
7
Schemat 21
1,5-Bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentan 7 otrzymałem w reakcji kondensacji
soli 4 z glioksalem w temperaturze pokojowej. Do soli 4 rozpuszczonej w wodzie z lodem
dodałem oziębiony do temperatury 0°C roztwór zawierający glioksal i kwaśny wodorowęglan
sodu. Całość mieszałem na mieszadle magnetycznym przez 5 minut a następnie dodałem równą
objętościowo ilość alkoholu metylowego aby zapobiec wypadaniu produktu w postaci gęstego
oleju. Czas reakcji kontrolowałem za pomocą TLC. Mieszaninę reakcyjną pozostawiłem na noc
kontynuując mieszanie. Alkohol metylowy odparowałem na wyparce obrotowej a produkt
ekstrahowałem dichlorometanem. Po oddestylowaniu rozpuszczalnika związek 7 oczyściłem
na kolumnie z żelem krzemionkowym stosując jako eluent mieszaninę dichlorometanu i acetonu
w stosunku 10:1. 1,5-Bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentan 7 powstawał z 33%
wydajnością.
Budowę związku 7 potwierdziłem za pomocą jego widma
1
H NMR oraz spektrometrii
masowej. Symetryczną strukturę związku 7 potwierdza jego widmo
1
H NMR,
w którym występują dwa triplety przy 3.47 i 3.83 ppm pochodzące od protonów grup
metylenowych. Widoczne są dwa dublety przy 8.36 i 8.92 ppm odpowiadające protonom
pierścieni triazynowych.
W widmie MS występuje pik masowy M
+
(m/z) = 296, który jest zgodny
z obliczoną masą cząsteczkową dla związku 7.
.
.
Br
H C
O
C
O
H
NaHCO
3
H
2
O/MeOH
S
O
S
C
N
H
2
N
NH
2
C
N
NH
2
NH
2
N
N
N
S
O
S
N
N
N

3.9. Synteza 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
29
2
N
NH
2
S
C
N
NH
2
NH
2
H
C
O
C
O
H
H
5
8
Schemat
22
Syntezę 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu
8 prowadziłem
w warunkach analogicznych jak dla związku 7 (patrz paragraf 3.8.). Produkt 8 oczyściłem
na kolumnie z żelem krzemionkowym stosując jako eluent mieszaninę dichlorometanu i acetonu
w stosunku 10:1. Związek 8 powstawał z 63% wydajnością.
Budowę związku 8 potwierdziłem za pomocą jego widm IR,
1
H NMR,
13
C NMR
i spektrometrii masowej. W widmie IR produktu 8 widoczne są pasma absorpcji w zakresie 1154
– 1032 cm
-1
charakterystyczne dla wiązań C-O-C, jak też pasma absorpcji w zakresie 1535 –
1509 cm
-1
odpowiadające drganiom pierścieni aromatycznych. W widmie widoczne są silne
pasma absorpcji charakterystyczne dla grup alkilowych w zakresie 2908 – 2873 cm
-1
.
W
widmie
1
H NMR występują dwa triplety przy 3.48 i 3.82 ppm oraz singlet przy
3.68 ppm pochodzący od protonów grup metylenowych. Widoczne są dwa dublety przy 8.38
i 8.92 ppm, które przypisałem protonom pierścienia 1,2,4-triazynowego.
Widmo
13
C NMR wykazuje liczbę sygnałów równą połowie liczby atomów węgla
znajdujących się w związku 8 ze względu na symetrię układu.
Masa
cząsteczkowa związku 8 określona metodą spektroskopii masowej jest zgodna
z wartością teoretyczną i wynosi M
= 340.
S
O
O
C
N
.
.
Br
Br
H
H
NaHCO
3
H
2
O/MeOH
N
N
N
N
N
N
S
O
O
S
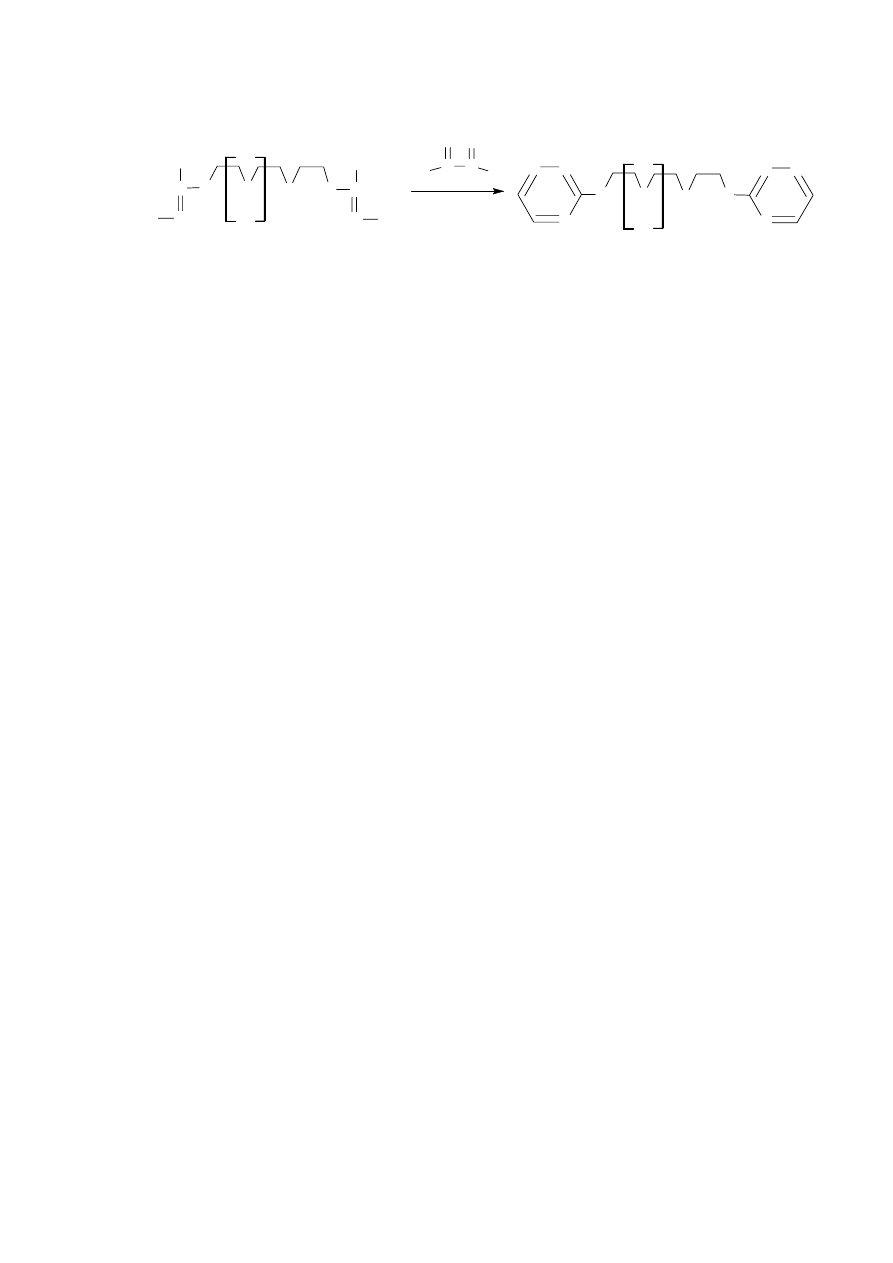
3.10. Synteza 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)
30
2
N
NH
2
S
C
N
NH
2
NH
2
H C
O
C
O
H
H
6
9
Schemat 23
Syntezę 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu 9 prowadziłem
w warunkach analogicznych jak dla związku 7 i 8 (reakcje opisane w paragrafach 3.8. i 3.9.).
Produkt 9 oczyściłem na kolumnie z żelem krzemionkowym stosując jako eluent mieszaninę
dichlorometanu i acetonu w stosunku 5:1. Związek 9 powstawał z 55% wydajnością.
Budowę związku 9 potwierdziłem za pomocą jego widm IR,
1
H NMR,
13
C NMR oraz
spektrometrii masowej. W widmie IR związku 9 widoczne są pasma przy 1198 – 1034 cm
-1
charakterystyczne dla wiązań eterowych C-O-C oraz pasma absorpcji w zakresie 1541 – 1525
cm
-1
odpowiadające drganiom układu aromatycznego. W widmie są widoczne pasma absorpcji
charakterystyczne dla grupy CH
2
-CH
2
w zakresie 2938 – 2874 cm
-1
.
Symetryczną strukturę związku 9 potwierdza jego widmo
1
H NMR, w którym występują
dwa triplety przy 3.48 i 3.82 ppm oraz multiplet w zakresie 3.63 – 3.74 ppm pochodzące
od protonów grup metylenowych. Widoczne są dwa dublety przy 8.36 i 8.92 ppm odpowiadające
protonom pierścieni triazynowych.
Widmo
13
C NMR wykazuje liczbę sygnałów równą połowie liczby atomów węgla
znajdujących się w związku 9 ze względu na symetrię układu.
W widmie MS występuje pik masowy M
+
(m/z) = 384, który jest zgodny z obliczoną
masą cząsteczkową dla związku 9.
S
O
O
C
N
.
.
Br
Br
H
H
NaHCO
3
H
2
O/MeOH
n = 2
n = 2
N
N
N
N
N
N
S
O
O
S
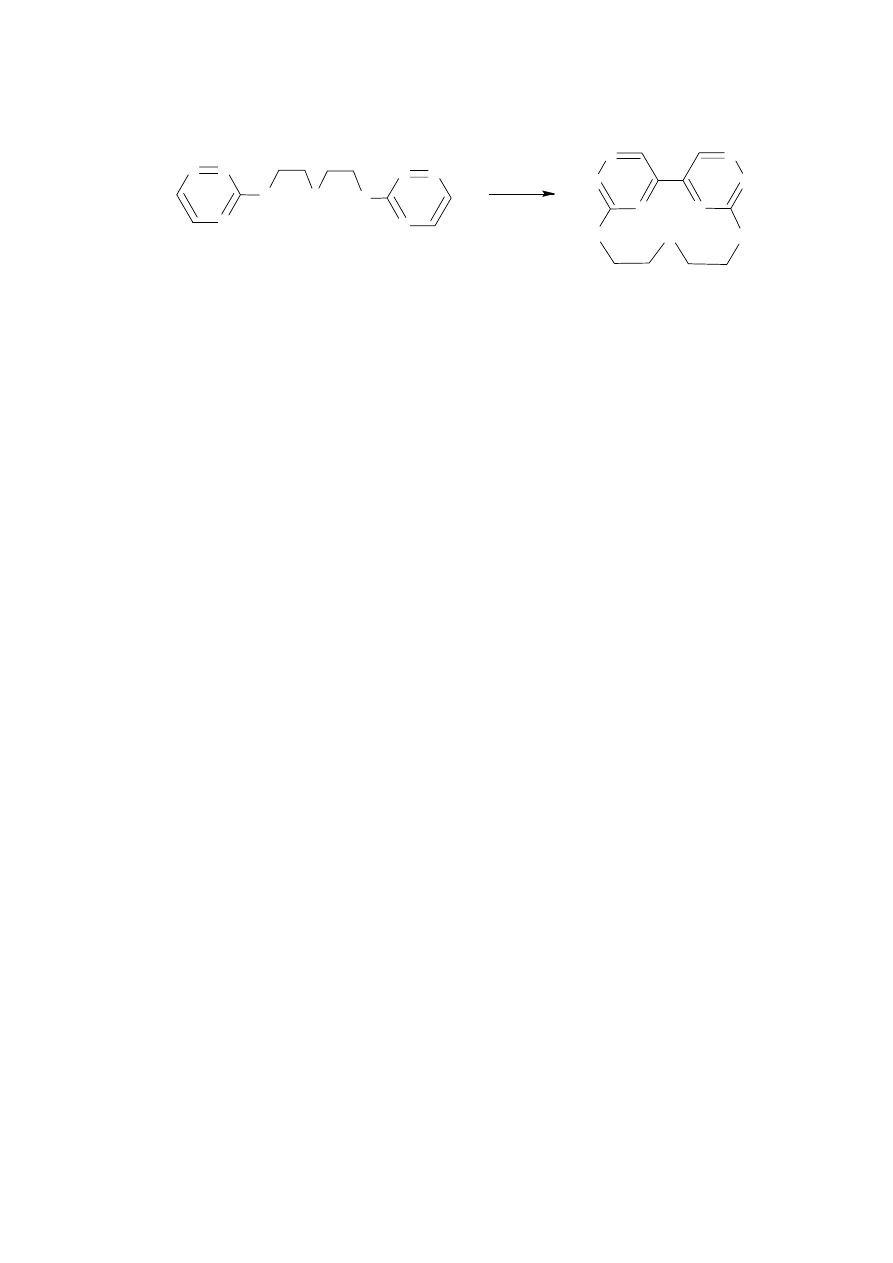
3.11. Reakcja 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7) z cyjankiem
potasu
O
S
S
N
N
N
N
N
N
KCN
H
2
O
N
N
N
S
O
S
N
N
N
7
10
Schemat 24
W celu rozpuszczenia triazynowego substratu zawiesinę związku 7 w wodzie
podgrzewałem do temperatury 40°C intensywnie mieszając. Samą reakcję dimeryzacji
prowadziłem po szybkim oziębieniu tak otrzymanego roztworu do temperatury pokojowej
i dodaniu trójkrotnego nadmiaru cyjanku potasu. Czas reakcji wyniósł 10 minut (TLC).
Otrzymany produkt ekstrahowałem do wyczerpania dichlorometanem. Po oddestylowaniu
rozpuszczalnika związek 10 oczyszczałem na kolumnie chromatograficznej stosując jako eluent
mieszaninę dichlorometanu i acetonu w stosunku 10:1. Związek 10 otrzymałem z 53%
wydajnością w postaci żółtopomarańczowego osadu.
Budowę związku 10 ustaliłem za pomocą widm
1
H NMR,
13
C NMR i MS. W widmie
1
H NMR widoczne są dwa czteroprotonowe multiplety w zakresie 3.22 – 3.39 ppm i 3.96 – 4.16
ppm pochodzące od protonów grup metylenowych łańcucha eterowego. Przy 9.55 ppm obecny
jest dwuprotonowy singlet odpowiadający protonom pierścieni triazynowych.
Widmo
13
C NMR wykazuje liczbę sygnałów równą połowie liczby atomów węgla
znajdujących się w związku 10 ze względu na symetrię układu.
Masa
cząsteczkowa związku 10 określona metodą spektroskopii masowej jest zgodna
z wartością teoretyczną i wynosi M
= 294.
31

3.12. Reakcja 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
z cyjankiem potasu
N
N
N
N
N
N
O
O
S
S
32
8
KCN
H
2
O
N
N
N
N
N
S
O
O
S
11
11a
Schemat 25
Ze
względu na słabą rozpuszczalność substratu 8 w wodzie, pierwsze próby syntezy
tioeteru 11 prowadziłem w mieszaninie woda – alkohol metylowy w stosunku 1:1. W reakcji
z cyjankiem potasu nie powstawał oczekiwany produkt dimeryzacji 11 zidentyfikowany
w późniejszych badaniach, lecz mieszanina kilku związków z niską wydajnością. W widmie IR
nieoczyszczonego produktu 11a widoczne są pasma absorpcji w zakresie 3214 – 3153 cm
-1
charakterystyczne dla grupy -NH
2
oraz pasmo przy 1641 cm
-1
odpowiadające grupie
karbonylowej występującej w amidach. Potwierdza to przypuszczenie, że związek 11a
(Schemat 25) nie jest oczekiwanym tioeterem a amidem, ponieważ z danych literaturowych
wynika [27], że reakcja dimeryzacji 3-podstawionych-1,2,4-triazyn prowadzona w innych
rozpuszczalnikach niż woda (np. w układzie dioksan – woda lub alkohol – woda) daje niekiedy
pochodne amidowe 1,2,4-triazyn (Schemat 26).
N
1). KCN
2). H
2
O / CH
3
OH
N
N
N
N
N
N
O
O
O
NH
2
O
N
H
2
S
S

N
N
N
R
1
R
2
N
N
N
R
1
NC
H
R
2
K
-
+
KCN
dioksan / H
2
O
N
N
N
R
NC
H
H
R
2
1). H
2
O
2). utl.
N
N
N
R
1
R
2
O
N
H
2
R
1
=OCH
3
, R
2
=H
R
1
=SCH
3
, R
2
=H
R
1
=SCH
3
, R
2
=CH
3
R
1
=R
2
=H
Schemat 26
Fakty te skłoniły mnie do wyeliminowania alkoholu metylowego z mieszaniny reakcyjnej
i prowadzenia procesu dimeryzacji w analogicznych warunkach jak dla związku 10 (Schemat
24). W celu rozpuszczenia triazynowego substratu zawiesinę związku 8 w wodzie podgrzewałem
do temperatury 40°C intensywnie mieszając. Samą reakcję dimeryzacji prowadziłem po szybkim
oziębieniu tak otrzymanego roztworu do temperatury pokojowej i dodaniu trójkrotnego
nadmiaru cyjanku potasu. Czas reakcji wyniósł 15 minut. Otrzymany produkt ekstrahowałem
do wyczerpania dichlorometanem. Po oddestylowaniu rozpuszczalnika związek 11 oczyszczałem
na kolumnie chromatograficznej stosując jako eluent mieszaninę dichlorometanu i acetonu
w stosunku 10:1. Związek 11 otrzymałem z 69% wydajnością w postaci żółtego osadu.
Z podanego opisu wynika, że w zachodzącej reakcji ważny jest zarówno rozpuszczalnik,
temperatura jak też czas prowadzonego procesu. Jak wykazały późniejsze badania wydłużenie
czasu reakcji do kilku godzin powoduje stopniowy zanik związku 11 i pojawienie się produktów
rozkładu.
Budowę związku 11 określiłem za pomocą widm IR,
1
H NMR,
13
C NMR i MS.
W widmie IR widoczne są pasma absorpcji charakterystyczne dla wiązań eterowych C-O-C przy
1120 – 1037 cm
-1
, oraz pasmo absorpcji o długości 1513 cm
-1
odpowiadające układowi
aromatycznemu. Widoczne pasma absorpcji w zakresie 2922 – 2854 cm
-1
przypisałem obecności
grup metylenowych pochodzących od łańcucha eterowego.
Symetryczną strukturę związku 11 potwierdza jego widmo
1
H NMR, w którym
występują dwa czteroprotonowe multiplety w zakresie 3.43 – 3.51 ppm i 3.81 – 3.89 ppm oraz
33
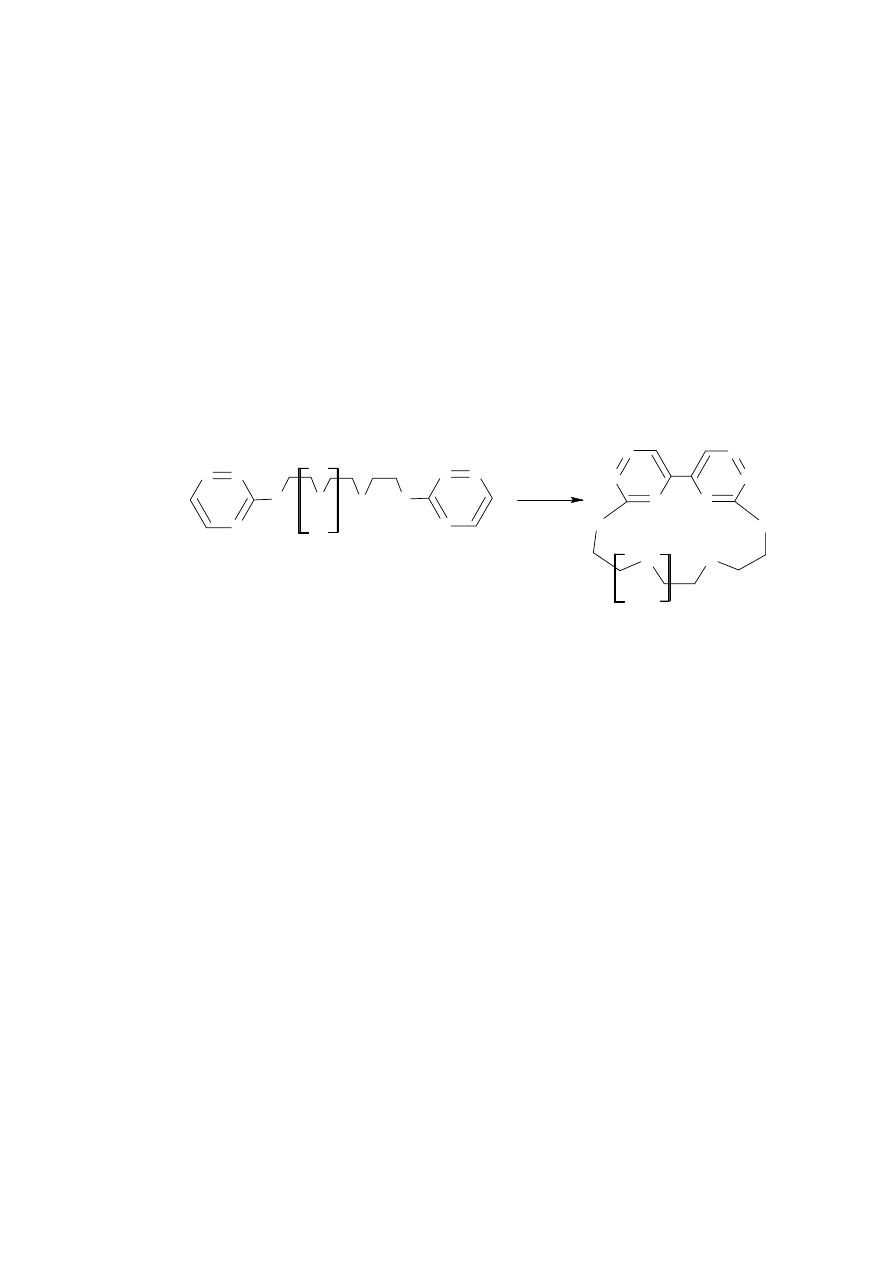
czteroprotonowy singlet przy 3.69 ppm odpowiadający protonom grup metylenowych łańcucha
eterowego. Widoczny jest dwuprotonowy singlet dla protonów pierścieni triazynowych przy
9.48 ppm.
Widmo
13
C NMR wykazuje połowę sygnałów odpowiadających liczbie atomów węgla
w związku 11.
W widmie MS występuje pik masowy M
+
(m/z) = 338, który jest zgodny z obliczoną
masą cząsteczkową dla makrocyklu 11.
3.13. Reakcja 1,11-bis(1,2,4-triazynylo-3-sylfanylo)-3,6,9-trioksaundekanu (9)
z cyjankiem potasu
KCN
H
2
O
n = 2
n = 2
N
N
N
N
N
N
S
O
O
S
N
N
N
N
N
N
O
O
S
S
9
12
Schemat 27
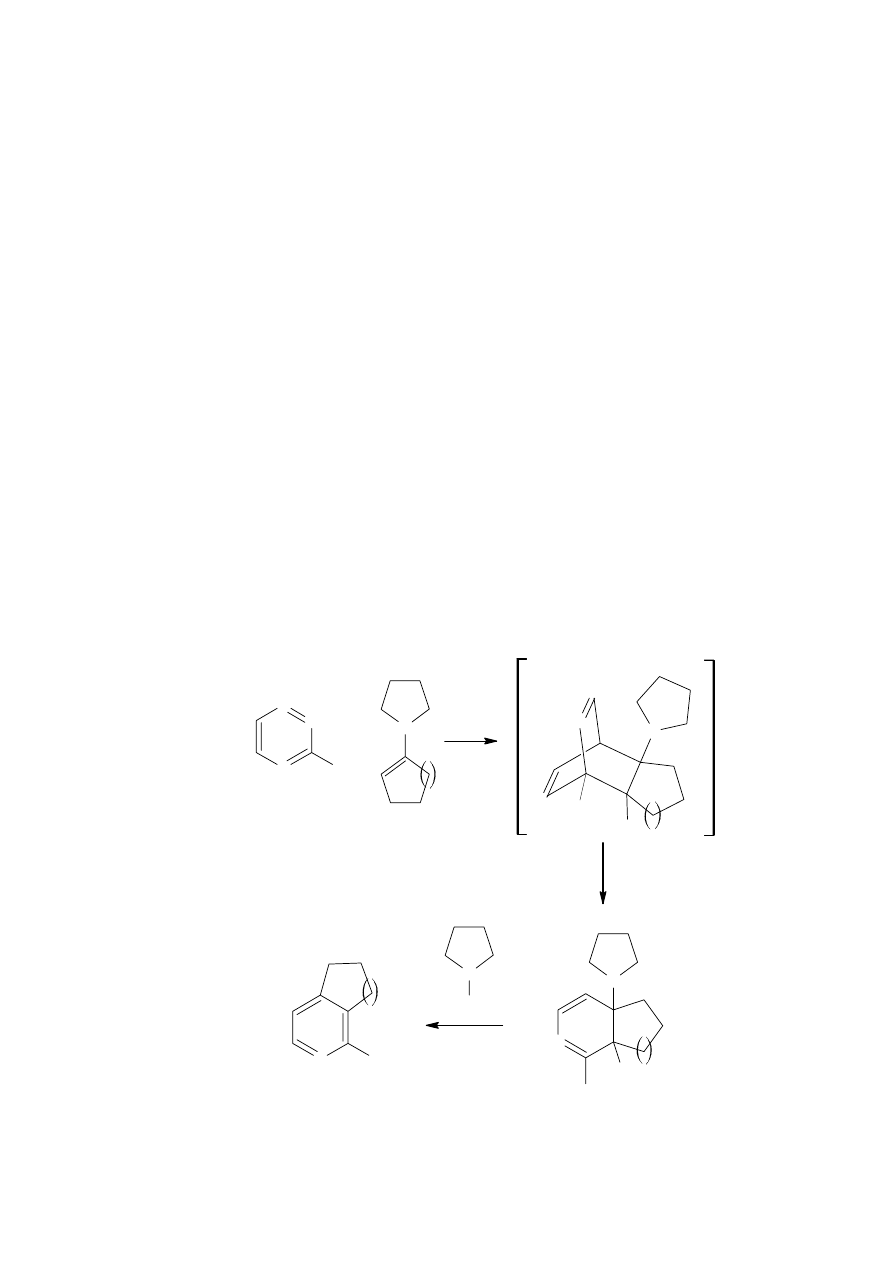
Podobnie jak w syntezie związków 10 i 11 również w reakcji otrzymywania związku 12
zastosowałem jako rozpuszczalnik wyłącznie wodę ogrzaną do temperatury 40°C w celu
rozpuszczenia substratu. Reakcję dimeryzacji związku 9 prowadziłem w sposób analogiczny
do reakcji związku 8 stosując trzykrotny nadmiar cyjanku potasu w temperaturze pokojowej.
Czas reakcji, który wyniósł 12 minut określiłem za pomocą TLC. Otrzymany produkt
ekstrahowałem dichlorometanem. Po oddestylowaniu rozpuszczalnika związek 12 oczyszczałem
na kolumnie chromatograficznej stosując jako eluent mieszaninę dichlorometanu i acetonu
w stosunku 7:1. Otrzymałem żółty osad związku 12, który powstawał z 70% wydajnością.
Podobnie jak w syntezie makrocyklu 11 wydłużenie czasu reakcji powoduje zmniejszenie
wydajności produktu 12.
Budowę związku 12 ustaliłem za pomocą widm IR,
1
H NMR,
13
C NMR i MS. W widmie
IR widoczne są pasma absorpcji w zakresie 1182 – 1038 cm
-1
odpowiadające absorpcji wiązań
eterowych. Widoczne jest również pasmo absorpcji charakterystyczne dla układu aromatycznego
34
przy 1512 cm
-1
oraz pasma w zakresie 2947 – 2877 cm
-1
charakterystyczne dla grup
metylenowych.
W
widmie
1
H NMR widoczne są dwa czteroprotonowe triplety przy 3.55 i 3.82 ppm oraz
dwa czteroprotonowe multiplety w zakresie 3.24 – 3.28 ppm i 3.43 – 3.47 ppm pochodzące
od protonów grup metylenowych łańcucha eterowego. Przy 9.68 ppm obecny jest dwuprotonowy
singlet odpowiadający protonom pierścieni triazynowych.
Widmo
13
C NMR wykazuje liczbę sygnałów równą połowie liczby atomów węgla
znajdujących się w związku 12 ze względu na symetrię układu.
Masa
cząsteczkowa związku 12 określona metodą spektroskopii masowej jest zgodna
z wartością teoretyczną i wynosi M
= 382.
3.14. Reakcja Dielsa-Aldera tioeteru (11) z N-pirolidynocyklopentenem
Jak wiadomo pierścień 1,2,4-triazyny pełni rolę elektrodeficytowego dienu i w reakcji
Dielsa-Aldera z odwróconymi wymaganiami elektronowymi łatwo reaguje z bogatymi
w elektrony dienofilami na przykład z enaminami [32,33], (Schemat 28).
N
N
N
R
+
N
N
N
N
R
N
H
-N
2
N
R
N
H
H
N
-
N
R
n=1-3
n=1-3
n=1-3
n=1-3
B
A
Schemat 28
35
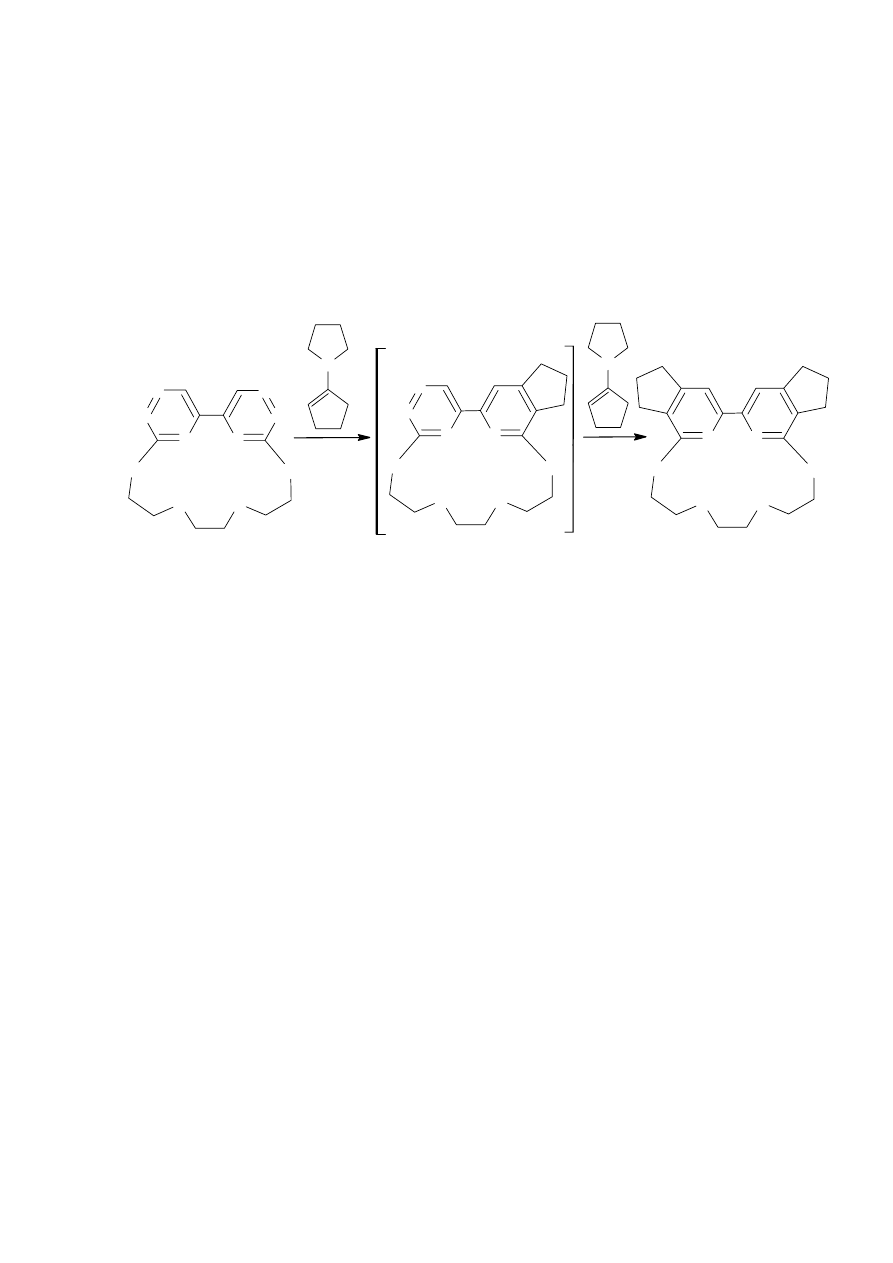
Tworzący się w pierwszym etapie reakcji cykloaddukt A jest nietrwały i rozpada się samorzutnie
z wydzieleniem cząsteczki azotu. Powstała w ten sposób dihydropochodna skondensowanej
pirydyny B ulega następnie aromatyzacji przez eliminację cząsteczki pirolidyny.
Wykorzystując wyżej opisaną właściwość pierścienia 1,2,4-triazyny, związek
makrocykliczny 11 postanowiłem poddać międzycząsteczkowej reakcji cykloaddycji [4+2]
z N-pirolidynocyklopentenem (Schemat 29). Reakcja Dielsa-Aldera 5,5’-bi-1,2,4-triazyny
wbudowanej w makrocykliczny pierścień nie była dotychczas badana.
N
150 °C
N
N
O
O
S
S
N
N
N
N
N
N
O
O
S
S
N
N
N
N
O
O
S
S
150 °C
N
11
13a
13
Schemat 29
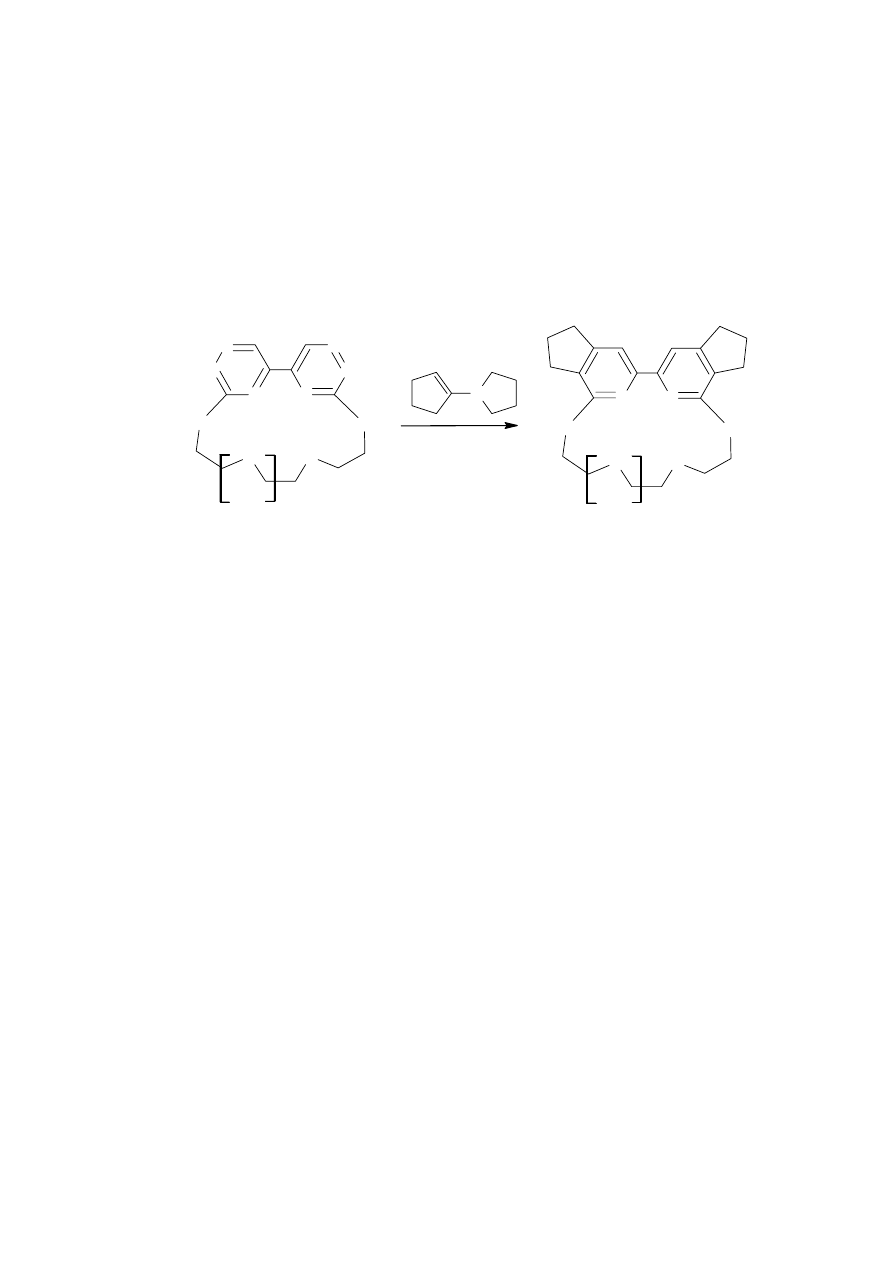
Syntezę prowadziłem w temperaturze 150°C bez udziału rozpuszczalnika. Kontrola
chromatograficzna wykazała, że reakcja tworzenia makrocyklu 13 przebiega w dwóch etapach.
Najpierw powstaje monoaddukt 13a, widoczny na płytce TLC, który reaguje z drugą cząsteczką
enaminy i przekształca się do związku 13. Po upływie 18 godzin proces powstawania związku
13 był zakończony. Powstały związek oczyszczałem na kolumnie chromatograficznej eluując
produkt mieszaniną dichlorometan – aceton w stosunku 50:1. Związek 13 powstawał z 68%
wydajnością.
Budowę związku 13 potwierdziłem za pomocą widm IR,
1
H NMR i MS. W widmie IR
widoczne są pasma absorpcji charakterystyczne dla wiązań eterowych C-O-C przy
1175 – 1039 cm
-1
, oraz pasmo absorpcji o długości 1552 cm
-1
odpowiadające układowi
aromatycznemu. Widoczne pasma absorpcji w zakresie 2925 – 2860 cm
-1
przypisałem obecności
grup metylenowych pochodzących od łańcucha eterowego.
W
widmie
1
H NMR występuje czteroprotonowy kwintet przy 2.14 ppm oraz dwa
czteroprotonowe triplety przy 2.83 i 2.95 ppm pochodzące od protonów grup metylenowych
pierścienia cyklopentanu. W widmie widoczne też są dwa multiplety: ośmioprotonowy
w zakresie 3.59 – 3.68 ppm i czteroprotonowy między 3.81 – 3.89 ppm, odpowiadający
36
protonom grup metylenowych łańcucha eterowego. Przy 7.36 ppm obecny jest dwuprotonowy
singlet odpowiadający protonom pierścieni pirydynowych.
W widmie MS pojawia się pasmo M
+
(m/z) = 414, które jest zgodne z obliczoną masą
cząsteczkową dla związku 13.
3.15. Reakcja Dielsa-Aldera tioeteru (12) z N-pirolidynocyklopentenem
N
150 °C
n = 2
n = 2
N
N
N
N
N
N
O
O
S
S
N
N
O
O
S
S
12
14
Schemat 30
Tioeter 14 zawierający trzy atomy tlenu i fragment skondensowanej 2,2’-bipirydyny
otrzymałem na drodze reakcji Dielsa-Aldera związku 12 z odwróconymi wymaganiami
elektronowymi stosując jako dienofil N-pirolidynocyklopenten. Reakcję prowadziłem
w identycznych warunkach jak dla makrocyklu 13 (patrz paragraf 3.14.), wydłużając tylko czas
reakcji do 22 godzin. Związek 14 powstał z 58% wydajnością.
Budowę związku 14 ustaliłem za pomocą widm IR,
1
H NMR i MS. W widmie IR
widoczne są pasma absorpcji w zakresie 1115 – 1041 cm
-1
odpowiadające absorpcji wiązań
eterowych. Widoczne jest również pasmo absorpcji charakterystyczne dla układu aromatycznego
przy 1548 cm
-1
oraz pasma w zakresie 2956 – 2875 cm
-1
charakterystyczne dla grup
metylenowych.
W
widmie
1
H NMR występuje czteroprotonowy kwintet przy 2.14 ppm oraz dwa
czteroprotonowe triplety przy 2.85 i 2.95 ppm pochodzące od protonów grup metylenowych
pierścienia cyklopentanu. W widmie widoczne też są multiplety: jeden ośmioprotonowy
w zakresie 3.53 – 3.66 ppm i dwa czteroprotonowe między 3.40 – 3.45 ppm oraz 3.79 – 3.86
ppm odpowiadający protonom grup metylenowych łańcucha eterowego. Przy 7.47 ppm obecny
jest dwuprotonowy singlet odpowiadający protonom pierścieni pirydynowych.
W widmie MS występuje pik masowy M
+
(m/z) = 458, który jest zgodny z obliczoną
masą cząsteczkową dla tioeteru 14.
37

38
4.
CZĘŚĆ DOŚWIADCZALNA
4.1. Uwagi ogólne
Widma IR wykonano na spektrometrze Magna FTIR – 760 firmy Nicolet.
Widma MS wykonano w Zespole Spektrometrii Masowej ICHO PAN w Warszawie
na spektrometrze mas AMD 604 Inectra GmbH.
Widma
1
H NMR wykonano na aparatach: Varian Gemini 200 (200 MHz), Varian Nova
500, Brucer DRX 500 Avance (500 MHz), stosując jako wzorzec wewnętrzny tetrametylosilan.
Wartości przesunięć chemicznych podano w skali
δ w [ppm]. Stałą sprzężenia J podano w [Hz].
Do opisu widm stosowano następujące oznaczenia:
s – singlet
d – dublet
t – triplet
kwi – kwintet
m – multiplet
Do chromatografii kolumnowej stosowano żel krzemionkowy o średnicy ziaren
0.04 – 0.0063 mm firmy Merck. Chromatogramy cienkowarstwowe (TLC) wykonano
na płytkach firmy Merck (Kiesegel 60 F
254
); płytki oświetlano lampą UV (254 nm). Temperatury
topnienia nie były korygowane.
Do syntez chemicznych używano następujących odczynników:
glikol trietylenowy cz.d.a. (Aldrich);
glikol tetraetylenowy cz.d.a. (Aldrich);
glikol pentaetylenowy cz.d.a. (Aldrich);
cyjanek potasu (POCH);
dichlorometan cz.d.a. (Alchem);
alkohol etylowy cz.d.a. (Linegal Chemicals);
alkohol metylowy cz.d.a. (Chempur);
aceton cz.d.a. (Chempur);
pirydyna (POCH);
wodorowęglan sodu (Chempur);
bromek tionylu (Aldrich);
brom (POCH);
bromek fosforu (III) (Aldrich);

39
N-pirolidynocyklopenten (POCH);
acetonitryl cz.d.a. (Fluka);
trifenylofosfina (Fluka);
glioksal 40% (Aldrich);
tiosemikarbazyd (Aldrich);
heksan (Alchem);
benzen (Alchem);
kwas solny (Alchem);
Chlorek metylenu był suszony chlorkiem wapnia i destylowany z nad pięciotlenku
fosforu bezpośrednio przed użyciem. Glikole tri-, tetra-, i pentaetylenowe były suszone stałym
siarczanem (VI) wapnia a następnie destylowane pod próżnią według procedury podanej
w literaturze [34]. Pirydyna była suszona stałym wodorotlenkiem potasu i destylowana
bezpośrednio przed użyciem z nad wodorku wapnia. Rozpuszczalniki do chromatografii były
destylowane.

4.2. Synteza 1,5-dibromo-3-oksapentanu (1)
Br
O
Br
Do 3.84 g (16 mmola) glikolu pentaetylenowego dodano 2.98 g (36.8
mmola) pirydyny. Mieszaniną doprowadzono do wrzenia pod chłodnicą
zwrotną zaopatrzoną w rurkę z chlorkiem wapnia. Do wrzącego roztworu
wkroplono w ciągu 3 godzin 7.65 g (36.8 mmola) bromku tionylu. Mieszaninę reakcyjną
ogrzewano przez 16 godzin a następnie ochłodzono do temperatury pokojowej i dodano do niej
2 ml 2% roztworu kwasu solnego i 8 ml wody. Mieszaninę ekstrahowano benzenem (5x10 ml).
Po oddestylowaniu rozpuszczalnika na wyparce próżniowej otrzymano brązowy olej, z którego
wyodrębniono związek 1 w temperaturze 56 – 60°C przy 2 mmHg (literatura [31], 92 - 93°C / 12
mmHg). Otrzymano 2.25 g (40%) 1,5-dibromo-3-oksapentanu 1 w postaci jasnożółtego oleju.
Podwyższając temperaturę procesu uzyskano dwie dodatkowe frakcje oleju wrzące w 70 i 85°C
przy 2 mmHg z niewielką wydajnością.
1
4.3. Synteza 1,8-dibromo-3,6-dioksaoktanu (2)
Br
O
O
Br
W kolbie trójszyjnej umieszczono 10 g (0.0665 mola) glikolu
trietylenowego i 2 g (0.25 mola) świeżo destylowanej pirydyny.
Mieszaninę ochłodzono do 0°C i w tej temperaturze wkroplono 14 g
(0.5 mola) bromku fosforu (III) w ciągu jednej godziny. Otrzymaną zawiesinę ogrzewano przez
4 godziny w temperaturze 60°C pod chłodnicą zwrotną zaopatrzoną w rurkę z chlorkiem wapnia.
Po tym czasie mieszaninę reakcyjną wylano na około 30 ml wody z drobno pokruszonym lodem.
Warstwę organiczną oddzielono i przemyto wodą (5x10 ml) a następnie wysuszono świeżo
aktywowanym siarczanem (VI) magnezu. Po odsączeniu siarczanu magnezu produkt
oczyszczono przez destylację próżniową zbierając frakcję wrzącą w temperaturze
98 – 101°C przy 0.9 mmHg, (literatura [28], 98 - 100°C / 0.9 mmHg). Otrzymano 9.61 g (52%)
1,8-dibromo-3,6-dioksaoktanu 2 w postaci bezbarwnego oleju.
2
4.4. Synteza 1,11-dibromo-3,6,9-trioksaundekanu (3)
Do 50 ml suchego acetonitrylu dodano 11.8 g (0,045 mola)
trifenylofosfiny. Mieszaninę reakcyjną ochłodzono do 0°C
w atmosferze argonu, a następnie wkroplono w tej temperaturze
Br
O
O
O
Br
3
40

w ciągu 45 minut 7.2 g (0.045 mola, 2.3 ml) bromu i 4.37 g (0.0225 mola) glikolu
tetraetylenowego. Mieszaninę reakcyjną doprowadzono do temperatury pokojowej i mieszano
na mieszadle magnetycznym przez 72 godziny. Powstały biały osad soli fosfiny odsączono
a otrzymany roztwór oddestylowano. Otrzymano pomarańczową pastę, którą ekstrahowano
heksanem. Rozpuszczalnik oddestylowano na wyparce rotacyjnej. Otrzymano 5.45 g (76%)
1,11-dibromo-3,6,9-trioksaundekanu 3 w postaci bezbarwnego oleju.
Analiza spektroskopowa związku 3
1
H NMR (CDCl
3
)
δ: 3.44 (t, J=6.4, 4H, Br-CH
2
-), 3.61 – 3.65 (m, 8H, -O-CH
2
-CH
2
-O-), 3.78
(t, J=6.4, 4H, Br-CH
2
-CH
2
-).
13
C NMR (CDCl
3
)
δ: 30.23 ( Br-CH
2
-), 70.35 (Br-CH
2
-CH
2
-), 70.40 (-O-CH
2
-CH
2
-O-), 71.02
(-O-CH
2
-CH
2
-O-).
4.5. Reakcja 1,5-dibromo-3-oksapentanu (1) z tiosemikarbazydem
Do zawiesiny 1.12 g (12.3 mmola) tiosemikarbazydu
w 17 ml bezwodnego alkoholu etylowego dodano
2.24 g (6.15 mmola) 1,5-dibromo-3-oksapentanu 1. Reakcję
prowadzono w temperaturze wrzenia etanolu pod chłodnicą
zwrotną zaopatrzoną w rurkę z chlorkiem wapnia. Na podstawie TLC stwierdzono całkowite
przereagowanie substratów po upływie 35 godzin. Rozpuszczalnik oddestylowano na wyparce
próżniowej. Otrzymano, po wysuszeniu w eksykatorze próżniowym, 3 g (88%) związku 4
w postaci gęstego, brązowego oleju.
.
.
Br
H
Br
H
S
O
S
C
N
H
2
N
NH
2
C
N
NH
2
NH
2
4
Analiza spektroskopowa związku 4
IR (KBr) cm
-1
:
1106 – 1033 (-C-O-C-)
2960 – 2890 (CH
2
)
3290 – 3163 (NH
2
)
41
4.6. Reakcja 1,8-dibromo-3,6-dioksaoktanu (2) z tiosemikarbazydem
Do zawiesiny 0.65 g (7.2 mmola) tiosemikarbazydu
w 10 ml bezwodnego alkoholu etylowego dodano
1 g (3.6 mmola) 1,8-dibromo-3,6-diokasaoktanu 2.
Reakcję prowadzono w temperaturze wrzenia etanolu
pod chłodnicą zwrotną zaopatrzoną w rurkę z chlorkiem wapnia. Na podstawie chromatografii
cienkowarstwowej (TLC) stwierdzono całkowite przereagowanie substratów po upływie
16 godzin. Mieszaninę reakcyjną ochłodzono a wytrącony jasnoróżowy osad odsączono
i przemyto zimnym alkoholem etylowym. Otrzymano, po wysuszeniu w eksykatorze
próżniowym, 1.49 g (90%) związku 5.
S
O
O
C
N
H
2
N
NH
2
S
C
N
NH
2
NH
2
.
.
Br
H
Br
H
5
Analiza spektroskopowa związku 5
IR (KBr) cm
-1
:
1166 – 1021 (-C-O-C-)
2965 – 2928 (CH
2
)
3347 – 3248 (NH
2
)
4.7. Reakcja 1,11-dibromo-3,6,9-trioksaundekanu (3) z tiosemikarbazydem
Do 0.39 g (4.38 mmola) tiosemikarbazydu dodano
6 ml bezwodnego alkoholu etylowego oraz 0.7 g
(2.19 mmola) 1,11-dibromo-3,6,9-trioksaundekanu 3.
Mieszaninę reakcyjną ogrzewano w temperaturze
wrzenia etanolu pod chłodnicą zwrotną zaopatrzoną w rurkę z chlorkiem wapnia. Na podstawie
chromatografii cienkowarstwowej (TLC) stwierdzono całkowite przereagowanie substratów
po upływie 25 godzin. Rozpuszczalnik odparowano na wyparce obrotowej. Otrzymano,
po wysuszeniu w eksykatorze próżniowym, 0.98 g (89%) związku 6 w postaci gęstego,
brązowego oleju.
S
O
O
C
N
H
2
N
NH
2
S
C
N
NH
2
NH
2
.
.
Br
H
Br
H
n = 2
6
42
Analiza spektroskopowa związku 6
IR (KBr) cm
-1
:
1170 – 1035 (-C-O-C-)
2960 – 2920 (CH
2
)
3347 – 3246 (NH
2
)
4.8. Synteza 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
Roztwór 2.3 g (15.9 mmola) 40% glioksalu
i 1.47 g (17.5 mmola) wodorowęglanu sodowego
w 30 ml lodowatej wody dodano
do przygotowanego wcześniej roztworu 3.3 g
(7.9 mmola) związku 4 w 21 ml lodowatej wody. Całość energicznie mieszano na mieszadle
magnetycznym. Po kilku minutach roztwór zabarwił się na żółto i zaczęły wydzielać się
pęcherzyki gazu. Następnie do roztworu dodano 50 ml alkoholu metylowego. Po 20 minutach
mieszania zaobserwowano pojawienie się produktu 7 (TLC). Mieszaninę reakcyjną
pozostawiono na noc. Następnie oddestylowano na wyparce rotacyjnej metanol a wodną
pozostałość ekstrahowano chlorkiem metylenu (5x30 ml). Warstwę organiczną suszono
siarczanem (VI) magnezu. Po oddestylowaniu dichlorometanu na wyparce próżniowej
otrzymano brązową, oleistą pozostałość. Związek 7 oczyszczono na kolumnie
chromatograficznej stosując jako eluent układ dichlorometanu i acetonu w stosunku 10:1.
Otrzymano 0.65g (33%) zielonożółtego związku 7 o temperaturze topnienia 56 – 57°C.
S
O
S
N
N
N
N
N
N
7
Analiza spektroskopowa związku 7
1
H NMR (CDCl
3
)
δ: 3.47 (t, J=6.5, 4H, -S-CH
2
-), 3.83 (t, J=6.5, 4H, -S-CH
2
-CH
2
-O-),
8.36 (d, J=2.4, 2H, Ar), 8.92 (d, J=2.4, 2H, Ar).
MS EI:
M
+
(m/z)
= 296
43

4.9. Synteza 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
Roztwór 0.319 g (2.2 mmola) 40% glioksalu
i 0.2016 (2.4 mmola) wodorowęglanu sodowego
w 5.5 ml lodowatej wody dodano do przygotowanego
wcześniej roztworu 0.5 g (1.09 mmola) związku 5 w 3.5 ml lodowatej wody. Całość energicznie
mieszano na mieszadle magnetycznym. Po kilku minutach roztwór zabarwił się na żółto
i zaczęły wydzielać się
pęcherzyki gazu. Następnie do roztworu dodano
9 ml alkoholu metylowego. Po 15 minutach mieszania zaobserwowano pojawienie się produktu
8 (TLC). Mieszaninę reakcyjną pozostawiono na noc. Następnie oddestylowano na wyparce
rotacyjnej metanol a wodną pozostałość ekstrahowano chlorkiem metylenu (5x10 ml). Warstwę
organiczną suszono siarczanem (VI) magnezu. Po oddestylowaniu dichlorometanu na wyparce
próżniowej otrzymano brązową, oleistą pozostałość. Związek 8 oczyszczono na kolumnie
chromatograficznej stosując jako eluent układ dichlorometanu i acetonu w stosunku 10:1.
Otrzymano 0.2296 g (63%) zielonożółtego związku 8 o temperaturze topnienia 72 – 73°C.
8
N
N
N
N
N
N
S
O
O
S
44
naliza spektroskopowa związku 8
3
)
δ: 3.48 (t, J=6.5, 4H, -S-CH
2
-), 3.68 (s, 4H, -O-CH
2
-CH
2
-O), 3.82 (t, J=6.5,
A
1
H NMR (CDCl
4H,
-S-CH
2
-CH
2
-O-), 8.36 (d, J=2.4, 2H, Ar), 8.92 (d, J=2.2, 2H, Ar).
13
C NMR (CDCl
3
)
δ: 30.08 (-S-CH
2
-), 69.25 (-S-CH
2
-CH
2
-O), 70.29 (-O-CH
2
-CH
2
-O-), 145.35
S EI:
= 340
(KBr) cm
-1
:
-O-C-)
atyczny
(Ar), 148.11 (Ar), 173.82 (Ar).
M
M
+
(m/z)
IR
1154 – 1032 (-C
1535 – 1509 układ arom
2908 – 2873 (CH
2
)

4.10. Synteza 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)
n = 2
N
N
N
N
N
N
S
O
O
S
Roztwór 0.5162 g (3.56 mmola) 40% glioksalu
i 0.3276 (3.92 mmola) wodorowęglanu sodowego
w 8.8 ml lodowatej wody dodano do
przygotowanego wcześniej roztworu 0.8955 g (1.78
mmola) związku 6 w 5.7 ml lodowatej wody. Całość energicznie mieszano na mieszadle
magnetycznym. Po kilku minutach roztwór zabarwił się na żółto i zaczęły wydzielać się
pęcherzyki gazu. Następnie do roztworu dodano 14 ml alkoholu metylowego. Po 20 minutach
mieszania zaobserwowano pojawienie się produktu 9 (TLC). Mieszaninę reakcyjną
pozostawiono na noc. Następnie oddestylowano na wyparce rotacyjnej alkohol metylowy
a wodną pozostałość ekstrahowano chlorkiem metylenu (5x15 ml). Warstwę organiczną suszono
siarczanem (VI) magnezu. Po oddestylowaniu dichlorometanu na wyparce próżniowej
otrzymano brązową, oleistą pozostałość. Związek 9 oczyszczono na kolumnie
chromatograficznej stosując jako eluent układ złozony z dichlorometanu i acetonu w stosunku
5:1. Otrzymano 0.333 g (55%) zielonożółtego związku 9 o temperaturze topnienia 48 – 49°C.
9
Analiza spektroskopowa związku 9
1
H NMR (CDCl
3
)
δ: 3.48 (t, J=6.5, 4H, -S-CH
2
-), 3.63 – 3.74 (m, 8H, -O-CH
2
-CH
2
-O), 3.82
(t, J=6.5, 4H, -S-CH
2
-CH
2
-O-), 8.36 (d, J=2.4, 2H, Ar), 8.92 (d, J=2.4,
2H,
Ar).
13
C NMR (CDCl
3
)
δ: 30.08 (-S-CH
2
-), 69.19 (-S-CH
2
-CH
2
-O), 70.35 (-O-CH
2
-CH
2
-O-), 70.48
(-O-CH
2
-CH
2
-O-), 145.33 (Ar), 148.09 (Ar), 173.85 (Ar).
MS EI:
M
+
(m/z)
= 384
IR (KBr) cm
-1
:
1198 – 1034 (-C-O-C-)
1541 – 1525 układ aromatyczny
2938 – 2874 (CH
2
)
45
4.11. Reakcja 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
z cyjankiem potasu
O
S
S
N
N
N
N
N
N
0.1 g (0.33 mmola) 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-
oksapentanu 7 rozpuszczono w 40 ml wody ogrzanej
do temperatury 40°C. Po oziębieniu tak przygotowanego roztworu
do temperatury pokojowej dodano 0.065 g (1.0 mmola) cyjanku
potasu. Substraty mieszano na mieszadle magnetycznym. Roztwór
zabarwił się na kolor pomarańczowy. Kontrola TLC potwierdziła zanik substratów po 10
minutach. Mieszaninę ekstrahowano natychmiast chlorkiem metylenu. Warstwę organiczną
suszono siarczanem (VI) magnezu. Rozpuszczalnik oddestylowano na wyparce obrotowej.
Pozostałość naniesiono na kolumnę chromatograficzną eluując związek 10 mieszaniną
dichlorometanu i acetonu w stosunku 10:1. Otrzymano 0.052 g związku 10 barwy
żółtopomarańczowej z wydajnością 53% o temperaturze topnienia 210°C z rozkładem.
10
Analiza spektroskopowa związku 10
1
H NMR (CDCl
3
)
δ: 3.22 – 3.39 (m, 4H, -S-CH
2
-), 3.96 – 4.16 (m, 4H, -S-CH
2
-CH
2
-O-),
9.55 (s, 2H, Ar).
13
C NMR (DMSO)
δ: 28.93 (-S-CH
2
-), 64.38 (-S-CH
2
-CH
2
-O), 143.52 (Ar), 150.04 (Ar),
173.55
(Ar).
MS EI:
M
+
(m/z)
= 294
4.12. Reakcja 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
z cyjankiem potasu
11
N
N
N
N
N
N
O
O
S
S
0.15 g (0.44 mmola) 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-
dioksaoktan 8 rozpuszczono w 100 ml wody ogrzanej do temperatury
40°C. Po oziębieniu tak przygotowanego roztworu do temperatury
pokojowej dodano 0.086 g (1.32 mmola) cyjanku potasu. Substraty
mieszano na mieszadle magnetycznym. Roztwór zabarwił się na
46

kolor ciemnozielony. Kontrola TLC potwierdziła zanik substratów po 15 minutach. Po tym
czasie mieszaninę ekstrahowano natychmiast chlorkiem metylenu. Warstwę organiczną suszono
siarczanem (VI) magnezu. Rozpuszczalnik oddestylowano na wyparce rotacyjnej. Pozostałość
naniesiono na kolumnę chromatograficzną eluując związek 11 mieszaniną dichlorometanu
i acetonu w stosunku 10:1. Otrzymano 0.104 g związku 11 barwy żółtej z wydajnością 69%
o temperaturze topnienia 228°C.
Analiza spektroskopowa związku 11
1
H NMR (CDCl
3
)
δ: 3.43 – 3.51 (m, 4H, -S-CH
2
-), 3.69 (s, 4H, -O-CH
2
-CH
2
-O), 3.81 – 3.89
(m,
4H,
-S-CH
2
-CH
2
-O-), 9.48 (s, 2H, Ar).
13
C NMR (CDCl
3
)
δ: 29.21 (-S-CH
2
-), 69.24 (-S-CH
2
-CH
2
-O), 70.32 (-O-CH
2
-CH
2
-O-), 141.90
(Ar),
150.15
(Ar).
IR (KBr) cm
-1
:
1120 – 1037 (-C-O-C-)
1513 układ aromatyczny
2922 – 2854 (CH
2
)
MS EI:
M
+
(m/z)
= 338
4.13. Reakcja 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)
z cyjankiem potasu
0.2 g (0.52 mmola) 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-
trioksaundekan 9 rozpuszczono w 80 ml wody ogrzanej
do temperatury 40°C. Po oziębieniu tak przygotowanego roztworu
do temperatury pokojowej dodano 0.1 g (1.56 mmola) cyjanku
potasu. Substraty mieszano na mieszadle magnetycznym. Roztwór
zabarwił się na kolor ciemnozielony. Kontrola TLC potwierdziła
zanik substratów po 12 minutach. Mieszaninę ekstrahowano natychmiast chlorkiem metylenu.
Warstwę organiczną suszono siarczanem (VI) magnezu. Rozpuszczalnik oddestylowano
n = 2
N
N
N
N
N
N
O
O
S
S
12
47

na wyparce obrotowej. Pozostałość naniesiono na kolumnę chromatograficzną eluując związek
12 mieszaniną dichlorometanu i acetonu w stosunku 7:1. Otrzymano 0.142 g związku 12 barwy
żółtej z wydajnością 70% o temperaturze topnienia 150°C.
Analiza spektroskopowa związku 12
1
H NMR (500 MHz, CDCl
3
)
δ: 3.24 – 3.28 (m, 4H, -S-CH
2
-), 3.43 – 3.47 (m, 4H, -S-CH
2
-
-CH
2
-O), 3.55 (t, J=5.8, 4H, -O-CH
2
-CH
2
-O-), 3.82 (t, J=5.8,
4H,
-O-CH
2
-CH
2
-O-), 9.68 (s, 2H, Ar).
13
C NMR (CDCl
3
)
δ: 30.21 (-S-CH
2
-), 69.99 (-S-CH
2
-CH
2
-O), 71.00 (-O-CH
2
-CH
2
-O-), 71.05
(-O-CH
2
-CH
2
-O-), 142.11 (Ar), 150.00 (Ar), 174.66 (Ar).
IR (KBr) cm
-1
:
1182 – 1038 (-C-O-C-)
1512 układ aromatyczny
2947 – 2877 (CH
2
)
MS EI:
M
+
(m/z)
= 382
4.14. Reakcja Dielsa-Aldera tioeteru (11) z N-pirolidynocyklopentenem
Do 0.06 g (0.18 mmola) związku makrocyklicznego 11 dodano
0.15 g (1.1 mmola) N-pirolidynocyklopentenu. Mieszaninę
ogrzewano pod chłodnicą zwrotną w temperaturze 150°C.
Przebieg reakcji kontrolowano za pomocą TLC. Po 18 godzinach
ogrzewania mieszaninę reakcyjną oziębiono a rozpuszczalnik
odparowano na wyparce próżniowej. Pozostałość naniesiono
na kolumnę chromatograficzną eluując związek 13 mieszaniną chlorku metylenu i acetonu
w stosunku 50:1. Otrzymano 0.0496 g związku 13 barwy jasnokremowej z 68% wydajnością,
który wykazywał temperaturę topnienia 148 – 149°C.
13
N
N
O
O
S
S
48
Analiza spektroskopowa związku 13
1
H NMR (CDCl
3
)
δ: 2.14 (kwi, J=7.4, 4H, -CH
2
-CH
2
-CH
2
-), 2.83 (t, J=7.6, 4H,
-CH
2
-CH
2
-CH
2
-), 2.95 (t, J=7.6, 4H, -CH
2
-CH
2
-CH
2
-), 3.59 – 3.68 (m, 8H,
-S-CH
2
-CH
2
-O-CH
2
-), 3.81 – 3.89 (m, 4H, -S-CH
2
-CH
2
-O-),
7.36 (s, 2H, Ar).
IR (KBr) cm
-1
:
1175 – 1039 (-C-O-C-)
1552 układ aromatyczny
2925 – 2860 (CH
2
)
MS EI:
M
+
(m/z) = 414
4.15. Reakcja Dielsa-Aldera tioeteru (12) z N-pirolidynocyklopentenem
Do 0.1 g (0.26 mmola) związku makrocyklicznego 12 dodano
0.22 g (1.6 mmola) N-pirolidynocyklopentenu. Mieszaninę
ogrzewano pod chłodnicą zwrotną w temperaturze 150°C.
Przebieg reakcji kontrolowano metodą TLC. Po 22 godzinach
mieszaninę reakcyjną oziębiono a rozpuszczalnik odparowano
na wyparce rotacyjnej. Pozostałość naniesiono na kolumnę
chromatograficzną eluując związek 14 mieszaniną chlorku
metylenu i acetonu w stosunku 50:1. Otrzymano 0.068 g związku 14 barwy kremowożółtej
z 57% wydajnością o temperaturze topnienia 121 – 122°C.
14
n = 2
N
N
O
O
S
S
Analiza spektroskopowa związku 14
1
H NMR (CDCl
3
)
δ: 2.14 (kwi, J=7.5, 4H, -CH
2
-CH
2
-CH
2
-), 2.85 (t, J=7.6, 4H,
-CH
2
-CH
2
-CH
2
-), 2.95 (t, J=7.8, 4H, -CH
2
-CH
2
-CH
2
-), 3.40 – 3.45 (m, 4H,
-S-CH
2
), 3.53 – 3.66 (m, 8H, -S-CH
2
-CH
2
-O-CH
2
-), 3.79 – 3.86 (m, 4H,
-O-CH
2
-CH
2
-O-), 7.47 (s, 2H, Ar).
49

50
MS EI:
M
+
(m/z) = 458
IR (KBr) cm
-1
:
1115 – 1041 (-C-O-C-)
1548 układ aromatyczny
2956 – 2875 (CH
2
)

51
5.
PODSUMOWANIE I WNIOSKI
W pracy przedstawiono wyniki badań nad nową, oryginalną metodą syntezy eterów
azatiokoronowych 10-12 zawierających układ 5,5’-bi-1,2,4-triazyny, które następnie
przekształcono do ich analogów 13-14 zawierających układ 2,2’-bipirydyny.
Pierwsza
część syntezy dotyczyła preparatyki związków 7-9 zawierających dwa
terminalne pierścienie 1,2,4-triazyny połączone poprzez atomy siarki w położeniu C-3
pierścienia z różnej długości łańcuchami eterowymi, otrzymanymi z łatwo dostępnych glikoli
tri-, tetra- i pentaetylenowych. Związki te były finalnymi substratami w syntezie tioeterów 10-12
z wbudowanym fragmentem 5,5’-bi-1,2,4-triazyny. Wykazano, że związki 7-9 traktowane
wodnym roztworem cyjanku potasu ulegały wewnątrzcząsteczkowej reakcji dimeryzacji
inicjowanej addycją jonów cyjankowych do wiązania N
4
– C
5
w 1,2,4-triazynie. Reakcja ta nie
była dotychczas opisana w literaturze.
Otrzymane azatioetery 10-12 powstawały z dobrymi wydajnościami (53 – 70%) i mogły być
wykorzystane w syntezie ich analogów bipirydynowych 13-14.
Związki 13-14 powstawały z 68% i 57% wydajnością w reakcji Dielsa – Aldera z odwróconymi
wymaganiami elektronowymi, w której jako dienofil stosowano N-pirolidynocyklopenten.
Metoda ta ma charakter ogólny i może być wykorzystana do syntezy eterów
azatiokoronowych zawierających dłuższe łańcuchy eterowe.
Wszystkie
otrzymane
pochodne
1,2,4-triazyny i 2,2’-bipirydyny są nowe i zostały
scharakteryzowane za pomocą metod spektroskopowych.

52
6.
BIBLIOGRAFIA
______________________________
1.
F. Vöglte, Supramolecular Chemistry, John Wiley & Sons Ltd., Chichester 1991.
2.
Ch. Kaes, A. Katz, M. W. Hosseini, Chem. Rev., 100, 3553, 2000.
3.
W. Radecka – Pazyrek, Supramolekularne makrocykliczne i acykliczne kompleksy metali,
Wyd. Naukowe UAM, Poznań, 2001.
4.
D. Branowska, I. Buczek, K. Kalińska, J. Nowaczyk, A. Rykowski, Tetrahedron Letters,
46, 8539 – 8541, 2005.
5.
G. W. Gokel, S. H. Korzeniowski, Macrocyclic Polyethers Sytheses, New – York, 268 –
272, 1982.
6.
B. Bujnicki, J. Drabowicz, J. Nowaczyk, A. Rykowski, Synteza chiralnych sulfotlenków
pochodnych 2,2’-bipirydyny, Zjazd PTCh, Gdańsk 2006.
7.
C. J. Pedersen, J. Am. Chem. Soc., 89, 2495, 1967.
8.
C. J. Pedersen, J. Am. Chem. Soc., 89, 7017, 1967.
9.
J. M. Lehn, Pure Appl. Chem., 50, 871, 1979.
10. D. J. Cram, Angew. Chem., Int. Ed. Engl., 27, 1009, 1988.
11. G. W. Gokel, D. M. Dishong, R. A. Schultz, V. J. Gatto, Sythesis, 997, 1982.
12. V. J. Gatto, G. W. Gokel, J. Am. Chem. Soc., 106, 8240, 1984.
13. R. H. Grubb’s, Handbook of Metathesis, vol. 2, Weinheim Wiley – VCH, 2003.
14. G. W. Gokel, Crown Ethers and Cryptands, New – York, 1994.
15. A. H. M. Elwahy, Tetrahedron, 55, 897 – 907, 2000.
16. A. A. Abbas, Terahedron, 60, 1541 – 1548, 2004.
17. F. Le Derf, M. Salle, M. Mazari, J. Becher, M. Jubault, A. Gorgues, J. Orduna, J. Garin,
Synthetic Matals, 94, 49 – 50, 1998.
18. X. Chen, D. M. Du, W. T. Hua, Tetrahedron Asymmetry, 14, 999 – 1007, 2003.
19. G. R. Newkome, I. Kawato, W. H. Benton, J. Org. Chem., 45, 626, 1980.
20. D. E. Fenton, D. H. Cook, I. W. Nowell, J. Chem. Soc. Chem. Commun., 274, 1977.
21. Y. A. Ibrahim, H. Behbehani, M. R. Ibrahim, Tetrahedron Letters, 43, 4207 – 4210, 2002.
22. A. Rykowski, informacje prywatne.
23. G. R. Newkome, A. Nayak, F. R. Fronczek, T. Kawato, H. C. R. Taylor, W. Mattice,
J. Am. Chem. Soc., 101(16), 4472 – 4477, 1979.
24. G. R. Newkome, G. E. Kiefer, D. K. Kohli, Y. J. Xia, F. R. Fronczek, G. B. Baker,
J. Org. Chem., 54, 5105 – 5110, 1989.

53
25. G. R. Newkome, A. Nayak, G. L. McClure, F. Denesh – Khoshboo, J. Broussard –
Simpson, J. Org. Chem., 42(9), 1500 – 1508, 1977.
26. D. K. Krass, T. Chen, W. W. Paudler, J. Heterocyclic Chem., 10, 343, 1973.
27. D. K. Krass, W. W. Paudler, J. Heterocyclic Chem., 11, 43, 1974.
28. J. F. W. Keana, Y. Wu, G. Wu, J. Org. Chem., 52(12), 2574, 1987.
29. E. Biron, F. Otis, J. Ch. Meillon, M. Robitaille, J. Lamothe, P. Van Hove, M. E. Cormier,
N. Voyer, Bioorganic & Medicinal Chemistry, 12, 1286, 2004.
30. J. F. W. Keana, G. S. Heo, J. S. Mann, F. L. Van Nice, L. Lex, V. S. Prabhu, G. Ferguson,
J. Org. Chem., 53(10), 2271 – 2272, 1988.
31. a) Katalog Aldricha, 258, 1999/2000; b) A. E. Baran, Praca magisterska, Siedlce 2002.
32. A. Rykowski, D. Branowska, J. Kielak, Tetrahedron Letters, 41, 3657 – 3659, 2000.
33. D. L. Boger, S. M. Weinreb, Hetero Diels – Alder Methodology in Organic Synthesis,
Academic Press: New – York, 321 – 335, 1987.
34. D. D. Perrin, W. L. F. Armarego, Puryfication of Labolatory Chemicals, third edition,
Pergamon Press Ltd., 1988.
Document Outline
- 1. WSTĘP I CEL PRACY
- 2. CZĘŚĆ LITERATUROWA
- 2.1 Wprowadzenie
- 2.2. Wybrane metody syntezy związków makrocyklicznych
- 3. BADANIA WŁASNE
- 3.1. Wstęp
- 3.2. Synteza 1,5-dibromo-3-oksapentanu (1)
- 3.3. Synteza 1,8-dibromo-3,6-dioksaoktanu (2)
- 3.4. Synteza 1,11-dibromo-3,6,9-trioksaundekanu (3)
- 3.5. Reakcja 1,5-dibromo-3-oksapentanu (1) z tiosemikarbazydem
- 3.6. Reakcja 1,8-dibromo-3,6-dioksaoktanu (2) z tiosemikarbazydem
- 3.7. Reakcja 1,11-dibromo-3,6,9-trioksaundekanu (3) z tiosemikarbazydem
- 3.8. Synteza 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
- 3.9. Synteza 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
- 3.10. Synteza 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)
- 3.11. Reakcja 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7) z cyjankiem potasu
- 3.12. Reakcja 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8) z cyjankiem potasu
- 3.13. Reakcja 1,11-bis(1,2,4-triazynylo-3-sylfanylo)-3,6,9-trioksaundekanu (9) z cyjankiem potasu
- 3.14. Reakcja Dielsa-Aldera tioeteru (11) z N-pirolidynocyklopentenem
- 3.15. Reakcja Dielsa-Aldera tioeteru (12) z N-pirolidynocyklopentenem
- 4. CZĘŚĆ DOŚWIADCZALNA
- 4.1. Uwagi ogólne
- 4.2. Synteza 1,5-dibromo-3-oksapentanu (1)
- 4.3. Synteza 1,8-dibromo-3,6-dioksaoktanu (2)
- 4.4. Synteza 1,11-dibromo-3,6,9-trioksaundekanu (3)
- 4.5. Reakcja 1,5-dibromo-3-oksapentanu (1) z tiosemikarbazydem
- 4.6. Reakcja 1,8-dibromo-3,6-dioksaoktanu (2) z tiosemikarbazydem
- 4.7. Reakcja 1,11-dibromo-3,6,9-trioksaundekanu (3) z tiosemikarbazydem
- 4.8. Synteza 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7)
- 4.9. Synteza 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8)
- 4.10. Synteza 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9)
- 4.11. Reakcja 1,5-bis(1,2,4-triazynylo-3-sulfanylo)-3-oksapentanu (7) z cyjankiem potasu
- 4.12. Reakcja 1,8-bis(1,2,4-triazynylo-3-sulfanylo)-3,6-dioksaoktanu (8) z cyjankiem potasu
- 4.13. Reakcja 1,11-bis(1,2,4-triazynylo-3-sulfanylo)-3,6,9-trioksaundekanu (9) z cyjankiem potasu
- 4.14. Reakcja Dielsa-Aldera tioeteru (11) z N-pirolidynocyklopentenem
- 4.15. Reakcja Dielsa-Aldera tioeteru (12) z N-pirolidynocyklopentenem
- 5. PODSUMOWANIE I WNIOSKI
- 6. BIBLIOGRAFIA
Wyszukiwarka
Podobne podstrony:
Nowa metoda syntezy krzemianu trójwapniowego i alitu
Nowa metoda oszustwa SMS owego Uważaj na te reklamy
NOWA METODA K WANTOWA, PLIKI Z CHOMIKA
Nowa metoda wyłudzeń Uważaj, co podpisujesz
Nowa metoda kradzieży na kartkę
patent cynakalcyt metoda syntezy
In vitro może się schować (Naprotechnologia - nowa metoda leczenia niepłodności), Położnictwo i gine
2007 03 Kinezjotaping nowa metoda leczenia
Nowa metoda w prognozowaniu pogody
Uwaga! Nowa metoda telefonicznych oszustów
2pkt Nowa metoda
Poradnik Purmo nowa metoda obliczania 12831 01 2012
Accusculpt nowa metoda modelowania twarzy i odmładzania zmienionych z wiekiem rysów
Nowa metoda oszustów Komornik ostrzega!
Wazne ((((Nowa metoda aktywacji ))))
patent cynakalcyt metoda syntezy
więcej podobnych podstron