10. E T E R Y
Aleksander Kołodziejczyk
Gdańsk 2012.
10.1 Wprowadzenie
Etery można uważać zarówno za pochodne wody, w której dwa atomy wodoru zostały zastąpione przez reszty organiczne, jak i za pochodne alkoholi; w nich wystarczy tylko jeden atom wodoru (przy -OH) zastąpić resztą organiczną.
![]()
W eterach nie ma takich wymogów, jak przy alkoholach, że atom tlenu musi być przyłączony wyłącznie do atomu węgla o hybrydyzacji sp3, dlatego R czy R' może być alkilem, arylem lub winylem. Jeżeli atom tlenu grupy hydroksylowej -OH jest połączony z atomem węgla sp2, to związki te (enole) są zwykle nietrwałe i przegrupowują się do formy karbonylowej. Etery, w których atom węgla sp2 jest związany z atomem tlenu są trwałe.

10.2 Występowanie
Etery są spotykane w przyrodzie. Do znanych naturalnych eterów należą:
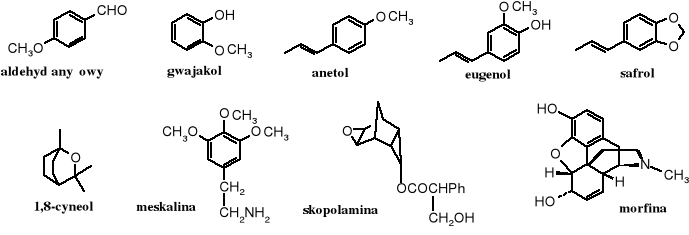
Rys.9.1 Wybrane przykłady związków naturalnych zawierających układy eterowe
Aldehyd anyżowy, anetol i eugenol należą do olejków eterycznych o przyjemnym zapachu, dwa pierwsze występują między innymi w anyżu, wanilii i w kwiatach akacji, a eugenol nadaje zapach goździkom. Safrol i cyneol są przedstawicielami terpenoidów.
Ugrupowania eterowe spotyka się często w alkaloidach, oprócz pokazanych na rysunku meskaliny, skopolaminy i morfiny - eterami są papaweryna, kantarydyna, narkotyna, kapsaicyna, rezerpina, serpentyna, strychnina, kurara i wiele innych.
10.3 Nomenklatura
10.3.1 Reguły UIPAC
Nazwy eterów tworzy się przez dodanie słowa eter do połączonych myślnikiem przymiotnikowych nazw obu reszt organicznych:
![]()
Eter metylopropylowy oznacza eter bis-2-metylopropylowy, tak jak eter etylowy oznacza eter dietylowy:

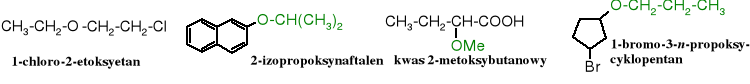
10.3.2 Nazewnictwo podstawnikowe
Resztę organiczną z atomem tlenu (R-O-) traktuje się jako podstawnik i umieszcza się w nazwie jako przedrostek alkoksylowy (Alk-O-) czy aryloksylowy (Ar-O-).
10.3.3 Nazewnictwo zamienne
Nazewnictwo zamienne jest stosowane głównie do tworzenia nazw polieterów, czyli związków zawierających kilka eterowych atomów tlenu. Eterowe atomy tlenu w łańcuchu są traktowane i liczone jak atomy węgla, czyli uwzględnia się je w nazwie węglowodoru macierzystego, a wyróżnia się je przedrostkiem oksa podając odpowiednie lokanty (w poniższym przykładzie - 2,5,8,11-) i liczebnik zwielokratniający (tetra).
![]()
Tego typu nazewnictwo jest bardzo przydatne w tworzeniu nazw eterów cyklicznych. Związki cykliczne zawierające w pierścieniu inny atom niż atom węgla (inne atomy) określane są jako heterocykle.
Słowo eter bez dodatkowych przymiotników oznacza eter dietylowy, z uwagi na fakt, że był to pierwszy poznany eter. Taką nazwę mu nadano ze względu na jego dużą lotność; jest to też najbardziej popularny eter, stosowany obecnie głównie jako rozpuszczalnik; dawniej był często używany do narkozy przed operacjami (anestetyk).
10.4 Właściwości fizyczne
10.4.1 Temperatura wrzenia eterów nie odbiega od reguł dotyczących związków organicznych, gdyż zależy przede wszystkim od masy cząsteczkowej i kształtu cząsteczki, podobnie jak w przypadku alkanów i innych związków nie tworzących międzycząsteczkowych wiązań wodorowych. Eter metylowy jest gazem (tw. -24oC), eter etylowy jest niskowrzącą cieczą (35oC), zaś tetrahydrofuran wrze w temperaturze 66oC, eter n-propylowy w 90oC, a butylowo-metylowy w 70oC. W laboratoriach, w których panuje wysoka temperatura zamiast popularnego rozpuszczalnika jakim jest eter etylowy stosuje się tetrahydrofuran lub eter butylowo-metylowy czy n-propylowy.
10.4.2 Zapach eterów
Zapach eterów określany jako przyjemny (eteryczny), odnosi się niższych eterów alifatycznych. Zapach tetrahydrofuranu trudno określić jako przyjemny, natomiast wiele wyższych eterów alifatycznych i aromatyczno-alifatycznych charakteryzuje się bardzo przyjemnymi zapachami kwiatów lub owoców. Etery metylowo-2-naftylowy i etylowo-2-naftylowy zawierające w swojej nazwie zwyczajowej odniesienie do zapachu gorzkiej pomarańczy - odpowiednio nerolina i nerolina nowa - są stosowane do perfumowania mydeł. Przyjemny zapach ma też anizol, czyli eter fenylowo-metylowy.
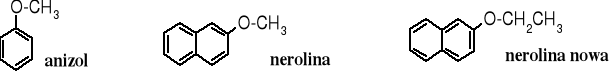
10.4.3 Rozpuszczalność
Etery, szczególnie te niższe są mniej hydrofobowe niż, np. alkany czy areny. W 100 ml wody w 20oC rozpuszcza się 6,9 g eteru etylowego, natomiast tetrahydrofuran jest w wodzie dobrze rozpuszczalny.
W eterach stosunkowo łatwo rozpuszczają się kwasy, ponieważ tworzą z nimi sole oksoniowe. Roztwór chlorowodoru w eterze jest znanym odczynnikiem chemicznym.
10.4.4 Zastosowanie
Etery są stosowane jako rozpuszczalniki, ponieważ są mało reaktywne, dobrze rozpuszczają wiele związków organicznych, a w niektórych reakcjach, np. ze związkami Grignarda są rozpuszczalnikami z wyboru, ponieważ tylko w nich tworzą się te związki i tylko w nich są trwałe w postaci roztworów.
Przy pracy z eterami trzeba pamiętać o zachowaniu środków bezpieczeństwa. Te niższe są lotne i tworzą z powietrzem mieszanki wybuchowe. Drugim niebezpieczeństwem jest podatność do tworzenia nadtlenków, dlatego eter przed użyciem należy pozbawić nadtlenków, gdyż przy odparowywaniu i zagęszczaniu roztworów eterowych może dojść (dochodziło) do niebezpiecznych wybuchów. Usuwanie nadtlenków polega na wytrząsaniu eteru z wodnym roztworem siarczanu żelaza (II) lub destylacji znad sodu. W tym drugim przypadku usuwa się równocześnie ślady wody.
10.4.5 Właściwości fizjologiczne
Eter etylowy (eter) był od 1842 r. używany jako środek do znieczulenia wziewnego (do anestezji) pacjentów przed zabiegami chirurgicznymi. Ma on szereg wad, ale jest mniej toksyczny od stosowanego dawniej chloroformu. Do jego wad należą: łatwopalność i nieprzyjemne skutki uboczne, szczególnie wywoływanie wymiotów po wybudzeniu. Obecnie w wziewnej anestezji chirurgicznej stosuje się głównie tlenek azotu (I) - N2O i halotan - CF3CHClBr.
10.5 Otrzymywanie eterów
10.5.1 Metoda przemysłowa
Przemysłowa produkcja eteru etylowego polega na dehydratacji etanolu, reakcji katalizowanej stężonym kwasem siarkowym. Reakcja biegnie w podobnych warunkach jak dehydratacja etanolu do etenu. Różnica polega na tym, że w procesie otrzymywania etenu stosuje się katalityczne ilości kwasu i wyższą temperaturę. Do przekształcania etanolu w eter używa się większych ilości kwasu (4 części na 9 części alkoholu), przy czym kwas nie zużywa się, a ponieważ eter i woda odparowują, dlatego też, żeby jego stężenie utrzymać na podobnym poziomie, alkohol dodaje się do reaktora w sposób ciągły w miarę postępu reakcji. W ten sposób zwiększa się wydajność produktu w stosunku do kwasu siarkowego i redukuje ilość ścieków.
![]()
Tym sposobem otrzymuje się inne etery symetryczne z odpowiednich alkoholi 1o. Reakcja biegnie wg mechanizmu SN2.
Mechanizm reakcji
![]()

10.5.2 Reakcja Williamsona
Alexander W. Williamson (1824-1904), ur. w Wandsworth (WB); doktorat w Giessen (1946); prof. w University College w Londynie.
Jest to ogólna metoda otrzymywania eterów poprzez alkilowanie alkoholanów halogenkami, siarczanami lub tosylanami alkilowymi. Została odkryta w 1850 r. przez Williamsona.

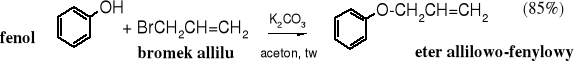
Fenole są bardziej reaktywne niż alkohole i dlatego reakcja z nimi biegnie nawet w wodzie w obecności tak słabej zasady, jak węglan potasu.
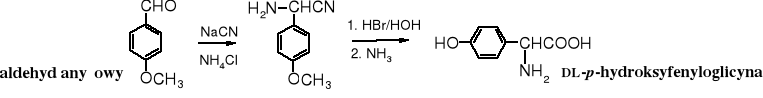
Atom wodoru grupy fenolowej jest wystarczająco kwaśny, żeby fenole mogły być metylowane za pomocą diazometanu. Anizol powstaje szybko w temperaturze pokojowej w reakcji fenolu z CH2N2. Ze względu na toksyczne właściwości diazometanu jego stosowanie jest ograniczone, a w niektórych laboratoriach wręcz zakazane.
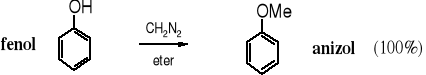
Reakcje otrzymania eterów alifatycznych wymagają bezwodnych warunków i silnych zasad, dlatego też alkoholany alifatyczne przygotowuje się używając, np. wodorku sodu.
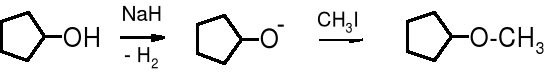
cyklopentanol cyklopentanolan eter cyklopentylowo- metylowy (74%)
Reakcja Williamsona biegnie wg mechanizmu SN2, przy czym alkoholan pełni rolę odczynnika nukleofilowego.
Zamiast wodorków można stosować tlenek srebra, która działa jako zasada, a równocześnie usuwa jony halogenkowe. Ten sposób syntezy eterów jest często stosowany w chemii cukrów do otrzymywania tzw. permetylowanych cukrów.

Cukry i wszystkie inne diole wicynalne można metylować za pomocą diazometanu. Diazometan nie metyluje alkoholi, ale diole wicynalne są silniejszymi kwasami niż zwykłe alkohole (wpływ grupy sąsiadującej) i reagują z diazometanem podobnie jak kwasy.

10.5.3 Alkoksyrtęciowanie/odrtęciowanie alkenów
Alkeny są bardzo dobrymi substratami do otrzymywania eterów, z nich w reakcji z octanem rtęci (lepiej z trifluorooctanem rtęci) w obecności alkoholu powstaje addukt, który pod wpływem NaBH4 ulega odrtęciowaniu (redukcji) do odpowiedniego eteru.

10.6 Właściwości chemiczne
Etery wg powszechnej opinii są mało reaktywne i dlatego wykorzystuje się je często jako rozpuszczalniki. Reagują jednak z tlenem z powietrza i tworzą, jak już wspomniano, niebezpieczne nadtlenki.
10.6.1 Acydolityczne rozszczepienie wiązania eterowego
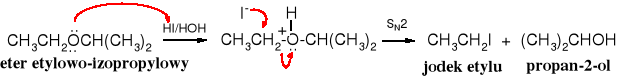
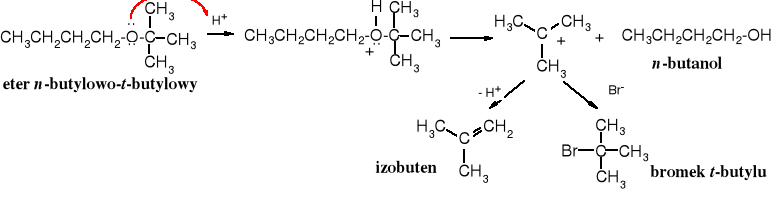
Pod wpływem silnych kwasów (halogenowodorów) w eterach dochodzi do rozerwania wiązania C-O, czyli reakcji zwanej rozszczepieniem eterów na halogenek i alkohol. Najtrudniej rozszczepieniu ulegają etery alifatyczne, łatwiej alifatyczno-aromatyczne, jeszcze łatwiej aromatyczne, a najłatwiej t-butylowe. Rola jonów jodkowych i bromkowych w reakcjach rozszczepiania eterów wynika z faktu, że są one silnymi nukleofilami, a słabymi zasadami.
Szereg eterów, wg podatności na rozszczepienie kwasowe:
Alk-O-Alk < Alk-O-Ar < Ar-O-Ar < Alk-O-t-Bu
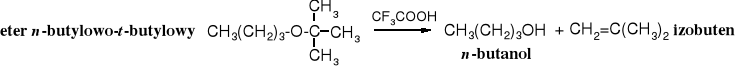
Etery alifatyczne rozkłada się za pomocą najsilniejszego kwasu halogenowodorowego, jakim jest jodowodór i to jest możliwe dopiero w podwyższonej temperaturze, etery alkilowo-aromatyczne ulegają tej reakcji już pod wpływem kwasu bromowodorowego (w temperaturze wrzenia), przy czym odszczepieniu ulega bromek alkilu, zaś etery t-butylowe rozkładają się już w 0oC obecności kwasu trifluorooctowego, przy czym wydziela się izobuten.
![]()
Mechanizm
Reakcja zaczyna się od protonowania atomu tlenu i utworzenia soli oksoniowej, która pod wpływem anionu halogenkowego (I-, nukleofila) przekształca się w halogenek alkilowy i alkohol, wg mechanizmu SN2 (ścieżka A).
A:
lub wg mechanizmu SN1 (ścieżka B) sól oksoniowa rozpada się na alkohol i karbokation, który stabilizuje się poprzez przyłączenie nukleofilu, przy czym powstaje halogenek alkilowy lub odszczepia proton i tworzy się alken. Ten drugi mechanizm dotyczy eterów zawierających 3o reszty alkilowe (np. t-butylową).
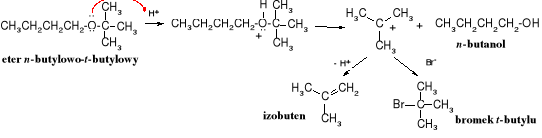
B:
Rozszczepianie eterów metylowo-arylowych zachodzi prawie ilościowo, dlatego wprowadzanie osłon metylowych na funkcje fenolowe i później ich usuwanie bromowodorem jest sposobem na czasowe ochranianie tych funkcji przed niepożądanymi reakcjami. Podczas rozszczepiania eterów alkilowo-arylowych powstają halogenek alkilu i fenol.

10.6.2 Autoksydacja eterów
Etery pod wpływem tlenu atmosferycznego ulegają samorzutnej, chociaż wolnej reakcji utlenienia (autooksydacji), która prowadzi do nadtlenków. Dostęp powietrza do eterów przechowywanych przez dłuższy czas (wystarcza warstwa powietrza w butli nad eterem) umożliwia wytworzenie na tyle znaczącej ilości nadtlenków, że podczas zatężania eterowych roztworów dochodzi do groźnych wybuchów. Im wyżej rzędowe etery, tym większa szybkość utleniania ich do nadtlenków.
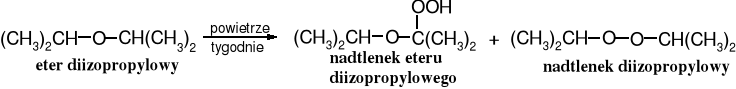
Przed zatężaniem długo przechowywanych eterów lub ich roztworów należy koniecznie rozłożyć występujące w nich nadtlenki, np. poprzez wytrząsanie tych roztworów z wodnym roztworem soli żelaza II, siarczynu lub wodorosiarczynu sodu.
10.7 Etery cykliczne, epoksydy
Związki cykliczne zawierające w pierścieniu atom tlenu związany z dwoma atomami węgla nazywane są eterami cyklicznymi. W zależności od wielkości pierścienia występują etery cykliczne trójpierścieniowe, czteropierścieniowe, pięciopierścieniowe, itd.

Niższe etery cykliczne często noszą nazwę tlenków, a niektóre z nich mają nazwy zwyczajowe. Tlenek etylenu produkowany jest na skalę wielu mln ton rocznie, służy bowiem do otrzymywania glikolu etylenowego − głównego składnika płynu do chłodnic samochodowych i ważnego surowca w przemyśle organicznym. Tlenek etylenu przetwarza się także na etanoloaminę, niejonowe detergenty, etery glikolu etylenowego i polietoksyglikole. Tlenek propylenu jest używany do dezynfekcji (sterylizacji) narzędzi chirurgicznych. Tetrahydrofuran i dioksan znalazły zastosowanie jako rozpuszczalniki.
10.7.1 Nomenklatura
Nazwy eterów cyklicznych zgodnie z zasadami IUPAC wywodzą się z nazw cykloalkanów, z tym że obecność atomu tlenu zaznacza się przedrostkiem „oksa” poprzedzonym odpowiednim lokantem.
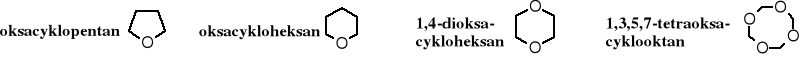
Ugrupowanie zawierające pierścień oksapropanowy nazywane jest epoksydem i słowo „epoksy-” stosuje się w przedrostkowym sposobie nazywania tych związków. Ugrupowanie to nosi również nazwę oksiranu i odpowiednie pochodne zawierają w swojej nazwie ten rdzeń.
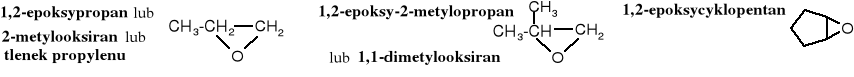
10.7.2 Otrzymywanie
Utlenienie alkenów nadkwasami
Laboratoryjne metody otrzymywania epoksydów polegają na utlenieniu alkenów nadkwasami - RCOOOH.
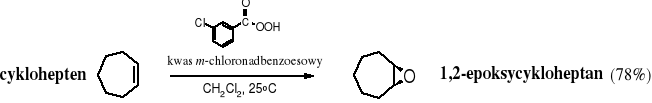
Ze względów sterycznych pierścień epoksydowy może znajdować się wyłącznie po jednej stronie pierścienia cykloalkanowego. W reakcji z alkenami atom tlenu z nadtlenokwasu zostaje przeniesiony w jednym etapie, przyłączając się równocześnie do obu atomów C; taki sposób przeniesienia atomu z jednej na drugą cząsteczkę nazywa się syn.
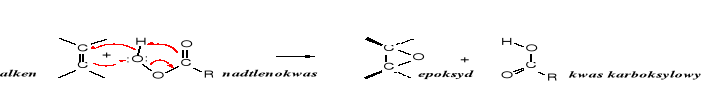
Z halohydryn
Inny sposób otrzymywania epoksydów polega na eliminacji halogenowodoru z 1,2-hydroksyhalogenozwiązków (halohydryn) w środowisku zasadowym. Jest to wewnątrzcząsteczkowa reakcja Williamsona (tworzenie eterów).
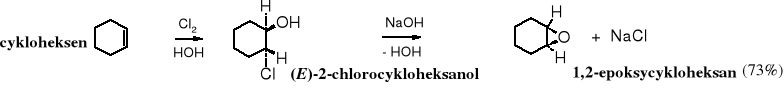
Traktowanie 2-chloroetanolu zasadą - Ca(OH)2 - było przez lata przemysłową metodą otrzymywania tlenku etylenu. Jednak ze względów ekologicznych, tj. z powodu powstawania ogromnych ilości ścieków zawierających zanieczyszczony chlorek wapnia, technologia ta została zaniechana.
Utlenianie alkenów
Ugrupowanie epoksydowe powstaje podczas utleniania alkenów tlenem z powietrza w obecności srebra jako katalizatora. Jest to sposób bezpośredniego utlenienia etenu do tlenku etylenu.
![]()
Proces jest specjalnie tak prowadzony, żeby konwersja etenu nie była wysoka. Ma to na celu zapobieżeniu dalszemu utlenieniu (degradacji) epoksydu. W tych warunkach pozostaje część niezmienionego etenu, który jest zawracany do reakcji.
10.8 Właściwości chemiczne
10.8.1 Hydroliza
Epoksydy są bardzo reaktywne. W wodnych roztworach kwasów ulegają przekształceniu w glikole wicynalne (1,2-diole). Reakcja biegnie w temperaturze pokojowej. Hydroliza epoksycykloalkanów, jako addycja anti, prowadzi do trans-dioli.
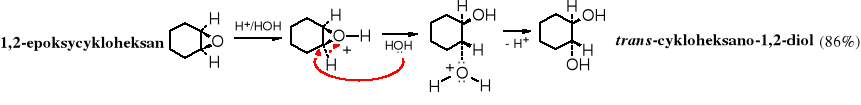
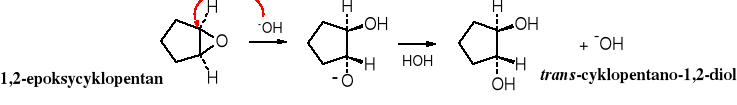
Epoksydy są również hydrolizowane przez zasady.
Utlenienie cykloalkenów za pomocą KMnO4 lub OsO4 prowadzi do wicynalnych cis-dioli. Tak, więc obie te reakcje, tzn. utlenianie cykloalkenów za pomocą nadmanganianu potasu lub tetratlenku osmu oraz drugi sposób utleniania do epoksydów i ich hydroliza są komplementarne, gdyż prowadzą do różnych stereoizomerów.
10.8.2 Reakcja z innymi odczynnikami nukleofilowymi
Rozszczepianie epoksydów za pomocą odczynników nukleofilowych, charakterystyczna reakcja tych związków, daje 1,2-difunkcyjne pochodne. Nukleofil przyłącza się w sposób anti, tzn. zajmuje pozycję po przeciwnej stronie pierścienia niż grupa -OH, pochodząca z rozczepionego pierścienia epoksydowego. W reakcji z alkoholami powstają alkoksyalkohole, z amoniakiem lub aminami - aminoalkohole, z halogenowodorami - halohydryny, zaś ze związkami Grignarda alkohole o przedłużonym łańcuchu węglowodorowym.
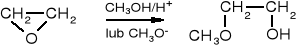
tlenek etylenu 2-metoksyetanol znany jako monoetylowy eter glikolu etylenowego
Reakcja z alkoholami jest katalizowana zarówno przez kwasy, jak i zasady.
W reakcji z amoniakiem powstaje etanoloamina, rozpuszczalnik wykorzystywany w przemyśle rafineryjnym do usuwania związków siarki z produktów naftowych. Etanoloamina jest ważnym składnikiem glicerofosfolipidów zwanych fosfatydyloetanoloaminami.

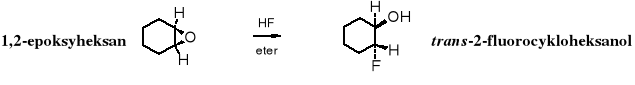
Reakcje z halogenowodorami biegną szybko, z dobrymi wydajnościami, zarówno z HF, HCl, HBr, jak i z HI.
Z epoksydów, za pomocą związków Grignarda można otrzymywać długołańcuchowe alkohole.
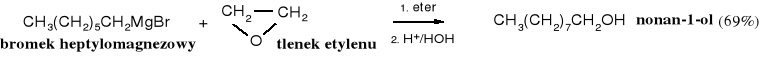
Wysoka reaktywność układów epoksydowych została wykorzystana do opracowania niezwykle skutecznych i silnie wiążących żywic epoksydowych, które służą zarówno jako uniwersalne kleje, jak i do wytwarzania kompozytowych elementów, np. kadłubów łodzi.
10.8.3 Regioselektywność otwierania pierścienia epoksydowego
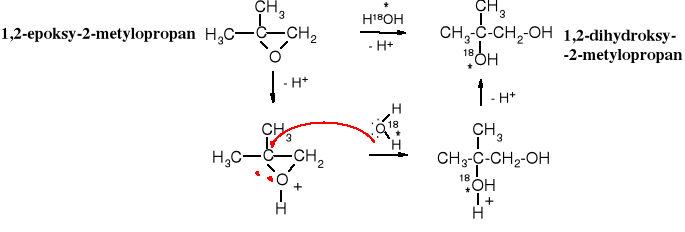
Orientacja, czyli kierunek ataku odczynnika nukleofilowego na atomy węgla pierścienia epoksydowego zależy od konstytucji substratu i warunków reakcji. Z katalizowanej kwasowo reakcji hydrolizy niesymetrycznego epoksydu wodą zawierającą izotopowo znakowany atom tlenu wynika, że cząsteczka wody przyłączą się do bardziej rozgałęzionego atomu węgla, gdyż na nim skupiony jest większy ładunek dodatni - wpływ podstawników alkilowych.
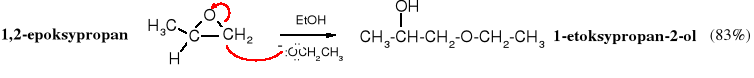
W trakcie alkoholizy epoksydów w środowisku zasadowym anion alkoksylowy przyłącza się wyłącznie do mniej zatłoczonego atomu węgla.
W reakcjach epoksydów niesymetrycznych z nukleofilami w środowisku kwaśnym powstaje zwykle mieszanina produktów.
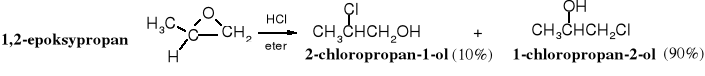
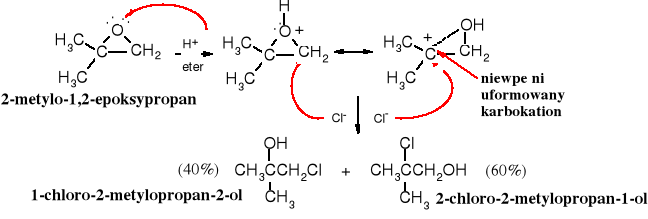
Główny produkt reakcji 1,2-epoksypropanu z chlorowodorem jest zgodny z oczekiwaniem, tzn. anion chloru przyłącza się do pierwszorzędowego, czyli mniej zatłoczonego atomu węgla. Jednak w podobnej reakcji z 2-metylo-1,2-epoksypropanem anion chlorkowy z niewielką preferencją wybiera 3o atom węgla:

Ta nieoczekiwana preferencja ukierunkowania regiochemicznego wynika z mechanizmu reakcji, który ma cechy reakcji pośredniej pomiędzy SN1 i SN2. Obecność w układzie epoksydowym 3o atomu węgla sprzyja tworzeniu się bardziej trwałego, chociaż nie w pełni wykształconego 3o karbokationu i w tym miejscu, pomimo większego zatłoczenia, następuje atak nukleofilowy. Karbokation przy 2o atomie węgla jest znacznie mniej trwały niż przy 3o C i dlatego w przypadku reakcji 1,2-epoksypropanu z chlorowodorem produkt addycji Cl- do 2o atomu węgla powstaje ze znacznie mniejszą wydajnością.
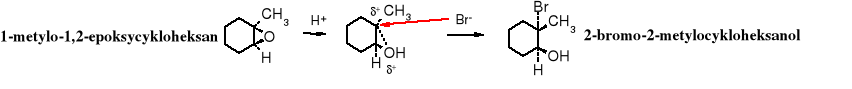
Problem: Jaki będzie produkt reakcji 1-metylo-1,2-epoksycykloheksanu z bromowodorem?
Teoretycznie mogą powstać dwa produkty:
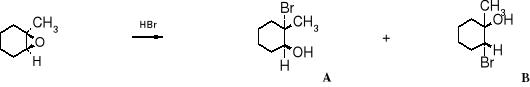
metylo-1,2-epoksycykloheksan 2-bromo-2-metylocykloheksanol 2-bromo-1-metylocykloheksanol
Zgodnie z przedstawioną powyżej teorią atak anionu bromkowego nastąpi na 3o atom węgla, powinien więc powstać produkt A. Doświadczenie potwierdza to przypuszczenie.
10.8.4 Wyższe etery cykliczne
Epoksydy ze względu na unikalne właściwości chemiczne, głównie z uwagi na dużą reaktywność są omawiane oddzielne w stosunku do innych eterów cyklicznych. Wyższe etery cykliczne, szczególnie te o pierścieniach od pięcioczłonowego wzwyż, chemicznymi właściwościami przypominają etery alifatyczne. Na uwagę zasługuje tetrahydrofuran, który jest szeroko stosowany w laboratoriach chemicznych jako rozpuszczalnik. Otrzymuje się go z furanu poprzez uwodornienie w obecności niklu jako katalizatora.
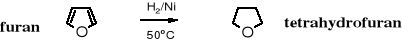
Tetrahydrofuran (THF) jest jednak reaktywniejszy od eterów alifatycznych, ponieważ ulega rozszczepieniu już pod wpływem bromowodoru, powstaje przy tym 1,4-dibromobutan.
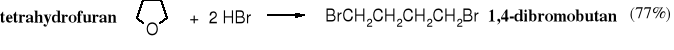
Tetrahydropiran jest mniej reaktywny od tetrahydrofuranu. Reaktywność eterów cyklicznych zależy od wielkości pierścienia i przypomina właściwości chemiczne cykloalkanów - najbardziej reaktywny jest cyklopropan, potem reaktywność spada; cykloheksan właściwościami chemicznymi przypomina alkany. Podobnie jest z eterami cyklicznymi.
Do popularnych rozpuszczalników należy dioksan. Jego rozpuszczalność w wodzie wynosi 8g/100 ml w 20oC. Tetrahydrofuran miesza się z wodą w każdym stosunku, jest więc bardziej hydrolilowy od eteru etylowego.
10.8.5 Etery koronowe - korony
Polietery cykliczne ze względu na kształt wzorów cząsteczek przypominający koronę zostały nazwane koronami.
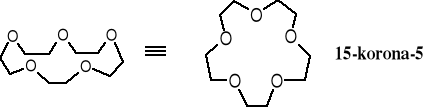
Nazwy polieterów cyklicznych tworzy się w ten sposób, że rdzeń nazwy - korona - jest poprzedzona przez liczbą wszystkich atomów tworzących pierścień, w powyższym wzorze - 15 , a na końcu po myślniku podaje się liczbę atomów tlenu znajdujących się w pierścieniu, w tym przypadku - 5.
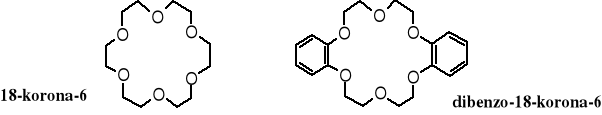
Poniżej podane są wzory i nawy koron o innych rozmiarach i z inną zawartością atomów tlenu w pieścieniu.

Warto zwrócić uwagę 18-koronę-6 i jej pochodną - dibenzo-18-koronę-6. Za pomocą różnych podstawników można modyfikować polarność (hydrofobowość) polieterów cyklicznych - dwa pierścienie aromatyczne znacznie zwiększają lipofilowość cząsteczki.
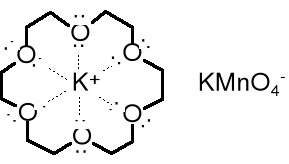
Odkrycie eterów koronowych w latach 60. XX w. było nie lada sensacją naukową, ponieważ okazało się, że mają one niezwykłe właściwości. Potrafią, np. ułatwić rozpuszczenie soli nieorganicznych w tak niepolarnych rozpuszczalnikach jak, np. benzen. Można się o tym łatwo przekonać wykonując doświadczenie opisane poniżej.
Dwie nie mieszające się z sobą ciecze umieszczone w rozdzielaczu - bezbarwny benzen i fioletowy wodny roztwór KMnO4 - nawet po wielokrotnym wytrząsaniu rozdzielą się i górna warstwa organiczna pozostanie bezbarwna, a dolna wodna fioletowa. To oznacza, że nadmanganian potasu jest nierozpuszczalny w benzenie. Jednak po dodaniu do rozdzielacza szczypty 18-korony-6 (eteru koronowego) i po ponownym wstrząśnięciu jego zawartości - warstwa benzenowa zabarwi się na fioletowo, co świadczy o tym, że fioletowe jony nadmanganianowe przeszły częściowo do warstwy benzenowej, tzn. rozpuściły się w benzenie. A co się stało z jonami potasu?
Rozpuszczenie nadmanganianu potasu w benzenie stało się możliwe dzięki temu, że jony potasu - kationy - zostały koordynacyjnie związane wewnątrz cząsteczki eteru koronowego i powstał nowy, bardziej lipofilowy kation. W tym kationie ładunek dodatni jest rozmyty na całą cząsteczkę eteru. Jako mniej polarny (bardziej lipofilowy) niż kation potasowy jest w stanie rozpuścić się w niepolarnym rozpuszczalniku.
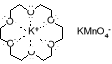
Kompleksowanie kationów przez eter koronowy ułatwia rozpuszczanie
soli nieorganicznych w rozpuszczalnikach niepolarnych
We wnętrzu każdej korony znajduje się wnęka o określonych rozmiarach, otoczona przez atomy tlenu zdolne do koordynowania kationów pasujących rozmiarami. We wnęce 18-korony-6 mieści dobrze kation K+. Kationy Na+ i Li+ są kompleksowane odpowiednio przez 15-koronę-5 i 12-koronę-4.
Jony nadmanganianu potasu w obecności eteru 18-korony-6 zostają rozdzielone - kation K+ skoordynowany we wnętrzu korony traci wysoką polarność i w nowej postaci staje się podatny na solwatowanie przez cząsteczki benzenu. Z kolei anion MnO4, który także ulega rozpuszczeniu w benzenie jest w stanie reagować z niepolarnymi substancjami znajdującymi się w niepolarnym rozpuszczalniku, np. utleniać je.
Możliwość rozpuszczenia polarnych odczynników, np. utleniaczy w niepolarnych rozpuszczalnikach, to nie jedyna korzyść, jaką daje stosowanie eterów koronowych w tego typu reakcjach. Uwięzienie kationu we wnęce eteru koronowego wywołuje podobny wpływ na reaktywność anionu jak działanie polarnych rozpuszczalników aprotycznych, typu DMSO, DMF czy HMPA. Uwolniony od kationu anion, zwany często „nagim” anionem staje się bardziej reaktywny.
Substancje, które są ułatwiają reakcję przez przenoszenie jonów ze środowiska polarnego do niepolarnego (np. etery koronowe) nazywane są katalizatorami przeniesienia międzyfazowego, a samo zjawisko określane jest jako kataliza międzyfazowa - TPC (ang. trans phase catalysis).
10.8.6 Otrzymywanie eterów koronowych
Etery koronowe można otrzymać poprzez alkilowanie alkoholanów, zgodnie z poznaną uprzednio reakcją Williamsona. Konkurencyjnie tworzą się etery liniowe. Dodatek do mieszaniny reakcyjnej odpowiednich kationów katalizuje cyklizację, np. jony K+ sprzyjają tworzeniu się 18-korony-6.
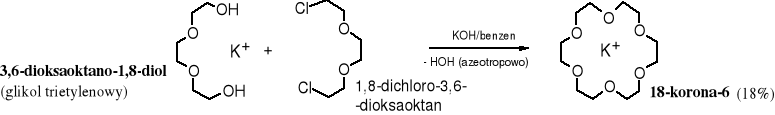
Zadanie: napisz schemat reakcji tworzenia się liniowych polieterów.
Wyszukiwarka
Podobne podstrony:
cw7, Technologia chemiczna PWR, SEMESTR III, Podstawy chemii organicznej - lab
6 - utlenianie cykloheksanolu, Technologia chemiczna PWR, SEMESTR III, Chemia techniczna organiczna
5 - sole diazoniowe, Technologia chemiczna PWR, SEMESTR III, Chemia techniczna organiczna
Chemia techniczna organiczna ćw. 1 destylacja, Technologia chemiczna PWR, SEMESTR III, Chemia techni
Sprawozdanie nr 1 - Kopia, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Sprawozdanie nr 5, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Sprawozdanie nr 1, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Kratownica2, Technologia chemiczna PWR, SEMESTR III, Maszynoznawstwo - projekt
Zadania na rozgrzewke, Technologia chemiczna PWR, SEMESTR IV, Obliczenia w chemii technicznej
Procesy jednostkowe - egzamin 0, Technologia chemiczna PWR, SEMESTR V, Podstawowe procesy jednostkow
Cwiczenie - E, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Polikondensacja cw 4, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
pytania koło koźlecki, Technologia chemiczna PWR, SEMESTR V, Inżynieria chemiczna - lab
Kopolimeryzacja cw 3, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Cwiczenie - B, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Cwiczenie - G, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
więcej podobnych podstron