CZY MOŻNA POLUBIĆ CHEMIĘ ORGANICZNĄ?
Michał Fedoryński
Politechnika Warszawska, Wydział Chemiczny
Żeby coś polubić, trzeba najpierw wiedzieć co to jest, a także czy to coś jest warte obdarzenia uczuciem. Chemia organiczna niewątpliwie jest tego warta!
Chemia organiczna jest to chemia związków węgla. Definicję tę możemy znaleźć w powieści Bolesława Prusa „Lalka” - tak odpowiedział Stanisław Wokulski na pytanie profesora Geista: „Czy pan wiesz co to jest chemia organiczna?”. Nawiasem mówiąc zachęcam do lektury.
Chemię związków węgla wydzielono z całości chemii - nauki przyrodniczej, zajmującej się budową i własnościami substancji, ich przemianami (jakościowymi i ilościowymi) oraz warunkami, w których te przemiany zachodzą - z powodu olbrzymiej liczby związków tego pierwiastka. Obecnie znanych jest około 12 milionów związków węgla i liczba ich szybko rośnie, a tylko około 120 tysięcy związków wszystkich innych pierwiastków. Nazwa „związki organiczne” wywodzi się z czasów, kiedy uważano, że ich synteza może dokonywać się wyłącznie w organizmach żywych. W 1828 r. Friedrich Wöhler (1800-1882), wybitny chemik niemiecki, otrzymał w laboratorium mocznik - związek organiczny - tym samym obalając tę teorię. Ale nazwa pozostała.
Żeby polubić chemię organiczną, należy ją zrozumieć. Nie jest to nauka tak ścisła jak matematyka czy fizyka. Obejmuje ogromny materiał - miliony związków, setki reakcji, często nazwanych od nazwisk odkrywcy lub rodzaju przemiany chemicznej. Pamięciowe opanowanie tego obszernego materiału jest zadaniem bardzo trudnym - ale niecelowym! Chemia organiczna wykazuje wewnętrzną logikę. Można ją przedstawić w taki sposób, żeby tę logikę uwidocznić, wykazać podobieństwo i analogie wielu reakcji oraz zrozumieć podstawowe reguły decydujące o przebiegu reakcji. Ogromna liczba różnych reakcji to warianty i szczególne przypadki niewielkiej liczby procesów podstawowych, których przebieg jest determinowany strukturą reagentów oraz warunkami reakcji.
Atomy węgla łączą się ze sobą, a także z atomami innych pierwiastków za pomocą wiązań pojedynczych, podwójnych lub potrójnych, tworząc z reguły trwałe połączenia. Z tego samego zbioru pierwiastków można utworzyć wiele różnych połączeń (zjawisko izomerii - związków, mających odmienne własności fizykochemiczne i biologiczne). Atom węgla posiada na swej zewnętrznej powłoce cztery elektrony, tzw. elektrony walencyjne, wszystkie one uczestniczą w tworzeniu wiązań kowalencyjnych. Dwa pozostałe elektrony na pierwszej powłoce najczęściej chemików nie interesują. „Chemia jest to fizyka zewnętrznych powłok elektronowych” - jak, nieco żartobliwie, powiedział Ernest Rutherford. Wiązania pojedyncze w cząsteczce metanu, CH4, skierowane są ku narożom czworościanu foremnego, a kąt pomiędzy wiązaniami wynosi 109,5º. Wszystkie atomy, które są połączone z atomami węgla, tworzącymi wiązanie podwójne, leżą w jednej płaszczyźnie. Cząsteczki związków zawierających wiązanie potrójne są liniowe.
Możliwość tworzenia wiązań pomiędzy atomami węgla, a więc tworzenia łańcuchów prostych lub rozgałęzionych, a także związków cyklicznych - pierścieni zbudowanych z atomów węgla - jest specyficzną cechą tych atomów. Porównajmy strukturę elektronową atomów węgla i azotu. W atomie azotu występuje pięć elektronów na zewnętrznej powłoce elektronowej, ale tylko trzy z nich są wykorzystywane do tworzenia wiązań chemicznych. W cząsteczce amoniaku, NH3, występuje więc para elektronów nie uczestnicząca w tworzeniu wiązań. Jeśli połączymy dwa atomy azotu wiązaniem pojedynczym (jak w cząsteczce hydrazyny, NH2NH2, związku stosowanego m.in. jako paliwo w turbinach samolotów i promów kosmicznych), te wolne pary elektronów odpychają się, osłabiając wiązanie azot-azot. Zjawisko to nie występuje w przypadku atomów węgla, którego wszystkie elektrony walencyjne wykorzystane są do tworzenia wiązań.
Nieskończona liczba możliwych związków organicznych może powodować zniechęcenie do przyswajania chemii organicznej, dodatkowo od rysowania skomplikowanych wzorów dużych cząsteczek może zaboleć ręka. Ta druga trudność jest łatwa do pokonania: należy nauczyć się rysować wzory związków organicznych za pomocą wzorów kreskowych (patrz wykład), w których pomija się atomy węgla i wodoru. We wzorach tych atomy węgla znajdują się w punktach połączenia łamanych linii przedstawiających szkielet węglowy.
Na szczęście istnieją typy połączeń organicznych preferowane przez naturę. Możemy wyróżnić kilkanaście najważniejszych rodzajów związków organicznych różniących się grupami funkcyjnymi:
węglowodory - składają się tylko z atomów węgla i wodoru. Wyróżniamy związki węgla i wodoru połączonych w różny sposób wiązaniami pojedynczymi (tzw. węglowodory nasycone, alkany, np. metan, propan); związki węgla i wodoru zawierające jedno lub więcej wiązanie podwójne węgiel-węgiel (alkeny, np. etylen), związki zawierające wiązanie potrójne węgiel-węgiel (alkiny, np. acetylen), węglowodory aromatyczne (nazwa nie ma nic wspólnego z zapachem!), np. benzen - o nich nie będziemy mówić.
alkohole - związki zawierające grupę OH (grupę hydroksylową), połączoną z podstawnikiem węglowodorowym, np. metanol, CH3OH.
aldehydy - związki zawierające grupę C=O (karbonylową), połączoną z atomem wodoru i podstawnikiem węglowodorowym, np. etanal (aldehyd octowy)
ketony - związki zawierające grupę karbonylową, połączoną z dwoma podstawnikami węglowodorowymi, np. propanon (aceton), CH3C(O)CH3
kwasy karboksylowe i ich pochodne (estry, chlorki kwasowe, bezwodniki kwasowe itp.)
etery
siarczki
aminy
chlorowcopochodne
Wszystkie wymienione typy związków, a także wiele innych, w szczególności takie, które zawierają kilka takich samych lub różnych grup funkcyjnych, chemicy otrzymują na drodze syntezy organicznej. Jest to jedno z najważniejszych zadań chemii organicznej.
Dalszą dyskusję ograniczymy do reakcji jonowych. Jony z ładunkiem ujemnym lub dodatnim na atomie węgla nazywamy odpowiednio karboanionami lub karbokationami. Odgrywają one olbrzymią rolę jako związki pośrednie w wielu reakcjach. Związki organiczne nie występują z reguły w postaci jonów. Musimy te jony wytworzyć przed reakcją.
Najważniejszym sposobem wytwarzania karboanionów jest oderwanie protonu od atomu węgla połączonego z atomem wodoru. Dokonujemy tego działaniem zasady - związku posiadającego ładunek ujemny lub wolną parę elektronów. Jednak nie od każdego związku organicznego zawierającego wiązanie węgiel-wodór proton da się oderwać. Karboanion musi mieć możliwość stabilizacji, czyli rozproszenia ładunku ujemnego na więcej niż jeden atom. W cząsteczce metanu taka możliwość nie istnieje, istnieje natomiast np. w anionie utworzonym z acetonu. Można to przedstawić rysując dwa (lub więcej) wzory strukturalne, pokazujące różne położenie wiązań i ładunków elektrycznych. Wzory te przedstawiają nieistniejące w rzeczywistości struktury ze zdelokalizowanymi wiązaniami i ładunkiem umieszczonym na różnych atomach. Zaznaczamy to za pomocą strzałki z dwoma grotami, umieszczonej między wzorami struktur, które nazywamy granicznymi albo rezonansowymi. Rzeczywista budowa związków jest pośrednia między jednym, a drugim wzorem granicznym. Dla anionu acetonu możemy narysować dwie struktury rezonansowe.
Dla anionu utworzonego z acetyloacetonu - trzy, ten anion jest lepiej stabilizowany w porównaniu z anionem acetonu i łatwiej go wytworzyć - innymi słowy do jego wytworzenia wystarczy użycie słabszej zasady.
Najważniejsze metody generowania karbokationów to:
reakcje dysocjacji
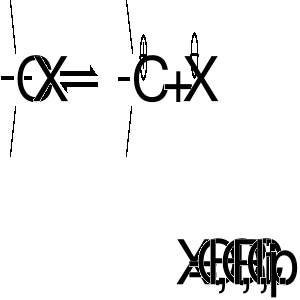
Proces ten jest energetycznie niekorzystny, gdyż oprócz energii dysocjacji wiązania C-X wymaga znacznej energii na rozdzielenie cząstek o przeciwnych ładunkach. Ta energia może być kompensowana przez energię solwatacji powstałych jonów w polarnych rozpuszczalnikach protonowych. Alkohole można przekształcać w karbokationy poprzez protonowanie grupy hydroksylowej i dysocjację wiązania węgiel-tlen w powstałej soli oksoniowej. Dla przesunięcia równowagi w prawo należy zmniejszyć nukleofilowość wody drogą protonowania.
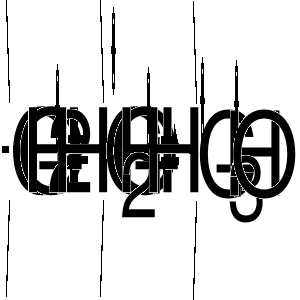
Znaczne ułatwienie dysocjacji wiązania węgiel-chlor i wytworzenie karbokationu uzyskujemy traktując chlorowcoalkany kwasami Lewisa.

reakcje przyłączania protonu do wiązań nienasyconych
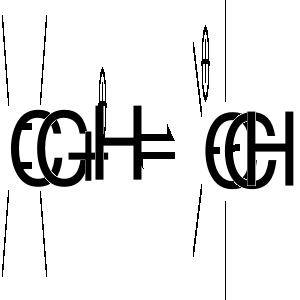
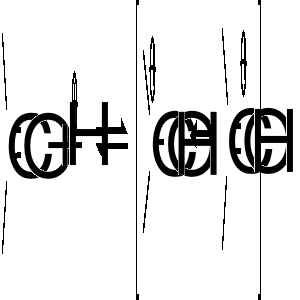

Zależność między budową karbokationów a ich stabilnością ograniczymy do stwierdzenia, że podstawniki zdolne do oddawania elektronów zmniejszają ich deficyt na dodatnio naładowanym atomie węgla, a tym samym sprzyjają stabilizacji karbokationu. Atom wodoru jest słabym donorem elektronów, a więc karbokation metylowy nie jest stabilizowany. Zastąpienie atomu wodoru w kationie metylowym podstawnikami węglowodorowymi (grupami alkilowymi) prowadzi do wzrostu stabilizacji karbokationu. W szeregu:

stabilizacja karbokationów rośnie z lewa na prawo.
Jest rzeczą oczywistą, że w jednym naczyniu reakcyjnym nie można jednocześnie wytworzyć karboanionu i karbokationu.
Rozpatrzmy po jednym przykładzie reakcji z udziałem karbokationów i karboanionów.
Dodanie do mieszaniny alkoholu t-butylowego (CH3)3COH i metanolu katalitycznej ilości kwasu siarkowego (źródło protonu) powoduje protonowanie atomu tlenu grupy hydroksylowej w obu alkoholach z utworzeniem odpowiednich kationów oksoniowych. Są to procesy odwracalne. Jednakże tylko z kationu oksoniowego utworzonego z alkoholu t-butylowego może nastąpić odszczepienie cząsteczki wody z utworzeniem karbokationut-butylowego, gdyż jest on dobrze stabilizowany. Karbokationt-butylowy tworzy się więc selektywnie w tym procesie. Karbokation ten może wstąpić w reakcję z atomem tlenu grupy hydroksylowej metanolu, a utworzony nowy kation oksoniowy odszczepia proton, tworząc eter t-butylowo metylowy.
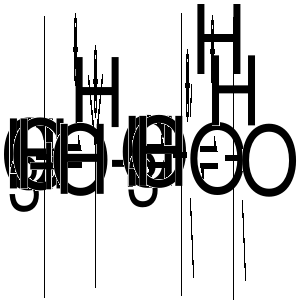
Eter ten jest cennym dodatkiem do paliw (poprawia liczbę oktanową), produkowanym na skalę przemysłową. W przemyśle zamiast alkoholu t-butylowego stosuje się tańszy izobuten (2-metylopropen), który w reakcji z protonem daje karbokationt-butylowy (patrz druga metoda generowania karbokationów).
Oczywiście można zapytać czy karbokationt-butylowy nie może utworzyć kationu oksoniowego z cząsteczką alkoholu t-butylowego - prowadziłoby to do eteru di-t-butylowego. W rzeczywistości proces ten zachodzi w niewielkim stopniu, gdyż podstawnik t-butylowy jest bardzo “objętościowy” i kontakt między alkoholem
t-butylowym i kationem oksoniowym utworzonym z tego alkoholu jest z powodów przestrzennych utrudniony. Można zminimalizować tworzenie eteru di-t-butylowego, prowadząc proces w nadmiarze metanolu, tym samym zwiększając szansę na kontakt karbokationut-butylowego z tym alkoholem. Logiczne, prawda?
Jedną z najważniejszych metod tworzenia wiązań węgiel-węgiel, a więc powiększania łańcucha węglowego, jest tzw. alkilowanie karboanionów chlorowcoalkanami. Przypomnijmy w tym miejscu, że elektroujemność jest to zdolność atomu w cząsteczkach związków chemicznych do przyciągania elektronów. Elektroujemność atomów w szeregu B, C, N, O, F rośnie z lewa na prawo, gdyż przy tej samej ilości powłok elektronowych (dwie) ładunek jądra rośnie z lewa na prawo. Z drugiej strony w szeregu chlorowców F, Cl, Br, I elektroujemność maleje z lewa na prawo, gdyż wprawdzie ładunek jądra rośnie z lewa na prawo, ale odległość zewnętrznej powłoki elektronowej od jądra też jest coraz większa (pięć powłok w przypadku atomu jodu) i oddziaływanie zewnętrznych elektronów z jądrem jest słabsze (tzw. efekt ekranowania). Fluor jest najbardziej elektroujemnym spośród wszystkich atomów. Wiązanie atomu węgla z bardziej od niego elektroujemnym atomem jest spolaryzowane, oznacza to iż gęstość chmury elektronowej w pobliżu bardziej elektroujemnego atomu jest większa niż w pobliżu atomu węgla. W cząsteczce jodku, bromku lub chlorku alkilu (np. 1-chlorobutan) wiązanie węgiel-chlorowiec jest więc spolaryzowane, gęstość elektronowa w pobliżu atomu węgla połączonego z atomem chloru jest mniejsza w porównaniu z gęstością w pobliżu atomu chloru.
W reakcji chlorowcoalkanu np. z jonem cyjankowym CN- ma miejsce atak tego anionu na atom węgla obdarzony cząstkowym ładunkiem dodatnim związanym z atomem chlorowca. Niekorzystne (odpychające) oddziaływanie karboanionu z chlorowcem niosącym cząstkowy ładunek ujemny jest najmniejsze, a więc jego zbliżenie do atomu węgla związanego z chlorowcem jest najbardziej korzystne energetycznie, gdy następuje od strony przeciwnej w stosunku do atomu chlorowca. Prowadzi to do stanu przejściowego o geometrii liniowej, w którym anion cyjankowy jest częściowo związany z atomem węgla, podczas gdy wiązanie węgiel-chlorowiec nie uległo jeszcze całkowitemu rozerwaniu. Pamiętaj, że stan przejściowy to nie to samo co związek pośredni! Stan przejściowy to struktura, która wykazuje maksimum energii przy przejściu od substratów do produktów. Nie można go wyodrębnić (wydzielić). Występują w nim częściowo utworzone wiązania lub takie, które niecałkowicie uległy rozpadowi. W stanie przejściowym omawianej reakcji synchronicznie tworzy się nowe wiązanie węgiel-anion cyjankowy i rozrywa stare wiązanie węgiel-chlorowiec.
Ten sposób przebiegu reakcji nosi nazwę podstawienia nukleofilowego dwucząsteczkowego SN2.
W podobny sposób można przy dzisiejszym stanie wiedzy wytłumaczyć przebieg większości reakcji organicznych. Mam nadzieję, że dostrzegasz w tym pewną logikę. Mimo, że do dziś chemia organiczna jest w głównej mierze nauką eksperymentalną, często potrafimy przewidzieć przebieg nieznanej reakcji, natomiast niemal zawsze potrafimy objaśni przebieg reakcji znając jej wynik.
To, co cię może jeszcze zniechęcić, to skomplikowane nazwy. Obejrzyj drugą część wykładu. Nie martw się, w miarę postępującego procesu starzenia, przyswoisz znaczną liczbę nazw zwyczajowych. One z reguły wystarczają chemikom do porozumiewania się.
Mam nadzieję, że ten krótki wykład nie odstraszył was od studiowania w przyszłości chemii w ogólności, a chemii organicznej w szczególności. Jedynie słuszna odpowiedź na tytułowe pytanie „Czy można polubić chemię organiczną?” brzmi: nie tylko można, ale trzeba. Zainteresowanych odsyłam (na początek) do dwóch świetnych podręczników autorstwa Przemysława Mastalerza: „Elementarna chemia organiczna”, Wydawnictwo Chemiczne, Wrocław 1998 oraz „Chemia organiczna”, to samo wydawnictwo, 2000.
Podręcznik dla nauczyciela
Projekt współfinansowany z Europejskiego Funduszu Społecznego w ramach Programu Operacyjnego Kapitał Ludzki
7
Projekt współfinansowany z Europejskiego Funduszu Społecznego w ramach Programu Operacyjnego Kapitał Ludzki
Wyszukiwarka