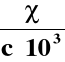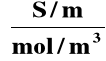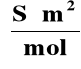ELEKTROLIZA
Przepływ elektronów : od katody (-) do anody (+)
Proste reakcje elektrodowe :
katoda (-) : redukcja kationów metal (K)
anoda (+) : utlenianie anionów gaz (Cl2)
Np. elektroliza CuCl2 :
katoda (-) : Cu2+ + 2 e- = Cu
anoda (+) : 2Cl- - 2 e- = Cl2
Złożone reakcje elektrodowe
Katoda (-) : 2 H2O + 2 e- = 2 OH- + H2
Anoda (+) : 2 OH- = H2O + ½ O2 + 2 e-
PRAWA FARADAY'A
I prawo : masa substancji wydzielona na odpowiedniej
elektrodzie jest proporcjonalna do ładunku, jaki
przepłynął przez elektrolit
m = k · q
lub m = k · i · t
m - masa substancji wydzielona na elektrodzie
i - natężenie prądu
q - ładunek, który przepłynął przez elektrolit
k - równoważnik elektrochemiczny ( równy liczbowo
ilości substancji wydzielonej przez nabój 1 kulomba
czyli przez prąd o natężeniu 1 A w czasie 1 sekundy)
II prawo : Jednakowe ładunki elektryczne wydzielają
z różnych elektrolitów masy substancji, które
są proporcjonalne do ich
równowazników chemicznych
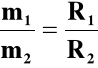
gdzie R - równoważnik chemiczny (mol/wartościowość jonu)
ponieważ m1 = k1· i · t i m2 = k2 · i · t
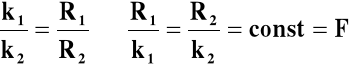
(stała Faraday'a)
nabój potrzebny do wydzielenia z roztworu
1 gramorównoważnika dowolnej substancji
Połączenie I i II prawa Faradaya :
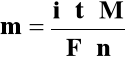
M - masa molowa elektrolizowanego związku
n - liczba elektronów biorących udział w procesie
utl/red jednej cząsteczki
Ogólne prawidłowości procesu elektrolizy
na anodzie zachodzi zawsze proces utleniania (oddawanie elektronów przez jony) a na katodzie redukcja (pobieranie elektronów przez jony)
jony metali szlachetnych (leżące powyżej wodoru w szeregu napięciowym) wydzielają się na katodzie w postaci metalicznej
w przypadku metali nieszlachetnych, (leżących poniżej wodoru w szeregu napięciowym) na katodzie wydziela się wodór
gdy aniony są resztami kwasów tlenowych lub grupami OH- zasadn na anodzie często wydziela się tlen
jeżeli anoda jest z metalu szlachetnego a aniony sa halogenami, na tej elektrodzie zachodzi wydzielanie gazowego chlorowca
ZASTOSOWANIE ELEKTROLIZY :
otrzymywanie związków będących produktami reakcji
elektrolitycznych np. gazów (wodór ,chlor), metali (np.![]()
miedź), kwasów, zasad
analiza ilościowa, np. wydzielenie składnika na jednej
z elektrod (np. metalu czy jego tlenku) i pomiar jej masy przed i po elektrolizie, pomiar objętości wydzielonego w trakcie procesu gazu, pomiar ładunku który przepłynął w trakcie elektrolizy (kulometria)
pomiar ruchliwości jonów
pomiar liczb przenoszenia jonów
RUCHLIWOŚĆ JONÓW ( u± )
Przepływ prądu przez elektrolit polega na równoczesnym ruchu
kationów i anionów w kierunku odpowiednich elektrod (katody
lub anody)
Szybkość poruszania się jonów jest wypadkową działających na nie
sił na które składają się :
natężenie pola elektrycznego ( E )
ładunek jonu ( q )
(im większe ich wartości tym większa szybkość jonu)
oraz opór środowiska (hamujący wpływ na szybkość jonu) zależny od
rodzaju i stężenia elektrolitu
wielkości jonu
lepkości roztworu
Z powodu wpływu wymienionych czynników szybkość poruszania się
jonów nie jest wielkością charakterystyczną dla danego jonu.
Szukając takiej wielkości wykorzystano wprost proporcjonalną zależność
pomiędzy tą szybkością jonu ( v ) a natężeniem pola elektrycznego ( E )
v = u · E
w której współczynnik proporcjonalności u stanowi t.zw. ruchliwość jonu
stąd u± = ![]()
Ruchliwość jonów prędkość ich poruszania się w polu
elektrycznym o natężeniu 1Volt/m
v - prędkość poruszania się jonów [ m/sek ] v = ![]()
E - natężenie pola elektrycznego [ Volt/m ] E = ![]()
![]()
u± = ![]()
lub (ponieważ ![]()
= v) u± = ![]()
[ m/sek · m/Volt] = [ m2/Volt · sek ]
Pomiar ruchliwości jonów z wykorzystaniem elektroforezy swobodnej
Jon Ruchliwość [m2/V · s] ·108
H+ 36.30
K+
7.61
Na+ 5.19
Li+ 4.01
OH- 20.50
SO42- 8.27
NO3- 7.40
HCO3- 4.61
Oblicz ruchliwość jonu Cr04 2- jeżeli porusza się on
z szybkością 2 · 10-5 m/s, odległość pomiędzy
elektrodami wynosi 20 cm, a przyłożone napięcie
było równe 150 V.
uCrO4 2- = 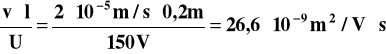
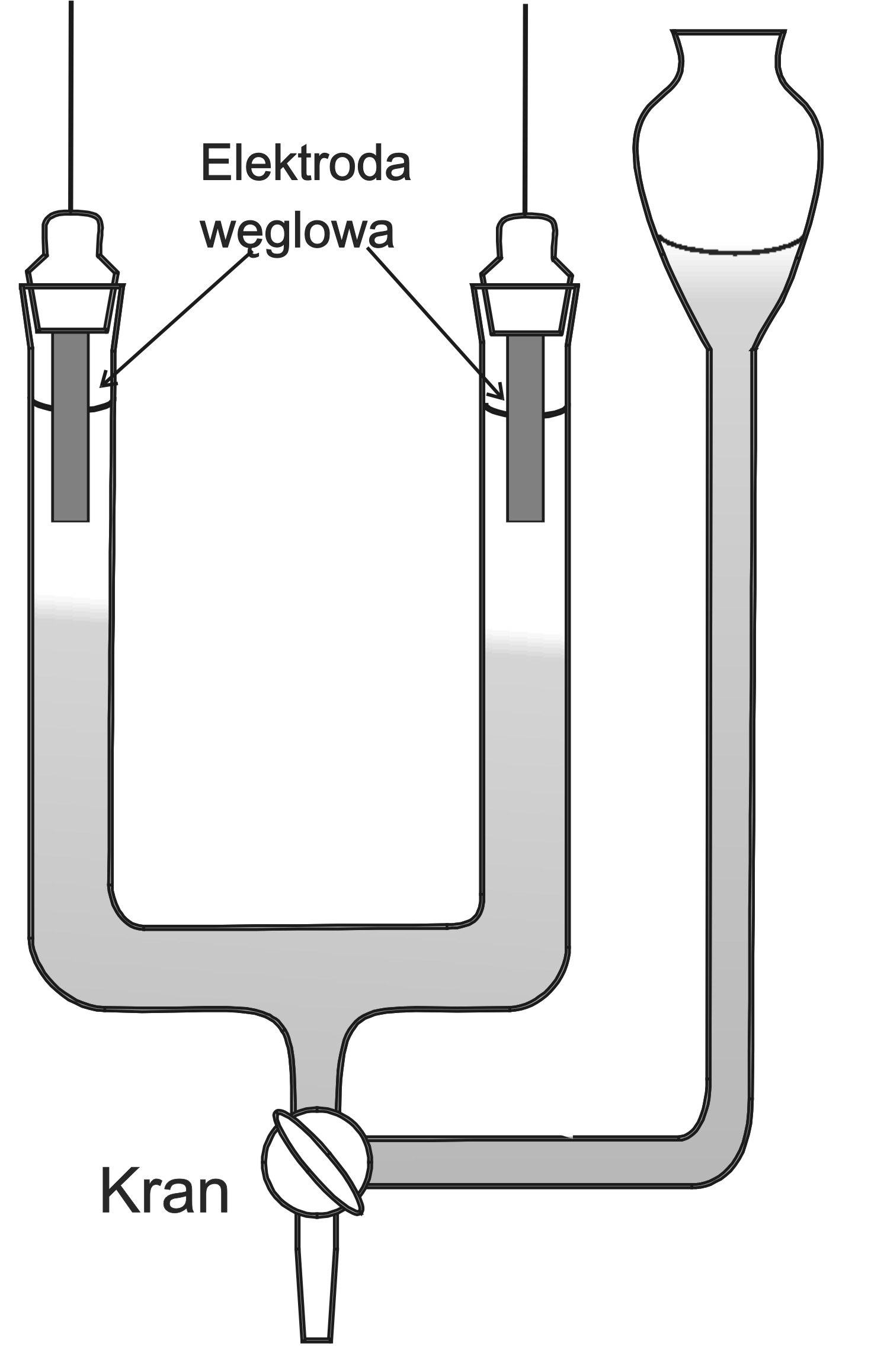
Oblicz liczby przenoszenia dla jonów Ag+ i NO3-, jeżeli
ubytek srebra w przestrzeni anodowej był równy
0,2777 g, a w katodowej 0,3105 g.
anoda katoda
1 mol = 108 g Ag+ 1 mol = 108 g Ag+
x moli = 0,2777g Ag+ x moli = 0,3105 g Ag+
x = 0,00257 mola x = 0,00287 mola
![]()
t NO3- = 1 - 0,472 = 0,528 LICZBY PRZENOSZENIA
Stosunek ładunku przeniesionego przez rozważany jon do całkowitego ładunku przeniesionego przez roztwór elektrolitu podczas elektrolizy.
Schemat przyrządu do pomiaru liczb przenoszenia
t(+) = 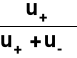
oraz t (-) = 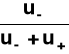
t+ + t - = 1
Ponieważ stosunek zmian stężenia jonów w przestrzeni katodowej
i anodowej(procesy redukcji i utleniania) jest równy stosunkowi
ruchliwości tych jonów :
t+ = zmiana stężenia kationów przy anodzie / całkowita zmiana
stężenia kationów ( przy anodzie i przy katodzie)
t- = zmiana stężenia anionów przy katodzie/ całkowita zmiana
stężenia anionów (przy anodzie i przy katodzie)
Liczba przenoszenia charakteryzuje elektrolit jako całość
(w różnych elektrolitach te same jony mogą mieć różną ruchliwość)
PRZEWODNICTWO ELEKTRYCZNE
W ROZTWORACH ELEKTROLITÓW
W roztworach elektrolitów kationy i aniony znajdują się
w ciągłym, chaotycznym ruchu, który ulega uporządko-
waniu pod wpływem pola elektrycznego. W tych warunkach kationy przemieszczają się w kierunku ujemnego, a aniony
w kierunku dodatniego potencjału.
Dochodzi w ten sposób do przepływu prądu elektrycznego,
który jest sumą prądów cząstkowych przenoszonych
przez wszystkie jony (kationy i aniony).
Przewodnictwo elektrolitów opisuje prawo Ohma :
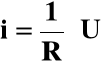
ponieważ 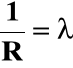
i = λ · U |
i - natężenie prądu
R - opór
U - różnica potencjałów elektrod
λ - przewodnictwo [Simens : 1 S = 1 om-1]
PRZEWODNICTWO WŁAŚCIWE
R = ρ ![]()
![]()
ponieważ ![]()
= λ ![]()
![]()
= ![]()
λ = |
χ - przewodnictwo właściwe [S/m]
WYZNACZANIE PRZEWODNICTWA WŁAŚCIWEGO
λ = χ · ![]()
![]()
χ = λ · ![]()
![]()
= k - pojemność oporowa naczynka
wyznaczanie : pomiar przewodnictwa roztworu elektrolitu
o znanym przewodnictwie właściwym
k = ![]()
znajomość pojemności oporowej naczynka umożliwia oblicze-
nie przewodnictwa właściwego dowolnego elektrolitu :
χ = k · λ |
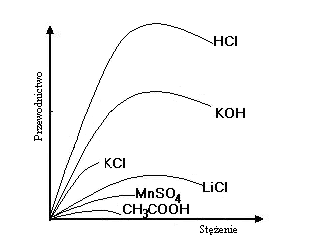
Wpływ stężenia słabych i mocnych
elektrolitów na ich przewodnictwo
właściwe
PRZEWODNICTWO RÓWNOWAŻNIKOWE (MOLOWE) (Λ)
Λ = |
Przewodnictwo równoważnikowe - przewodnictwo roztworu elektrolitu znajdującego się między dwoma elektrodami
odległymi o 1 metr i zawierającego w danej objętości
1 gramorównoważnik (mol) jonów
WPŁYW STĘŻENIA ELEKTROLITU NA PRZEWODNICTWO RÓWNOWAŻNIKOWE
Przewodnictwo
mocne elektrolity :
Λ0 np. KCl
Λ = Λ0 - a![]()
![]()
Λ0 - graniczne przewodnictwo równoważnikowe, czyli
przewodnictwo elektrolitu przy jego nieskończenie dużym
rozcieńczeniu (nieskończenie małym stężeniu)
W przypadku mocnych elektrolitów można je wyznaczyć
przez ekstrapolację linii prostej do osi rzędnych
b. słabe elektrolity
Λ
np. CH3COOH
![]()
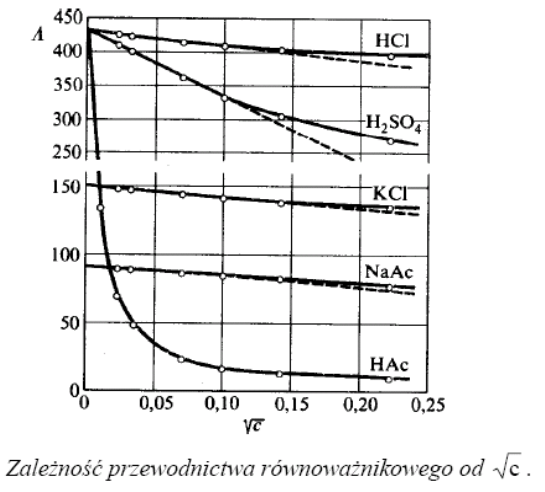
Wyznaczanie Λ0 dla słabych elektrolitów
1. prawo niezależnej wędrówki jonów (prawo Kolrauscha)
Λ0 = l (kationu) + l (anionu)
gdzie l (kat) i l (an) - graniczne przewodnictwa jonów
ze wzoru uwzględniającego ruchliwość anionów i kationów :
Λ0 = F(u+ + u-)
3. metodą graficzną
ZASTOSOWANIE POMIARÓW PRZEWODNICTWA
Miareczkowanie konduktometryczne
2. Badanie rozpuszczalności trudno rozpuszczalnego
elektrolitu
3. Badanie czystości wody
4. Badanie typu emulsji
Wyznaczanie stopnia i stałej dysocjacji słabego
elektrolitu
3. Wyznaczanie stopnia dysocjacji słabego elektrolitu :
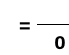
4. Wyznaczanie stałej dysocjacji słabych elektrolitów :
a. metoda obliczeniowa
ponieważ 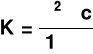
a 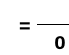
stąd 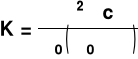
b. metoda graficzna ( po przekształceniu równania na K w postać liniową )
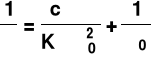
lub 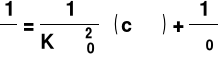
y = a · x + b y = a · x + b
1/Λ
Punkt przecięcia linii prostej z osią
rzędnych wyznacza wartość 1/ Λ0
1/Λ0
c · Λ
5. Badanie czystości wody (np. w temp. 298 K najczystsza woda wykazuje przewodnictwo 5,8 · 10-6, a woda redestylowana : 1,0 · 10-4
6. Określanie typu emulsji (większe przewodnictwo wykazuje emulsja
typu o/w niż w/o
PRZYKŁAD RACHUNKOWY
Obliczyć stopień i stałą dysocjacji 0,001 M roztworu CH3COOH.
Wyznaczamy pojemność oporową naczyńka wykorzystywanego do
pomiarów przewodnictwa stosując 0,02 M roztwór KCl, dla które-
go χ = 0,2765 S/m, a zmierzone λ = 3,42 · 10-3 S.
χ = k · λ ![]()
k = χ / λ
k = 80,85 1/m
Mierzymy konduktometrem przewodnictwo (λ) dla badanego
0,001 M CH3COOH
λ = 56 · 10-6 S
i obliczamy jego przewodnictwo właściwe :
χ = k · λ = 80,85 1/m · 56 · 10-6 S = 4,527 · 10-3 S/m
Obliczamy następnie przewodnictwo równoważnikowe tego
roztworu :
Λ = 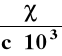
= 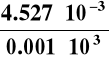
= 4,527 · 10-3 Sm2/mol
4. Wyznaczamy metodą graficzną lub obliczamy z odpowiedniego
równania wartość Λ0 dla badanego roztworu :
Λ0 = 390,72 · 10-4 Sm2/mol
Obliczamy stopień dysocjacji elektrolitu :
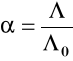
= 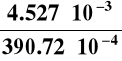
= 0,116
Oraz stałą dysocjacji kwasu octowego :
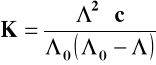
= 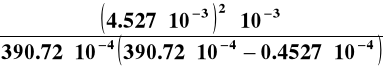
=
= 1,339 · 10-5
pKa = -lg 1,339 · 10-5 = 4,87
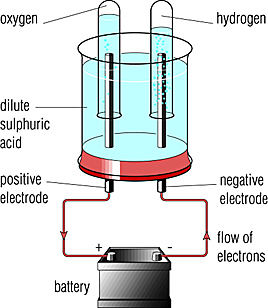
Źródło prądu stałego
ANODA (+)
KATODA (-)
Kierunek przepływu
elektronów
Źródło prądu
wodór
Rozcieńczony
roztwór
NaOH
katoda
tlen
anoda
KNO3
KMnO4
A (+) K (-)
Zależność przewodnictwa równoważnikowego od
stężenia elektrolitu
Wyszukiwarka