ZESTAW I
1. Krzywe l-b;
Wykres Lineweavera-Burka to graficzna wizualizacja będąca przekształceniem do postaci liniowej równania Michealisa-Mentena opisującego kinetykę enzymów.
Wykres Lineweavera-Burka stanowi narzędzie metody graficznej pozwalającej szybko określić maksymalną szybkość reakcji enzymatycznej oraz stałą Michaelisa. Pozwala też określić warunki inhibicji enzymowej kompetycyjnej oraz akompetycyjnej.
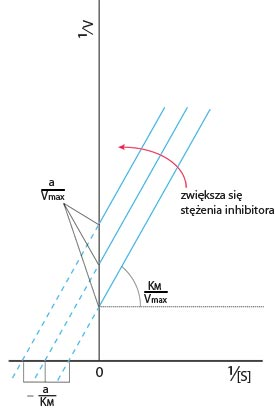
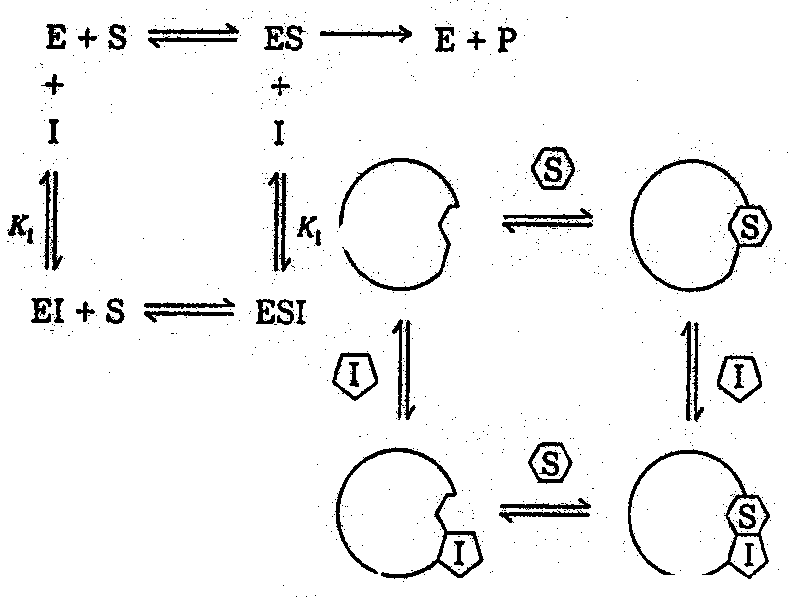
W przypadku inhibicji niekompetycyjnej, czyli niekonkurencyjnej, inhibitor nie wiąże się z wolnym enzymem, lecz z kompleksem ES (enzym-substrat). Efekt inhibitora nie jest w takim przypadku niwelowany wzrostem stężenia substratu, a ponieważ następuje zwiększanie stężenia ES obserwuje się przesunięcie reakcji w stronę nieaktywnego kompleksu ESI (enzym-substrat-inhibitor). Dzięki analizie metodą stanu stacjonarnego można stwierdzić, że wartości Vmax i KM zmieniają się o ten sam czynnik. W efekcie czego linie na wykresie Lineweavera-Burka dla różnych stężeń inhibitora są równoległe
W Inhibicji kompetycyjnej, inaczej konkurencyjnej, inhibitor wiąże się (odwracalnie) z tymi samymi centrami aktywnymi enzymu co substrat. Substrat i inhibitor współzawodniczą o miejsce katalityczne, przez co zwiększenie stężenia substratu lub inhibitora, powoduje przesunięcie szybkości reakcji na stronę jednego z nich.
2. Co to jest Km i 1Km;
Stała Michaelisa (Km) - jest to takie stężenie substratu, przy którym szybkość reakcji enzymatycznej jest równa połowie szybkości maksymalnej (Vmax) tej reakcji. Stała ta jest wyrażana w molach na dm3 i określa powinowactwo enzymu do substratu: im jest mniejsza, tym powinowactwo jest większe, natomiast duża wartość tej stałej mówi o małym powinowactwie enzymu do substratu.
Wartość stałej Km dla większości enzymów przyjmuje wartości z zakresu 10-3 do 10-5 mol/dm3 (odpowiada stężeniu substratu, przy którym połowa enzymu jest w postaci kompleksu ES (enzym-substrat)).
Równanie Michaelisa-Menten opisuje zależność szybkości reakcji od stężenia substratu:
Prawdziwość powyższego równania opiera się na przedstawionym poniżej schemacie reakcji na dwóch kluczowych założeniach: całkowite stężenie enzymu i stężenie produktu pośredniego nie zmieniają się w czasie. Najbardziej odpowiednim równaniem Michaelisa-Menten jest równanie opisane przez Briggsa i J. B. S. Haldane, które przedstawiono poniżej (należy zauważyć, że eksperymentalny parametr kcat również jest używany, ale w tym przypadku jest równy parametrowi kinetycznemu k2):
![]()
Założono, że reakcja enzymatyczna jest nieodwracalna, a produkt nie kompleksuje się z enzymem.
Pierwszym założeniem w tym wyprowadzeniu jest pseudo-stan równowagi chemicznej, założenie określające, że stężenie enzymu połączonego z substratem ([ES]) zmienia się wolniej niż stężenie produktu ([P]) i substratu ([S]). To umożliwia nam ustalenie stopnia zmian [ES] jako zero
3. Co to jest szybkość początkowa i od czego zależny;
Wyrażenie wiążące szybkość katalizy ze stężeniem substratu i enzymu oraz z szybkościami poszczególnych etapów reakcji nazywamy równaniem Michaelisa-Menten:
gdzie:
V0 - szybkość początkowa,
S - stężenie substratu,
Km - stała Michaelisa-Menten.
Szybkość reakcji enzymatycznych wzrasta wraz ze wzrostem temperatury. Wiąże się to z podwyższeniem energii kinetycznej systemu (cząstek) i większą częstotliwością ich zderzeń w roztworze.Wpływ temperatury na aktywność enzymów nie jest prostą zależnością. Aktywność rośnie wraz ze wzrostem temperatury, jednakże tylko w takim zakresie temperatury, w którym enzym pozostaje stabilny. Po przekroczeniu temperatury krytycznej, postępuje denaturacja termiczna enzymów i aktywność gwałtownie spada.
Większość enzymów ma także swoje optymalne pH działania. Optimum pH, obok optimum temperaturowego, to drugi najważniejszy parametr środowiska charakteryzujący aktywność enzymów. Wykres zależności aktywności enzymu od pH ma najczęściej kształt dzwonowaty, czyli enzym ma największą aktywność w swoim optymalnym pH i aktywność ta spada wraz z oddalaniem się od tego punktu (np. trypsyna).
4. Budowa centrum aktywnego z jakich aminokwasów i dlaczego;
Gr. funkcyjne enzymu znajdujące się w określonym układzie przestrzennym wzajemnie ze sobą współdziałające w połączeniu substratu nazywamy centrum aktywnym enzymu. Grupy te najczęściej pochodzą od aminokwasów znacznie od siebie oddalonych w łańcuchu polipeptydowym, lecz dzięki odpowiedniemu przestawnemu ułożeniu łańcucha są do siebie zbliżone te aminokwasy, które delegują swoje gr. funkcyjne do centrum aktywnego. Te aminokwasy nazywamy kontaktowymi. Wśród nich najważniejsze to: cysteina, seryna, kw. glutaminowy, lizyna, histydyna, arginina. Centrum aktywne enzymu zajmuje stosunkowo niewielką objętość, tj. miej niż 1% objętości całego enzymu i znajduje się w zagłębieniu cząsteczki w miejscu niedostępnym dla cząsteczek wody. Pomimo, że centrum aktywne tworzą gr. polarnych to samo zagłębienie ma charakter apolarny tworzone przez takie aminokwasy jak walina, leucyna i izoleucyna.
5. Czas połowicznego rozpadu;
Czas połowicznego rozpadu (zaniku) (okres połowicznego rozpadu) jest to czas, w ciągu którego liczba nietrwałych obiektów lub stanów zmniejsza się o połowę. Czas ten, oznaczany symbolem T1/2, zgodnie z definicją musi spełniać zależność:
gdzie
N(t) - liczba obiektów pozostałych po czasie t,
N0 - początkowa liczba obiektów.
Pierwotnie czas ten dotyczył nietrwałych jąder atomowych pierwiastków (promieniotwórczych). W tym przypadku po czasie połowicznego rozpadu aktywność promieniotwórcza próbki zmniejsza się również o połowę. Okres połowicznego rozpadu dotyczy również nietrwałych cząstek. Może być wyznaczony z wykładniczego charakteru rozpadu, który w przypadku izotopów promieniotwórczych nosi nazwę prawa rozpadu naturalnego.
6. Jaka jest szybkość reakcji gdy po 6 min stężenie substratu zmalało z 0,5 do 0,18M?
ZESTAW II
Metaloenzymy - czym są i co robią jony metali w katalizie;
Metaloenzymy to enzymy należące do metaloprotein o specyficznych funkcjach katalitycznych. W ich katalitycznych centrach aktywnych znajdują się jonym metalu np. miedzi, cynku lub molibdenu, które koordynowane są przez ligandy lub grupy boczne aminokwasów. Najczęstszymi ligandami są: grupa tiolowa cysteiny, imidazolowa histydyny, grupy karboksylowe kwasów glutaminowego i asparaginowego oraz grupa fenolowa tyrozyny.Miedź (Cu) występuje w kilkunastu poznanych metaloenzymach. Najlepiej zbadane to: dysmutaza ponadtlenkowa (niezbędna do dekompozycji wolnych rodników), oksydaza cytochromowa, hydroksylaza dopaminy (niezbędna do syntezy noradrenaliny), urykaza, oksydaza lizylowa (niezbędna do tworzenia wiązań krzyżowych w kolagenie i elastynie), dioksygenaza tryptofanowa, tyrozynaza (synteza melaniny), oksydaza tiolowa (utrzymanie struktury keratyny), lecytynaza, katalaza i inne oksydazy mono- i dwuaminowe.Molibden (Mo) jest składnikiem co najmniej trzech enzymów: aldehydooksydazy, ksantynooksydazy i oksydazy tiolowej.Cynk (Zn) jest składnikiem kilkudziesięciu enzymów, w tym np. dehydrogenazy alkoholowej.metale sa najczęściej czynnikami układu aktywującego, tzn bialko enzymatyczne jest niezdolne do aktywacji substratu ,jezelo brakuje odpowiedniego jonu metalu. Aktywatorami nazywamy związki niskocząsteczkowe, których obecność w miejscu katalizy enzymatycznej przyspiesza przebieg reakcji. Aktywatorami enzymów mogą być jony metali (np. Mn2+, Mg2+, Zn2+, Ca2+, rzadziej Co2+, Cu2+, Ni2+), czy aniony współdziałające z białkami (np. Cl-). Jon metalu może być zlokalizowany w katalitycznym centrum enzymu (bierze wówczas bezpośredni udział w reakcji) lub też w innym fragmencie molekuły (stabilizuje wtedy jej aktywną konformację). Niespecyficznymi inhibitorami enzymów są jony metali ciężkich (Cu, Pb, Hg, Ag). Wiążą się one łatwo i w sposób nieodwracalny ze wszystkimi białkami, powodując rozległe zmiany ich konformacji, prowadzące do denaturacji, której często towarzyszy wypadanie białka w postaci osadu. Szczególnie podatne na wiązanie jonów metali ciężkich są grupy sulfhydrylowe (-SH); metal może się również wbudować w mostek disiarczkowy.
Cechy sprawnie działającego katalizatora
Tak jak wszystkie katalizatory enzymy nie zmieniają stanu równowagi reakcji chemicznej, a jedynie przyspieszają jego ustalenie. Zazwyczaj w obecności enzymu reakcja zachodzi w kierunku takim samym, w jakim by zachodziła spontanicznie, jedynie wzrasta jej szybkość. Jednak nieobecność enzymu oznacza, że najbardziej wydajnie (najszybciej) będzie zachodzić reakcja najbardziej faworyzowana energetycznie (o najniższej energii S*) i nie zawsze oznacza to, że z grupy możliwych reakcji jest to ta sama, która byłaby katalizowana przez enzym. Enzym może uczynić reakcję bardziej faworyzowaną, która w normalnych warunkach nie byłaby energetycznie optymalna.
Jest to termodynamicznie możliwe, gdyż enzymy sprzęgają reakcje niekoniecznie wydajne energetycznie (takie, które spontanicznie zachodziłyby niezwykle wolno) z reakcjami wybitnie energetycznie korzystnymi, tak że taka para reakcji, w sumie, jest energetycznie faworyzowana i korzystna. Przykładem może być sprzężenie reakcji hydrolizy ATP z innymi licznymi reakcjami chemicznymi, wymagającymi do zajścia dużej ilości energii..
Enzymy zwiększają szybkość reakcji zachodzącej w obu kierunkach. Na przykład, anhydraza węglanowa katalizuje swoją reakcję dwukierunkowo w zależności od stosunku stężenia substratów i produktów.
3. Izoenzymy - opisać gdzie występują i ich znaczenie
Izoenzymy (izozymy) - homologiczne enzymy w obrębie danego organizmu, które katalizują tę samą reakcję, ale różnią się nieznacznie strukturą, wartościami Km i Vmax oraz właściwościami regulacyjnymi. Izoenzymy ulegają ekspresji w różnych tkankach lub organellach w różnych stadiach rozwojowych. Są kodowane przez geny zajmujące różne loci, które zwykle powstają w wyniku duplikacji genu i dywergencji. Izoenzymy można często odróżnić od siebie na podstawie właściwości biochemicznych, takich jak ruchliwość elektroforetyczna.Przykładem izoenzymu może być dehydrogenaza mleczanowa (LDH), enzym uczestniczący w beztlenowym metabolizmie glukozy i syntezie glukozy. W organizmie człowieka istnieją dwa izozymowe łańcuchy polipeptydowe tego enzymu: izozym H, ulegający silnej ekspresji w sercu i izozym M, występujący w mięśniach. Ich sekwencja aminokwasowa jest identyczna w 75%. Funkcjonalny enzym jest tetramerem i zawiera różne kombinacje wspomnianych podjednostek. Izozym H4, występujący w sercu wykazuje mniejsze powinowactwo względem substratu niż izozym M4. Te dwa izozymy różni również cecha, iż duże stężenie pirogronianu allosterycznie hamuje izozym H4, ale nie izozym M4. Inne połączenie takie jak H3M, mają właściwości pośrednie, zależne od proporcji między dwoma typami łańcuchów.
4. Schemat powstawania ES u Fishera
Model "klucza i zamka" (ang. "Lock and key" model)
W większości przypadków enzymy są niezwykle specyficzne wobec swoich substratów. Jak sugerował w roku 1894 Hermann Emil Fischer, zarówno enzym jak i jego substraty są do siebie geometrycznie dopasowane w taki sposób, że idealnie pasują jeden do drugiego (jak "klucz i zamek")[35]. Model ten wyjaśnia specyficzność enzymów, ale nie wyjaśnia w jaki sposób stabilizowany jest stan przejściowy podczas reakcji enzymatycznej. Enzymy łączą się poprzez centrum aktywne z substratem na zasadzie przestrzennego dopasowania, tworząc kompleks enzym - substrat (ES) Przestrzenne dopasowanie substratu do centrum aktywnego enzymu porównano: wg Fishera, jak klucz do zamka. Model ten oznacza, że następuje precyzyjne dopasowanie substratu do centrum aktywnego co jednak nie obniża energii aktywnej. Model indukcyjnego dopasowania, porównany jak ręka do rękawiczki wg Koshalda zakłada, że w rzeczywistości konformacja substratu i centrum aktywnego nie są identyczne. W momencie powstania kompleksu enzym-substrat następuje wciągnięcie substratu do centrum aktywnego przy naprężeniu wiązań w obu składnikach kompleksu E-S. W tej sytuacji już mała porcja energii wystarcza do pokonania progu energetycznego reakcji
5. Energia aktywacji i jak wplywa na szybkość reakcji
Zmiany energii w czasie reakcji. By przeprowadzić substraty (S) w stan przejściowy (S*) potrzeba dużej energii do pokonania progu aktywacji. Składniki reakcji w stanie przejściowym są konwertowane następnie w produkty końcowe (P). Enzym obniża energię aktywacji reakcji poprzez utworzenie alternatywnej ścieżki reakcji ze stanem pośrednim (ES*) o mniejszej energii oraz stabilizują go poprzez jego specyficzne wiązanie. Zmniejszenie energii aktywacji zwiększa szybkość reakcji.
6. Przedstawić kinetykę zależności inhibitora współzawodniczącego z substratem
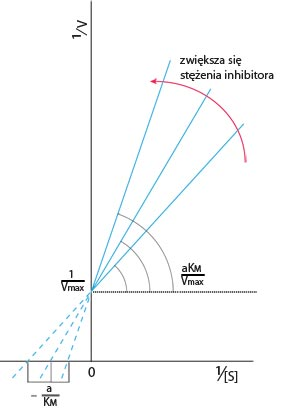
Inhibicja kompetycyjna: polega na współzawodnictwie pomiędzy substratem i inhibitorem o centrum aktywne enzymu. Zawsze substrat i inhibitor przyłączane są do centrum aktywnego. Inhibitor musi być strukturalnie podobny do substratu. Stopień zahamowania reakcji zależy od stosunku stężenia inhibitora do stężenia substratu. Inhibicję tę można cofnąć zwiększając stężenie substratu. Najprostszym przykładem inhibicji kompetycyjnej jest działanie kwasu malonowego HOOC-CH2-COOH, który hamuje reakcję katalizowaną przez dehydrogenazę bursztynową.
v1= Vmax /1+Km(1+[I]/Ki)/[S]
Zestaw III
1. Co to jest centrum aktywne, jakie aminokwasy je budują i dlaczego;
Centrum aktywne to ściśle określony fragment enzymu, z którym łączy się substrat w czasie reakcji, uczestniczy ono w procesie aktywacji substratu i w akcie katalizy. Centrum aktywne ma silne powinowactwo do określonego substratu. Częstymi aminokwasami centrum aktywnego są aminokwasy zasadowe oraz kwasowe. Aminokwasy z niepolarnym (hydrofobowym) łańcuchem bocznym bardzo rzadko wchodzą w skład centrum aktywnego, ponieważ taki łańcuch boczny wchodzi w niewiele reakcji. Aminokwasy wchodzące w skład centrum aktywnego są zazwyczaj ewolucyjnie bardziej stabilne niż aminokwasy na innych pozycjach, ponieważ zmiana aminokwasu w tej pozycji mogłaby uniemożliwić enzymowi katalizowanie dotychczasowej reakcji. W wielu enzymach niektóre z aminokwasów centrum aktywnego są identyczne nawet u bardzo słabo spokrewnionych organizmów.
Centrum aktywne charakteryzuje się następującymi własnościami:
a/ obejmuje niewielką część całkowitej objętości enzymu
b/ jest trójwymiarową strukturą, którą często tworzą bardzo odległe sekwencyjnie aminokwasy (np. chymotrypsyna)
c/ stanowi zagłębienie w strukturze enzymu (niszę, szczelinę, kieszeń) dzięki czemu otoczenie wiązanego substratu ma charakter hydrofobowy i jest mniej lub bardziej izolowane od wody
d/ substrat wiązany jest poprzez wiele oddziaływań nie kowalencyjnych jak
hydrofobowe, jonowe, wodorowe czy van der Waalsa a swoistość wiązania substratu
uzależniona jest w efekcie od precyzyjnego ułożenia i dopasowania wielu atomów centrum aktywnego i substratu
e/ w jego skład wchodzą:
- aminokwasy odpowiedzialne za związanie substratu, określające tym samym swoistość substratową (1-szy etap procesu katalizy) oraz
-aminokwasy uczestniczące w katalizie, tzw. centra katalityczne określające swoistość reakcji (2-gi etap procesu katalizy)
2. Wpływ pH;
Enzymy działają tylko w ściśle określonym pH. Optimum działania pH jest charakterystyczne dla danego enzymu. Jego występowanie można wyjaśnić tym, że enzymy, jak i inne białka mają ładunek elektryczny i dlatego struktura ich zależy od pH środowiska (zmiana ładunku elektrycznego prowadzi do zmiany szybkości działania enzymu).
Np. pepsyna rozkłada białko przy optymalnej wartości pH równej 1,5 a hemoglobinę przy 2,2; amylaza ślinowa działa najlepiej w pH 7, podobnie jak trypsyna, chymotrypsyna, amylaza trzustkowa, lipaza, które działają przy pH zasadowym (od 7).
3. Model Fishera;
Model obrazujący wiązanie substratu przez enzym- model zamka i klucza - zakłada, że każdorazowo w reakcji chemicznej dany enzym "pasuje" do substratu niczym zamek do klucza i możliwe jest połączeni tylko odpowiedniego enzymu z jemu przynależnym substratem. Ich kształty są sztywne i pasują jedynie po odpowiednim dopasowaniu.
4. Wyjaśnić równanie Michaelisa, dla S=K, S>K, S<K;
Równanie Michaelisa-Menten opisuje zależność szybkości reakcji od stężenia substratu.
Gdy [S] < Km to szybkość reakcji jest znacznie mniejsza od kcat (większość miejsc aktywnych nie jest zajęta).
5. Co to jest rząd reakcji i scharakteryzować rząd 1 i O;
Rząd reakcji to suma wykładników potęgowych w równaniu kinetycznym. Jest wielkością empiryczną wyznaczaną na podstawie doświadczalnego równania kinetycznego.
Reakcja 1 rzędu: v = k * [S]1
W tej reakcji szybkość zależy od stężenia tylko jednego substratu zapisanego w pierwszej potędze.
Rząd zerowy
Oznacza, że na szybkość reakcji nie ma wpływu stężenie. Szybkość reakcji jest stała i równa stałej szybkości reakcji
v - k * [S]0 = k
Reakcja II rzędu v= k * [S]2
W tej reakcji szybkość zależy od iloczynu stężeniu dwóch substratów w potędze pierwszej lub od stężenia jednego substratu podniesionego do potęgi drugiej.
ZESTAW IV
1. Enzymy allosteryczne;
enzymy allosteryczne, enzymy złożone z wielu podjednostek, z których każda ma jedno lub więcej miejsc aktywnych, kontrolujące najczęściej pierwszą reakcję w szlakach lub cyklach biochemicznych, pełniące ważne funkcje w regulacji metabolizmu; dla e. a. zależność szybkości reakcji od stężenia substratu charakteryzuje sigmoidalny przebieg krzywej; e. a. są wrażliwe na małe zmiany stężenia substratu; e. a. są kontrolowane przez cząsteczki efektorów, aktywatory i inhibitory.
2. Hamowanie niekompetycyjne + przedstawienie graficzne;
Inhibicja niekompetycyjna, hamowanie niekompetycyjne (niewspółzawodnicze) - typ inhibicji odwracalnej enzymów.
Hamowanie niekompetycyjne zachodzi wtedy gdy inhibitor nie jest strukturalnie podobny do substratu i niewspółzawodniczy z nim o centrum aktywne enzymu, jak w hamowaniu kompetycyjnym, lecz inhibitor blokuje częściowo centrum aktywne hamując przebieg reakcji enzymatycznej, pomimo tego substrat może być wiązany. Przykładem może być działanie siarkowodoru na enzymy zawierające w centrum aktywnym atom metalu, np. żelaza lub miedzi. Zjawisko to jest podstawą silnej toksyczności siarkowodoru.
Inhibitory niekompetycyjne nieodwracalne nie wykazują strukturalnego podobieństwa do substratu, zwiększenie stężenia substratu na ogół nie zmniejsza hamowania (np. gazy bojowe paraliżujące).
Vmax (i) = Vmax/ (1 + [I] / Ki )
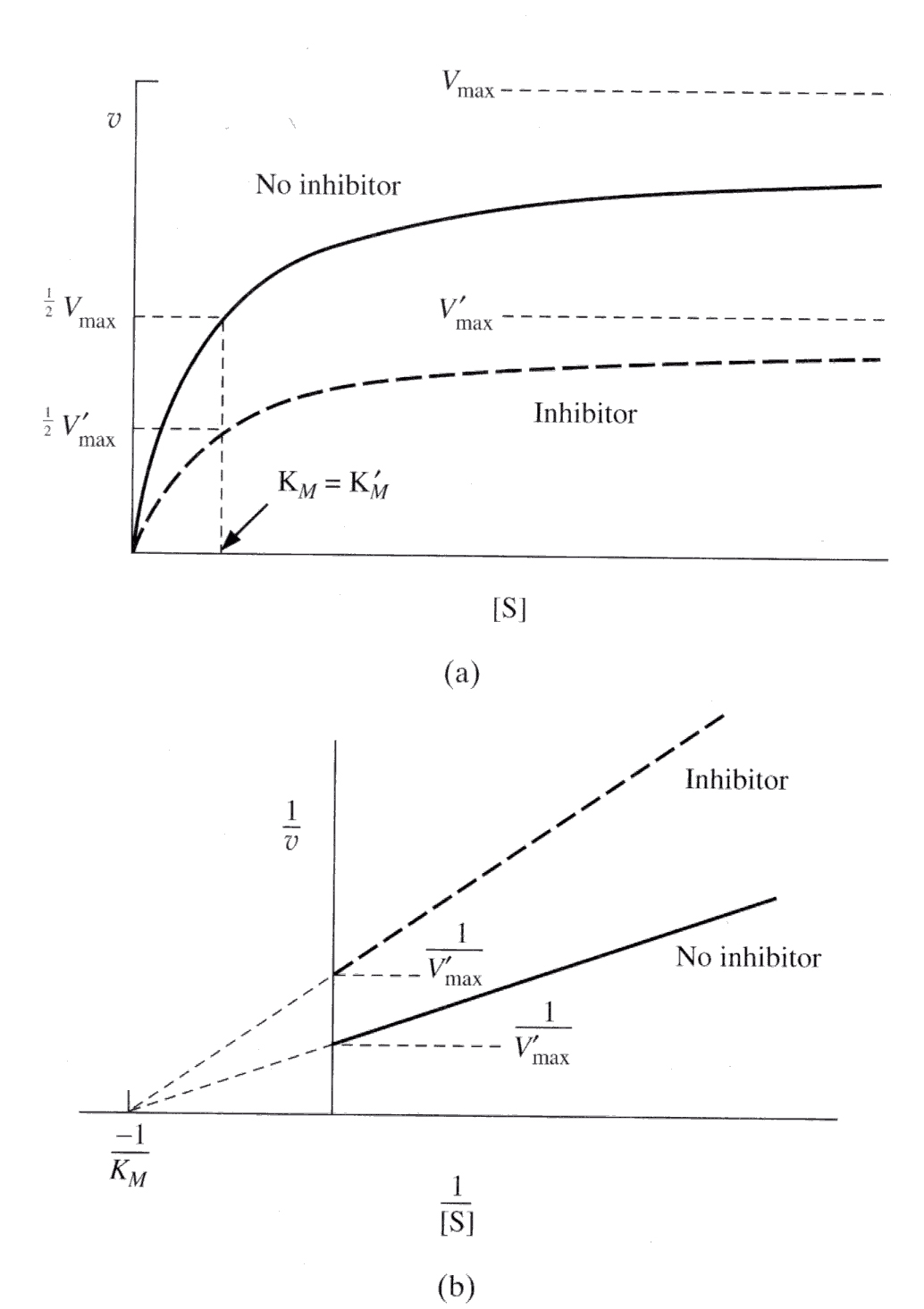
Vmax zmniejsza się
Km się nie zmienia
3. Przedstaw graficznie reakcję I i II rzędu- coś w tym stylu
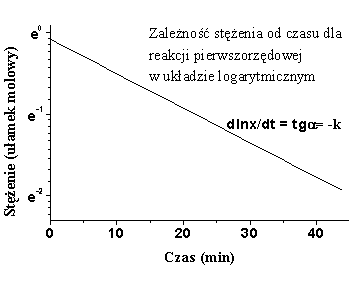
- d [S]
V = ----------- = k [S]
dt
gdzie:
[S] - stężenie substratu w danej chwili
t - czas reakcji
k - współczynnik zwany stałą szybkości reakcji
Równanie to nazywa się równaniem reakcji I rzędu.
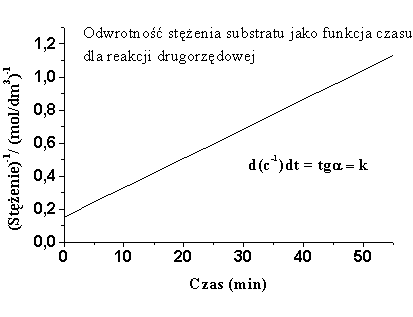
W przypadku gdy stężenie obydwu substratów zmienia się w wyniku reakcji (A + Bprodukty) równanie kinetyczne reakcji II rzędu przedstawia się następująco:
- d[SA] -d[SB]
V = ------------- = ------------ = k[SA] [SB]
dt dt
4. Wpływ stężenia enzymu na szybkość reakcji chemicznej;
Stężenie enzymu - w warunkach nadmiaru substratu szybkość reakcji enzymatycznej jest wprost proporcjonalna do stężenia enzymu i do czasu reakcji.
5. Specyficzność substratowa + przykład;
Właściwość enzymów, która polega na tym, że enzym łączy się tylko z konkretnym substratem, do którego dopasowuje się jego centrum aktywne. Enzymy często nie mają całkowitej specyficzności substratowej, tzn. mogą łączyć się z wieloma podobnymi substratami lub ichanalogami. Większość enzymów charakteryzuje się natomiast całkowitą specyficznością typu reakcji, tzn. przeprowadza tylko jeden, określony typ reakcji.
Do najważniejszych typów specyficzności substratowej zaliczamy:
1. Specyficzność absolutna - polega na tym, że enzym może przekształcić tylko jeden związek jako substrat np. ureaza lub mocznik jako substrat.
2. Specyficzność grupowa - enzym może katalizować przekształcanie kilku związków jako substraty. Związki te muszą charakteryzować się wspólną cechą np. fosfatazy przekształcają monoestry fosforanowe.
3. Specyficzność stechiometryczna
a) Specyficzność stosunku do szeregu L lub D np. syntetaza glutaminy wykorzystuje tylko L - glutaminian jako substrat.
b) Specyficzność do izomerii cis lub trans np. hydroliaza jabłczanowa przyłącza cząsteczkę wody tylko do fumaranu (trans)
c) Specyficzność do wiązania a lub b np. a-glikozydaza rozkłada tylko wiązania typu a. a-amylaza rozkłada wiązanie a-1,4-glikozydowe.
d) Specyficzność do miejsca ataku (miejsce wiązania rozkładanego) np. endopeptynaza cysteinowa rozkłada tylko wiązania peptydowe wewnątrz łańcucha (nigdy na skraju), aminopeptydaza leucynowa atakuje skrajne wiązania peptydowe od N-końca.
6. W jakim celu i jak obliczamy prędkość maksymalną?
Wysycanie enzymu substratem (zbliżanie się do szybkości maksymalnej) oznacza, że maleje liczba wolnych cząsteczek enzymu, gdyż rośnie ilość tych związanych w kompleksie z substratem (ES). Osiągana asymptotycznie maksymalna szybkość (Vmax) reakcji enzymatycznej, oznacza, że praktycznie wszystkie miejsca aktywne enzymu (wolne enzymy) zostają wysycone substratem, a wówczas suma ilości (stężenie) kompleksów ES jest miarą ilości samego enzymu. Niemniej jednak, Vmax jest tylko jedną stałą kinetyczną opisującą enzym. Inną jest ilość substratu (stężenie) potrzebne do osiągnięcia ustalonej szybkości reakcji.
1
Wyszukiwarka