Ćwiczenie 4 - 04.03.2011
Hemoglobina, produkty przemiany hemoglobiny, metabolizm żelaza
ZAGADNIENIA DO PRZYGOTOWANIA
1. Transport O2 i CO2 przez hemoglobinę (Hb).
2. Katabolizm hemu, bilirubina wolna i związana.
3. Białka transportujące i magazynujące jony żelaza.
4. Metody wykorzystywane do oznaczania bilirubiny, Hb i żelaza.
WPROWADZENIE
Hemoglobina
Hemoglobina jest hemoproteiną zbudowaną z czterech łańcuchów polipeptydowych, a każdy łańcuch połączony jest z cząsteczką hemu. Bierze ona udział w transporcie tlenu z płuc do tkanek i w pewnym stopniu także CO2 z tkanek do płuc. W naczyniach włosowatych pęcherzyków płucnych, do jonów Fe2+ znajdujących się w grupie hemowej cząsteczki hemoglobiny, przyłączają się cztery cząsteczki tlenu (1 g Hb wiąże 1,36 cm3 tlenu); powstaje oksyhemoglobina - hemoglobina utlenowana. W krwi żylnej tlen odłącza się i dyfunduje do komórek różnych tkanek.
Do wolnych grup aminowych w części białkowej cząsteczki Hb może przyłączyć się CO2, powstają karbaminiany hemoglobiny. W tej postaci transportowane jest około 20% CO2.
Prawidłowa zawartość Hb w 100 cm3 krwi pełnej wynosi u mężczyzn 14-18 g, u kobiet 12-16g, a u noworodków 18-27 g.
Bilirubina
Rozpad erytrocytów zachodzi w komórkach układu siateczkowo-śródbłonkowego, głównie wątroby, śledziony i szpiku kostnego. Tam też następuje przemiana hemu w bilirubinę. W pierwszym etapie tego procesu bierze udział zlokalizowana w mikrosomach oksygenaza hemowa, związana z mikrosomalnym łańcuchem transportu elektronów. Przy udziale O2 i NADPH+H+ prowadzi ona hydroksylację węgla w grupie metinowej znajdującej się między dwoma pierścieniami pirolowymi i następnie jego usunięcie w postaci CO. W wyniku tego następuje rozerwanie układu porfirynowego i powstaje niebieskozielony barwnik - biliwerdyna, posiadająca czteropirolowy układ łańcuchowy. Następnie biliwerdyna redukuje się pod wpływem reduktazy biliwerdyny i powstaje pomarańczowożółta bilirubina, która dyfunduje do krwi.
Reakcja katalizowana przez reduktazę biliwerdyny:
biliwerdyna + NADPH + H+ → bilirubina + NADP+
Bilirubina jest związkiem trudnorozpuszczalnym, transportowanym do wątroby w połączeniu z albuminami. Jedna cząsteczka albuminy łączy się z dwiema cząsteczkami bilirubiny. Jest to tzw. bilirubina wolna, nazywana także bilirubiną pośrednią lub przedwątrobową. W warunkach fizjologicznych jej stężenie waha się w granicach 0,1-1,0 mg/100 cm3. W warunkach prawidłowych w osoczu występuje tylko bilirubina wolna. Jest ona wychwytywana przez komórki wątroby, zostaje odłączona od albuminy i przeniesiona do wnętrza hepatocytu.
W wątrobie słabo polarna cząsteczka bilirubiny ulega dalszym przemianom, które zwiększają jej rozpuszczalność i umożliwiają sekrecję do żółci.
1) 75% bilirubiny wchodzi w reakcję z UDP-glukuronianem i powstają diglukuronidy bilirubiny (kwas glukuronowy tworzy wiązanie estrowe z grupą karboksylową bilirubiny). Reakcja katalizowana jest przez UDP-glukuronozylotransferazę bilirubiny:
bilirubina + 2 UDP-glukuronian → diglukuronid bilirubiny + 2 UDP
2) 15% bilirubiny wchodzi w reakcję z aktywnym siarczanem (5` fosfosiarczanem 3` fosfoadenozyny), przy udziale sulfotransferazy ulega ona estryfikacji i tworzą się siarczany bilirubiny.
3) 10% bilirubiny tworzy połączenia z glicyną, tauryną i metioniną.
Powstające pochodne bilirubiny tworzą tzw. bilirubinę związaną, nazywaną także bilirubiną bezpośrednią lub wątrobową. W tej postaci bilirubina aktywnie wydzielana jest do żółci i wraz z nią przechodzi do przewodu pokarmowego, gdzie ulega dalszym przemianom pod wpływem flory bakteryjnej. W warunkach prawidłowych bilirubina związana nie występuje w osoczu. Dla odróżnienia obu postaci bilirubiny (tzn. wolnej i związanej) wykonuje się odczyn van den Bergha. Dodatni wynik tej próby wskazuje na obecność we krwi bilirubiny związanej.
Stężenie bilirubiny w osoczu przekraczające 1 mg/100 cm3 oznacza bilirubinemię. Umiarkowany wzrost stężenia bilirubiny nie zawsze jest zjawiskiem patologicznym. U 5-7% populacji stwierdza się nieznaczną bilirubinemię bez towarzyszących zmian patologicznych.
Hiperbilirubinemia może być spowodowana upośledzeniem sprzęgania bilirubiny w wątrobie lub zaczopowaniem przewodów żółciowych, a także wytwarzaniem większej ilości bilirubiny niż jest w stanie wydzielić do przewodów żółciowych prawidłowo funkcjonująca wątroba. Przy stężeniu bilirubiny w osoczu przekraczającym 2-2,5 mg/100 cm3 dyfunduje ona do tkanek dając obraz kliniczny określany mianem żółtaczki. Oznaczanie stężenia bilirubiny w osoczu (pośredniej i bezpośredniej) ma duże znaczenie w diagnozowaniu żółtaczek. Wzrost stężenia bilirubiny przedwątrobowej (pośredniej) towarzyszy żółtaczce noworodków. Przyczyną tego stanu jest nadmierna hemoliza erytrocytów oraz niezdolność wątroby do skutecznego sprzęgania i wydzielania zwiększonej ilości bilirubiny. Stan taki uznaje się za fizjologiczny. Jednak, gdy stężenie bilirubiny wolnej u noworodków wzrośnie powyżej 20 mg/100 cm3 może ona przekraczać barierę krew-mózg. Następstwem tego stanu jest kernicterus - żółtaczka jąder podstawnych mózgu, prowadząca do upośledzenia umysłowego.
Przyczyną podwyższonego stężenia bilirubiny przedwątrobowej może być też niedokrwistość hemolityczna, a także dziedziczne zaburzenia sprzęgania bilirubiny w wątrobie spowodowane brakiem lub poważnymi niedoborami UDP-glukuronozylotransferazy bilirubiny (zespół Criglera-Najjara, typ I, typ II). Umiarkowanie podwyższone stężenie bilirubiny wolnej (1,2-3,0 mg/100 cm3) występuje też u osób dotkniętych zespołem Gilberta, obejmującym 3-10% populacji. Spowodowane jest to upośledzeniem wychwytu bilirubiny przez wątrobę lub znacznie częściej niedoborem UDP-glukuronozylotransferazy bilirubiny. Obecność dwu dodatkowych nukleotydów (TA) w regionie promotora genu tego enzymu powoduje jego obniżoną ekspresję.
Podwyższony poziom bilirubiny wolnej może być też spowodowany uszkodzeniem miąższu wątroby, powstałym w następstwie: wirusowego zapalenia wątroby, marskości wątroby, zatruć (chlorowcopochodnymi węglowodorów, α-amanityną), długotrwałego przyjmowania hepatotoksycznych leków. Takim stanom na ogół towarzyszy upośledzenie wydzielania sprzężonej bilirubiny, prowadzące do wzrostu jej stężenia w osoczu.
Zwiększone stężenie bilirubiny sprzężonej może być wynikiem defektu wydzielania bilirubiny do żółci (zespół Dubina-Johnsona), ale przede wszystkim wskazuje na niedrożność przewodów żółciowych. Przyczyną niedrożności może być kamica żółciowa, nowotwór lub zwężenie przewodów żółciowych.
Hiperbilirubinemia spowodowana wzrostem stężenia bilirubiny sprzężonej wiąże się z obecnością bilirubiny w moczu (bilirubinuria), podczas gdy wolna bilirubina (skompleksowana z albuminą) nigdy nie pojawia się w moczu.
Metabolizm żelaza
Żelazo odgrywa zasadniczą rolę w metabolizmie energetycznym żywej komórki, biorąc udział w utlenianiu substancji organicznych. Znaczenie biologiczne tego pierwiastka warunkują jego dwie podstawowe własności.
1. Istnienie dwóch trwałych stanów wartościowości - Fe2+ i Fe3+ - co umożliwia udział w reakcjach utleniania i redukcji.
2. Zdolność tworzenia trwałych kompleksów z wieloma związkami o bardzo różnorodnej strukturze.
Jony żelaza mogą być składnikiem hemoprotein, gdzie wbudowane są w pierścień protoporfiryny, albo mogą występować w postaci związków niehemowych. Do hemoprotein należy szereg enzymów biorących udział w procesach utleniania i redukcji (np. cytochromy, oksydaza cytochromowa, katalaza, peroksydaza) oraz białka przenoszące tlen (hemoglobina i mioglobina). Do białek niehemowych należą: białko transportujące żelazo - transferyna, białka magazynujące żelazo - ferrytyna i hemosyderyna, a także szereg enzymów np. dehydrogenaza bursztynianowa, oksydaza ksantynowa, hydroksylaza fenyloalaninowa i inne.
Całkowita ilość żelaza w organizmie dorosłego mężczyzny o masie 70 kg wynosi około 3,8 g (u dorosłej kobiety o zbliżonej masie ciała jest nieco mniejsza): w hemoglobinie znajduje się około 2,5g (65%), w ferrytynie i hemosyderynie około 1,0 g (25%), w mioglobinie i enzymach około 0,3 g (8%) i w transferynie 3-4 mg.
Żelazo zawarte w osoczu stanowi bardzo małą część całkowitej ilości żelaza w organizmie. Obrót metaboliczny żelaza jest bardzo szybki. W czasie 1 sekundy 3 miliony krwinek czerwonych ulega zniszczeniu; większość uwalnianego żelaza wraca do szpiku i jest wbudowywana w cząsteczki hemoglobiny.
Transferyna jest β1-globuliną osocza o masie cząsteczkowej około 80000. Cząsteczka apotransferyny ma zdolność do przyłączenia dwóch jonów Fe3+ w obecności HCO3-. Powstały kompleks ma budowę: transferyna - (Fe3+)2 - (HCO3-)2. W warunkach prawidłowych transferyna jest wysycona żelazem w około 30%.
Ferrytyna jest to rozpuszczalne w wodzie połączenie apoferrytyny z Fe3+. Cząsteczka apoferrytyny (m. cz. około 430000 - 480000) jest białkiem zbudowanym z 20-24 podjednostek. Wewnątrz części białkowej znajduje się około 4000-5000 atomów Fe w postaci hydroksyfosforanów żelazowych. Całkowicie wysycona żelazem cząsteczka ferrytyny zawiera 17-23% żelaza. W warunkach prawidłowych ferrytyna występuje w bardzo małych ilościach w surowicy krwi - 12-250 μg/dm3.
Dzienne wydalanie żelaza jest bardzo małe: 0,5 - 1,0 mg (przez nerki, jelito grube, w wyniku złuszczania nabłonków). W warunkach prawidłowych powinna istnieć równowaga pomiędzy wydalaniem wchłanianiem żelaza. Dieta dzienna zawiera średnio od 10 do 15 mg żelaza, z tego wchłaniane jest 5-10%, czyli około 1 mg. Stany, które wymagają większego zapotrzebowania na żelazo, np. przewlekłe krwawienia, ciąża, wzrost organizmu, stosunkowo łatwo naruszają stan równowagi i doprowadzają do utajonego niedoboru żelaza, tzn. do obniżenia jego zawartości w magazynach. Oznaczanie stężenia żelaza w surowicy nie jest dobrym wskaźnikiem dla oceny stanu magazynów.
W warunkach prawidłowych stężenie żelaza w surowicy wynosi około 120 μg/100 cm3.
CZĘŚĆ DOŚWIADCZALNA
1. Oznaczanie bilirubiny całkowitej
Zasada metody
Słabe wiązania między cząsteczkami bilirubiny i białka ulegają rozpadowi w obecności kofeiny. W środowisku zasadowym bilirubina pod wpływem diazowanego kwasu sulfanilowego przechodzi w azobarwnik.
Materiał i odczynniki
1. Wzorcowe roztwory bilirubiny - 1 mg/100 cm3, 2 mg/100 cm3, 3 mg/100 cm3,
(bilirubina rozpuszczona jest w roztworze zawierającym 0,06% NaHCO3, 0,3%
NaCl, 70% etanol).
2. Odczynnik kofeinowy (5% kofeina, 7,5% benzoesan sodu, 12,5% octan sodu).
3. Odczynnik diazo I (0,5% kwas sulfanilowy, 2% HCl).
4. Odczynnik diazo II (0,1% roztwór NaNO2).
5. Odczynnik Fehlinga II (10% NaOH, 35% winian sodowo-potasowy).
6. Surowica krwi.
Wykonanie doświadczenia
1.Przygotować 7 probówek:
-do pierwszej dodać 2 cm3 roztworu bilirubiny o stężeniu 1 mg/100 cm3
-do drugiej dodać 2 cm3 roztworu bilirubiny o stężeniu 2 mg/100 cm3
-do trzeciej dodać 2 cm3 roztworu bilirubiny o stężeniu 3 mg/100 cm3
-do czwartej dodać 2 cm3 wody (próba ślepa)
-do piątej dodać 2 cm3 surowicy
-do szóstej i siódmej dodać po 2 cm3 zadania
2.Do wszystkich probówek dodać po 3 cm3 odczynnika kofeinowego
3.Przygotować odczynnik diazowy - zmieszać: 10 cm3 diazo I i 0,3 cm3 diazo II
(resztę pozostawić do ćwiczenia nr 2)
4.Do wszystkich probówek dodać po 1 cm3 odczynnika diazowego
5.Po 10 minutach dodać do wszystkich probówek po 2 cm3 odczynnika Fehlinga II
6.Próby odstawić na 10 minut (ciemność)
7.Po tym czasie próby przesączyć, próba ślepa i zadanie nie wymagają sączenia
8.Zmierzyć absorbancję wobec próby ślepej przy długości fali 600 nm.
9.Zawartość bilirubiny w surowicy i zadaniu odczytać z wykreślonej krzywej wzorcowej - probówki 1, 2 i 3.
2. Badanie bilirubiny bezpośredniej wg Hejmansa van den Bergha
Materiał i odczynniki
1. Odczynnik diazo I ( 0,5% kwas sulfanilowy, 2% HCl).
2. Odczynnik diazo II (0,1% roztwór NaNO2).
3. Surowica krwi.
Wykonanie doświadczenia
Do 2-4 kropli surowicy dodać 1-2 krople odczynnika diazowego - z poprzedniego doświadczenia
Jeżeli w ciągu 30 sekund powstanie czerwonofioletowe zabarwienie, to wynik interpretujemy jako odczyn bezpośredni, dodatni, natychmiastowy (obecność bilirubiny związanej).
Jeżeli w ciągu 30 sekund nie pojawi się zabarwienie, lecz wystąpi później, np. po upływie 10 minut, jest to odczyn bezpośredni, dodatni, opóźniony (obecność bilirubiny związanej w małym stężeniu).
Jeżeli w ciągu 30 minut nie powstanie zabarwienie jest to odczyn bezpośredni, ujemny (brak bilirubiny związanej).
3. Oznaczanie hemoglobiny (Hb)
Zasada metody
Hemoglobina i niektóre jej pochodne są utleniane przez K3[Fe(CN)6] do methemoglobiny, a następnie przekształcane pod wpływem KCN w trwały związek cyjanmethemoglobinę, która wykazuje maksimum absorbancji przy 540 nm.
Materiał i odczynniki
1. Odczynnik Drabkina (0,03% K3[Fe(CN)6], 0,1% NaHCO3, 0,005% KCN).
2. Krew.
Wykonanie doświadczenia
Do 5 cm3 odczynnika Drabkina dodać 0,025 cm3 krwi. Po upływie 10 minut odczytać absorbancję wobec odczynnika Drabkina przy długości fali 540 nm.
Obliczenia
Abad × 64400 × 201
Hb (g/100 cm3 krwi) = __________
44 × 10 × 1000
201 - rozcieńczenie krwi = 5,025 : 0,025
64400 - masa molowa Hb (g/mol)
44 - milimolowy współczynnik absorbancji przy λ = 540 nm
(jest to absorbancja jaką wykazuje roztwór o stężeniu 1 mmol/dm3 i grubości warstwy 1 cm)
dzielnik 10 - wynika z przeliczenia z 1 dm3 na 100 cm3
dzielnik 1000 - wynika z przeliczenia z milimoli na mole
4. Oznaczanie żelaza w surowicy
Zasada metody
Siarczyn sodu redukuje Fe3+ do Fe2+, 2,2'-dipirydyl w środowisku kwaśnym tworzy z jonami Fe2+ związek kompleksowy o zabarwieniu czerwonofioletowym. Chloroform wytrąca zdenaturowane białka.
Materiał i odczynniki
1. 0,1 mol/dm3 roztwór Na2SO3 .
2. Odczynnik dipirydylowy (0,1% 2,2`-dipirydyl w 3% roztworze CH3COOH).
3. Chloroform.
4. Roztwór wzorcowy Fe3+ o stężeniu 100 µg Fe/100 cm3.
5. Surowica krwi.
Wykonanie doświadczenia
Przygotować 5 probówek:
1. Próba właściwa: 2 cm3 surowicy,
2. Próba wzorcowa: 2 cm3 roztworu wzorcowego Fe3+.
3. Próba ślepa: 2 cm3 H2O.
4 i 5. Zadanie na zaliczenie: 2 cm3 zadania.
5. Do wszystkich probówek dodać po 2 cm3 0,1 mol/dm3 roztworu Na2SO3 oraz po 2 cm3 0,1% odczynnika dipirydylowego, wymieszać i wstawić probówki na 5 minut do wrzącej łaźni wodnej.
6. Próby oziębić.
7. Do probówki nr 1 - próba właściwa - dodać 2 cm3 chloroformu, wstrząsać 30 sekund, Zawartość probówki przelać do probówki wirówkowej i wirować (5 minut/3000 obr./min). Jeżeli warstwa górna (wodna) lub dolna (chloroformowa) jest mętna należy próbę ponownie wstrząsać i wirowanie powtórzyć. Górną warstwę zebrać ostrożnie pipetą, przenieść do kuwety i zmierzyć absorbancję przy 520 nm wobec ślepej próby. UWAGA! Chloroform rozpuszcza plastik, jeśli ścianki kuwety zmętnieją wymienić kuwetę na nową!
8. Zmierzyć absorbancję zadania i próby wzorcowej wobec próby ślepej. (W próbach 2, 3, 4 i 5 nie ma białka - więc niepotrzebne jest dodawanie chloroformu i wirowanie).
Obliczenia:
A zad (sur)
μg Fe/100 cm3 zadania (surowicy krwi) = ────── × stężenie wzorca
A wz
ĆWICZENIE 5 - 18.03.2011
PRODUKTY PRZEMIANY AZOTOWEJ
ZAGADNIENIA DO PRZYGOTOWANIA
1. Powstawanie kwasu moczowego i jego rola w organizmie człowieka.
2. Synteza mocznika (reakcje i enzymy).
3. Metabolizm kreatyny (reakcje i enzymy).
4. Metody wykorzystywane do oznaczania w surowicy krwi stężenia kwasu moczowego, kreatyniny i mocznika. Prawidłowe stężenia tych związków we krwi.
WPROWADZENIE
Kwas moczowy
Kwas moczowy jest końcowym produktem katabolizmu zasad purynowych w organizmie człowieka. Nukleotydy w komórkach ulegają stałym przemianom. Związki te są rozkładane za pomocą enzymów, a także ulegają samorzutnemu rozpadowi na skutek wpływu środowiska.
Nukleotydazy rozkładają hydrolitycznie nukleotydy do nukleozydów. Z nukleozydów fosforylazy nukleozydowe uwalniają wolne zasady i rybozo-1-fosforan. Większość uwolnionych zasad purynowych zostaje ponownie użyta do tworzenia nukleotydów na drodze rezerwowych szlaków metabolicznych.
Niewielka część uwolnionych zasad ulega przekształceniu do kwasu moczowego i jest wydalana z moczem.
Główne szlaki metaboliczne przemiany AMP i GMP prowadzące do utworzenia kwasu moczowego nieco się różnią. Katabolizm AMP rozpoczyna deaminaza AMP:
AMP + H2O → IMP + NH3
IMP i GMP są substratami dla 5' nukleotydazy, która przekształca je w nukleozydy.
IMP + H2O → inozyna + Pi
GMP + H2O → guanozyna Pi
Następnie nukleozydy są rozkładane za pomocą fosforylazy nukleozydów purynowych.
inozyna + Pi → hipoksantyna + rybozo-1-fosforan
guanozyna + Pi → guanina + rybozo-1-fosforan
Guanina pod wpływem hydrolazy - guanazy (deaminazy guaninowej) przekształcana jest do ksantyny.
guanina + H2O → ksantyna + NH3
Hipoksantyna i ksantyna są przekształcane w kwas moczowy przy udziale oksydazy ksantynowej.
hipoksantyna → ksantyna→ kwas moczowy
Mechanizm tej reakcji jest złożony, enzym do swojego działania wymaga udziału O2, FAD, jonów molibdenu i żelaza. Jeden atom tlenu cząsteczkowego, utleniacza w obu reakcjach, zostaje dołączony do pierścienia puryny, drugi zaś zostaje zredukowany do H2O2. Nadtlenek wodoru następnie jest rozkładany przez katalazę do H2O i O2.
Przyłączenie tlenu do pierścienia puryny powoduje zwiększenie polarności, a zatem zwiększa rozpuszczalność związku w wodzie. Jednak kwas moczowy jest nadal związkiem trudno rozpuszczalnym. Lepiej rozpuszczalne są jego sole - moczany, które tworzą się w pH obojętnym i zasadowym. Kryształy moczanów wytrącają się w roztworach przekraczających stężenie 7 miligramów tego związku na 100 cm3 wody. Dlatego też znaczna część moczanów w osoczu zaadsorbowana jest na albuminach, co przeciwdziała ich wytrącaniu.
Prawidłowe stężenie kwasu moczowego (głównie w postaci moczanów) we krwi dorosłych kobiet wynosi od 2 do 6 mg/100 cm3, u mężczyzn od 3 do 7,5 mg/100 cm3. Stężenie kwasu moczowego w osoczu zależy także od diety, niższe stężenia tego związku występują u ludzi stosujących dietę wegetariańską.
W ciągu doby organizm zdrowego, dorosłego człowieka wytwarza przeciętnie od 400 do 800 miligramów kwasu moczowego, który następnie jest wydalany z moczem.
Nadmierne jego wytwarzanie powoduje podwyższenie jego stężenia we krwi (hiperurykemia) i jest przyczyną zmian chorobowych, wywołanych przez wytrącanie się kryształów moczanu sodu szczególnie w stawach i nerkach. Choroba ta jest znana jako dna moczanowa. Większość ssaków przekształca dalej kwas moczowy do łatwo rozpuszczalnej substancji - alantoiny. Brak możliwości przekształcania kwasu moczowego do alantoiny jest jednak korzystnym czynnikiem selekcyjnym. Moczany bardzo łatwo się utleniają i są bardzo wydajną substancją usuwającą wysoce reaktywne, szkodliwe formy tlenu, np.: rodniki hydroksylowe, aniony ponadtlenkowe. Obecność moczanów w osoczu może wydatnie przyczyniać się do wydłużenia życia ludzkiego i do zmniejszenia zapadalności na choroby nowotworowe. Moczany jak również bilirubina są przykładami reguły, że niektóre produkty końcowe pochodzące ze szlaków metabolicznych odgrywają ważną rolę jako czynniki ochronne.
Mocznik
Mocznik powstaje w organizmie w tzw. cyklu mocznikowym. Związek ten pochodzi głównie z przemiany azotowej białek.
Podczas deaminacji aminokwasów tworzy się bardzo toksyczny amoniak. Powstaje on również w mniejszej ilości, w przemianach innych związków, np. nukleotydów purynowych i pirymidynowych oraz amin. Proces syntezy mocznika pełni ważną biologiczną rolę w przekształcaniu amoniaku w łatwo rozpuszczalny, nietoksyczny w stężeniach fizjologicznych związek, który następnie jest wydalany z moczem.
Zdrowy, dorosły człowiek, na prawidłowej diecie jest w stanie tzw. równowagi azotowej. Dobowa ilość azotu wydalana z organizmu jest równa ilości azotu przyjmowanego z pożywieniem. Przy spożyciu białka w ilości około 100 gramów na dobę wydalane jest 16 gramów azotu. 80 - 90% całkowitej puli wydalanego azotu stanowi mocznik. Ilość wytworzonego w organizmie dorosłego człowieka mocznika zależy głównie od zawartości białka w pożywieniu i przeciętnie wynosi od 20 do 40 g na dobę. Stężenie tego związku we krwi w warunkach prawidłowych waha się w szerokich granicach, od 20 do 40 mg/100 cm3, a nawet może osiągać 50 mg/100 cm3.
Synteza mocznika zachodzi wyłącznie w wątrobie. Amoniak łączy się z CO2 tworząc karbamoilofosforan, reakcja ta wymaga udziału dwóch cząsteczek ATP, jako źródła energii. Karbamoilofosforan następnie reaguje z ornityną, tworząc cytrulinę. Cytrulina przy udziale energii pochodzącej z hydrolizy ATP kondensuje z asparaginianem, który jest dawcą drugiego atomu azotu. Powstały argininobursztynian ulega rozszczepieniu na argininę i fumaran. Arginina hydrolizuje dając mocznik i ornitynę, zamykając w ten sposób jeden obrót cyklu. Dwie pierwsze reakcje zachodzą w mitochondriach komórek wątroby, pozostałe trzy przebiegają w cytoplazmie.
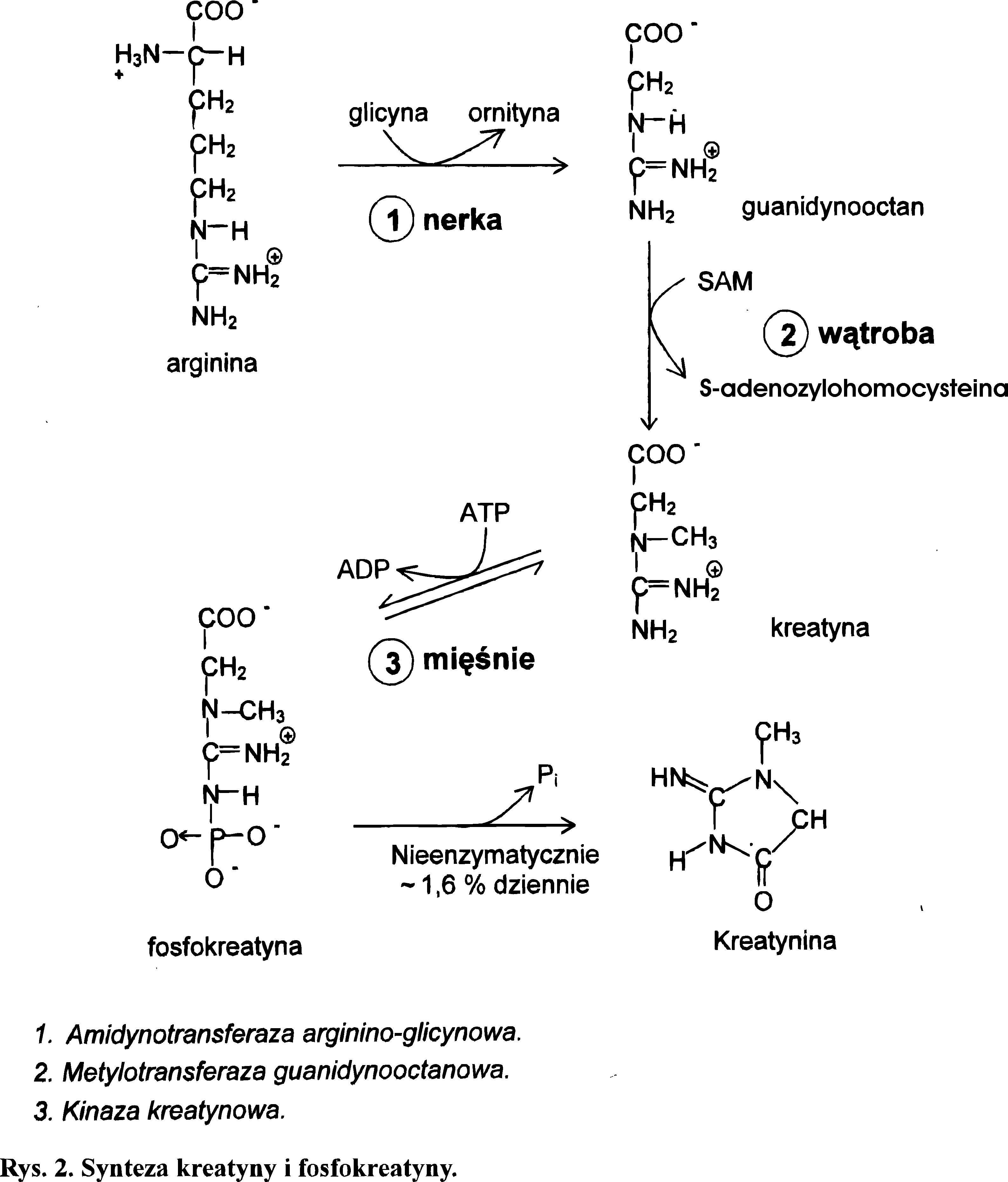
Kreatynina
Kreatynina jest produktem degradacji kreatyny. Kreatyna występuje głównie w mięśniach i w postaci fosforanu jest magazynem energii. Cykl mocznikowy jest także punktem wyjścia do syntezy tego ważnego metabolitu. Arginina, metabolit cyklu mocznikowego, ulega w komórkach nerki kondensacji z glicyną. Powstaje guanidynooctan, który jest metylowany przez S-adenozylometioninę (SAM) do kreatyny. Kreatyna jest następnie fosforylowana za pomocą ATP i przechodzi w fosforan kreatyny, stanowiący zapas łatwo uruchamianej energii w mięśniu. Ostatni etap przemiany odbywa się bez udziału enzymów. W ciągu doby około 1,6% fosfokreatyny przekształca się w bezwodnik - kreatyninę (Rys. 2).
Kreatynina jest wydalana z moczem, przeciętnie od 1 do 1,8 gramów na dobę. Prawidłowe stężenie kreatyniny w surowicy wynosi u dorosłych kobiet od 0,5 do 1 mg/100 cm3, a u mężczyzn 0,6 - 1,2 mg/100 cm3. Znacznie niższe stężenie kreatyniny występuje u małych dzieci do trzech lat (0,2-0,4 mg/100 cm3). W miarę dorastania stężenie to stopniowo wzrasta, aby osiągnąć w wieku 17 lat wartości charakterystyczne dla ludzi dorosłych.
Podwyższone stężenie kreatyniny we krwi może wystąpić w chorobach nerek, mięśni i zatruciach witaminą D.
CZĘŚĆ DOŚWIADCZALNA
1. Oznaczanie kwasu moczowego w surowicy krwi
Zasada metody
Kwas moczowy w środowisku alkalicznym redukuje sole kwasu fosforowolframowego do tlenków wolframu na niższym stopniu utlenienia, mających zabarwienie niebieskie, a sam utlenia się do alantoiny (Rys. 1). Kwas moczowy należy oznaczyć w roztworze otrzymanym po odbiałczeniu surowicy. Denaturację białek przeprowadza się za pomocą soli metali ciężkich, w tym przypadku jonów wolframu.
Odczynniki
1. 10% roztwór wolframianu sodu.
2. 0,3 mol/dm3 roztwór H2SO4.
3. Wzorcowy roztwór kwasu moczowego o stężeniu 1 mg/100 cm3.
4. 10,3% roztwór Na2CO3.
5. Odczynnik fosforowolframowy (4% Na2WO4 x 2 H2O w 3% roztworze H3PO4).
a) Odbiałczanie surowicy
Wykonanie doświadczenia
1.Do probówki odmierzyć 8 cm3 wody i 1 cm3 surowicy.
2.Dodać 0,5 cm3 10% roztworu wolframianu sodu, a następnie 0,5 cm3 0,3 mol/dm3 roztworuH2SO4 i dokładnie wymieszać.
3.Odstawić na 30 minut, a następnie odwirować (15 min, 4000 obr./min), do dalszych oznaczeń pobrać płyn znad osadu.
b) Oznaczenie ilościowe kwasu moczowego
Wykonanie doświadczenia
1. Przygotować trzy probówki.
2. Do jednej odmierzyć 3 cm3 płynu znad osadu po odbiałczeniu surowicy (próba badana)
3. Do drugiej 3 cm3 roztworu wzorcowego kwasu moczowego (próba wzorcowa)
4. Do trzeciej 3 cm3 wody (próba ślepa).
5. Do wszystkich probówek dodać po 0.5 cm3 10,3% roztworu węglanu sodu i wymieszać.
6. Następnie odmierzyć po 0.15cm3 odczynnika fosforowolframowego
7. Zawartość probówek dokładnie wymieszać, odstawić na 5 minut.
8. Odczytać absorbancję przy 610 nm wobec próby ślepej.
Obliczenia
Współczynnik 10 wynika z faktu, że surowica w trakcie doświadczenia została dziesięć razy rozcieńczona.
2. Oznaczanie mocznika w surowicy krwi metodą ureazową
Zasada metody
Mocznik ulega hydrolizie w reakcji katalizowanej przez ureazę (enzym pochodzenia roślinnego lub bakteryjnego). Powstałe jony amonowe reagują z odczynnikiem Nesslera i tworzy się barwny produkt.
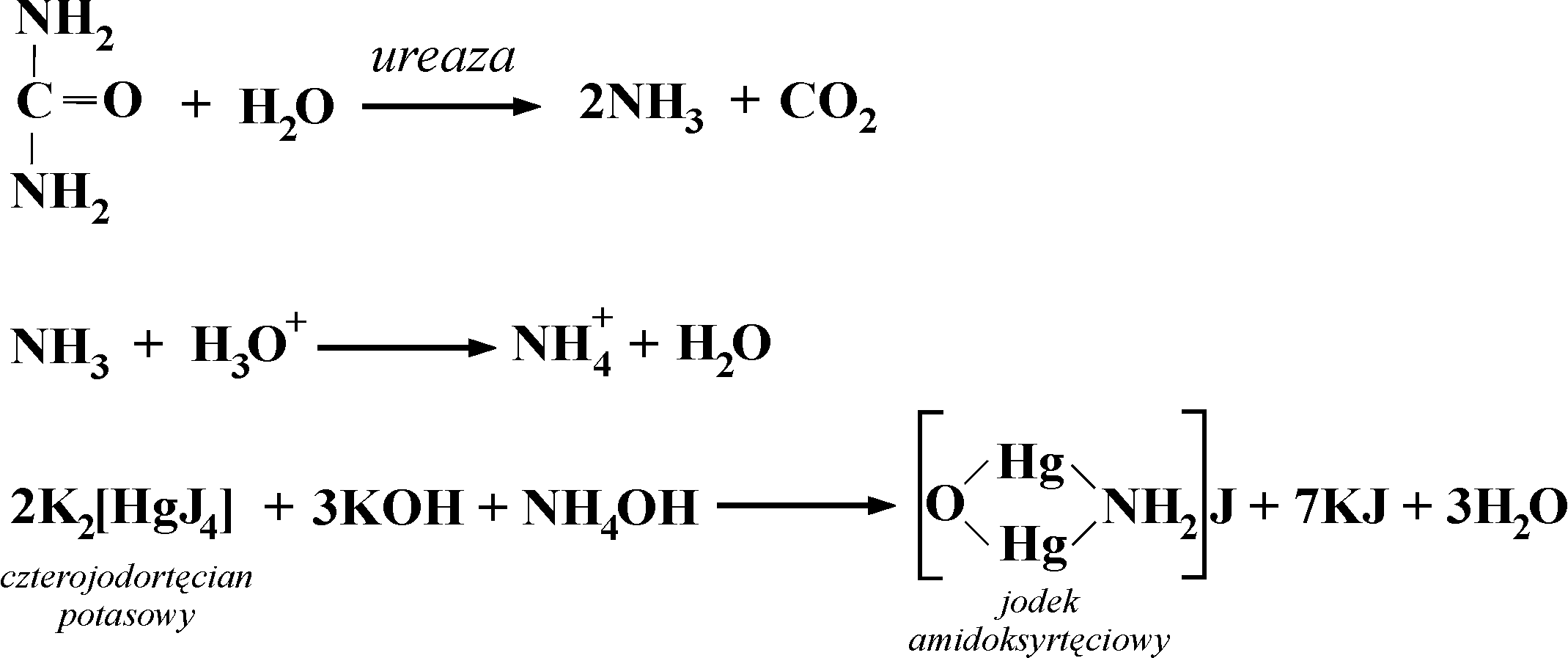
Odczynniki
1. Roztwór ureazy z ziaren soi w buforze Tris-HCl o pH 7,4.
2. 10% roztwór ZnSO4.
3. 0,5 mol/dm3 roztwór NaOH.
4. Wzorzec do oznaczania mocznika (roztwór NH4Cl o stężeniu 1 mg N/100 cm3).
5. Odczynnik Nesslera (zasadowy roztwór K2[HgJ4]).
Wykonanie doświadczenia
Przygotować trzy probówki
1. Do pierwszej probówki wirówkowej odmierzyć 1 cm3 wody i 0,2 cm3 surowicy - próba badana
2. Do drugiej i trzeciej probówki wirówkowej odmierzyć 1 cm3 wody i 0,2 cm3 zadania
3. Następnie do wszystkich probówek dodać 2 cm3 roztworu ureazy w buforze Tris-HCl, pH 7,4.
4. Probówki zakryć parafilmem, wstawić do łaźni wodnej o temp. 370 C i inkubować 20 minut.
5. Po inkubacji dodać do probówki zawierającej surowicę i do probówek zawierających zadanie
0,5 cm3 10% roztworu ZnSO4 i 0,3 cm3 0,5 mol/dm3 roztworu NaOH w celu wytrącenia białek.
6. Zawartość probówek dokładnie wymieszać i odwirować (5 min, 3000 obr./min). Płyn znad osadu zdenaturowanych białek zlać do suchych probówek.
Przygotować 5 probówek:
1. Do pierwszej odmierzyć 2 cm3 płynu nadosadowego z probówki z próbą badaną i 5 cm3 wody
9.Do drugiej i trzeciej odmierzyć 2 cm3 płynu nadosadowego z probówek z zadaniem
i 5 cm3 wody
12. Do czwartej dodać 1 cm3 roztworu wzorcowego i 6 cm3 wody (próba wzorcowa),
13.Do piątej 7 cm3 wody (próba ślepa),
14. Zawartość probówek wymieszać.
15.Do wszystkich probówek dodać po 1 cm3 odczynnika Nesslera, wymieszać.
16. Absorbancję odczytać po 5 minutach, przy długości fali 470 nm, wobec próby ślepej.
Obliczenia
1 mg azotu odpowiada 2,14 mg mocznika (60:28, 60 - względna masa cząsteczkowa mocznika, 28 - względna masa cząsteczkowa azotu), współczynnik 10 wynika z rozcieńczenia surowicy - w końcowej objętości znajduje się 0,1 cm3 surowicy, a 1 cm3 wzorca.
3. Oznaczanie kreatyniny w surowicy krwi
Zasada metody
Kreatynina z kwasem pikrynowym tworzy kompleks o zabarwieniu czerwonym. Reakcja ta jest mało swoista i w zależności od warunków (temperatura, czas inkubacji, pH środowiska) intensywność zabarwienia może zmieniać się nieproporcjonalnie. Rzeczywista zawartość kreatyniny w osoczu stanowi zwykle około 80% wartości oznaczanej tą metodą. (Stosowane są również metody opierające się na oznaczeniach enzymatycznych).
Odczynniki
1. 10% roztwór Na2WO4.
2. 0,3 mol/dm3 roztwór H2SO4,
3. 1 mol/dm3 roztwór NaOH.
4. 1,5% roztwór kwasu pikrynowego.
5. Wzorcowy roztwór kreatyniny o stężeniu 4 mg/ 100 cm3.
Wykonanie doświadczenia
a) Odbiałczanie surowicy
Do probówki wirówkowej pobrać 3 cm3 surowicy, dodać 1,5 cm3 10% roztworu Na2WO4 i 1,5 cm3 0,3 mol/dm3 roztworu H2SO4 celem zdenaturowania białek. Dokładnie wymieszać, odstawić na 30 minut, a następnie odwirować (15 min, 4000 obr./min), Płyn znad osadu zlać do suchej probówki.
b) Wykonanie oznaczenia ilościowego
Przygotować 5 probówek:
1. do pierwszej dodać 2 cm3 płynu znad osadu (próba badana)
2. do drugiej i trzeciej dodać 1 cm3 roztworu zadania i 1 cm3 wody
3. do trzeciej 1 cm3 roztworu wzorcowego kreatyniny i 1 cm3 wody (próba wzorcowa)
4. do trzeciej 2 cm3 wody (próba ślepa).
Nastepnie do wszystkich probówek dodać 1 cm3 1,5% roztworu kwasu pikrynowego i 1 cm3 1mol/dm3 roztworu NaOH. Wymieszać, odstawić na 15 minut i zmierzyć absorbancję wobec próby ślepej przy długości fali 520 nm.
Obliczenia
ĆWICZENIE 6 - 29.04.2011
GLIKOGEN
ZAGADNIENIA DO PRZYGOTOWANIA
1. Struktura glikogenu.
2. Synteza i rozpad glikogenu (reakcje wzorami i enzymy). Hormony regulujące te procesy.
3. Rola glikogenu wątrobowego i mięśniowego.
4. Metody izolowania i oznaczania procentowej zawartości glikogenu w wątrobie.
WPROWADZENIE
Glikogen jest zapasowym materiałem energetycznym zwierząt i człowieka. Jest to rozgałęziony homoglikan, zbudowany z jednostek α,D-glukopiranozowych, które są połączone dwoma typami wiązań glikozydowych: α-1,4 i występującym średnio co dziewięć reszt glukozowych wiązaniem α-1,6.
Glikogen jest magazynowany głównie w wątrobie i mięśniach. Ilość glikogenu w wątrobie dochodzi do 6-8% masy tego narządu, natomiast w mięśniach jego zawartość może wynosić 0,7%. Jednak mięśnie, z powodu dużej masy, zawierają 3-4-krotnie większy zapas glikogenu niż wątroba. Rezerwa glukozy znajdująca się w glikogenie wątrobowym służy do utrzymywania odpowiedniego stężenia tego związku we krwi w przerwach między posiłkami. Prawidłowe stężenie glukozy we krwi waha się niewielkich granicach i wynosi 3,9-6,1 mmola/dm3 (70-110 mg/100 cm3). Zapas glikogenu zgromadzony w wątrobie wystarcza na uzupełnianie stężenia glukozy przez 12-16 godzin.
Utrzymywanie stałego stężenia glukozy we krwi jest niezwykle istotne dla organizmu. Glukoza stanowi podstawowe źródło energii dla większości tkanek. Ciągłe dostarczanie glukozy jest konieczne do sprawnego funkcjonowania układu nerwowego i erytrocytów, dla których glukoza jest jedynym materiałem energetycznym. Neurony nie katabolizują kwasów tłuszczowych i przy normalnej diecie glukoza jest głównym źródłem energii potrzebnej do podtrzymania procesów życiowych tkanki nerwowej. Już poniżej stężenia 70 mg glukozy na 100 cm3 pojawiają się pierwsze objawy hipoglikemii jak np.: senność, drażliwość, bóle głowy i poczucie głodu. Przy bardzo niskim stężeniu glukozy we krwi występuje zaburzenie czynności mózgu, które może doprowadzić do śpiączki a nawet zgonu.
W stanach przedłużonego głodzenia lub przy braku węglowodanów w pożywieniu większość energii niezbędnej dla życia neuronów pochodzi z katabolizmu tzw. ciał ketonowych - acetooctanu i 3-hydroksymaślanu, których synteza nasila się w tych warunkach. Związki te są także metabolizowane przez inne tkanki z wyłączeniem wątroby i krwinek czerwonych. Jednak podczas głodzenia stężenie glukozy nie powinno spadać znacznie poniżej dolnych granic normy. Niezbędna ilość glukozy wytwarzana jest wtedy na drodze glukoneogenezy - syntezy glukozy z substancji niewęglowodanowych.
Glikogen zmagazynowany w mięśniach nie służy utrzymywaniu stałego stężenia glukozy we krwi, a jedynie dostarcza energii w trakcie przedłużonego skurczu mięśnia. Po 12-18 godzinach głodzenia wątroba zostaje niemal zupełnie pozbawiona glikogenu, natomiast zapas glikogenu w mięśniach zmniejsza się po długotrwałym, intensywnym wysiłku.
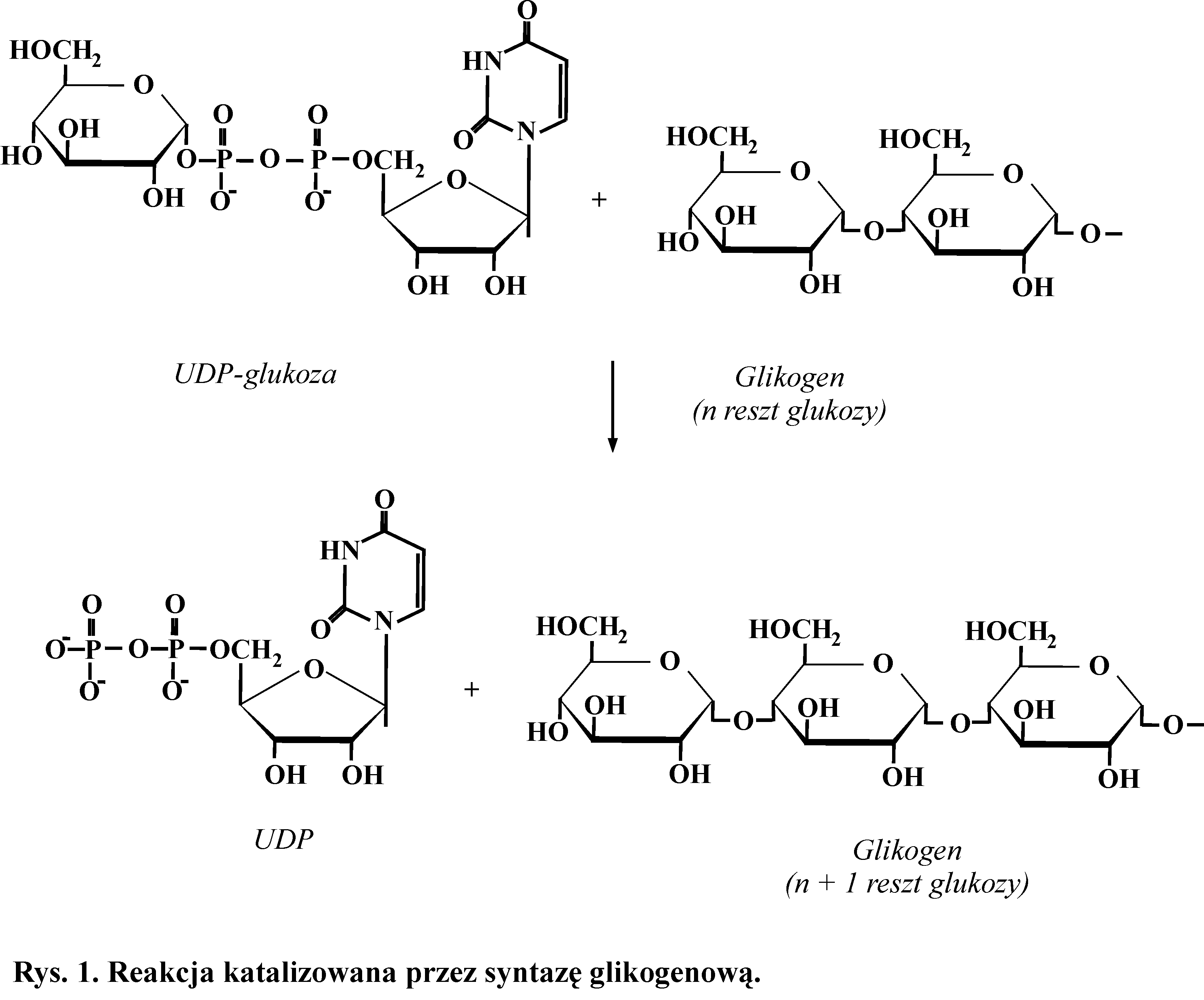
Syntezę glikogenu katalizują dwa enzymy z klasy transferaz. Syntaza glikogenowa, która tworzy wiązania α-1,4-glikozydowe i enzym rozgałęziający (amylo[α-1→4]→[α-1→6]-transglukozydaza), który syntetyzuje wiązania α-1,6-glikozydowe. Syntaza glikogenowa może jedynie wydłużać już istniejący łańcuch. Do rozpoczęcia reakcji potrzebny jest inicjator, białko - glikogenina. Dodatkowy enzym, glukozylotransferaza, przyłącza kolejno do grupy -OH specyficznej reszty seryny w tym białku kilka reszt glukozy, łącząc je wiązaniami α-1,4- glikozydowymi. Właściwa reakcja katalizowana jest przez syntazę glikogenową. Substratem do syntezy glikogenu jest UDP-glukoza (Rys. 1).
Gdy łańcuch zostanie przedłużony, do co najmniej 11 reszt glukozowych, wówczas enzym rozgałęziający przenosi część łańcucha z jednego rozgałęzienia na inne, tworząc wiązanie α-1,6 glikozydowe i ustanawiając w ten sposób nowy punkt rozgałęzienia. Powstaje cząsteczka bardzo rozgałęziona. Zwiększenie liczby nieredukujących zakończeń łańcuchów glukozowych umożliwia przyśpieszenie zarówno syntezy glikogenu, jak i jego rozkładu na drodze fosforolizy.
Głównym enzymem przeprowadzającym rozpad glikogenu (glikogenolizę) jest fosforylaza glikogenowa, należąca do klasy transferaz. Enzym ten przy udziale ortofosforanu prowadzi fosforolizę glikogenu od nieredukujących zakończeń cząsteczki tworząc glukozo-1-fosforan.
glikogen(n reszt glukozy) + Pi → glikogen(n-1 reszt glukozy) + glukozo-1-fosforan
Fosforylaza glikogenowa rozłącza tylko wiązania α-1,4-glikozydowe, degradując stopniowo łańcuchy glukozowe, aż do miejsc oddalonych o cztery reszty glukozowe od punktu rozgałęzienia, stworzonego za pomocą wiązania α-1,6. Następnie enzym odgałęziający, α-[1→4]→[1→4]-transferaza glukanowa przenosi fragment trzech reszt glukozy na łańcuch główny. W ten sposób odsłania się miejsce odgałęzienia. Rozkład wiązań α-1,6 katalizuje hydrolaza - amylo-α-[1→6]-glukozydaza, która uwalnia wolną glukozę.
Glukozo-1-fosforan, będący produktem działania fosforylazy, zostaje przekształcony w glukozo-6-fosforan za pomocą fosfoglukomutazy.
Dalsze losy glukozo-6-fosforanu zależą od rodzaju tkanki. W wątrobie występuje enzym fosfataza glukozo-6-fosforanowa, przekształcająca glukozo-6-fosforan w glukozę. Tylko wolna glukoza może być przenoszona przez błonę komórkową; dokonuje tego znajdujący się w błonie komórkowej układ transportujący. Rozkład glikogenu wątrobowego powoduje wzrost stężenia glukozy we krwi.
W mięśniach nie występuje fosfataza glukozo-6-fosforanowej i brak tego enzymu uniemożliwia przekształcenie glukozo-6-fosforanu do wolnej glukozy. Uwolniony glukozo-6-fosforan służy jako materiał energetyczny wykorzystywany podczas skurczu mięśnia.
Rozkład i synteza glikogenu zależy głównie od wpływu hormonów. Kontrolę nad tworzeniem i rozkładem glikogenu prowadzą przede wszystkim dwa hormony- glukagon i insulina. Glikogenolizę w mięśniach i wątrobie może także wywołać hormon stresu - adrenalina.
CZĘŚĆ DOŚWIADCZALNA
1. Izolowanie glikogenu z wątroby zwierzęcej.
Zasada metody
Wiązania glikozydowe występujące w glikogenie są oporne na działanie hydrolityczne jonów OHˉ w podwyższonej temperaturze. W wysokiej temperaturze w środowisku zasadowym wiązania peptydowe białek, estrowe lipidów i fosfodiestrowe kwasów rybonukleinowych ulegają hydrolizie. W wyniku ogrzewania tkanki w roztworze KOH otrzymuje się roztwór glikogenu zanieczyszczony innymi wielocukrami, fragmentami zdenaturowanego DNA oraz związkami małocząsteczkowymi, które znajdowały się w tkance lub powstały na skutek hydrolizy. Dodanie alkoholu etylowego powoduje wytrącenie glikogenu, który jest w niewielkim stopniu zanieczyszczony zdenaturowanym DNA i wysokocząsteczkowymi heteroglikanami, które również strącają się w tych warunkach.
Odczynniki
1. 30% roztwór KOH.
2. 96% etanol.
3. NaCl in subst.
Wykonanie doświadczenia
1. 1 g wątroby umieścić w probówce wirówkowej zawierającej 2,5 cm3 30%
roztworu KOH.
2. Probówkę zakryć korkiem z chłodniczką zwrotną i wstawić na 30 minut do
wrzącej łaźni wodnej, wstrząsać, co kilka minut.
3. Po całkowitym rozpuszczeniu tkanki, probówkę wyjąć z łaźni, oziębić i dodać
4,5 cm3 96% etanolu, dobrze wymieszać.
4. Probówkę ponownie zakryć korkiem z chłodniczką zwrotną i wstawić do gorącej
łaźni wodnej (uwaga - nie odparowywać alkoholu, wyjąć natychmiast
po osiągnięciu wrzenia).
5. Po ostudzeniu wytrącony osad glikogenu odwirować (5 min, 3000 obr./min).
6. Płyn znad osadu wylać, osad rozpuścić w 3 cm3 wody (mieszać bagietką).
7. Wytrącić glikogen przez dodanie 6 cm3 96% etanolu (zawartość probówki dobrze
wymieszać bagietką). Jeśli osad nie ulegnie wytrąceniu należy dodać kilka krysz-
tałków NaCl, zamieszać i wstawić na chwilę do ciepłej łaźni wodnej.
8. Wytrącony glikogen odwirować jak poprzednio (5 min, 3000 obr/min)
9. Płyn znad osadu ostrożnie wylać.
10. Osad osuszyć przez postawienie probówki do góry dnem na bibule, a następnie
rozpuścić w 10 cm3 wody destylowanej. Powstały opalizujący roztwór używać do
dalszych oznaczeń.
2. Wyznaczanie krzywej wzorcowej do oznaczania glukozy.
Zasada metody
Glukoza posiada właściwości redukujące i w środowisku zasadowym redukuje odczynnik dinitrosalicylowy, sama zaś utlenia się do kwasu glukonowego. Odczynnik dinitrosalicylowy po redukcji zmienia barwę z żółtej na pomarańczową o maksimum absorbancji 550 nm. Powstałe zabarwienie roztworu jest proporcjonalne do ilości glukozy w próbce.
Odczynniki
1. 0,01 mol/ dm3 roztwór glukozy.
2. 0,05 mol/dm3 bufor fosforanowy pH 6,9.
3. Odczynnik dinitrosalicylowy (1% kwas 3,5-dinitrosalicylosalicylowy, 1,6% NaOH, 30% winian sodowo-potasowy).
Wykonanie doświadczenia
Do 7 probówek skalowanych na 10 cm3 dodać kolejno odczynniki według tabeli 1:
Tabela 1
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Ilości dodawanych odczynników w cm3 |
||||||
H2O |
1,8 |
1,6 |
1,4 |
1,2 |
1,0 |
0,8 |
2,0 |
. 0,01 mol/ dm3 roztwór glukozy |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
1,2 |
- |
Bufor fosforanowy |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
Odczynnik dinitro-salicylowy |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
1. Po dodaniu odczynników zawartość probówek dobrze wymieszać
2. Wstawić na 10 minut do wrzącej łaźni wodnej.
3. Po wyjęciu z łaźni probówki oziębić.
4. Uzupełnić wodą do 10 cm3, wymieszać.
5. Dokonać pomiarów absorbancji przy długości fali 550 nm, wobec próby ślepej
probówka nr 7.
6. Sporządzić wykres zależności absorbancji od ilości μmoli glukozy w próbie.
3. Hydroliza kwaśna glikogenu. Oznaczanie zawartości procentowej glikogenu w wątrobie na podstawie ilości uwolnionej glukozy.
Zasada metody
Glikogen ulega hydrolizie w 1000 C w środowisku silnie kwaśnym, gdyż w tych warunkach wiązania glikozydowe ulegają rozpadowi. Jeśli hydroliza będzie prowadzona przez odpowiednio długi okres czasu to cała ilość glikogenu ulegnie rozkładowi do wolnej glukozy. Na podstawie ilości uwolnionej glukozy można wyliczyć zawartość procentową glikogenu w wątrobie.
Odczynniki
1. 2 mol/dm3 roztwór HCl.
2. 1,2 mol/dm3 roztwór NaOH .
3. Odczynnik dinitrosalicylowy (1% kwas 3,5-dinitrosalicylosalicylowy,
1,6% NaOH, 30% winian sodowo-potasowy).
4. 0,05 mol/dm3 bufor fosforanowy pH 6,9.
Wykonanie doświadczenia
1. Otrzymany w doświadczeniu 1 roztwór glikogenu rozcieńczyć dwukrotnie:
pobrać 5 cm3, dodać 5 cm3 wody i dokładnie wymieszać.
2. Przygotować dziesięć probówek.
3. Do probówek 1-9 odmierzyć po 0,4 cm3 rozcieńczonego dwa razy roztworu
glikogenu, do probówki nr 10 dodać 0,4 cm3 wody (próba ślepa).
4. Do wszystkich probówek dodać po 0,6 cm3 2 mol/dm3 roztworu HCl i zanotować
czas (t0).
5. Zawartość probówki nr 1 i 10 natychmiast zobojętnić przez dodanie 1 cm3
1,2 mol/dm3 roztworu NaOH.
6. Pozostałe probówki (2-9) wstawić do wrzącej łaźni wodnej.
7. Probówki od 2 do 8smej wyjmować z łaźni w odstępach co cztery minuty, a
zawartość ich, natychmiast po wyjęciu, zobojętnić dodając 1cm3 1,2 mol/dm3
roztworu NaOH.
8. Probówkę nr 9 wyjąć z łaźni po 40 minutach, następnie zobojętnić, jak
poprzednio.
9. Do wszystkich probówek dodać po 0,5 cm3 0,05 mol/dm3 buforu fosforanowego
pH 6,9 w celu wyrównania we wszystkich probówkach wartości pH.
10. Następnie do wszystkich probówek dodać 2 cm3 odczynnika dinitrosalicylowego,
zawartość probówek dobrze wymieszać i wstawić do wrzącej łaźni wodnej na
10 minut.
11. Probówkę wyjąć, ochłodzić i uzupełnić do 10 cm3 wodą destylowaną, ponownie
wymieszać.
12. Zmierzyć absorbancję przy długości fali 550 nm, wobec próby ślepej (probówka
nr 7 z doświadczenia nr 2).
Z krzywej wzorcowej do oznaczania glukozy (doświadczenie nr 2), odczytać ilość μmoli glukozy. Sporządzić wykres zależności ilości μmoli uwolnionej glukozy od czasu trwania hydrolizy kwaśnej glikogenu.
Obliczyć ilość μg glukozy uwolnionej podczas całkowitej hydrolizy próbki glikogenu i obliczyć zawartość procentową glikogenu w wątrobie. Należy uwzględnić wszystkie stosowane rozcieńczenia preparatu glikogenu uzyskanego z jednego grama tkanki i ilość oznaczonej glukozy pomnożyć przez 0,9, aby uwzględnić fakt, że ze 162 g glikogenu powstaje 180 g glukozy (162:180).
4. Zadanie ilościowe - oznaczanie glukozy (indywidualne dla każdego
studenta)
Wykonanie doświadczenia
Do 1 cm3 roztworu zadania dodać 1 cm3 wody, 0,5 cm3 0,05 mol/dm3 buforu fosforanowego pH 6,9 i 2 cm3 odczynnika dinitrosalicylowego.
Zawartość probówek dokładnie wymieszać i ogrzewać przez 10 minut we wrzącej łaźni wodnej. Po wyjęciu oziębić i uzupełnić wodą do 10 cm3. Zmierzyć absorbancję przy długości fali 550 nm wobec próby ślepej (probówka nr 7 z doświadczenia 2). Z krzywej wzorcowej odczytać ilość μg glukozy w 1 cm3 zadania.
Wyszukiwarka
Podobne podstrony:
Materialy do cw lab biochemia
tabela do cw 6 z lab, Studia Budownictwo PB, 5 semestr, laborki metal
sprawozdanie cw.8 do parafiny, far, II rok III sem, biochemia, lab
materiały do egzaminu cz.II, Studia z psychologii, Psychologia rozwoju człowieka w cyklu życia
UAM-wyniki pomiarów podatności magnetycznej, Geologia GZMiW UAM 2010-2013, II rok, Geofizyka, CD-1
więcej podobnych podstron