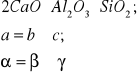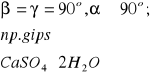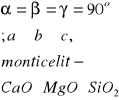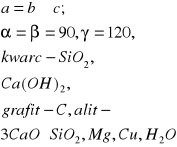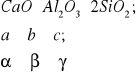Materiał ma budowę krystaliczną-jego elementy struktury(atomy, jony) ułożone są regularnie, budowa:
Krystalografia-zajmuje się budową kryształów
Krystalografia-konstrukcja sieci przestrzennej
Układy krystaliczne(7 układów krystalicznych)
14 możliwych typów sieci przestrzennych:
1.regularny P,F,I 2.tetragonalny P, I 3.romboedryczny P 4.heksagonalny P 5.rombowy P, C, F, I 6.jednoskośny P, C 7. trójskośny P Podział kryształów ze względu na rodzaj wiązań:
Liczna koordynacji: Liczba Magnusa r kationu: r anionu
5.
Kryształy
Zakłócenia w kryształach:
-defekty punktowe -defekty liniowe( dyslokacje) -defekty powierzchniowe Defekty:
Struktura krystaliczna krzemianow i glinokrzemianow:
Diadochia: homowalentna(gdy jeden pierwiastek jest zastępowany przez inny o tej samej wartościowości );heterowalentna
|
Wyszukiwarka
Podobne podstrony:
analiza matematyczna, chomik Franek, Studia - materiały dla studentów, Analiza
W3 ch org - materialy dla studentow, chemia
W5 ch org - materialy dla studentow, chemia
W1 ch. org. - materialy dla P.T. Studentow, chemia
ćwiczenia 1-2 materialy dla studentów, psychologia, studia psychologia, semestr V, egzaminy semestr
MATERIAŁY DLA STUDENTÓW, Pedagogika, Studia stacjonarne I stopnia, Rok 3, Komunikacja społeczna - n
materiały dla studentów-fizjologia, biologia- studia, budowa i fizjologia zwierząt, ogólne
ćwiczenia 3 materialy dla studentów, psychologia, studia psychologia, semestr V, egzaminy semestr 5,
MACIERZ MCKINSEY - materiał dla studentów, studia AGH, ZiIP, Magister, Innowacje
nadzór epidemiologiczny - materiały dla studentów WSIiZ, studia pielęgniarstwo
epidemiologia - materiały dla studentó w WSIiZ, studia pielęgniarstwo
Nasiennictwo-materiały dla studentów, Studia, II rok, II rok, IV semestr, Nasiennictwo
etyka - materialy dla studentow, Studia (PRz Informatyka), Etyka
Materiały dla studentów ENDOKRYNOLOGIA
materiały dla studentów 8
Socjalizm utopijny, Materiały dla studentów WSB DG
Test z Monitoringu Biologicznego, Materiały dla studentów, ochrona srodowiska
więcej podobnych podstron