nr cwicz. 10 |
data
|
Krzysztof Pittner |
Wydzial Technologii chemicznej |
Semestr II |
grupa IPC |
|
przygotowanie |
wykonanie |
ocena ostatecz. |
||
Reakcje redoks
Wstęp teoretyczny:
Reakcja redoks jest to reakcja przebiegająca z wymianą elektronu. W reakcji tej bierze udział utleniacz oraz reduktor. Utleniacz przyjmuje elektron od reduktora co powoduje zmniejszenie się stopnia utlenienia (redukcja), natomiast reduktor oddaje elektron zwiększając swój stopień utlenienia (utlenianie). Ogólne równanie reakcji redoks można zapisać następująco:
![]()
Aby określić zdolność redukującą lub utleniającą pierwiastka wprowadzono pojęcie potencjału redoks, który można obliczyć ze wzoru Nersta.
![]()
n-ilość elektronów biorąca udział w reakcji
a=fc ![]()
ponieważ ![]()
= ![]()
wzór przyjmuje postać ![]()
ponieważ nie można obliczyć zerowego potencjału zatem przyjęto umownie za potencjał zerowy potencjał elektrody wodorowej.
Elektroda wodorowa jest to płytka platynowa pokryta czernią platynową omywana jonami wodorowymi o aktywności a=1 oraz pod ciśnieniem 1 atm. W układzie tym ustala się równowaga:
![]()
potencjał układu wynosi: 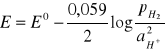
ponieważ ![]()
=![]()
=1 wzór przyjmuje postać ![]()
=0.
Obliczenie potencjałów różnych pierwiastków pozwoliło na ich uporządkowanie pod względem wartości potencjału redoks. Uporządkowanie to jest przedstawione w szeregu napięciowym metali, który jest wyraźnie podzielony na 2 grupy. Pierwszą grupe stanowią metale nie szlachetne o potencjale mniejszym niż potencjał elektrody wodorowej. Charakteryzują się one tym, że wypierają wodór z kwasu więc rozpuszczają się w nim np. Zn. Drugą grupę stanowią metale szlachetne o potencjale wyższym od potencjału elektrody wodorowej. Metale te nie wypierają wodoru z kwasu, więc nie rozpuszczają się w kwasach. Metale te można jednak rozpuścić w kwasach silnie utleniających jak np. kwas azotowy (V).
Na reakcje reoks duży wpływa ma również środowisko w jakim ta reakcja zachodzi. W środowisku silnie kwaśnym oraz zasadowym zwiększa się potencjał utleniający układu, natomiast w środowisku obojętnym zwiększa się potencjał redukujący. Ponieważ pH ma duży wpływ na przebieg reakcji stworzone formalne potencjał redoks, w którym uwzględniono wpływ pH. Przykładem reakcji, w której pH ma wpływ jest reakcja wanadu z jodem ![]()
w środowisku kwasowym reakcja ta przebiega w prawo wanad (V) utleni jodki redukując się do wanadu (IV) natomiast w środowisku obojętnym lub lekko alkaicznym jod utleni wanad (IV) do wanadu(V).
Wykonanie ćwiczenia
Redukcja przez metal.
Na blaszkę miedziową nanieść kroplę roztworu następujących soli: Hg2+, Hg2+2, Ag+, Cu2+, Bi3+, Zn2+. Po kilku minutach blaszkę przemyć wodą destylowaną.
Powstał czarny osad
![]()
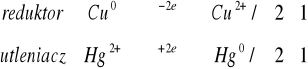
![]()
![]()
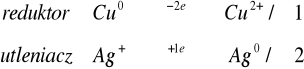
Powstał czarny osad
![]()
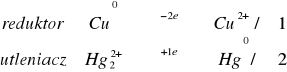
![]()
![]()
Reakcje utleniania miedzi zachodzi wyłącznie z metalami o większym potencjale niż potencjał miedzi
Na blaszkę cynową nanieść kroplę roztworu następujących soli: Hg2+, Hg2+2, Ag+, Cu2+, Bi3+, Zn2+. Po kilku minutach blaszkę przemyć wodą destylowaną.
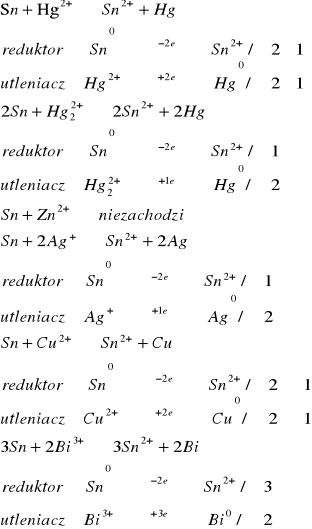
Teoretycznie reakcja ta powinna zajść we wszystkich przypadkach, poza reakcja z cynkiem, jednak w trakcie wykonania doświadczenia zaszła jedynie reakcja z bizmutem. Niezgodność z teorią może być spowodowana nie dokładnym oczyszczeniem blaszki
Na blaszkę glinową nanieść kroplę roztworu następujących soli: Hg2+, Hg2+2, Ag+, Cu2+, Bi3+, Zn2+. Po kilku minutach blaszkę przemyć wodą destylowaną.

Glin powinien zredukować wszystkie próbki. Podczas wykonywania ćwiczenia 2 reakcje (z Cu, Zn) nie zaszły co mogło być spowodowane nie dokładnym oczyszczeniem płytki
Własności utleniające jonów wodorowych.
Do czterech probówek zawierających kilka miligramów opiłków: żelaza, glinu, cynku, magnezu dodać 1 - 2 cm3 stężonego kwasu solnego. W razie potrzeby należy probówkę podgrzać. Obserwować wydzielanie się wodoru.
![]()
reakcja zaszła gwałtownie, nie wymagała podgrzania
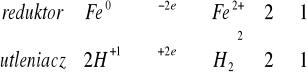
![]()
na początku reakcja zachodziła powoli, w wyniki podgrzania przyspieszyła
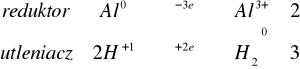
![]()
reakcja zaszła szybko
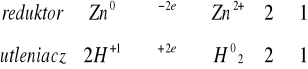
![]()
reakcja zaszła szybko.
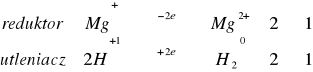
![]()
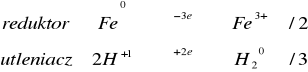
![]()
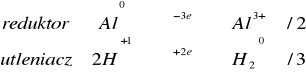
![]()
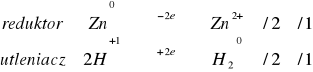
![]()
reakcja nie zajdzie
Reakcje zachodzą tylko w probówkach w których do reakcji z NaOH wzięto metale wykazujące właściwości amfoteryczne.
Moc utleniaczy i reduktorów - przewidywanie reakcji redoks.
Do probówki zawierającej 1 - 2 cm3 świeżo przygotowanego roztworu Na2SO3 dodać kilka kropel 0,01 M jodu w jodku potasu tj. J3-.
Przed reakcja roztwór był bezbarwny po dodaniu 0,01M jodku potasu nic się nie zmieniło. Reakcja nie zaszła
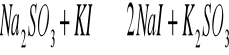
Do probówki zawierającej 1 - 2 cm3 świeżo przygotowanego roztworu NaNO2 dodać kilka kropel 2 M HCl oraz kilka kropel KJ. Obecność jodu sprawdzić dodając kroplę roztworu skrobi.
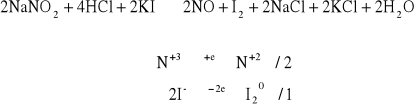
Do 1 - 2 cm3 roztworu NaNO3 dodać kilka miligramów pyłu cynkowego oraz 1 - 2 cm3 roztworu 6 M KOH. Roztwór delikatnie ogrzewać. Nad probówką zwilżonym papierkiem uniwersalnym badać obecność par amoniaku, którego występowanie świadczy o przebiegu reakcji.
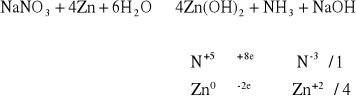
Papierek przyłożony podczas ogrzewania odbarwił się na niebiesko co świadczy o wydzielaniu się amoniaku i przebiegu reakcji zgodnym z równaniem:
Wpływ temperatury na kierunek reakcji redoks.
Do 1 - 2 cm3 roztworu szczawianu amonowego dodać kilka kropel 2 M H2SO4. Następnie dodać kilka kropel 0,01 M KMnO4. Wyniku doświadczenia roztwór stał się bezbarwny co świadczy o redukcji manganu.
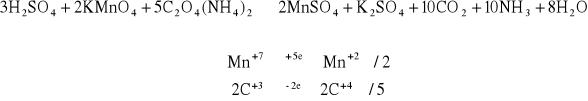
Identyczną próbę zrobić jak w pkt 1.4.1. tylko roztwór podgrzać. Ćwiczenie to zostało wykonane identycznie jak 1.4.1 z tą różnicą, że wyniku podgrzania odbarwienie nastąpiło znacznie szybciej.
Do 0,5 - 1 cm3 6% roztworu H2O2 dodać kilka kropel 2 M KOH oraz kroplę soli Cr3+. Roztwór wstrząsać przez kilka minut, a następnie pobrać część roztworu do oddzielnej probówki i dodać kilka kropel roztworu soli Pb2+ w celu stwierdzenia obecności jonów chromianowych w próbce. Pozostałą część roztworu ogrzewać przez kilka minut, następnie roztwór ostudzić i wykonać reakcję charakterystyczną na obecność jonów chromianowych przy pomocy jonów Pb2+.
Do roztwory wody utlenionej i 2M KOH dodaliśmy Cr3+ a następnie Pb2+ . Wyniku reakcji opisanej poniżej wytrącił się żółto-zielony osad.
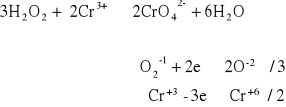
Do probówki wsypać odrobinę stałego PbO2, dodać 1 - 2 cm3 roztworu 2 M HNO3 oraz 1 - 2 kropel roztworu zawierającego jony Mn2+. Po kilku minutach wstrząsania osad odwirować i zaobserwować barwę roztworu po opadnięciu osadu.
Wyniku reakcji strącił się lekko brązowy osad, nie stwierdzono zmiany barwy roztworu.
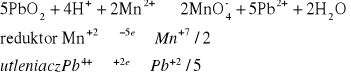
Reakcje utlenienia i redukcji w solach stopionych.
Do tygielka wsypać ok. 0,5 g mieszaniny azotanu(V) sodu i węglanu sodu (zmieszanych stosunku 1: 1) oraz dodać odrobinę soli Cr3+. Zawartość tygielka wymieszać bagietką i ogrzewać do momentu stopienia soli. Następnie tygiel ostudzić a zawartość tygla ostrożnie rozpuścić w wodzie. 1 - 2 cm3 otrzymanego roztworu przenieść do probówki i dodać około 1 cm3 roztworu zawierającego jony Pb2+ w celu stwierdzenia obecności jonów CrO42-.
Po dodaniu roztworu zawierającego Pb2+ dość szybko wytrącił się żółty osad. Świadczy to o obecności jonów na +6 stopniu utlenienia. W wyniku reakcji chrom utlenił się.
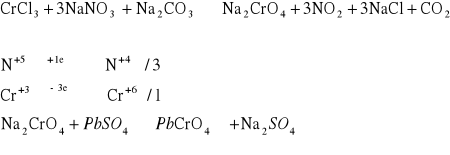
Reakcje redoks z udziałem związków organicznych.
Do 1 cm3 dichromianu potasu dodać 1 cm3 6 M H2SO4 oraz 1 cm3 alkoholu. Zaobserwować zmianę barwy roztworu świadczącą o przebiegu reakcji.
Pomarańczowy roztwór po dodaniu alkoholu powoli się odbarwił na jasno zielono. Świadczy to o redukcji chromu z +6 stopnia utlenienia na stopień +3.
![]()
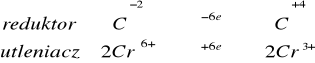
Wnioski:
W zadaniach 1.1.1 do 1.1.3 zachodziły te reakcje, w których potencjał jonu utleniającego był większy do potencjału metalu utlenianego. W doświadczeniu 1.1.2 powinny zajść prawie wszystkie reakcje. Nie zgodność z teorii z wynikami doświadczenie może być spowodowana nie dokładnym oczyszczeniem blaszki. Potencjały metali biorących udział w tych reakcjach zestawiono w tabeli poniżej.
Metal: |
Potencjał normalny [V] |
Hg/Hg2+ |
+0,85 |
|
+0,79 |
Ag/Ag+ |
+0,79 |
Cu/Cu2+ |
+0,34 |
Bi/Bi3+ |
+0,31 |
Zn/Zn2+ |
-0,76 |
Sn/Sn2+ |
-0,13 |
Al./Al3+ |
-1,6 |
W zadaniu 1.2.1 metale wyparły wodór z kwasu ponieważ mają niższy potencjał niż wodór, są metalami nie szlachetnymi. Poniżej zestawiono potencjały tych metali oraz wodoru.
Metal: |
Potencjał normalny [V] |
Fe/Fe2+ |
-0,44 |
|
-2,36 |
Zn/Zn2+ |
-0,76 |
Al./Al3+ |
-1,6 |
H/ H+ |
0 |
W reakcjach 1.4 badaliśmy wpływ temperatury na przebieg reakcji redoks. Na podstawie obserwacji można wywnioskować, że zwiększenie temperatury przyśpiesza przebieg reakcji.
Obliczanie stałych równowagi reakcji:
Do obliczenia stałej równowagi używam wzoru ![]()
Przykładowe obliczenie dla reakcji: ![]()
![]()
= +0,854
![]()
= +0,345
![]()
![]()
log K = 34,51
w analogiczny sposób obliczam pozostałe stałe równowagi. Wyniki zestawiono w tabeli poniżej.
Reakcja |
Stała równowagi (log K) |
K |
|
15,29 |
11,8 |
|
15,39 |
11,87 |
|
67,12 |
1,8 |
|
31,59 |
1,5 |
|
31,69 |
1,5 |
|
32,61 |
1,51 |
|
46,07 |
1,66 |
|
255,61 |
2,4 |
|
124,88 |
2,09 |
|
125,03 |
2,097 |
|
203 |
2,3 |
|
31,58 |
1,5 |
|
91,22 |
1,96 |
Topniki utleniające są szczególnie przydatne do utleniania substancji trudno rozpuszczalnej w wodzie. Stapiając się wraz z tą substancja utleniają ja do postaci łatwo rozpuszczalnej w wodzie co pomaga na przeprowadzenie dalszej analizy. Przykładem topnika utleniającego może być nadtlenek sodu.
![]()
![]()
![]()
![]()
![]()
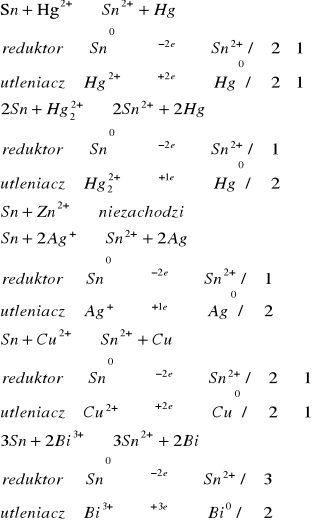

![]()
![]()
![]()
![]()
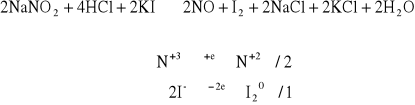
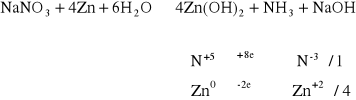
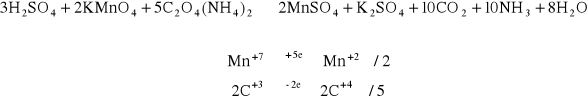
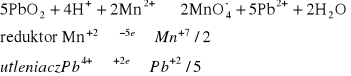
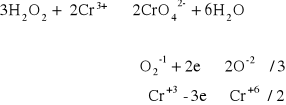
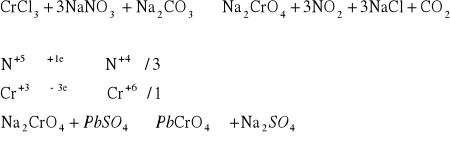
Wyszukiwarka
Podobne podstrony:
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
sprawko cw2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawko z kompleksów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
sprawko cw1 wersja 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron