1.Dlaczego katalizator trójfazowy nie jest doskonały?
- działa w wysokich temperaturach
- musi być suchy aby działać
- trzeba go wymieniać co jakiś czas.
2. Powody dezaktywacji katalizatora:
Zmiany jakim ulega katalizator w mieszaninie reakcyjnej mogą prowadzić do obniżenia aktywności w czasie, czyli dezaktywacji katalizatora na skutek zmniejszenia się powierzchni składnika aktywnego a także do zmiany selektywności katalizatora.
- spiekanie (wynika z samej struktury)- polega na łączeniu się w podwyższonej temperaturze małych cząstek (kryształów) ciała stałego w większe czemu towarzyszy zmniejszenie powierzchni właściwej, objętości porów, liczby defektów a także w niektórych przypadkach zmiany morfologii krystalitów (jest procesem samorzutnym). Powoduje powstanie wiązań wzajemnie sąsiednich krystalitów, które łącza się w wyniku spiekania, granica złączenia wzrasta i tworzy się aglomerat.
- zatruwanie (zjawisko chemiczne)- chemiczna blokada miejsc aktywnych. Blokowanie katalityczne aktywnych miejsc na powierzchni przez atomy lub cząsteczki ulegające silnej chemisorpcji trucizn (bardzo silne wiązania, czyli nieodwracalne). W pewnych procesach stosuje się częściowe zatruwanie katalizatora małymi ilościami trucizny w celu obniżenia aktywności o niekorzystnym kierunku np. SiCl, S, Cl2; nieodwracalne pokrywanie się powierzchni nieaktywnymi substancjami powstającymi w czasie reakcji ubocznych lub zanieczyszczeniami reagentów (truciznami).
- zwęglanie (karbonizacja)-w wyniku ogrzewania rozpoczyna się rozkład węgla, następuje osadzanie się substancji nieaktywnych (koksu), następuje zablokowanie powierzchni krystalitów otoczką węglową; zjawisko fizyczne.
Mechanizmy spiekania (cząsteczek metalicznych na nośniku):
metoda dyfuzji (migracji) krystalitów do powierzchni
metoda dyfuzji poprzez fazę gazową atomów lub związków metali wyrwanych z małych cząstek w kierunku większych kryształów,
zjawisko koalescencji- skupienie się krystalitów na powierzchni po zetknięciu (zlewanie)
3. Formy dyspersji/ stany:
- pojedyncze atomy na nośniku (rozmieszczone w sposób chaotyczny)
- tratfy ( termicznie niestabilne; udekorowane pojedynczymi atomami), rafty
- klastry ( klaster-grono powiązanych ze sobą atomów)
- krystality
- kryształy (makrokryształ)- nie jest dobry w katalizie, bo ma małą powierzchnię
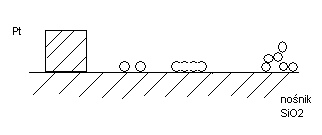
1- faza krystaliczna
2,3,4- faza bezpostaciowa (niekrystaliczna)
Pt może być osadzona na dużych kryształach, na pojedynczych lub trójwymiarowych- nie tworzących kryształów.
Tak więc metal może być rozproszony na nośniku jako:
1-kryształy
2- atomy
3- tratwy (rafts)
4- klastery (cluster, grono nieregularnych atomów).
W katalizatorze metal jest naniesiony jako mieszanina dyspersyjna, nigdy jako monodyspersja. Dążenie jest takie aby występował w katalizatorze jeden z 4 typów dyspersji a kryształy były tego samego kształtu i rozmiaru.
4. 5 zjawisk powierzchniowych:
- adsorpcja fiz., chemisorpcja, korozja, dyspersja, adhezja, kohezja, napięcie powierzchniowe, migracja powierzchniowa, menisk wypukły i wklęsły, tarcie, flotacja, desorpcja. NOŚNIKI: SiO2-Al2O3, α-Al2O3 i SiO2
5. Co to jest trucizna i co powoduje?
Trucizny są to związki org. nieorg. np. N, P, Ar, S, aminy, RS, H, R2S. Trucizna jest tym samym co katalizator, różni się tylko energią wiązania. Powoduje zatrucie, czyli formę dezaktywacji katalizatora. Trucizna może powodować szybki spadek aktywności katalizatora tzw. zatruwanie katalizatora. Szczególnie wrażliwe na zatrucia są kat. zawierające metale. Najbardziej szkodliwymi substancjami są związki siarki, azotu, arsenu i fosforu.
6. Jakie spaliny w samochodzie oczyszcza katalizator?
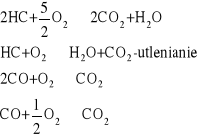
Pt
![]()
Rh
7. Czym różni się kompleks aktywny od produktu aktywnego (przejściowego)?
Długością trwania- kompleks jest b. krótkotrwały a produkt to ostateczny etap. Kompleks aktywny trwa krócej niż τ <10-13. Kompleks aktywny zmniejsza entalpię ΔH a zwiększa entropię ΔG; szybko przechodzi w końcowy produkt ( nietrwały stan przejściowy pomiędzy substancjami a prod. reakcji)
8. Gdzie i czym są centra aktywne?
- na powierzchni, tam gdzie znajduje się największe ugrupowanie atomów kat. reagujących z substratem,
- to ugrupowanie atomów lub atomy katalizatora oddziałujące chemicznie z substratami. Pojedyncze atomy lub gr. atomów na powierzchni katalizatora, które tworzą wiązanie z cząsteczkami reagującej substancji w procesie powstawania produktu przejściowego i kompleksu aktywnego.
9. Co to są katalizatory bimetaliczne i dwufazowe:
- bimetaliczne to Pt-Rh/γAl2O3 , Pt-Ge/γAl2O3, Pt-Sn/γAl2O3, Pt-Rh/MgO-Al2O3-SiO2 (kordieryt); powodują wzrost aktywności procesów i odporności na zwęglanie i spiekanie. Składają się z 2 metali w porównywalnych ilościach osadzonych na tym samym nośniku np. Pt-Pd/SiO2.
Pt/SiO2- katalizator monometaliczny,
Pt-Pd/ SiO2- kat. bimetaliczny,
(Me- )n/ SiO2- multikatalizator.
Ilość metalu w procentach wagowych na nośniku:
5 % wag. Pt/ SiO2 w 100 g katalizatora jest 5 % platyny
Katalizatory przemysłowe mają przeważnie od 0,1-1 % metalu. Ta ilość jest wystarczająca bowiem metal na nośniku ma bardzo dobrze rozwiniętą powierzchnię. Ostatnie badania wykazały, że centra aktywne nie są stateczne, podlegają ciągłym zmianą, ruchom, pulsują, przekształcają się, znikają, pojawiają się na nowo.
Katalizator dwufazowy- gdy reakcje pewne zachodzą na powierzchni fazy aktywnej (hydrogenacja, dehydrogenacja) inne zaś na centrach kwasowych nośnika (kraking, izomeryzacja). Każda z faz katalizatora dwufazowego może stanowić składnik dla poszczególnych etapów. Składa się z jednego metalu osadzonego na nośniku M/nośnik (M-faza rozdrobniona, nośnik- faza nieaktywna katalitycznie)
10. Co to nośnik?
- ma nieregularna powierzchnię
- rozwija powierzchnie aktywną katalizatora
- wpływa na szybkość reakcji
- jest nieaktywny.
Nośnik- substancja, która zwiększa stosunek powierzchni aktywnej do jej masy; materiały naturalne występujące w przyrodzie (ziemia okrzemkowa, gliny, pumeks); syntetyczne nieorganiczne materiały (tlenki glinu, krzemu, magnezu, węgiel aktywny); polimery organiczne np. nylon.
Nośnik- to nieaktywne katalitycznie ciało stałe na powierzchni którego osadza się metal pełniący rolę katalizatora. Ich rola polega na: zwiększeniu powierzchni swojej fazy metalicznej, utrzymaniu dużej dyspersji fazy metalicznej.
11. Regeneracja katalizatorów (formy regeneracji) i redyspersja
- zwęglanie- trzeba spalić ( wys. temp.) i j.n.
- utlenienie- w przypadku spiekania, żeby rozbić warstwę podziałać w atmosferze tlenowej wys. temperaturą i zredukować 150-500°C
- uwodornienie (redukcja gazowym wodorem)
- przemywanie kwasem (HNO3, HCl)
- powtórne formowanie
- modyfikacje termiczne (O2, N2)
Regeneracja- odzyskanie aktywności kat.
a) spiekanie-zregenerować przez utlenianie, redyspersję
b) zatrucie- zregenerować przez utylizację, rozpuszczanie metalu i ponowne osadzanie na prekursorze, nośniku
c) pokrywanie otoczkami węglowymi- zregenerować przez spalenie w temp. 1000°C ; temp. dobrać tak, aby nie doszło do spiekania a więc zatruwania pierwszego typu,
- uwodornienie,
- przemywanie kwasami,
-sianie, oblewanie,
- mielenie i powtórne formowanie.
Regeneratywność- określa na ile i ile razy można przywrócić utraconą aktywność kat.
Regeneracja jest ciężka, bowiem regenerując jeden typ zatrucia można zakłócić drugi rodzaj.
12. Katalizator a promotor
- promotor- aktywator- po dodaniu kataliz. powoduje wzrost szybkości reakcji. Bez katalizatora nie działa, ale z katalizatorem już tak. Katalizator bez promotora działa.
Promotor- podstawowy skł. katalizatora, polepsza jego aktywność, selektywność lub czas życia. Promotory mogą modyfikować strukturę i teksturę katal. oddziałując chemicznie z katal. lub wpływając na dyspersję fazy aktywnej w drodze oddziaływań międzyfazowych.. Promotory: potas, fosfor i berylowce.
Promotor:
- modyfikuje strukturę fizyczną i chemiczną substancji aktywnych,
- zapobiegają rekrystalizacji sub. aktywnej,
- hamuje niekorzystne przemiany fazowe substancji aktywnych, niepożądane reakcje sub. aktyw. z nośnikiem.
- zapobiegają niekorzystnym reakcjom ubocznym np. koksowaniu,
- poprawiają selektywność procesu.
Katalizator:
- możemy rozróżnić (oddzielić) od produktu końcowego,
- nie zmienia termodynamiki reakcji, nie przesuwa stanu równowagi
- nie występuje w sumarycznym zapisie reakcji.
13. Co to jest katalizator?
To:
- głównie pierwiastki przejściowe, gdyż mają dużą liczbę stopni utleniania (różnych),
- pierwiastki lub związki chemiczne w postaci gazów, cieczy, ciał stałych amorficznych lub krystalicznych a także układów koloidalnych,
- rolę katalizatorów reakcji zachodzących w org. żywych pełnią enzymy,
- w reakcjach zachodzących w roztworach katalizatorami mogą być jony H+ lub OH- (kataliza kwasowo-zasadowa),
- prawie wszystkie pierwiastki bloku d, ich tlenki , siarczki czy
- wśród pierwiastków: metale grup: VIII, VIA, VIIA,
- wśród zw. chem.: tlenki grup III i IV,
- kompleksy metaloorganiczne.
Jego działanie opiera się na powstawaniu w reakcji z substratem przejściowego związku- który jest nietrwały, reaguje dalej z wytworzeniem produktu końcowego i odtworzeniu wyjściowego katalizatora
Zachowanie się katalizatora:
- wpływa jedynie na szybkość osiągania stanu równowagi chemicznej,
- nie wpływa na położenie stałej równowagi chemicznej (położenie zmienia temp.),
- oddziałuje chemicznie z substratami reakcji,
- nie wchodzi do zapisu stechiometrycznego,
- tworzy nietrwałe połączenia przejściowe (kompleks aktywny),
- praktycznie nie zużywa się w reakcji
Istota działania katalizatora polega na obniżaniu energii aktywacji reakcji względem reakcji bez katalizatora.
Katalizator może składać się z:
kilku metali- multimetaliczny,
jeśli jeden metal- monometaliczny.
Faza rozpraszająca- nieaktywna, dysperguje fazę aktywną na małe elementy izolowane cząsteczki- kryształy.
Krystality mają bardzo istotne znaczenie, ich układ jest specyficzny.
Dla katalizatora platynowego Pt jest rozproszone na SiO2 epiteksjalnie.
Epitaksja:
kryształ rośnie na podłożu, które nie jest chemicznie związane z kryształem,
kryształ nie rośnie jednak dowolnie- istnieją jakieś oddziaływania pomiędzy nim a podłożem,
kryształy muszą mieć taką budowę taką jak dany metal.
Metale:
krystalizują w układzie(regularnie w ciele centralnie usieciowany) b.c.c.
krystalizują w ukł. ( w narożach i na każdym narożu sciany) f.c.c.
krystalizują w ukł. heksagonalnym h.p.c.
Metal będący katalizatorem, skł. się z dużej ilości małych elementów.
14. Kataliza hetero i homogeniczna/ Rodzaje katalizy
Heterogeniczna- wielofazowa (katalizator i reagenty znajdują się w różnych fazach); reakcja zachodzi na granicy faz katalizator-substraty (osadzanie kat. na nieaktywnych katalitycznie nośnikach); wiązania pomiędzy kat. a nośnikiem są z reguły natury chemicznej.
Homogeniczna- jednofazowa, ta sama faza reagentów i katalizatora; jako kat. stosuje się kompleksy metaloorganiczne; reakcje zachodzą już w niskich temp.
Enzymatyczna (biokataliza)- przyspieszenie lub opóźnienie reakcji chem. przebiegających w żywym organizmie wskutek obecności biokatalizatora.
15. Adsorpcja fiz.
- wywołana siłami Van der Wallsa (oddziaływanie międzycząst. między trwałymi dipolami a nietrwałymi jak i indukowanymi)
- ciepło 480(470)-1450 J/kcal- małe
- wielowarstwowa
- zwykle maleje ze wzrostem temp.
- łatwa desorpcja (odwracalność)
Ads. chemiczna (Chemisorpcja):
- wywołana wiązaniami natury chemicznej
- często rośnie ze wzrostem temp.
- duże ciepło 4800 J/kcal większe od 4200 J/mol
- jednowarstwowa
- aktywowana (wymaga Ea)
- trudniejsza desorpcja.
16. Napisać reakcję katalityczną, przedst. na wykresie

17. Co ulega silnej chemisorpcji?
- trucizny różnego rodzaju.
- atomy i cząsteczki trucizn np. Pb 2+, S 2-, H2O siarczki, arsen, rtęć, substancje , które zatruwają katalizator (zanieczyszczają go). Jest to nieodwracalne.
Chemisorpcja- prowadzi do gruntownych zmian w strukturze cząsteczek adsorbentu; jest jednowarstwowa; polega na wytworzeniu nowych wiązań chemicznych między zaadsorbowanymi cząsteczkami reagentów a centrami aktywnymi na powierzchni kat. R-CAK;
pokrywanie się powierzchni nieaktywnymi substancjami w czasie reakcji ubocznych lub zanieczyszczeniami reagentów, zatruwanie katalizatora
18. Co znaczy, że chemisorpcja jest aktywowana?
Wymaga dostarczenia energii aktywacji- równej energii reakcji chem.; posiada silną energię aktywacji, zdolność do pochłaniania…
Dlatego, że najpierw musimy dostarczyć minimalna energię (aktywacji) aby mógł wytworzyć się kompleks aktywny.
19. Dlaczego mała ilość trucizny zatruwa cały katalizator?
- katalizator nie działa całą powierzchnią tylko centrami aktywnymi; na nich zostaje sorbowana trucizna
- trucizna wpływa na metabolizm miejsc aktywnych, co za tym idzie na selektywność
- gdy trucizna trafi na centrum aktywne katalizatora to katalizator jest cały zatruty, bo pracuje tylko centrami aktywnymi.
20. Ile warstw powstaje przy absorpcji wodoru na nośniku Pt?
- jedna
21. Jaka budowę maja zeolity ?
- sit molekularnych
zeolit φ= 0,41 mm
fojryt φ= 0,74 mm
- wysoko uporządkowana konstrukcja,
- działa jak sito molekularne,
- bardzo regularna budowa- stały wymiar porów,
- duża powierzchnia właściwa,
- wysoka stabilność termiczna,
- niektóre zeolity mają zdolność wymiany jonów znajdujących się w lukach strukturalnych na inne jony,
- skł. się z przestrzennie ułożonych tetraedrów SiO4 różniących się ładunkiem elektrycznym,
- są to kanały, pory kryształów przez co można je modyfikować
Wewnątrz kostki zeolitu jest klatka, znajduje się ona na skrzyżowaniu kanałów. Jest to frakcja minerałów, uwodnionych glinokrzemianów n Al2O3 ⋅ m SiO2 i krzemianów przeważnie wapnia i sodu
22. Wada katalizatorów samochodowych.
Kataliza. wielofunkcyjne pracują bez dopływu dodatkowego powietrza. Jednocześnie neutralizują NOx, CO i HC.
- wys. temperatura pracy kat. i skraplanie mieszanki na ściankach kolektora ssącego przy zimnym silniku oraz mniej precyzyjne dawkowanie paliwa,
- uwalnianie platynowców do środowiska jako rezultat ścierania katalizatora
- nie działają przy niskich temperaturach
Dwie podstawowe wady katalizatorów jeśli chodzi o emisję zanieczyszczeń:
- pierwszy moment- dogrzanie reaktora ( katalizator pracuje w temp. 700°C), w tym czasie katalizator nie pracuje prawidłowo a emituje zanieczyszczenia do środowiska
- drugi moment- związany z szybkością pojazdu- im szybciej jedzie tym wzrasta emisja zanieczyszczeń przy prędkości powyżej 150 km/h.
23. Miejsca aktywne:
- naroża, wypukłości,
- określone ściany mikrokrystalitów,
- defekty faz,
- w przypadku adsorbentów złożonych- granice faz,
- w katalizatorach kwas- zasada- centra aktywne spełniają rolę kwasów Lewisa (np. jony Al 3+ na powierzchni Al2O3) i Brőnsteda (np. grupy kwasowe OH na powierzchni żelu Al2O3).
Miejsca aktywne są to ugrupowania atomów katalizatora, które oddziałują z substratami. Znajdują się na powierzchni katalizatora.
24. Katalizator kontaktowy (katalizator heterogeniczny) -stały katalizator wpływający na szybkość reakcji chemicznej w układach ciekłych i gazowych np. V2O5 (utlenianie SO2 do SO3) RYSUNEK
( katalizator znajduje się w innej fazie niż reagenty); substancja gazowa przepływa przez stały nieruchomy katalizator z okresową kontrolowaną szybkością. Katalizator unieruchomiony jest w reaktorze o kontrolowanej regularnej temperaturze. Rodzaj stosowanego nośnika zależy od typu reakcji katalizatora oraz warunków prowadzenia reakcji kataliz. Najczęściej w formie ciała stałego, reagenty zaś w innej formie.
Nośnik- stopień rozdrobnienia substancji aktywnej na nośniku może się zmieniać w szerokim zakresie, charakteryzuje się zazwyczaj struktura porowatą, stosuje się w celu zwiększenia stosunku powierzchni aktywnej substancji do jej masy, wpływa na szybkość reakcji.
25. Czym różni się nośnik od sita molekularnego?
Sito charakteryzuje się porami o regularnych kształtach i rozmiarach , regularnie rozłożone; może być nośnikiem; używane są do oczyszczania gazów i cieczy, do pochłaniania ze środowiska atomów promieniotwórczych oraz jako wymieniacze jonów nośniki katalizatorów.
Nośnik ma duży stopień dyspersji, nieregularną powierzchnię, nieregularne pory, nie może być sitem molekularnym, osadza się na nim katalizator. Pozwala na najlepsze spotkanie katal. z substancją. Powiększa powierzchnię katalizatora.
amorficzne- nie krystaliczne np. sadza węglowa; badanie rentgenowskie pozwala określić siatkę
26. Wymień 5 katalizatorów M/związek
Ni / γ-Al2O3
Cu / ZnO
Ni / Al.,Ni
Fe / SiO2
Co-Mo / γ-Al2O3
Ni / glinokrzemiany
Pt-Rh / kordieryt
Fe / F2O3
Ni / TiO2
Pt / SiO2
Rh / SiO2
27. Reakcje otrzymywania HNO3 i H2SO4- patrz pyt. 41, pkt. A
28. Wymień zatrucia jakie mogą być na katalizatorze Me/nośnik.
29. Wymień 5 katalizatorów Me/nośnik
Ni / SiO2-Al2O3 (hydrokraking) SiO2-Al2O3 (kraking)
Pt / γAl2O3 (reforming) /Pt-Re / γ-Al2O3
Cu/ZnO /Pt-Rh / γ-Al2O3
Ni / γ-Al2O3 (kraking parowy) CrOx /SiO2
Co-Mo / γ-Al2O3 (hydroodsiarczanie) Pd / γ-Al2O3
Ni/SiO2 (uwodornienie tłuszczów) Co-MnO2-MgO / SiO2
30. Jakie zanieczyszczenia usuwa katalizator samochodowy?
NOx, CO, CH - zatrucia kat, samochodowego
2NO + 2CO = N2 +2CO2
2CO + O2 = 2CO2
2C2H6 + 7O2= 4 CO2 + 6H2O
31. Kompleks aktywny- jest to niestabilne połączenie substratu/-ów i katalizatora o krótkim czasie życia <10-13 [s], nie adsorbuje się, nie może być zaabsorbowane. Produkt aktywny- może być zaabsorbowany lub nawet wydzielony, może żyć dłużej.
32. Przyczyny zatrucia katalizatora
Przyczyną zatrucia katalizatora jest najczęściej zabrudzenie substratów związkami siarki, azotu, siarki org., metalami ciężkimi. Dlatego często stosuje się odsiarczanie lub azotowanie substratów.
33. Adsorpcja a kataliza
W reakcjach katalizy heterogenicznej decydujące znaczenie ma chemisorpcja, która polega na wytworzeniu nowych wiązań chemicznych pomiędzy zaadsorbowanymi cząsteczkami reagentów a centrami aktywnymi katalizatora.
34. Katalizator bifunkcyjny- kat. typu Pt / γ-Al2O3, gdyż pewne reakcje zachodzą na powierzchni fazy aktywnej Pt (np. hydrogenacja lub dehydrogenacja), inne zaś jak kraking czy izomeryzacja poprzez jon karbonowy na centrach kwasowych nośnika. Ma centra aktywne dwojakiego rodzaju, nie musi być bimetalem ani trimetalem czy multi.
35. Otrzymywanie H2SO4 w przemyśle
- na drodze wieloetapowego procesu; produktem wyjściowym jest tu siarka, najpierw spala się ją otrzymując tlenek siarki (IV)
S + O2 → SO2
Następnie otrzymaną mieszaninę tlenku siarki (IV) rozpuszcza się w stężonym H2SO4. Powstaje oleum, które później rozcieńcza się H2O do pożądanego stężenia.
H2O + SO3 → H2SO4
36. Otrzymywanie HNO3 w przemyśle
- reakcji katalitycznego utlenienia amoniaku w temp.900°C i obecności platyny i rodu.
4NH3 + 5O2 → 4NO + 6H20
Tak uzyskany tlenek azotu II utlenia się do tlenku azotu III, który potem reaguje tlenem i wodą dając kw. azotowy:
2NO + O2 → 2NO2
NO2 ulega rozpuszczeniu w H2O i ulega dysproporcjonowaniu:
2NO2 + H2O → HNO3 + HNO2
W reakcji powstaje kw. azotowy V i III. Ten ostatni jest nietrwały i ulega dalszemu dysproporcjonowaniu:
3HNO2 → HNO3 + 2NO + H2O
Powstały tlenek azotu II jest ponownie utleniany i wykorzystany w procesie.
37. Zjawiska powierzchniowo czynne
Napięcie powierzchniowe- jest to praca jaką należy wykonać aby zwiększyć powierzchnię cieczy o jednostkę.
Kohezja- stawianie oporu przez ciała fiz., poddawane rozdzielaniu na części. Jej miarą jest praca potrzebna do rozdzielenia określonego ciała na części podzielone przez powierzchnię powstałą na skutek tego rozdziału
Adhezja- łączenie się ze sobą powierzchniowych warstw ciał fiz. (stałych lub ciekłych). Miarą adhezji jest praca przypadająca na jednostkę powierzchni, którą należy wykonać aby rozłączyć stykające się ciała.
Adsorpcja- proces wiązania się cząsteczek atomów lub jonów na powierzchni lub granicy faz fizycznych powodujący lokalne zmiany stężenia.
Elektrokapilarność- zmiana napięcia powierzchniowego na granicy faz elektroda- roztwór wywołana wymuszoną zmianą skoku potencjału na tej granicy.
Powstawanie szczątków innej fazy w danym ośrodku (bąbelków pary przy wrzeniu).
38. Czy promienie świetlne mogą być katalizatorem w katalizie heterogenicznej?
Nie:
ponieważ zostaje pobrana energia i zmienia się długość fali a katalizator nie może się zużywać ani zmieniać,
po zakończeniu reakcji zmienia się stan energetyczny, uwalnia się pewna ilość kwantów a katalizator charakteryzuje się tym, że pozostaje niezmieniony po zajściu reakcji,
bo, katalizator przed i po reakcji musi być w tej samej ilości.
39. Metody identyfikacji /pomiaru dyspersji
Aby poznać jakie są formy dyspersji metalu na nośniku prowadzi się badania takie jak:
selektywna chemisorpcja gazów (np. O2, H2, CO)- chemisorbujemy wybiórczo gaz tylko na centrach metalu a nie na nośniku i obliczamy powierzchnię właściwą i jakie cząstki występują; gazy muszą być inertne; metoda najczęściej stosowana. Znając liczbę atomów powierzchniowych metalu (obliczoną na podstawie pomiaru ilości zaadsorbowanego gazu), całkowitą ilość metalu w próbce oraz powierzchnię zajmowaną przez 1 atom metalu, możemy obliczyć wielkość powierzchni właściwej fazy metalicznej,
metoda rentgenograficzna (3-100 nm)- metoda dyfrakcji promieni X; oparta na podst. poszerzenia B linii dyfrakcyjnej; z wzoru Sherrera:
B= 0,893 λ / d cos θ
B- stopień poszerzenia wiązki
0,893- współczynnik poszerzenia
mikroskopia elektronomikroskopowa (1nm i wiecej)- światło mikroskopowe przechodzi przez struktury i pokazuje obrazy- formy dyspersji,
metoda oparta na pomiarze podatności magnetycznej- tylko do ferromagnetyków, czyli Co, Ni i Fe.
40. Katalizatory homogenne w porównaniu z heterogennymi:
- bardziej selektywne, specyficzne, działają w łagodniejszych warunkach.
41. Podstawowe procesy przemysłowe w katalizie heterogenicznej
A) przemysł nieorganiczny:
- synteza amoniaku:
N2+ 3H2 → 2NH3
NH3→HNO3, - produkt docelowy (np. nawozy sztuczne)
Katalizator: Fe-K2O-CaO (Fe promowane K2O i CaO; tzw. promotory)- kreseczki ozn. multikatalizator, albo jak w tym przypadku promowanie dodatkami- uaktywniaczami
- utlenianie SO2
![]()
SO3→H2SO4 -produkt docelowy
Katalizator: Pt, V2O5-K2SO4, Fe2O3 (Pt albo V2O5- promowany K2SO4)
- synteza NO
![]()
NO→HNO3- produkt docelowy
Katalizator: Pt-Rh (kat. bimetaliczny), Fe2O3-Cr2O3 (kat. tlenkowy)
B) produkcja gazu syntezowego i wodoru (parą wodną nad rozgrzanym pyłem węglowym)
- reforming gazowy (parowy) →CO+H2
Kat.: Ni / γ-Al2O3
- przeróbka CO:
CO+H2O→CO2+H2
Katalizator: Fe2O3, Zn-CuO-Cr2O3
C) przemysł rafineryjny i surowców petrochemicznych:
- kraking katalityczny: benzyna, alkeny, węglowodory aromatyczne.
Kat.: glinokrzemiany amorficzne, zeolity (glinokrzemiany krystaliczne, mają strukturę tetraedru SiAlO4- tzw. chemiczne oraz fizyczne- kryształy.
- reforming: wysokogatunkowa benzyna
Kat.: Pt-Re / γ-Al2O3 - katalizator bifunkcyjny
- hydrokraking: benzyna (rozbijanie łańcuchów za pomocą wodoru)
Kat.: Ni lub Ni-W/glinokrzemiany
- hydroodsiarczanie: produkty naftowe pozbawione zw. siarki
Kat.: Co-Mo / γ-Al2O3, MoS2, WS2
-polimeryzacja alkanów: polimery PE, PP, oligomery.
Kat.: CrOx/SiO2-kat.Pfilipsa, P2O5/SiO2
- synteza Fischera-Tropscha: węglowodory, benzyna, synteza z CO, C, H2
Kat.: Co, Ni, Fe lub Co-ThO2-MgO/SiO2
- alkilowanie benzenu: kumen, etylobenzen→detergenty, (wstawianie gr. alkilowych CH3, C2H5)
Kat.: zeolity, glinokrzemiany.
42. Co powoduje silną selektywność?
Promotor- przyspiesza lub opóźnia działanie katalizatorów.
43. Ile warstw adsorpcji utworzy się przy adsorpcji H2 / Pt?
Powstanie 1 warstwa, ponieważ kat. taki jak Pt powoduje adsorpcję dysocjatywną (chemisorpcję).
44. Wymień 4 nośniki
Al2O3, MgO, La2O3, Cr2O3, SiO2, zeolity syntetyczne, glinokrzemiany, MgO-Al2O3-SiO2, γ-Al2O3, TiO2, CrO3, teflon.
45. Zjawiska jakim ulega katalizator heterogeniczny? (etapy heterogenicznej reakcji katalitycznej):
Transport substratu do powierzchni katalizatora (dyfuzja)
Dyfuzja substancji w porach katalizatora
Chemisorpcja substancji w centrach aktywnych kat.
Reakcja katalityczna (kompleks aktywny)
Desorpcja produktów z pow. kat.
Dyfuzja produktów z porów katalizatora
Etapy 3, 4, 5, to procesy chemiczne składające się na reakcję kat,
Etapy 1, 2 i 6 to procesy fizyczne.
Wszystkie te 6 czynników warunkuje (reguluje) szybkość reakcji kat.
46. Aktywność Ak:
ilościowa miara oddziaływania przyspieszającego,
różnica między szybkościami r. chemicznej zachodzącej w obecności katalizatora Vk i bez niego Vn:
Ak= Vk - Vn
a ponieważ Vk >> Vn to: Ak ∼ Vk
jest wielkością charakteryzują układ katalityczny (katalizator- reagenty),
ma sens jedynie w odniesieniu do określonej reakcji:
![]()
Mówimy zatem o aktywności kat. w reakcji uwodornienia benzenu do cykloheksanu.
47. Selektywność Si:
jest ilościową miarą działania ukierunkowującego,
stosunek ilości wybranego produktu do ilości wszystkich produktów
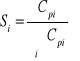
definiując w stosunku do liczby moli przereagowanego substratu A:
![]()
selektywność w reakcjach przemysłowych od 75-90 %; enzymów-100 %
48. Katalizatory metal/nośnik np.Pt/SiO2; wady i zalety wynikające z ich korzystania
Me- faza aktywna
Nośnik- faza nieaktywna, rozproszona.
bardzo duża powierzchnia właściwa na metalu (20-300 m2/g) w skutek objętości fazy aktywnej w postaci krystalitów o wielkości kilka nm
wysoka stabilność termiczna, bo kontakt między krystalitami nie jest zbyt bliski
można tolerować niewielkie straty kat., ponieważ zwykle zawiera on od 1-10% metalu na nośniku,
łatwość operowania katalizatorem,
odporność na zatrucie, duże procesy dezaktywacji,
łatwość i wygoda w regeneracji
w środowisku ciekłym można odzyskać poprzez osączenie.
49. Półprzewodniki- metale grupy przejściowej posiadają wakancje-luki-centra aktywne; domieszki takie jak K2SO4 powodują powstanie wakancji.
![]()
Kat. Fe2O3 - MoO3 (promotor)
50. Ochrona środowiska
Usuwanie CO2 i węglowodorów z przemysłowych gazów odlotowych i spalin samochodowych. Stosowane kat.: Pt hopkalit (MnO-CuO-CoO).
Usuwanie NOx, kat. V2O5-TiO2
Usuwanie SO2, H2S (reakcja Clausa). Kat.: zeolity.
51. Prognozy:
Procesy wykorzystujące syntetyczne katalizatory nieorganiczne będą dominowały w przemyśle chemicznym od lat 2050-2100.
Przez okres najbliższych kilkunastu lat pozostaną aktualne badania nad poszukiwaniem nowych katalizatorów.
Dobór katalizatorów będzie się w coraz większym stopniu opierał na podstawach nauki o katalizie, zastępując prace empiryczne.
52. Przemysł petrochemiczny
1. Uwodornienie
![]()
Kat. ZnO-Al2O3-CuO
![]()
Kat.: CuO-Cr2O3
nienasycone kw. tłuszczowe![]()
nasycone kw. tłuszczowe Kat.: Ni , Ni-Al. (kat. Raney'a)
Selektywne utlenianie
![]()
Kat.: Ag
![]()
Kat.: Bi, FeSbO4, molibdeniany, Mo3O9
![]()
(bezwodnik maleinowy) Kat.: V2O5-MoO3; głębokie utl.
53. Katalizatory heterogeniczne, które służą w ochronie środowiska do niwelowania zanieczyszczeń są to:
pierwiastki d-elektronowe:
- żelazowce,
- platynowce lekkie,
- platynowce ciężkie,
- złoto.
tlenki metali- V2O5, TiO2, MoO3- działają samoistnie, nie osadzone na nośniku, ponieważ same są porowate,
tlenki ceramiczne- Al2O3 (α, β, γ, δ), γ- najbardziej porowaty; SiO2 (wiele odmian krystalicznych i amorficznych), MgO (stosowany rzadko), La2O3, TiO2
Nośniki:
węgiel aktywny
ziemie okrzemkowe- nAl2O3 ⋅ mSiO2- glinokrzemiany o jednakowym kształcie kanalików np. zeolit A-4,81 A
nośniki nietypowe- pumeks, PE, PS.
54. Fizykochemiczna charakterystyka katalizatorów:
stężenie metalu na nośniku w % wag.,
dyspersja fazy aktywnej (średni rozmiar katalizatorów d),
rozkład wielkości kryształów,
kształt i lokalizacja kryształów na nośniku,
ustalenie zawartości zanieczyszczeń (np. Cl, S, K).
55. Metody zmniejszenia emisji NOx:
metody pierwotne (czyste)- kontrola procesu spalania:
zawartość azotu w paliwie,
konstrukcja palnika,
konstrukcja pieca
metody wtórne (obróbka gazów spalinowych):
sposoby mokre:
utl. w fazie gazowej i absorpcja,
utl. w fazie gazowej, absorpcja, redukcja
sposoby suche:
redukcja niekatalityczna
redukcja katalityczna (SRK- selektywna redukcja katalityczna; katalizatory SRK: Pt, Rh, Pd, V2O5, TiO2, MoO3, V2O5-TiO2)
adsorpcja (np. na sitach molekularnych)
napromieniowanie.
56. Różnorodność procesów katalitycznych w przyrodzie:
kataliza w roztorach:
kwasowo- zasadowa,
związana z przeniesieniem elektronów,
za pomocą kompleksów metaloorganicznych
za pomocą makrocząsteczek,
związane z przejściem fazowym,
za pomocą miceli
kataliza enzymatyczna
kataliza powierzchniowa:
metale
tlenki metali i niemetali
układy metali na nośnikach
siarczki metali
kataliza kształtoselektywna na zeolitach
fotokataliza.
57. Kataliza heterogeniczna- klasyfikacja układów
1. K ciecz: roztwór PdCl2 CuCl2 (katalizator w postaci jonów)
S gaz: C2H4
![]()
(ald. octowy)
2. K ciecz: kompleksy metali przejściowych (karbonylki)
S ciało stałe + gaz: uwodornienie węgla (upłynnienie węgla do np. benzyn)
3. K ciało stałe: Al2O3-SiO2 (wysoko porowate tlenki o dużej powierzchni właściwej)
S ciecz: odwodornienie wyższych alkoholi do najczęściej nienasyconych węglowodorów (np. butanol do butenu, heksanol do heksanu)
4. K ciało stałe: Ag2O
S gaz: utl. np. etylenu do tlenku etylenu
5. K ciało stałe: Ni
S ciało + gaz: uwodornienie nienasyconych kw. tłuszczowych na niklu Raneja.
58. Najczęściej stosowany układ heterogeniczny:
Katalizator- zanieczyszczenie (NOx, SOx, CO)
ciało stałe - gaz
Gazowe substraty przepływają z kontrolowaną szybkością przez złoże stałego katalizatora (najczęściej nieruchome) umieszczone w reaktorze o kontrolowanej temperaturze.
RYS
Mogą w reaktorze znajdować się nie jedna warstwa ale kilka warstw złoża z katalizatorem przez które kolejno przepływa substrat (zanieczyszczenie) i następuje jego stopniowe pochłanianie. Stopień przereagowania (oczyszczenia) na poszczególnych warstwach katalizatora jest różny, na ostatnim największy.
RYS.
59.
![]()
[kordieryt]
Pt-Rh - jest to faza aktywna: katalizator multimetaliczny-bimetaliczny
Stężenia składników podobne
Razem tworzą ilość % ( Pt>>Rh)
Nośnikiem jest kordieryt - są to porównywalne tlenki, zespolone chemicznie, nie jest to jednak mieszanina
Kordieryt:
- sztucznie zrobiony twardy minerał
- poszczególne tlenki łączą się, gdyż mają inne właściwości kwasowo-zasadowe i tak:
MgO - zasadowy
- amfoteryczny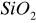
- kwasowy
Często tlenki glinu różnią się od siebie, gdyż mają różne ilości grup OH, np. 5 grup OH/![]()
lub 1 grupę OH/![]()
Wynika to stąd, że otrzymywano go przez dehydratację (odwodornienie)
Skonstruować dobry katalizator - znaleźć dobre centra aktywne
Wiązanie Pt i Rh dzięki kordierytowi dało możliwość odnalezienia trzech center aktywnych - stąd działanie katalityczne trójfazowe.
I centra: Na Rh wobec Pt następuje utlenienie
II centra: Na Pt jest drugi etap - utlenienie CO wobec ![]()
III typ - utlenienie HC
Stąd mówimy, że faza aktywna i nośnik wytwarzają trzy typy centr aktywnych
60. Jak wygląda złoże katalityczne w rurze?
Przekrój przez kształtkę nośnika - siatka o strukturze regularnej
61. Przekrój pojedynczego kanalika katalizatora
RYS
Dopuszczalne poziomy emisji substancji szkodliwych dla aut osobowych ( benzynowych) w Unii Europejskiej, jednostka g/km
Norma (od dnia) |
CO |
HC i |
Euro - 1 1.07.1992 |
3,16 |
1,13 |
Euro - 2 1.01.1996 |
2,20 |
0,50 |
Euro - 3 1.01.2000 |
2,20 |
0,35 |
Euro - 4 1.01.2005 |
1,00 |
0,33 |
Inne przemysłowe wykorzystanie katalizy to unieszkodliwianie zakwaszenia atmosfery (kwaśnych deszczów)
62. Katalityczne oczyszczanie gazów spalinowych z ![]()
Tlenki azotu tworzą się podczas spalania paliw:
- przez przyłączane azotu atmosferycznego
- przez utlenianie związków azotu w paliwie
- przez utlenianie HCl, który jest związkiem pośrednim ( czas życia 1-5µm) w reakcji HC i H z rodnikami azotu.
63. Schemat układu oczyszczania spalin samochodowych z katalizatorem trójfunkcyjnym i elektroniczną regulacją
RYS
63. Działanie trójfunkcyjnego katalizatora oczyszczania spalin:
![]()
Jest on dwuskładnikowy, ale trójfunkcyjny
![]()
![]()
- niebezpieczne
[Pt] 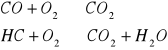
64. Podstawowe problemy nauki o katalizie
Znaleźć prawidłowości, które opisują zależność zjawisk katalitycznych od własności układu katalitycznego, a więc są to problemy związane z następującymi pytaniami:
Związek między naturą chemiczną katalizatora a jego aktywnością i selektywnością danej reakcji.
Jakie czynności oprócz układu chemicznego decydują o selektywności i selektywności
Z jakich etapów elementarnych składa się katalizowana reakcja, który z nich limituje szybkość reakcji chemicznej
Jaka jest struktura geometryczna oraz elektronowa kompleksu aktywnego:
- Które atomy lub grupy atomów na powierzchni katalizatora biorą udział w tworzeniu kompleksu aktywnego ( bada się za pomocą radionuklidów - metoda znaczonych izotopów, np. deuter, węgiel ![]()
, izotopy innych pierwiastków)
- Struktura geometryczna i elektronowa centrum aktywnego - czy jest symetryczna czy asymetryczna, jakie są odległości między centrami aktywnymi
- jaki jest typ wiązań ( rozłożenie ładunków) w kompleksie aktywnym
Warunkiem zajścia reakcji na katalizatorze jest adsorpcja substratu na jego powierzchni. Jeżeli energia adsorpcji będzie równa lub mniejsza niż energia wiązania substrat - katalizator, to następuje zatrucie katalizatora.
65. Co jest ilościową miarą katalizy?
- jest to aktywność i selektywność (pyt.46, 47)
66. Dlaczego przy preparatyce katalizatorów przemywa się je na końcu bardzo czystym wodorem?
Ponieważ czysty wodór (prekursor) pomaga sprowadzić metal po wszystkich reakcjach, czynnościach do czystego metalu (reduktor-spektralne czynniki).
67. Dlaczego w katalizie używa się pierwiastki grupy d?
Wysoki stopień utlenienia, wysoka selektywność, własności: zmienna wartościowość, podatność do tworzenia kompleksów, powłoki d biorą udział w tworzeniu wiązań.
68. Zdolność rozdzielcza TEM i SEM (mikroskopów elektronowych)
TEM, SEM ( Transmission, Scanning Electron Microscopy) - transmisyjna, skanująca mikroskopia elektronowa - tekstura katalizatorów i adsorbentów stałych, pomiary dyspersji katalizatorów metal/nośnik, dyfrakcja elektronów.
SEM- powiększenie rzędu 10 -105 razy, rozdzielczość 3 nm
TEM- powiększenie rzędu 102- 107 razy, rozdzielczość lepsza 3 A; d∼ 1,5-2,1 Å
0,15- 0,2 nm
69. 2-3 zdania na temat regeneracji filtrów diesla
Regeneracja filtrów polega na spalaniu zatrzymanej sadzy na drodze katalitycznej lub niekatalitycznej.
Katalityczne usuwanie cząstek stałych zatrzymanych na filtrze jest bardziej efektywne. Polega ono na dodatku do paliwa związku metaloorganicznego (najczęściej nafteniany i sulfoniany, karbookrylany, acetaniany i acetyloacetoniany Cr, Cu, Ni, Fe, Mn, Zn) lub ich wtrysku do spalin tuż przed filtrem.
Innym najbardziej racjonalnym sposobem rozwiązywania problemu usuwania sadzy ze spalin Diesla jest zastosowanie filtra ceramicznego pokrytego katalitycznie aktywnymi komponentami. Nośniki ceramiczne mogą być z powodzeniem zastępowane przez trwalsze mechanicznie nośniki wykonane z żaroodpornych stopów metalicznych np. NiCr, FeCrAl w formie gąbek, siatek lub spieków
70.Co to jest pętla histerezy przy pomiarach BET i co dzięki niej można określić (AGA 10)
68. Przedstawić teorię izotermy BET. Wypisać wzory (AGA 10)
69. Schemat katalizatora samochodowego
70.Substrat i produkt katalizy Fischera- Tropscha.
71. Narysuj krzywe dla nowo spreparowanego katalizatora i dezaktywowanego
72. Wykres dla katalizatorów mono i polidyspersyjnych (Aga 14)
73. Wykres energetyczny A+B→C dla reakcji endotermicznej (skany kat pyt 16)
3
niekorzystne, nieekonomiczne, ulegają spiekaniu
twardość
najlepsze
niekorzystne,
mała dyspersja
4
3
2
1
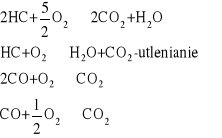
HC
CO
![]()
NOx
kat. Pt-Rh / MgO-Al2O3-SiO2
kat. metaliczne rozłożone na nośnikach w celu maksymalnego rozwinięcia powierzchni
Wyszukiwarka
Podobne podstrony:
wymiennik ciepła, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
Kopia PROJEKT-WYMIENNIK-Alicja, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
ald.octowypod, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
WYMIENNIKI Obliczanie, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
korpal2, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
kw.mlekowypo, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
kontrolka2013, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Recykling polimerów
Ćwiczenie 1 BUFOROWE WŁAŚCIWOŚCI GLEB, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Techniki
wymiennik ciepła CCl4-korpal, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
wymiennik ciepła CCl4-korpal, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
Ćwiczenie 10 REKULTYWACJA GLEB ZASOLONYCH, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Tech
Tematy i zakres ćwiczeń, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Techniki odnowy środow
metanol, Studia, UTP Ochrona środowiska, III rok, Semestr VI, Aparatura OS
więcej podobnych podstron