POLITECHNIKA WARSZAWSKA Wydział Inżynierii Lądowej
|
S P R A W O Z D A N I E Z ĆWICZEŃ LABORATORYJNYCH Z PRZEDMIOTU: CHEMIA BUDOWLANA
|
Imię i Nazwisko |
Data wykonania ćwiczenia: |
08.01.2005 |
|
|
Nr ćwiczenia: |
13.3 |
|
|
|
Temat ćwiczenia: |
|
Rok studiów: |
I |
|
|
Semestr: |
I |
Badanie odporności korozyjnej metali (żelaza) |
|
Grupa: |
6 |
|
|
Zespół: |
5 |
|
|
|
|
||
Data: |
Ocena: |
||
|
|
||
Uwagi prowadzącego ćwiczenie:
|
SPRAWOZDANIE Z PRZEPROWADZENIA ĆWICZENIA NR 13.3
TEMAT ĆWICZENIA
Badanie odporności korozyjnej metali (żelaza)
CEL ĆWICZENIA
Celem ćwiczenia jest porównanie stopnia odporności korozyjnej stali w kąpieli 2 m H2SO4 bez inhibitora i z inhibitorem (jodek potasu)
PODSTAWY TEORETYCZNE ĆWICZENIA
Korozja materiału budowlanego są to samorzutne procesy niszczące zachodzące w materiale, prowadzące do pogorszenia jego cech użytkowych, aż do jego całkowitego zniszczenia.
Przyczyną korozji może być wpływ czynników zewnętrznych lub procesy zachodzące w materiale lub procesy zachodzące wewnątrz materiału (korozja wewnętrzna).
W praktyce najczęściej występuje kilka czynników korozyjnych, których działanie wzmacnia proces korozji.
Przedmiotem ćwiczenia 13.3 będzie korozja metalu.
3.1. Korozja metalu
Procesy korozji metali różnią się od korozji betonu mechanizmami oraz przede wszystkim znacznie większa szybkością, nawet pod wpływem czynników atmosferycznych. Zjawiska związane z przebiegiem procesów korozyjnych sa zróżnicowane.
Najczęściej stosuje się podział w zależności od:
mechanizmu korozji;
korozja chemiczna
korozja elektrochemiczna
typu zniszczeń korozyjnych
3.1.1Korozja chemiczna
Korozja chemiczna spowodowana jest wynikiem reakcji chemicznych zachodzących w środowisku nie wykazującym przewodnictwa jonowego (gaz lub ciecz nie będąca elektrolitem.
3.1.2 Korozja elektrochemiczna
Korozja elektrochemiczna przebiega w środowisku wodnych roztworów elektrolitów. W wyniku zachodzących procesów chemicznych powstają miejsca o różnym potencjale, które tworzą ogniwo korozyjne, a na granicy metal-elektrolit występuje przepływ elektronów lub jonów. W odróżnieniu od elektrolizy, w przypadku mechanizmu elektrochemicznego korozji, anodę stanowi elektroda oddająca elektrony, a katodę elektroda przyjmująca elektrony.
Ze względu na zjawisko przewodnictwa elektronowego w metalu oraz przewodnictwa jonowego w roztworze wyróżnia się dwa niezależne od siebie procesy:
anodowy - przechodzenie metalu (rozpuszczanie) do roztworu w postaci uwodnionych jonów, przy czym w metalu pozostaje równoważna liczba elektronów;
katodowy - przyłączanie nadmiaru elektronów przez utleniacze (atomy, cząstki lub jony mogące ulegać redukcji na katodzie)
Sumaryczny ładunek wymieniany w procesach anodowym i katodowym musi być sobie równy. O całkowitej szybkości reakcji decyduje zwykle proces katodowy jako etap wolniejszy.
W środowisku wodnym o odczynie zasadowym i obojętnym występuje najczęściej redukcja tlenu (depolaryzacja tlenowa):
|
W środowisku kwaśnym występuje najczęściej redukcja wodoru (depolaryzacja wodorowa)
2H+ + 2e 2H H2 |
Na anodzie, niezależnie od odczynu środowiska zachodzi utlenianie metalu (rozpuszczanie anodowe).
Me Me+z + ze |
Miarą tendencji metalu do przechodzenia w stan jonowy jest potencjał standardowy. Określa on różnicę potencjałów między elektrodą pierwszego rodzaju (metal zanurzony w roztworze swoich jonów), a standardową elektrodą odniesienia (elektroda wodorowa).
Reakcje elektodowe uszeregowane są według wzrastającej wartości ich potencjałów standardowych i noszą nazwę szeregu elektrochemicznego. Miejsce zajmowane przez metal w szeregu pozwala wnioskować o jego aktywności.
W analizie procesów elektrodowych zachodzących w czasie korozji elektrochemicznej wykorzystuje się wykresy przedstawiające zależność potencjału standardowego od pH - tzw. wykresy Pourbaix. Linie pochyłe oznaczają równowagi reakcji zależnych od pH, linie pionowe odpowiadają stanom równowagi niezależnych od potencjału, zaś linie poziome równowagi niezależne od pH.
W zależności od zachodzących reakcji w procesie korozji elektrochemicznej metali prowadzących do powstawania miejsc o zróżnicowanym potencjale.
Wyróżnia się trzy typy ogniw:
- 1. Ogniwo stykowe (dwumetaliczne)
Powstaje ono w przypadku zetknięcia się dwóch różnych metali w środowisku wodnego roztworu elektrolitu. Anodę stanowi metal o niższym potencjale standardowym, który wypiera z roztworu jony metalu o wyższym potencjale.
Przykładem ogniwa stykowego może być blacha żelazna ocynkowana z uszkodzoną mechanicznie powłoką, znajdująca się w wodnym roztworze elektrolitu. W miejscu uszkodzenia powstaje lokalne ogniwo.
- 2a. Ogniwo stężeniowe
Powstaje ono przy zanurzeniu elektrod z tego samego metalu w wodnym roztworze elektrolitu o różnym lokalnym stężeniu jonów metalu. W wyniku procesu korozyjnego następuje wyrównanie stężeń.
Ogniwa tego typu powstają często w aparaturze chemicznej lub przewodach, którymi przesyłane są ciecze.
- 2b. Ogniwo stężeniowe oksydacyjne
Powstaje ono przy nierównomiernym dopływie tlenu do metalu znajdującego się w środowisku wodnym (np. wilgoć z powietrza). Anodą (częścią korodującą) jest miejsce o mniejszym dopływie tlenu, a na katodzie zachodzi reakcja depolaryzacji tlenowej (powstanie jonów OH -).
Przykładem może być połączenie gwintowych korozji ulega część śruby która jest wkręcona, która spełnia rolę anody, zaś główka śruby znajdująca się na zewnątrz, która jest katodą, nie ulega korozji.
Powstawaniu ogniw stężeniowych sprzyja także obecność różnego rodzaju zanieczyszczeń utrudniających dopływ tlenu.
- 3. Ogniwa naprężeniowe
Powstają w przypadku zetknięcia się z elektrolitem metalu znajdującego się pod działaniem naprężeń. Jest to rodzaj korozji miejscowej, w której metal na skutek współdziałania środowiska korozyjnego i naprężeń, przy czym oddzielne działanie tych czynników nie powoduje korozji.
Naprężenia w materiale mogą być dwojakiego rodzaju i spowodowane są przez:
obciążenia mechaniczne, metal w miejscach odkształceń wykazuje większą podatność na korozję. Do tego typu korozji zalicza się korozję zmęczeniową, polegającą na obniżeniu wytrzymałości zmęczeniowej materiału w środowisku agresywnym;
różnicę składu chemicznego metalu na granicy ziaren i w ich wnętrzu, ten typ korozji nosi nazwę korozji międzykrystalicznej. Bardziej podatne na korozję międzykrystaliczną są metale drobnoziarniste niż gruboziarniste, wynika to z powierzchni granic ziaren.
Podatność na ten typ korozji wykazują konstrukcje sprężone.
OPIS STANOWISKA
Ćwiczenie przeprowadza się na stole laboratoryjnym.
Sprzęt potrzebny do wykonania ćwiczenia:
kolba stożkowa 300 cm3 (1 szt.);
zbiornik szklany z przewodem gumowym;
pipeta z podziałką;
elektroniczna waga jednoszalkowa (bezodważnikowa);
Stosowane odczynniki i inne materiały:
wióry żelazne;
inhibitor (jodek sodu);
H2SO4 2 m.
Ćwiczenie przeprowadza się z zachowaniem ostrożności i przepisów BHP (użycie kwasu) po wcześniejszym założeniu fartucha.
PRZEBIEG WYKONYWANYCH CZYNNOŚCI
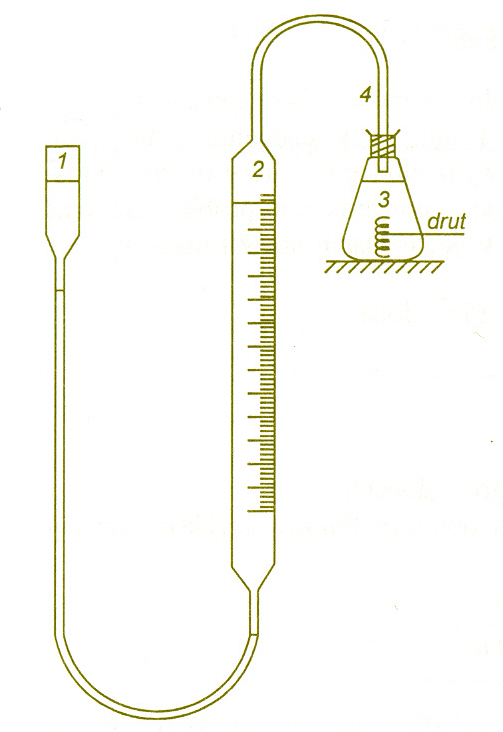
Przed przystąpieniem do ćwiczenia sprawdzamy zestaw pomiarowy i regulując wysokość zamocowania zbiorniczka ustawiamy poziom cieczy w pipecie na „0”.
1 - zbiornik szklany
2 - pipeta z podziałką
3 - kolba stożkowa 300 cm3
4 - wąż gumowy
Ćwiczenie składa się z dwóch części:
Część I - Badanie odporności korozyjnej żelaza w roztworze bez inhibitora
za pomocą wagi odważamy próbkę wiórów żelaznych o masie 1,0 g
wkładamy do kolby stożkowej odważoną próbkę wiórów żelaznych
zalewamy próbkę 2 m roztworem H2SO4 tak aby zakrył całą próbkę
zamykamy kolbę, notujemy czas i wartość poziomu płynu w pipecie
w odstępach 10 minutowych notujemy wartość poziomu cieczy w pipecie
Wartości odczytów:
Po 10 minutach : 1,0 cm3
Po 20 minutach : 2,0 cm3
Po 30 minutach : 3,0 cm3
Część II - Badanie odporności korozyjnej żelaza w roztworze z inhibitorem (KI)
Po zakończeniu części I doświadczenia opróżniamy kolbę, myjemy i przystępujemy do II części.
za pomocą wagi odważamy próbkę wiórów żelaznych o masie 1,0 g
wkładamy do kolby stożkowej odważoną próbkę wiórów żelaznych
zalewamy próbkę 2 m roztworem H2SO4 tak aby zakrył całą próbkę
dodajemy szczyptę jodku sodu (KI), który pełni rolę inhibitora
zamykamy kolbę, notujemy czas i wartość poziomu płynu w pipecie
w odstępach 10 minutowych notujemy wartość poziomu cieczy w pipecie
Wartości odczytów:
Po 10 minutach : 0,6 cm3
Po 20 minutach : 1,0 cm3
Po 30 minutach : 1,4 cm3
WYNIKI POMIARÓW
Po przeprowadzeniu obu części doświadczenia zapisujemy wyniki:
Czas od momentu zamknięcia kolby [min] |
Objętość wydzielonego wodoru H2 [cm3] |
|
|
Próbka żelaza |
|
|
bez inhibitora |
z inhibitorem |
10 |
1,0 |
0,6 |
20 |
2,0 |
1,0 |
30 |
3,0 |
1,4 |
OBLICZENIA
Podczas przeprowadzenia kąpieli próbki wiórów żelaza w 2 m H2SO4 zachodzi rozpuszczanie się metalu (reakcja anodowa), towarzyszy temu wydzielanie gazowego wodoru. Zgodnie z zapisem sumarycznym reakcji:
|
Wynika, że rozpuszczeniu jednego mola żelaza towarzyszy wydzielenie jednego mola wodoru o objętości 22,4 dm3 (przy ciśnieniu 1 atm w temperaturze 25oC)
Mierząc objętość wydzielonego wodoru określamy ubytek masy (Δm)próbki żelaza.
Schemat obliczeń:
1. Korzystając ze wzoru obliczamy szybkość korozji νc:
νc |
= |
Δm |
|
|
|
S . t |
|
gdzie:
Δm - ubytek masy
S - powierzchnia czynną próbki
t - czas pomiaru
2. Znając gęstość właściwą metalu i korzystając ze wzoru obliczamy liniową szybkość reakcji, która posłuży nam do określenia stopnia odporności korozyjnej ok:
Vp |
= |
365 |
. νc |
|
|
1000 . ρ |
|
gdzie:
νc - szybkość korozji
ρ - gęstość właściwa metalu
Przystępujemy do obliczeń:
Korzystając ze wzoru obliczamy powierzchnię czynną próbki:
S |
= |
m |
|
|
|
ρ . n |
|
gdzie:
m - masa próbki = 1,0 g
ρ - gęstość właściwa żelaza = 7,65 g/cm3
n - grubość wióra żelaza = 0,1 mm = 0,01 cm
S |
= |
1,0 |
= |
13,07 |
|
g |
= |
cm 2 |
|
|
|
7,65 . 0,01 |
|
|
|
g/cm3 . cm |
|
|
|
Powierzchnia czynna próbki wiórów żelaza wynosi 13,07 cm 2
7.1.Obliczenia dla doświadczenia z próbką bez inhibitora
Obliczamy ubytek masy próbki żelaza:
Wiemy, że podczas kąpieli próbki żelaza w 2 m H2SO4 każdemu jednemu molowi wydzielonego wodoru towarzyszy rozpuszczenie jednego mola żelaza. Korzystamy z tej zależności i piszemy proporcję:
Objętość wydzielonego wodoru H2 |
= |
Ilość moli wydzielonego żelaza |
Objętość jednego mola wodoru H2 |
|
|
stąd:
0,003 |
= |
1,34 . 10 -4 |
|
dm 3 |
= mol |
|
22,4 |
|
|
|
dm 3/mol |
|
|
Mnożymy ilość moli żelaza x masę molową żelaza
Δm = 1,34 . 10 -4 . 55,85 = 7,48 . 10 -3 [mol . g/mol= g]
Ubytek masy próbki żelaza wynosi Δm = 7,48 . 10 -3 g
Obliczamy szybkość korozji
Δm = 7,48 . 10 -3 g
S = 13,07 cm 2
t = 0,5 h (mnożnik 48; 48.0,5=24h= 1 doba)
νc |
= |
Δm |
= |
7,48 . 10 -3 |
. 48 |
= 0,055 |
|
g |
doba |
|
|
|
S . t |
|
13,07 . 0,5 |
|
|
|
cm 2 |
|
|
Szybkość korozji próbki żelaza wynosi νc = 0,055 g.doba/cm 2
Obliczamy liniową szybkość korozji
ρ - gęstość właściwa żelaza = 7,65 g/cm3
νc = 0,055 g.doba/cm 2
Vp |
= |
365 |
. νc |
= |
365 |
. 0,055 |
= |
2,62.10-3 |
|
g/cm2 |
= cm/rok |
|
|
|
1000 . ρ |
|
|
1000 . 7,65 |
|
|
|
|
g/cm3 |
|
|
Liniowa szybkość korozji próbki żelaza wynosi Vp=2,62.10-3cm/rok
Odczytujemy z tablicy 13.3 (Ćwiczenia laboratoryjne z chemii budowlanej) wartość stopnia odporności korozyjnej ok:
Dla Vp = 0,00262 cm/rok = 0,026 mm/rok stopień odporności korozyjnej ok wynosi 4
Wpisujemy otrzymane wyniki do tablicy w pkt. 8
Obliczenia dla doświadczenia z próbką z inhibitorem
Obliczamy ubytek masy próbki żelaza:
Wiemy, że podczas kąpieli próbki żelaza w 2 m H2SO4 każdemu jednemu molowi wydzielonego wodoru towarzyszy rozpuszczenie jednego mola żelaza. Korzystamy z tej zależności i piszemy proporcję:
Objętość wydzielonego wodoru H2 |
= |
Ilość moli wydzielonego żelaza |
Objętość jednego mola wodoru H2 |
|
|
stąd:
0,0014 |
= |
6,25 . 10 -5 |
|
dm 3 |
= mol |
|
22,4 |
|
|
|
dm 3/mol |
|
|
Mnożymy ilość moli żelaza x masę molową żelaza
Δm = 6,25 . 10 -5 . 55,85 = 3,49 . 10 -3 [mol . g/mol= g]
Ubytek masy próbki żelaza wynosi Δm = 3,49 . 10 -3 g
Obliczamy szybkość korozji
Δm = 3.49 . 10 -3 g
S = 13,07 cm 2
t = 0,5 h (mnożnik 48; 48.0,5=24h= 1 doba)
νc |
= |
Δm |
= |
3,49 . 10 -3 |
. 48 |
= 0,026 |
|
g |
doba |
|
|
|
S . t |
|
13,07 . 0,5 |
|
|
|
cm 2 |
|
|
Szybkość korozji próbki żelaza wynosi νc = 0,026 g.doba/cm 2
Obliczamy liniową szybkość korozji
ρ - gęstość właściwa żelaza = 7,65 g/cm3
νc = 0,026 g /cm 2. doba
Vp |
= |
365 |
. νc |
= |
365 |
. 0,026 |
= |
1,24.10-3 |
|
g/cm2 |
= cm |
|
|
|
1000 . ρ |
|
|
1000 . 7,65 |
|
|
|
|
g/cm3 |
|
|
Liniowa szybkość korozji próbki żelaza wynosi Vp=1,24.10-3cm/rok
Odczytujemy z tablicy 13.3 (Ćwiczenia laboratoryjne z chemii budowlanej) wartość stopnia odporności korozyjnej ok:
Dla Vp = 0,00124 cm/rok = 0,0124 mm/rok stopień odporności korozyjnej ok wynosi 4
Wpisujemy otrzymane wyniki do tablicy w pkt. 8
ZBIORCZA TABELA WYNIKÓW POMIARÓW ODPORNOŚCI KOROZYJNEJ ŻELAZA ORAZ WYKRES WYDZIELANEGO WODORU
Zbiorcza tabela wyników doświadczenia 13.3
Czas od momentu zamknięcia kolby [min] |
Objętość wydzielonego wodoru H2 [cm3] |
|
|
Próbka żelaza |
|
|
bez inhibitora |
z inhibitorem |
10 |
1,0 |
0,6 |
20 |
2,0 |
1,0 |
30 |
3,0 |
1,4 |
νcśr [g/cm2 . doba] |
0,55 |
0,26 |
Vp [mm/rok] |
0,026 |
0,0124 |
Stopień odporności korozyjnej ok |
4 |
4 |
Wykres ilości wydzielonego wodoru w trakcie ćwiczenia 13.3
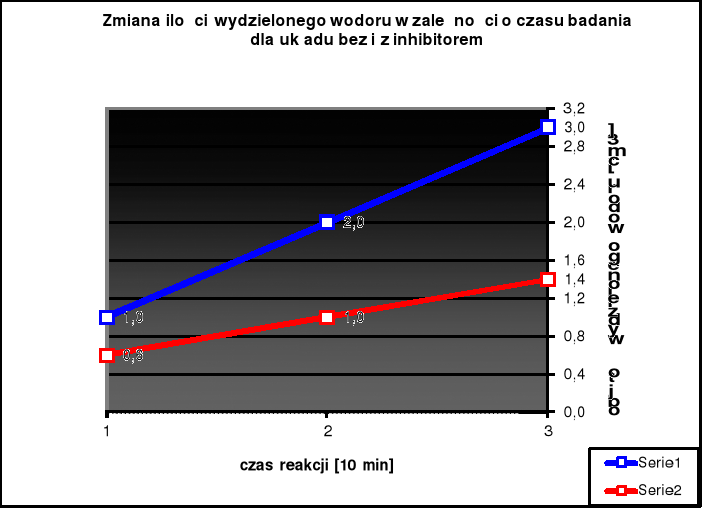
seria 1 - próbka bez inhibitora
seria 2 - próbka z inhibitorem
WNIOSKI
Podczas przeprowadzenia kąpieli próbki wiórów żelaza w 2 m H2SO4 zachodzi rozpuszczanie się metalu (reakcja anodowa), towarzyszy temu wydzielanie gazowego wodoru. Zgodnie z zapisem sumarycznym reakcji:
|
|
Wynika, że rozpuszczeniu jednego mola żelaza towarzyszy wydzielenie jednego mola wodoru o objętości 22,4 dm3 (przy ciśnieniu 1 atm w temperaturze 25oC)
Mierząc objętość wydzielonego wodoru określamy ubytek masy (Δm)próbki żelaza.
Następnie po określeniu liniowej szybkości korozji odczytujemy wartość stopnia odporności korozyjnej dla żelaza.
Po przeprowadzeniu doświadczenia przekonaliśmy się, że zastosowanie inhibitora powoduje spowolnienie powyższej reakcji i wydzielenie mniejszej ilości gazowego wodoru, a co za tym idzie mniejszy ubytek masy próbki żelaza. Im więcej inhibitora w roztworze, tym bardziej spowolniona zostaje reakcja i tym mniejszy ubytek masy.
Inhibitor spełnia rolę substancji hamującej lub nawet w dużych stężeniach wstrzymującej proces reakcji korozyjnej.
Stopień odporności korozyjnej określa podatność metalu na wpływ korozji. Im większy ubytek masy, tym większa szybkość liniowa korozji a co za tym idzie wyższy stopień odporności. Wynika z tego wniosek, że im wyższy stopień odporności korozyjnej, tym mniejsza odporność metalu na wpływ korozji.
Jeśli chodzi o konkretny przypadek badany w doświadczeniu, to pomimo, że stopień odporności w obu częściach ćwiczenia (bez dodatku inhibitora i z dodatkiem inhibitora) są równe, to jednak wartość liniowej szybkości reakcji korozji próbki z dodatkiem inhibitora znajduje się w części dolnej wartości obejmujących stopień odporności, a wartość liniowej szybkości reakcji korozji próbki bez dodatku inhibitora lokuje się w górnej strefie zakresu obejmującego stopień 4 odporności korozyjnej.
Gdybyśmy w doświadczeniu dodali więcej inhibitora to można przyjąć, że wartości odporności różniłyby się jeszcze znaczniej i lokowałyby się w dwóch różnych stopniach odporności korozyjnej. Dla próbki z inhibitorem wartość k=3, a dla próbki bez inhibitora k=4.
W doświadczeniu jako inhibitora użyto jodek potasu.
LITERATURA
Praca zbiorowa pod redakcją Lecha Czarneckiego „ Ćwiczenia laboratoryjne z chemii budowlanej” Oficyna Wydawnicza PW. Warszawa 2001
L. Czarnecki, T.Broniewski, O.Henning. „Chemia w Budownictwie”.Wydawnictwo ARKADY. Warszawa 1996, s. 236-237
Załącznik:
notatki z przeprowadzenia doświadczenia w laboratorium
18
Wyszukiwarka
Podobne podstrony:
CHEMIA cwiczenie 13 1, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
CHEMIA cwiczenie 12 1, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
CHEMIA cwiczenie 7 2, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
CHEMIA cwiczenie 7 1, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
CHEMIA cwiczenie 4 2, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
CHEMIA cwiczenie 8 2, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
CHEMIA cwiczenie 9 1, BUDOWNICTWO IL PW, SEMESTR I, Chemia Budowlana, Sprawozdania testy
ściaga - trzonowce, Budownictwo IL PW, Semestr 7 KBI, METAL3
ściąga - zbiorniki, Budownictwo IL PW, Semestr 7 KBI, METAL3
ściąga - rurociąg, Budownictwo IL PW, Semestr 7 KBI, METAL3
ściąga - hale, Budownictwo IL PW, Semestr 7 KBI, METAL3
egzamin analiza 2006, BUDOWNICTWO IL PW, SEMESTR I, Analiza Matematyczna I, Egzaminy
ściąga - wieże maszty, Budownictwo IL PW, Semestr 7 KBI, METAL3
ściąga - szkieletowce, Budownictwo IL PW, Semestr 7 KBI, METAL3
ściąga - hale, Budownictwo IL PW, Semestr 7 KBI, METAL3
Sprawozdanie- Chemia Budowlana-1 ćwiczenie Spoiwa gipsowe, Studia Budownictwo UZ, 1 semestr, Chemia
Sprawozdanie 4 kaśki, Studia Budownictwo UZ, 1 semestr, Chemia budowlana, Sprawozdania, Sprawozdania
sprawozdanie chemia 3, Budownictwo UZ semestr I , II, Chemia budowlana, Sprawozdania od Seweryna
więcej podobnych podstron