Politechnika Wrocławska |
INŻYNIERIA BIOREAKTORÓW Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji izomeryzacji D-glukozy do D-fruktozy |
|
|
Piotr Cegła, 168657 Aleksandra Drozd, 168659
|
Prowadząca:
Data ćwiczenia: |
Wstęp teoretyczny
Zasada działania reaktora przepływowego ze złożem stałym opiera się na przepływie roztworu badanej substancji przez rurę/kolumnę upakowaną katalizatorem. Reaktory tego typu mogą być zbudowane z jednego cylindra wypełnionego odpowiednim złożem lub z ułożonych równolegle kilku rur z katalizatorem [ Gavhane, 2009, Chemical reaction engineering I]. Reaktor ze złożem upakowanym jest bardzo często stosowany w laboratoriach i przemyśle chemicznym i biotechnologicznym, ponieważ użytkowanie jego nie jest zbyt drogie oraz nie bardzo skomplikowane. Reaktory te charakteryzują się łatwością we wprowadzaniu substratów i wyprowadzaniu produktów oraz czyszczenie nie zajmuje zbyt dużo czasu [ Rzążewska, 2005, tłumaczenie patentu europejskiego dla Reaktor oraz sposób fermentacji na podłożu stałym].
Badanym w czasie doświadczenia enzymem była izomeraza glukozowa, która odpowiedzialna jest za przeprowadzenie reakcji izomeryzacji glukozy do fruktozy oraz ksylozy do ksylulozy. Izomerazy glukozowe są aktywowane przez różne jony metali, m.in. przez jony kobaltu Co2+ lub jony magnezu Mg2+ [Polska Akademia Nauk. Komitet Mikrobiologiczny, 1978, Postępy mikrobiologii]. Reakcja izomeryzacji glukozy do fruktozy jest przykładem reakcji, w której stosowany enzym reaguje tak z glukozą, jak i z fruktozą. Spełnia ona założenia kinetyki Michaelisa-Menten, dzięki czemu możliwe jest wyznaczenie szybkości maksymalnej reakcji oraz stałej Michaelisa [Bryjak, 2011, instrukcja do zajęć laboratoryjnych z inżynierii bioreaktorów Reaktory przepływowe - kolumna ze złożem upakowanym].
Materiały i metody
Materiały:
immobilizowana izomeraza glukozowa otrzymana nieodpłatnie z firmy Novozyme,
objętość całkowita złoża - 20 cm3,
objętość wolna reaktora - 6,8 cm3,
temperatura procesu - 40oC,
roztwory glukozy i fruktozy,
0,05M bufor tris-HCl + 3 mmol Mg, pH 7,8 w 40oC,
Odczynniki do enzymatycznego oznaczania stężenia glukozy.
Aparatura:
spektrofotometr UV-VIS Shimadzu,
termostatowane reaktory kolumnowe,
pompy tłokowe Prominent.
Metody:
Oznaczenie stężenia glukozy testem enzymatycznym
Do suchych i czystych probówek wprowadzono po 1 cm3 roztworu roboczego. Przygotowano również 2 probówki na standard glukozy i kontrolę. Z probówek zawierających odpowiednio rozcieńczone próbki badane oraz z próbki zawierającej standard pobrano po 10 μl roztworu i wprowadzono do roztworów roboczych. Każdorazowo kilkakrotnie przepłukano końcówkę roztworem roboczym. Całość wstawiono na 5 min do łaźni wodnej o temperaturze 37 °C, a następnie zmierzono absorbancję (500 nm) wobec próby kontrolnej. W przypadku fruktozy, jako substratu, pobranych próbek nie rozcieńczono. Stosując jako substrat glukozę, wykonano następujące rozcieńczenia:
Stężenie glukozy [mM] |
Rozcieńczenie [-] |
Objętość roztworu badanego [μl] |
Objętość wody [ml] |
50 |
2x |
1000 |
1,0 |
100 |
3x |
1000 |
2,0 |
200 |
10x |
1000 |
9,0 |
400 |
20x |
500 |
9,5 |
600 |
20x |
500 |
9,5 |
800 |
40x |
250 |
9,75 |
1000 |
40x |
250 |
9,75 |
1250 |
50x |
200 |
9,8 |
1500 |
50x |
200 |
9,8 |
1750 |
100x |
100 |
9,9 |
Wyznaczenie wartości Keq reakcji izomeryzacji
Do 5 cm3 0,05 M roztworu glukozy dodano 50 μl natywnej izomerazy glukozowej i umieszczono w łaźni wodnej o temperaturze 40 °C celem osiągnięcia stanu równowagi termodynamicznej. Pobrano próbki z wyjściowego roztworu substratu oraz z mieszaniny reakcyjnej, rozcieńczono próbki wodą destylowaną (podane w tabeli) oraz oznaczono stężenie glukozy metodą enzymatyczną.
Pomiar zmiany stężeń reagentów w warunkach początkowej szybkości reakcji
Przygotowano po 500 cm3 dwóch roztworów glukozy lub fruktozy o podanych przez osobę prowadzącą stężeniach. Do termostatowanych (40°C) reaktorów kolumnowych ze złożem upakowanym dozowano substrat z podanymi szybkościami przepływu (pompa „mała” - 60/120; 40/120; 20/120; 10/120 / pompa „duża” - 15/120; 7,5/120; 2,5/120; 0/120). Dla każdego przepływu zmierzono strumień (zmierzono czas napełnienia cylindra na 50 cm3), a następnie pobrano próbkę do analiz z wylotu z reaktora, zwracając uwagę na osiągnięcie stanu ustalonego. Pobrano również próbkę substratu na wejściu reaktora. Wszystkie próbki odpowiednio rozcieńczono i oznaczono stężenie glukozy testem enzymatycznym.
Obliczenia i wyniki:
1) Stężenia (C):
Z proporcji:
Absśr.stand - 15 mM
Absśr - x
![]()
![]()
Absśr.stand - absorbancja średnia standardu glukozy
Absśr - absorbancja średnia roztworu
R - rozcienczenie roztworu
2) Stężenia produktów (Cp):
- reakcja izomeryzacji glukozy do fruktozy:
Cp=C0,rz,s - Cg = 43,48 - 42,34 = 1,14 mM
Cp - stężenie produktu (fruktozy),
C0,rz,s - rzeczywiste początkowe stężenie substratu (glukozy),
Cg - stężenie glukozy na wylocie z bioreaktora
- reakcja izomeryzacji fruktozy do glukozy:
Cp - stężenie produktu (glukozy) na wylocie z reaktora
C0,rz,s = C założone
3) Objętościowe natężenie przepływu (V):
![]()
50 - objętość roztworu zbierana do cylindra
t - czas pobierania 50 ml roztworu
4) Czas przebywania (τ) :
![]()
6,8 - objętość wolna reaktora
V - objętościowe natężenie przepływu
5) Stopień przereagowania (α):
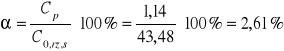
Cp - stężenie produktu
C0,rz,s - rzeczywiste początkowe stężenie substratu
6) Szybkość reakcji (r):
![]()
Cp - stężenie produktu
τ - czas przebywania
Tabela 1. Wyliczone wartości dla reakcji izomeryzacji glukozy do fruktozy
Na żółto zaznaczono wartości użyte do wykonania wykresów.
C=50 mM |
R=2 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,445 |
0,997 |
59,59 |
1,441 |
43,476 |
43,336 |
0,140 |
0,839 |
8,104 |
0,323 |
0,017 |
||||
|
|
75,71 |
1,408 |
43,476 |
42,343 |
1,133 |
0,660 |
10,297 |
2,606 |
0,110 |
||||
|
|
108,62 |
1,418 |
43,476 |
42,644 |
0,832 |
0,460 |
14,772 |
1,914 |
0,056 |
||||
|
|
222,50 |
1,333 |
43,476 |
42,740 |
0,736 |
0,225 |
30,260 |
1,694 |
0,024 |
||||
|
||||||||||||||
C=100 mM |
R=3 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,885 |
0,936 |
34,18 |
1,823 |
90,673 |
89,688 |
0,985 |
1,463 |
4,648 |
1,086 |
0,212 |
||||
|
|
52,40 |
1,913 |
90,673 |
91,988 |
-1,315 |
0,954 |
7,126 |
-1,450 |
-0,184 |
||||
|
|
78,58 |
1,876 |
90,673 |
90,224 |
0,449 |
0,636 |
10,687 |
0,495 |
0,042 |
||||
|
|
186,30 |
1,853 |
90,673 |
89,118 |
1,555 |
0,268 |
25,337 |
1,715 |
0,061 |
||||
|
||||||||||||||
C=200 mM |
R=10 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,220 |
0,955 |
87,00 |
BRAK |
191,556 |
|
|
|
|
|
|
||||
|
|
107,00 |
1,122 |
191,556 |
176,169 |
15,387 |
0,467 |
14,552 |
8,033 |
1,057 |
||||
|
|
168,00 |
1,170 |
191,556 |
183,706 |
7,851 |
0,298 |
22,848 |
4,098 |
0,344 |
||||
|
|
258,00 |
1,108 |
191,556 |
174,023 |
17,533 |
0,194 |
35,088 |
9,153 |
0,500 |
||||
|
||||||||||||||
C=400 mM |
R=20 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,246 |
0,972 |
68,00 |
1,133 |
384,568 |
349,794 |
34,774 |
0,735 |
9,248 |
9,042 |
3,760 |
||||
|
|
86,00 |
1,224 |
384,568 |
377,778 |
6,790 |
0,581 |
11,696 |
1,766 |
0,581 |
||||
|
|
117,00 |
1,319 |
384,568 |
406,996 |
-22,428 |
0,427 |
15,912 |
-5,832 |
-1,410 |
||||
|
|
273,00 |
1,284 |
384,568 |
396,296 |
-11,728 |
0,183 |
37,128 |
-3,050 |
-0,316 |
||||
|
||||||||||||||
C=400 mM |
R=20 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,223 |
0,888 |
81,00 |
|
413,133 |
|
|
|
|
|
|
||||
|
|
112,00 |
1,196 |
413,133 |
403,790 |
9,343 |
0,446 |
15,232 |
2,262 |
0,613 |
||||
|
|
168,00 |
1,220 |
413,133 |
411,895 |
1,238 |
0,298 |
22,848 |
0,300 |
0,054 |
||||
|
|
243,00 |
1,200 |
413,133 |
405,253 |
7,880 |
0,206 |
33,048 |
1,907 |
0,238 |
||||
|
||||||||||||||
C=1000 mM |
R=40 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,521 |
0,915 |
87,00 |
1,516 |
997,741 |
994,133 |
3,608 |
0,575 |
11,832 |
0,362 |
0,305 |
||||
|
|
124,00 |
1,514 |
997,741 |
993,149 |
4,592 |
0,403 |
16,864 |
0,460 |
0,272 |
||||
|
|
163,00 |
1,719 |
997,741 |
1127,624 |
-129,883 |
0,307 |
22,168 |
-13,018 |
-5,859 |
||||
|
|
253,00 |
1,488 |
997,741 |
976,093 |
21,647 |
0,198 |
34,408 |
2,170 |
0,629 |
||||
|
||||||||||||||
C=1500 mM |
R=50 |
|
|
|
|
|
|
|
|
|
||||
Absśr.subs |
Absśr.stand |
t [s] |
Absśr.g |
Co,rz,s [mM] |
Cg [mM] |
Cp [mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
||||
1,820 |
0,891 |
38,57 |
1,817 |
1492,347 |
1489,477 |
2,870 |
1,296 |
5,246 |
0,192 |
0,547 |
||||
|
|
57,81 |
1,574 |
1492,347 |
1290,361 |
201,986 |
0,865 |
7,862 |
13,535 |
25,691 |
||||
|
|
97,39 |
1,840 |
1492,347 |
1508,473 |
-16,126 |
0,513 |
13,245 |
-1,081 |
-1,218 |
||||
|
|
218,35 |
1,790 |
1492,347 |
1467,748 |
24,599 |
0,229 |
29,696 |
1,648 |
0,828 |
||||
|
|
|
|
|
|
|
|
|
średnia |
0,688 |
||||
Tabela 2. Wyliczone wartości dla reakcji izomeryzacji fruktozy do gluzkozy
Na żółto zaznaczono wartości użyte do wykonania wykresów.
c = 50mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,968 |
50,52 |
0,017 |
0,258 |
0,990 |
6,871 |
0,517 |
0,038 |
|
63,53 |
0,042 |
0,646 |
0,787 |
8,640 |
1,291 |
0,075 |
|
97,23 |
0,073 |
1,131 |
0,514 |
13,223 |
2,262 |
0,086 |
|
251,46 |
0,207 |
3,202 |
0,199 |
34,199 |
6,405 |
0,094 |
|
|||||||
C=100mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
1,039 |
30,91 |
0,099 |
1,422 |
1,618 |
4,204 |
1,422 |
0,338 |
|
49,21 |
0,152 |
2,194 |
1,016 |
6,693 |
2,194 |
0,328 |
|
76,49 |
0,283 |
4,086 |
0,654 |
10,403 |
4,086 |
0,393 |
|
217,69 |
0,729 |
10,529 |
0,230 |
29,606 |
10,529 |
0,356 |
|
|||||||
C=200mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
1,017 |
34,52 |
0,136 |
2,006 |
1,448 |
4,695 |
1,003 |
0,427 |
|
48,48 |
0,196 |
2,891 |
1,031 |
6,593 |
1,445 |
0,438 |
|
73,22 |
0,372 |
5,487 |
0,683 |
9,958 |
2,743 |
0,551 |
|
182,62 |
1,247 |
18,397 |
0,274 |
24,836 |
9,199 |
0,741 |
|
|||||||
C=400mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,850 |
77,00 |
0,062 |
1,100 |
0,649 |
10,472 |
0,275 |
0,105 |
|
110,00 |
0,467 |
8,238 |
0,455 |
14,960 |
2,059 |
0,551 |
|
157,00 |
0,675 |
11,907 |
0,318 |
21,352 |
2,977 |
0,558 |
|
233,00 |
1,071 |
18,898 |
0,215 |
31,688 |
4,725 |
0,596 |
|
|||||||
C=600mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,851 |
84,00 |
0,498 |
8,784 |
0,595 |
11,424 |
1,464 |
0,769 |
|
105,00 |
0,679 |
11,974 |
0,476 |
14,280 |
1,996 |
0,839 |
|
155,00 |
1,004 |
17,703 |
0,323 |
21,080 |
2,950 |
0,840 |
|
244,00 |
1,386 |
24,430 |
0,205 |
33,184 |
4,072 |
0,736 |
|
|||||||
C=800mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,851 |
77,00 |
0,626 |
11,040 |
0,649 |
10,472 |
1,380 |
1,054 |
|
107,00 |
0,700 |
12,344 |
0,467 |
14,552 |
1,543 |
0,848 |
|
146,00 |
0,816 |
14,383 |
0,342 |
19,856 |
1,798 |
0,724 |
|
241,00 |
1,502 |
26,469 |
0,207 |
32,776 |
3,309 |
0,808 |
|
|||||||
C=1250mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,892 |
45,68 |
0,529 |
8,898 |
1,095 |
6,212 |
0,712 |
1,432 |
|
59,68 |
0,408 |
6,853 |
0,838 |
8,116 |
0,548 |
0,844 |
|
80,64 |
0,604 |
10,159 |
0,620 |
10,967 |
0,813 |
0,926 |
|
186,72 |
1,017 |
17,096 |
0,268 |
25,394 |
1,368 |
0,673 |
|
|||||||
C=1500mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,888 |
46,31 |
0,514 |
8,686 |
1,080 |
6,298 |
0,579 |
1,379 |
|
59,11 |
0,492 |
8,320 |
0,846 |
8,039 |
0,555 |
1,035 |
|
82,26 |
0,643 |
10,860 |
0,608 |
11,187 |
0,724 |
0,971 |
|
190,52 |
1,517 |
25,635 |
0,262 |
25,911 |
1,709 |
0,989 |
|
|||||||
C=1750mM |
|
|
|
|
|
|
|
Absśr.stand |
t [s] |
Abs.śr.prod |
Cp[mM] |
V* [ml/s] |
τ [s] |
α |
r [mM/s] |
0,959 |
54,22 |
0,459 |
7,187 |
0,922 |
7,374 |
0,411 |
0,975 |
|
70,23 |
0,426 |
6,666 |
0,712 |
9,551 |
0,381 |
0,698 |
|
108,14 |
0,570 |
8,913 |
0,462 |
14,707 |
0,509 |
0,606 |
|
253,09 |
1,467 |
22,949 |
0,198 |
34,420 |
1,311 |
0,667 |
Wykres 1. Wykres Lineweavera-Burka dla izomeryzacji glukozy do fruktozy.
Wykres 2. Wykres Lineweavera-Burka dla izomeryzacji fruktozy do glukozy.
Wyznaczenie parametrów kinetycznych reakcji:
Dla równań linii trendu w postaci y = ax + b
![]()
![]()
Tabela 3. Obliczone parametry kinetyczne
|
Vmax |
Km |
glukoza |
0,91 |
312,34 |
fruktoza |
1,17 |
349,32 |
I. Stała równowagi:
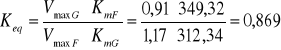
II. Obliczanie stałej równowagi ze stężeń równowagowych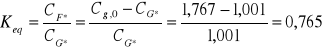
Tabela 3.
Abs |
Cg, o (G) |
Cg* (G+E) |
Keq |
1 |
1,767 |
1,001 |
0,765 |
3 |
1,922 |
1,004 |
0,914 |
|
|||
1 |
1,872 |
0,993 |
0,885 |
2 |
1,918 |
1,014 |
0,892 |
|
|||
2 |
1,793 |
1,011 |
0,773 |
3 |
1,793 |
1,015 |
0,767 |
|
|||
1 |
0,693 |
0,376 |
0,843 |
2 |
0,671 |
0,364 |
0,843 |
3 |
0,669 |
0,345 |
0,939 |
|
|||
1 |
1,407 |
0,785 |
0,792 |
2 |
1,472 |
0,816 |
0,804 |
|
|||
1 |
1,464 |
0,778 |
0,882 |
2 |
1,483 |
0,792 |
0,872 |
3 |
1,474 |
0,785 |
0,877 |
|
|||
Średnie Keq: |
0,846 |
||
Wyniki
Stała równowagi z równania kinetycznego:
Keq = 0,869
Stała równowagi wyznaczona eksperymentalnie:
Keq = 0,846
Wyszukiwarka