ANALIZA KATIONÓW
Systematyczna analiza kationów opiera się na wytrącaniu osadów zawierających kationy zaliczane do jednej z grup analitycznych.
Do wytrącania kationów w postaci trudno rozpuszczalnych soli służą tzw. odczynniki grupowe.
W analizie jakościowej wykrywa się najczęściej 24 kationy, zaliczane do 5 grup analitycznych (tabela X).
Ze względu na niewielką liczbę godzin przewidzianych w programie na wykonanie analiz kationów, studenci kierunku Biotechnologii Medycznej zostaną zapoznani z wykrywaniem wg toku analizy tylko wybranych jonów (w tab. nr X zaznaczono te kationy pogrubioną czcionką).
Tabela X.
Podział kationów na grupy analityczne wg Freseniusa
Grupa |
Odczynnik grupowy |
Jony wykrywane |
Skład osadu |
I |
3M HCl |
Ag+, Pb2+, Hg22+ |
AgCl,PbCl2, Hg2Cl2 |
II |
H2S (AKT) środowisko kwaśne (HCl) |
Hg2+, Pb2+, Bi3+, Cu2+, Cd2+, Sn2+, Sn4+, As3+, As5+, Sb3+, Sb5+ |
HgS, PbS, Bi2S3, CuS, CdS, SnS, SnS2, As2S3, As2S5, Sb2S3, Sb2S5 |
III |
H2S (AKT) NH3∙H2O i NH4Cl |
Al3+, Cr3+, Fe2+, Fe3+,Ni2+,Co2+, Mn2+, Zn2+ |
Al./OH/3, Cr/OH/3, Fe2S3, FeS, NiS, CoS, MnS, ZnS |
IV |
/NH4/2CO3 wobec NH3∙H2O i NH4Cl |
Ca2+, Sr2+, Ba2+ |
CaCO3, SrCO3, BaCO3 |
V |
Brak |
Mg2+, Na+, K+, NH4+ |
Brak |
SREBRO - ARGENTUM - Ag 2.8.18.18.1
Z = 47 Masa molowa. = 107,87 g/mol
11 grupa (I podgrupa) układu okresowego;
stopień utlenienia +1, +2
Srebro należy do metali ciężkich, w szeregu napięciowym znajduje się za wodorem i dlatego nie wypiera go z kwasów. Reakcję srebra z kwasami utleniającymi przedstawić można w następujący sposób:
Ag + kwas → sól + tlenek + H2O
utleniający srebra obojętny
Ag + 2HNO3 → AgNO3 + ↑NO2 + H2O
Srebro i jego związki mają w lecznictwie zastosowanie jako środki o właściwościach ściągających, żrących i antyseptycznych. Mechanizm działania soli srebra na ustrój polega na tym, że uwolniony jon srebra wytrąca białko, tworząc osad białczanu srebra. Sole srebra podane do wewnątrz wywołują zatrucie organizmu.
Wykrywanie jonów srebra - Ag+
Odczynnik grupowy - kwas solny HCl oraz rozpuszczalne sole zawierające jony Cl- wytrącają z obojętnych i kwaśnych roztworów osad AgCl
AgNO3 + HCl → ↓AgCl + HNO3∗
Ag+ + Cl- → ↓AgCl
↓AgCl - chlorek srebra, biały, serowaty, fiołkowieje na świetle; nie rozpuszcza się
w HNO3;
jest rozpuszczalny w NH3∙H2O, KCN, Na2S2O3 i stęż. HCl
a/ NH3∙H2O
↓AgCl + 2NH3∙H2O → [Ag(NH3)2]Cl + 2H2O
powstaje roztwór - chlorek diamosrebra(I) sól kompleksowa, z której pod wpływem rozcieńczonego HNO3 wydziela się ponownie biały osad AgCl
[Ag(NH3)2]Cl + 2HNO3 → ↓AgCl + 2NH4NO3
b/ KCN
↓AgCl + 2KCN → K[Ag/CN/2] + KCl
dicyjanosrebrzan(I) potasu
c/ Na2S2O3
↓AgCl + 2Na2S2O3 → Na3[Ag/S2O3/2] + NaCl
ditiosiarczanosrebrzan (I)
trisodu
d/ stężony HCl
↓AgCl + HCl → H[AgCl2]
kwas chlorosrebrowy
Bromek lub jodek potasu: KBr, KJ wytrąca osady
AgNO3 + KBr → ↓AgBr + KNO3
AgNO3 + KJ → ↓AgJ + KNO3
↓AgBr - bromek srebra, jasnożółty; rozpuszczalny w NH3∙H2O
↓AgJ - jodek srebra, żółty; nierozpuszczalny nawet w stężonym NH3∙H2O
Wodorotlenek sodu NaOH wytrąca osad
2AgNO3 + 2NaOH → ↓Ag2O + 2NaNO3 + H2O
↓Ag2O - tlenek srebra, czarno-brunatny; nie rozpuszcza się w nadmiarze odczynnika
.
Amoniak NH3∙H2O wytrąca osad nietrwały, początkowo biały, brunatniejący, który rozpuszcza się w nadmiarze odczynnika z utworzeniem jonu kompleksowego.
AgNO3 + NH3∙H2O → ↓AgOH + NH4NO3
↓2AgOH → ↓Ag2O + H2O
↓Ag2O + 4NH3∙H2O → 2[Ag/NH3/2]OH + 3H2O
wodorotlenek
diaamoosrebra (I)
Chromian(VI) potasu K2CrO4 lub dichromian(VI) potasu K2Cr2O7 wytrąca osad
2AgNO3 + K2Cr2O7 → ↓Ag2Cr2O7 + 2KNO3
↓Ag2CrO4 - chromian(VI)srebra(I), brunatno-czerwony; rozpuszcza się w NH3∙H2O i HNO3,
nie rozpuszcza się w rozcieńczonym CH3COOH
↓Ag2Cr2O7 - dichromian(VI) srebra(I) czerwono-brunatny, rozpuszczalność analogiczna
jak Ag2CrO4
Siarkowodór H2S (AKT)wytrąca z roztworów kwaśnych, obojętnych i amoniakalnych osad
2AgNO3 + H2S → ↓Ag2S + 2HNO3
↓Ag2S - siarczek srebra(I) czarny, nie rozpuszcza się w NH3∙H2O, rozcieńczonym HNO3,
rozpuszcza się w stężonym, gorącym HNO3.
RTĘĆ - HYDRARGYRUM - Hg 2.8.18.32.10.2
Z = 80 Masa molowa. = 200,6 g/mol
12 grupa (II podgrupa) układu okresowego;
Stopień utlenienia +1, +2
Rtęć należy do metali ciężkich, w szeregu napięciowym znajduje się za wodorem. Metal ten nie rozpuszcza się w kwasie solnym oraz rozcieńczonym kwasie siarkowym. Ogrzewany w gorącym, stężonym kwasie siarkowym lub azotowym tworzy odpowiednie sole:
3Hg + 8HNO3 → 3Hg/NO3/2 + ↑2NO + 4H2O
Pary rtęci są trujące.
W lecznictwie wykorzystuje się metaliczną rtęć oraz jej sole. Związki rtęci są truciznami protoplazmy i wskutek tego dobrymi środkami dezynfekcyjnymi. Rtęć z innymi metalami tworzy stopy zwane amalgamatami, stosowanymi min. w dentystyce.
Wykrywanie jonów rtęci(II) - Hg2+
Odczynnik grupowy - siarkowodór H2S (AKT) w środowisku zakwaszonym HCl wytrąca
osad HgS
3HgCl3 + 2H2S → ↓HgCl2∙2HgS + 4HCl
biały chlorosiarczek
rtęci(II)
↓HgCl2∙2HgS + H2S → ↓3HgS + 2HCl
czarny siarczek
rtęci(II)
↓HgS - nie rozpuszcza się w rozcieńczonych kwasach na
zimno i na gorąco; rozpuszcza się w wodzie królewskiej /aqua regia - mieszanina stężonego HCl i stężonego HNO3 w stosunku 3:1/
3HCl + HNO3 → ↑CL2 + ↑NOCl + 2H2O
chlorek
nitrozylu
Woda królewska działa chlorująco na HgS
↓3HgS + 2HNO3 + 6HCl → 3HgCl2 + ↓3S + ↑2NO + 4H2O
Uwaga! Ze względu na trujące właściwości chloru i tlenku azotu rozpuszczanie należy wykonywać pod wyciągiem.
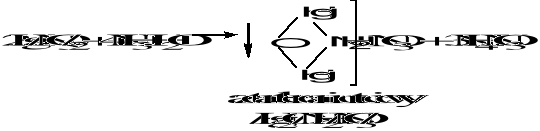
Amoniak NH3∙H2O wytrąca osad
HgCl2 + 2NH3∙H2O → ↓HgNH2Cl + NH4Cl + H2O
Chlorek amidortęci(II)
W przypadku soli Hg/NO3/2 powstaje
![]()
Jodek potasu KJ wytrąca osad
HgCl2 + 2KJ → ↓HgJ2 + 2KCl
↓HgJ2 - jodek rtęciowy, czerwony, rozpuszcza się w nadmiarze KJ
↓HgJ2 + 2KJ → K2[HgJ4]
tetrajodortęcian(II) potasu
Roztwór K2[HgJ4] zalkalizowany KOH znany jest pod nazwą odczynnika Nesslera
/do wykrywania jonu amonowego/.
Chlorek cyny(II) SnCl2 redukuje sole rtęci(II) najpierw do soli rtęci(I) a następnie do metalicznej rtęci
2HgCl2 + SnCl2 → ↓Hg2Cl2 + SnCl4
chlorek rtęci(I)
/kalomel/
↓Hg2Cl2 + SnCl2 → ↓2Hgo + SnCl4
rtęć metaliczna - czarna
ARSEN - ARSENIUM - As 2.8.18.5
Z = 33 Masa molowa. = 74,92 g/mol
15 grupa (V grupa) układu okresowego;
Stopień utlenienia -3, +3, +5
Arsen właściwościami fizycznymi zbliżony jest do metali, natomiast chemicznymi do niemetali.
Arsen oraz jego związki wykazują charakter amfoteryczny tj; rozpuszczają się w kwasach i zasadach.
Arsen działa w małych dawkach pobudzająco na aktywność krwiotwórczą szpiku kostnego, wpływa hamująco na ogólną przemianę materii, co zaznacza się przyrostem masy ciała. Z ustroju wydalany jest przez nerki; może ulegać kumulacji. Odkłada się w tkankach oraz włosach, paznokciach, kościach - pobudza ich wzrost.
Wykrywanie jonów arsenu(III) - As3+
Odczynnik grupowy - siarkowodór H2S (AKT) w roztworze kwaśnym wytrąca As2S3
2AsCl3 + 3H2S → ↓As 2S3 + 6HCl
↓As2S3 - siarczek arsenu(III), żółty; rozpuszcza się w /NH4/2S; NaOH i KOH, /NH4/2CO3, HNO3 stęż.
a/ ↓As2S3 + 3/NH4/2S → 2/NH4/3AsS3
tioarsenian(III) amonu
b/ ↓As2S3 + 6KOH → K3AsS3 + K3AsO3 + 3H2O
tioarsenian(III) arsenian(III)
potasu potasu
c/ ↓As2S3 + 3/NH4/2CO3 → /NH4/3AsS3 + /NH4/3AsO3 + ↑3CO2
d/ ↓3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + ↑28NO
Obliczenie współczynników reakcji rozpuszczania As2S3 w HNO3 /stęż./ przedstawia się następująco:
2As+3 - 2x2ē = 4ē → 2As+5
utlenianie
3 S-2 - 3x8ē = 24ē → 3 S+6
suma 28ē
|
28 |
|
3 |
|
|
84 |
|
N+5 + 3ē → N2+ redukcja |
3 |
|
28 |
Wodorotlenek sodu - NaOH wytrąca osad, który następnie rozpuszcza się w nadmiarze odczynnika (amfoteryczność As/OH/3 )
AsCl3 + 3NaOH → ↓As/OH/3 + 3NaCl
↓As/OH/3 + NaOH → Na[As/OH/4] ![]()
NaAsO2
arsenian(III) sodu
Azotan srebra(I) - AgNO3 wytrąca osad żółty, rozpuszczalny w HNO3 i w NH3∙H2O
AsCl3 + 4AgNO3 ![]()
↓AgAsO2 + ↓3AgCl + 4HNO3 + H2O
4. Nadtlenek wodoru - H2O2 - utlenia związki As3+ do As5+

Anion arsenianu(V) /As+5/ wykrywa się za pomocą:
mieszaniny magnezjowej, która wytrąca biały osad MgNH4AsO4
molibdenianu(VI)amonu (NH4)2MoO4, który w środowisku kwaśnym wytrąca żółty osad (NH4)3[As(Mo3O10)4]
Próba Gutzeita - polega na redukcji związków arsenu /As3+ oraz As5+/ do gazowego arsenowodoru, który tworzy z AgNO3 początkowo zabarwienie żółte, przechodzące w czarne, na skutek redukcji do metalicznego srebra:
6AgNO3 + AsH3 → ↓Ag3As∙3AgNO3 + 3HNO3
Ag3As∙3AgNO3 + 3H2O → H3AsO3 + 3HNO3 + ↓6Ago
Wykonanie:
Do probówki zawierającej analizowany roztwór dodaje się metalicznego cynku /Zn/
i rozc. H2SO4. Wylot probówki zakrywa się zwitkiem waty lub podziurkowaną bibułą,
na której umieszcza się parę kryształków AgNO3, względnie zwilża 50% roztworem
AgNO3. Obecność As w próbie powoduje powstanie żółtej a następnie czarnej barwy
AgNO3.
MANGAN - MANGANUM - Mn 2.8.13.2
Z = 25 Masa molowa. = 54,93 g/mol
7 grupa(VII podgrupa) układu okresowego;
Stopień utlenienia +2, +3, +4, +6, +7
Mangan rozpuszcza się w gorącej wodzie, w kwasach /nawet octowym/ i zasadach. Największe znaczenie mają związki manganu na +2 i +7 stopniu utlenienia. Wszystkie związki manganu są barwne: sole manganu(II) /Mn+2/ bezwodne są białe, w roztworze bladoróżowe, sole manganu /Mn+3/ - manganiany(III) są czerwone, manganiany(VI) /Mn+6/ bezwodne są fioletowe, w roztworze zielone, natomiast związki Mn+7 - manganiany(VII) ( do niedawna nazywane „nadmanganiany”) zarówno w stanie stałym jak i w roztworze są ciemnofioletowe.
Właściwości chemiczne związków manganu zależą od stopnia utlenienia i są: Mn+2 - zasadowe, Mn+3 - słabo zasadowe, Mn+4 - amfoteryczne, Mn+6 i Mn+7- charakter kwasowy.
Mangan jest jednym z najbardziej rozpowszechnionych /poza żelazem/ pierwiastkiem w tkankach i cieczach ustroju. Jest to pierwiastek nieodzowny dla normalnego rozwoju organizmu, wpływa katalizująco na aktywność katalazy. Niedobór manganu powoduje zahamowanie wzrostu, nieprawidłową mineralizację kości, niedorozwój narządów płciowych. Zapotrzebowanie dzienne manganu wynosi 4-5 mg.
Wykrywanie jonów manganu(II) - Mn2+
Odczynnik grupowy H2S (AKT) wytrąca wobec mieszaniny buforowej, złożonej z NH3∙H2O i NH4Cl osad MnS
MnCl2 + /NH4/2S → ↓MnS + 2NH4Cl
MnS - siarczek manganu(II), cielisty, rozpuszczalny w kwasach mineralnych oraz
CH3COOH
Wodorotlenek sodu - NaOH wytrąca osad
MnCl2 + 2NaOH → ↓Mn/OH/2 + 2NaCl
Mn/OH/2 - wodorotlenek manganu(II); rozpuszczalny w kwasach oraz solach amonowych; nierozpuszczalny w nadmiarze NaOH
Utlenianie soli manganu(II) do jonu manganianu(VII)
2Mn/NO3/2 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5Bi/NO3/3 + 5NaNO3 + 7H2O
/in subst./

Powstające w reakcji jony manganianowe(VII) zabarwiają roztwór na fiołkowo. Reakcji przeszkadzają inne reduktory, natomiast nie przeszkadzają duże ilości jonów Mn2+ jak również nieduża ilość chlorków.
Wykonanie:
Do analizy dodaje się kilka kropli stęż. HNO3 i ogrzewa do wrzenia. W osobnej probówce ogrzewa się wodną zawiesinę NaBiO3 poczym zawartość obu probówek łączy się.
ŻELAZO - FERRUM - Fe 2.8.14.2
Z = 26 Masa molowa. = 55,85 g/mol
8 grupa (VIII grupa) układu okresowego /triada żelazowców/;
Stopień utlenienia +2, +3
Żelazo należy do metali ciężkich, w szeregu napięciowym znajduje się przed wodorem, oznacza to, że z kwasów wypiera wodór. Jony żelaza na +2 stopniu utleniania wykazują właściwości redukujące, natomiast jony Fe3+ mogą działać utleniająco.
Sole żelaza(II) mają barwę zieloną a żelaza(III) brunatną lub żółtą.
Związki żelaza spełniają ważną rolę w organizmie. Dla procesów biochemicznych szczególne znaczenie mają jego kompleksy metaloorganiczne z porfirynami, proteinami i in. Do tej grupy związków należą: hemoglobina /Fe+2/, katalaza /Fe+3/. Niedobór żelaza może wywoływać schorzenie zwane niedokrwistością /anemia/. Sole żelaza są resorbowane z przewodu pokarmowego, przy czym sole żelaza trójwartościowego nie ulegają resorpcji. Sole żelaza dwuwartościowego resorbują się w ilości 20-25%. Wchłanianie zależy od ilości kwasu solnego w żołądku i poziomu witaminy C w ustroju.
Wykrywanie jonów żelaza - Fe 2+/3+
Odczynnik grupowy H2S( AKT) w środowisku zasadowym wytrąca osady FeS i Fe2S3
FeSO4 + /NH4/2S → ↓FeS + /NH4/2SO4
czarny
2FeCl3 + 3/NH4/2S → ↓Fe2S3 + 6NH4Cl
czarny
↓FeS i ↓Fe2S3 - rozpuszcza się w kwasach
Wodorotlenek sodu - NaOH wytrąca osady
FeSO4 + 2NaOH → ↓Fe/OH/2 + Na2SO4
wodorotlenek żelaza(II),
brunatnozielony
FeCl3 + 3NaOH → ↓Fe/OH/3 + 3NaCl
wodorotlenek żelaza(III)
czerwonobrunatny
↓Fe/OH/2 na powietrzu łatwo utlenia się do ↓Fe/OH/3
Oba wodorotlenki nie rozpuszczają się w nadmiarze odczynnika; są łatwo rozpuszczalne w kwasach.
Tiocyjanian amonu (rodanek amonu lub potasu) NH4SCN, KSCN
Fe2+ - nie wytrąca się osad i barwa roztworu nie zmienia się
Fe3+ - reaguje z utworzeniem krwistoczerwonego roztworu, barwa nie znika po zakwaszeniu
HCl /odróżnienie od octanów/
FeCl3 + 3KSCN → Fe/SCN/3 + 3KCl
Tritiocyjanian żelaza(III)
Cyjanek potasu - KCN wytrąca osady
FeSO4 + 2KCN → ↓Fe/CN/2 + K2SO4
cyjanek żelaza(II) żółto-brunatny
rozpuszczalny w KCN
↓Fe/CN/2 + 4KCN → K4[Fe/CN/6]
heksacyjanożelazian(II) potasu
żółty roztwór
FeCl3 + 3KCN → ↓Fe/CN/3 + 3KCl
cyjanek żelaza(III)
rozpuszczalny w KCN
↓Fe/CN/3 + 3KCN → K3[Fe/CN/6]
heksacyjanożelazian(III) potasu,
żółto-zielony roztwór
Heksacyjanożelazian(II) potasu - K4[Fe/CN/6]
2Fe2+ + [Fe/CN/6]4- → Fe2[Fe/CN/6]
heksacyjanożelazian(II) żelaza(II)
osad na powietrzu niebieszczeje, ponieważ tworzy się tzw. błękit pruski Fe4[Fe/CN/6]3
4Fe3+ 3[Fe/CN/6]4- → Fe4[Fe/CN/6]3
heksacyjanożelazian(II) żelaza(III)
/błękit pruski/
nierozpuszczalny w rozc. HCl;
rozpuszczalny w stęż. HCl
WAPŃ - CALCIUM - Ca 2.8.8.2
Z = 20 Masa molowa = 40,08g/mol
2 grupa (II grupa) układu okresowego
stopień utlenienia +2
Wapń jest pierwiastkiem lekkim, rozkładającym w normalnych warunkach wodę z wydzieleniem wodoru.
Jony wapnia są niezbędne dla normalnej czynności serca jak i konieczne dla zachowania prawidłowej aktywności układu mięśniowo-nerwowego. Wapń jest składnikiem kości, zębów i jak również błon komórkowych, wpływając na ich przepuszczalność i utrzymanie integralności. Mając możność odkładania się w tkankach znekrotyzowanych wapń hamuje patologiczną przepuszczalność naczyń włosowatych i ułatwia leczenie niektórych procesów zapalnych. Jony Ca2+ wprowadzone do jelit wpływają hamująco na ich
perystaltykę. Nadmiar w ustroju jonów wapnia wpływa na wydalanie jonów sodowych /wzrost diurezy/. Duże znaczenie ma zawartość wapnia we krwi gdzie występuje głównie
w osoczu. Jony wapnia są też nieodzowne dla przemiany protrombiny w trembinę w procesie krzepnięcia krwi.
Wykrywanie jonów wapnia - Ca2+
Odczynnik grupowy - węglan amonowy /NH4/2CO3 w środowisku zasadowym wytrąca osad CaCO3
CaCl2 + /NH4/2CO3 → ↓CaCO3 + 2NH4Cl
węglan wapnia,
biały, bezpostaciowy,
po ogrzaniu krystaliczny
↓CaCO3 - rozpuszcza się w HCl, HNO3, CH3COOH
Chromian(VI) potasu (K2CrO4) i dichromian(VI) potasu (K2Cr2O7) - nie wytrąca osadu
Kwas szczawiowy /COOH/2 - wytrąca osad z roztworów alkalicznych lub po zbuforowaniu CH3COONa
CaCl2 + /COOH/2 → ↓CaC2O4 + 2HCl
↓CaC2O4 szczawian wapnia, biały, rozpuszcza się w kwasach mineralnych;
nie rozpuszcza się w CH3COOH, nawet po ogrzaniu.
Zabarwienie płomienia
Lotne sole wapniowe /chlorki/ barwią płomień na kolor ceglasto-czerwony.
MAGNEZ - MAGNESIUM - Mg 2.8.2
Z = 12 Masa molowa. = 35,453 g/mol
2 grupa (II grupa) układu okresowego
stopień utlenienia +2
Magnez jest metalem srebrzystobiałym. Na powietrzu w obecności wilgoci pokrywa się warstwą tlenku magnezu. Z wodą w temperaturze pokojowej reaguje bardzo słabo, natomiast z parą wodną w temperaturze 100oC reaguje bardzo energicznie.
Mg + H2O → ↓MgO + ↑H2
Sole magnezu rozpuszczalne w wodzie: chlorek, bromek, jodek, azotan (V), octan.
Sole magnezu nierozpuszczalne w wodzie: Mg/OH/2, MgCO3, MgNH4PO4∙6H2O, MgNH4AsO4∙6H2O
Magnez jest niezbędny w prawidłowym przebiegu procesów metabolicznych dostarczających energii, jak również w syntezie białek oraz fosforylacji beztlenowej. Największe ilości magnezu znajdują się w szkielecie i mięśniu sercowym jak również w wątrobie. Bez uzupełniania niedoboru magnezu niemożliwe staje się m.in. wyrównanie komórkowego niedoboru potasu, co jest jednym z ważniejszych czynników proarytmicznych.
Wykrywanie jonów magnezu - Mg2+
Wodorotlenek sodu lub potasu NaOH lub KOH wytrąca z roztworów galaretowaty osad
MgCl2 + 2NaOH → ↓Mg/OH/2 + 2NaCl
wodorotlenek magnezu,
biały
Amoniak NH3∙H2O wytrąca z obojętnych roztworów galaretowaty osad
MgCl2 + 2NH3∙H2O → ↓Mg/OH/2 + 2NH4Cl
wodorotlenek magnezu,
biały
3. Szczawian amonu /NH4/2CO3 ze stężonych roztworów wytrąca osad
MgCl2 + /NH4/2C2O4 + 2H2O → ↓MgC2O4∙2H2O + 2NH4Cl
szczawian magnezu,
biały
4. Magnezon
z roztworów zalkalizowanych NaOH lub KOH wytrąca niebieski osad
Wykonanie:
Do roztworu dodaje się kilka kropli odczynnika i alkalizuje się roztworem NaOH. Fioletowo-czerwony roztwór barwi się w obecności Mg2+ na niebiesko, a w obecności dużej ilości jonów Mg2+ powstaje niebieski osad.
SÓD - NATRIUM - Na 2.8.1
Z = 11 Masa molowa. = 22,99 g/mol
1 grupa (I grupa) układu okresowego
Stopień utlenienia +1
Sód jest pierwiastkiem lekkim, rozkładającym w normalnych warunkach wodę. Na powietrzu ulega natychmiastowemu procesowi utleniania.
Na ogół wszystkie sole sodu są rozpuszczalne w wodzie, za wyjątkiem np. heksafluorokrzemianu(IV)sodu i soli NaCH3COO∙Mg/CH3COO/2∙3UO2/CH3COO/2∙9H2O
Jony sodu są głównym kationem w cieczy pozakomórkowej. Wobec dużej ich zdolności wiązania wody, jony sodu są podstawowym czynnikiem regulacji osmotycznej płynów ustroju. Jony sodu oddziaływują również na enzymy (/aktywują adenilopirofosfatazę a hamują aktywność transfosforylazy).
Jony sodu łącznie z resztą kwasu węglowego stanowią tak zwaną rezerwę alkaliczną ustroju i wpływają na utrzymanie jego równowagi kwasowo-zasadowej.
Wykrywanie jonów sodu - Na+
Oktaoctan magnezu i tris(ditlenkuuranu(VI))- wytrąca osad
NaCl + nMg/UO2/3CH3COO/8 ![]()
![]()
![]()
NaCH3COO∙Mg/CH3COO/2∙3UO2/CH3COO/2∙9H2O
POTAS - KALIUM - K 2.8.8.1
Z = 19 Masa molowa. 39,096 g/mol
1 grupa (I grupa) układu okresowego
stopień utlenienia +1
Potas jest metalem lekkim, bardzo aktywnie rozkładającym wodę w normalnych warunkach. Na powietrzu ulega bardzo szybko procesowi utleniania.
Prawie wszystkie sole potasu są dobrze rozpuszczalne w wodzie, wyjątek stanowią połączenia jonu K+ z następującymi anionami: wodorowinianem, heksaazotano(III)kobaltanem(II), heksachloroplatynianem(IV) i chloranem(VII) . Jony potasu są w ustroju przede wszystkim składnikiem plazmy i głównym kationem nieorganicznym komórek. Wykazują bardzo dużą aktywność w regulowaniu ciśnienia osmotycznego płynów ustrojowych, gdyż wpływają na zwiększenie przepuszczalności ścian komórkowych. Aktywuje również transfosforylazę ATP - kwas pirogronowy oraz adenilopirofosfatazę i fosfotransacetylazę. Jony potasu w ustroju są antagonistami jonów sodu i wapnia. Są konieczne do normalnej pracy serca i produkcji w ustroju tłuszczów i białek oraz ich pochodnych.
Wykrywanie jonów potasu - K+
Wodorowinian sodu NaHC4H4O6 wytrąca z roztworów obojętnych lub kwaśnych osad
KCl + NaHC4H4O6 → ↓KHC4H4O6 + NaCl
wodorowinian potasu,
biały
Kwas heksachloroplatynowy(IV) H2PtCl6 wytrąca z roztworów stężonych osad
2KCl + H2PtCl6 → ↓K2[PtCl6] + 2HCl
heksachloroplatynian(IV) potasu,
krystaliczny, żółty
Kwas nadchlorowy(VII) - HClO4 wytrąca osad
KCl + HClO4 → ↓KClO4 + HCl
chloran(VII) potasu,
biały
Zabarwienie płomienia
Lotne sole potasowe barwią płomień na kolor fiołkowy /widoczny przez szkło kobaltowe - filtr światła/.
AMON - AMONIUM - NH4+
Masa molowa = 18,04 g/mol
Jony NH4+ są kationem kompleksowym, powstającym w wyniku reakcji protonu z amoniakiem.
NH3 + H+ → [ NH4]+
Jony amonowe tworzą słabą zasadę NH3∙H2O. Wodne roztwory soli amonowych ulegają hydrolizie.
Niektóre sole jak np.: NH4Cl i /NH4/2CO3 stosuje się do przygotowywania leków wykrztuśnych oraz wywołujących kwasicę ustroju. Jony te w organizmie przekształcają się w amoniak i następnie w mocznik.
Wykrywanie jonów amonu - NH4+
Wodorotlenek sodu - NaOH oraz inne zasady rozkładają sole amonu z wydzieleniem amoniaku. Reakcja przebiega najlepiej na gorąco
NH4Cl + NaOH → ↑NH3 + H2O + NaCl
Sprawdzanie obecności NH3
Charakterystyczny zapach NH3
Umieścić wilgotny papierek lakmusowy u wylotu probówki. Zmiana barwy na kolor niebieski świadczy o obecności NH3
Umieścić wilgotny papierek rtęciawy ( bibuła nasycona azotanem(V) rtęci(II) ) u wylotu probówki. Wystąpienie czarnej barwy na bibule /Hgo/ świadczy o obecności NH3
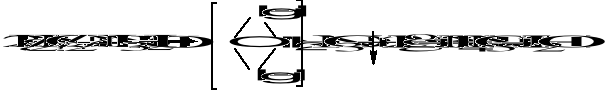
Odczynnik Nesslera - K2[HgJ4] z obojętnych lub alkalicznych roztworów wytraca osad
barwa osadu zależna jest od stężenia jonów NH4+ i zmienia się od żółtej do czerwonbrunatnej.
ANALIZA ANIONÓW
Systematyczna analiza jakościowa anionów wg Bunsena obejmuje 7 grup analitycznych /tab. X/. Podział ten oparty jest na reakcjach anionów z jonami Ag+ i Pb2+, stosowanymi w postaci rozpuszczalnych soli.
Studentów I roku kierunku Biotechnologii Medycznej obowiązuje znajomość następujących anionów: Cl-, Br-, I-, CO32-, PO43-, NO3-, MnO4-.
Tabela X. Podział anionów na grupy wg Bunsena
Grupa |
Odczynnik grupowy |
Jony wykrywane |
I |
AgNO3 - ↓Ø HNO3 BaCl2 - osadu nie wytrąca |
Cl-, Br-, I-, CN-, SCN-, [Fe(CN)6]4-, [Fe(CN)6]3- |
II |
AgNO3 - ↓O HNO3 BaCl2 - osadu nie wytrąca |
S2-, CH3COO-, NO2- |
III |
AgNO3 - ↓O HNO3 BaCl2 - ↓O HNO3 |
SO32-, CO32-, C2O42-, C4H4O62-, BO2- |
IV |
AgNO3 - ↓barwne O HNO3 BaCl2 - ↓barwne OHNO3 |
S2O32-, CrO42-, Cr2O72-, AsO43-, AsO33-, PO43- |
V |
AgNO3 - osadu nie wytrąca BaCl2 - osadu nie wytrąca |
NO3-, ClO3-, MnO4- |
VI |
AgNO3 - osadu nie wytrąca BaCl2 - ↓Ø HNO3 |
SO42-, F- |
VII |
AgNO3 - ↓ żółty O HNO3 BaCl2 - ↓ biały O HNO3 |
SiO32- |
CHLOR - CHLORUM - Cl 2.8.7
Z = 17 Masa molowa = 35,453 g/mol
…17 (VII) grupa układu okresowego
stopień utlenienia: -1, +1, +3, +5, +7
Jony chlorkowe są anionami kwasu chlorowodorowego /solnego/ i jego soli, zwanych chlorkami. Kwas solny jest roztworem wodnym gazowego chlorowodoru; należy do mocnych kwasów. Chlorki są przeważnie solami dobrze rozpuszczalnymi w wodzie; do trudno rozpuszczalnych należą: AgCl, Hg2Cl2, PbCl2 i Cu2Cl2. Chlorki występują w organizmie ludzkim obok jonów sodu, potasu, wapnia i magnezu. Jony chlorkowe są ważnym składnikiem plazmy krwi oraz płynów ustrojowych. Kwas solny wchodzi w skład soku żołądkowego, tworząc kwaśne środowisko dla aktywowania enzymów trawiennych. Chlor i jego związki uwalniające w roztworach wodnych gazowy pierwiastek, wykorzystuje się jako środki odkażające. Chlor gazowy, będący silnym środkiem utleniającym, działa odkażająco już w stężeniach 2∙10-4 mol/dm3. Chlor stosowany jest do odkażania wody.
Do dezynfekcji pomieszczeń stosuje się często sole kwasu chlorowego(I): chloran(I) sodu(I), NaOCl oraz chloran(I) wapnia(II), CaOCl2, tzw. wapno chlorowane.
Wykrywanie jonów chlorkowych - Cl-
1. AgNO3 + Cl- → ↓AgCl + NO3-
↓AgCl - chlorek srebra(I)
Uwaga! Charakterystyka osadu została podana przy wykrywaniu jonów Ag+ .
2. Pb/NO3/2 + 2Cl- → ↓PbCl2 + 2NO3-
↓PbCl2 - chlorek ołowiu(II), biały
rozpuszczalny w gorącej wodzie, po oziębieniu krystalizuje w postaci igieł
3. Hg2/NO3/2 + 2Cl- → ↓Hg2Cl2 + 2NO3-
↓Hg2Cl2 - chlorek rtęci(I), biały
czernieje pod wpływem NH3∙H2O
4. KMnO4
Roztwór KMnO4 utlenia chlorki w środowisku kwaśnym na gorąco, do wolnego chloru, ulegając podczas reakcji odbarwieniu
10NaCl + 2KMnO4 + 8H2SO4 → ↑5Cl2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
Wolny chlor identyfikuje się po charakterystycznym zapachu oraz po fioletowieniu papierka jodoskrobiowego (bibuła nasycona KI i skrobią).
BROM - BROMUM - Br 2.8.18.7
Z = 35 Masa molowa = 79,909 g/mol
…17 (VII) grupa układu okresowego
Stopień utlenienia: -1, +1, +3, +5, +7
Jony bromkowe są anionami kwasu bromowodorowego i jego soli zwanych bromkami. Kwas bromowodorowy jest wodnym roztworem gazowego bromowodoru. Do nierozpuszczalnych soli tego kwasu należą: AgBr, Hg2Br2, PbBr2 i Cu2Br2. Bromki są silniejszymi reduktorami od chlorków.
Jony bromkowe działają depresyjnie na czynności ośrodkowego układu nerwowego. Po podaniu większych dawek bromków metali alkalicznych następuje osłabienie i zwolnienie procesów myślowych, zanik pamięci i ogólne zmęczenie psychiczne. Jony bromkowe nie wywierają działania nasennego lecz tylko ułatwiają zasypianie.
Związki bromu stosuje się jako środki uspokajające w przypadku niektórych schorzeń nerwowych.
Wykrywanie jonów bromkowych - Br-
1. AgNO3 + Br- → ↓AgBr + NO3-
↓AgBr - bromek srebra(I), jasnożółty, serowaty, zieleniejący na świetle
rozpuszczalny w stęż. NH3∙H2O, Na2S2O3
nierozpuszczalny w kwasach
2. Pb/NO3/2 + Br- → ↓PbBr2 + 2NO3-
↓PbBr2 - bromek ołowiu(II), biały
rozpuszczalny w gorącej wodzie
Właściwości redukujące jonów Br—
Cl2 aq. w obecności rozpuszczalnika organicznego np. CHCl3, CCl4
NaBr + Cl2o → 2NaCl + ↑Br2o
Reakcja ta polega na wypieraniu bromu z roztworu jego soli przez silniejszy utleniacz jakim jest chlor.
Wykonanie:
Do badanego roztworu w probówce dodać CHCl3 lub CCl4 a następnie kroplami - stale mieszając wodę chlorową. Rozpuszczalnik organiczny zabarwi się na kolor brunatno-czerwony. Nadmiar wody chlorowej utlenia wydzielony brom do bezbarwnego kwasu bromowego.
↑Br2o + 5Cl2o + 6H2O → 2HBrO3 + 10HCl
K2Cr2O7 /stały/ w obecności stęż. H2SO4
K2Cr2O7 + 6HBr + 4H2SO4 → ↑3Br2o + Cr2(SO4)3 + K2SO4 + 7H2O
Wydzielający się brom utlenia bezbarwny odczynnik Schiffa do fiołkowej fuksyny.
Wykonanie:
Do probówki zawierającej suchą pozostałość po odparowaniu badanego roztworu dodać stałego K2Cr2O7 oraz kilka kropli stęż. H2SO4. Wylot probówki nakryć bibułą zwilżoną odczynnikiem Schiffa. Całość ostrożnie ogrzać.
Pojawienie się fiołkowej barwy bibuły nad wylotem probówki świadczy o obecności jonów Br-.
IOD - IODUM - I 2.8.18.7
Z = 53 Masa molowa = 126,904 g/mol
17 (VII) grupa układu okresowego
Stopień utlenienia: -1, +1, +3, +5, +7
Jony jodkowe są anionami mocnego kwasu jodowodorowego i jego soli zwanych jodkami. Jodki mają silniejsze właściwości redukujące od bromków. Do trudno rozpuszczalnych soli jodkowych należą: AgI, Hg2I2, HgI2, PbI2, Cu2I2 i BiI3.
Jod jest antyseptykiem a jego działanie oparte jest na wyzwalaniu tlenu /in statu nascendi/ w reakcji z wodą
I2o + H2O → HI + HIO
HIO → HI + ↑Oo
W organizmie ludzkim jod występuje w ilościach od 20-25 mg: połowa tej ilości w tarczycy. Brak jodu w tym organie powoduje powstawanie wola. Schorzenie to leczy się podawaniem jodków.
Jodki powodują także zwiększenie przenikliwości naczyń włosowatych, a tym samym ułatwiają wchłanianie uszkodzonych tkanek - zastosowanie w leczeniu gruźlicy kostnej i kiły. Oprócz tych właściwości jodki i jodany obniżają lepkość, a tym samym zmniejszają ciśnienie krwi. W nadciśnieniu, szczególnie połączonym z miażdżycą stosuje się: jodek sodu(I) i potasu(I) oraz jodan(V) sodu(I).
Jodki podaje się zwykle doustnie, jodany - podskórnie.
Wykrywanie jonów jodkowych - I-
1. AgNO3 + I- → ↓AgI + NO3-
↓AgI - jodek srebra(I), żółty, serowaty
rozpuszczalny w Na2S2O3, KCN
nierozpuszczalny w roz. NH3∙H2O, HNO3
2. Pb(NO3)2 + 2I- → ↓PbI2 + 2NO3-
↓PbI2 - jodek ołowiu(II), jasnożółty
rozpuszczalny w gorącej wodzie, KI
PbI2 + KI → K[PbI3]
trijodoołowian(II) potasu(I)
3. HgCl2 + 2I- → ↓HgI2 + 2Cl-
↓HgI2 - jodek rtęci(II), żółty, przechodzący w jasno-czerwony, rozpuszczalny w KI
HgI2 + 2KI → K2[HgI4]
tetrajodortęcian(II) potasu(I)
Właściwości redukujące jonów I-
Cl2aq. lub Br2aq. w obecności CHCl3, CCl4
2I- + Cl2o → I2o + 2Cl-
Wykonanie:
Próbę wykonać analogicznie jak przy wykrywaniu jonów Br-. Warstwa organiczna zabarwia się na kolor fioletowy od wydzielonego jodu.
Nadmiar wody chlorowej utlenia I2o do kwasu jodowego
I2o + 5Cl2o + 6H2O → 2HIO3 + 10HCl
K2Cr2O7 /stały/ w obecności stęż. H2SO4
K2Cr2O7 + 6HI + 4H2SO4 → 3I2o + Cr2(SO4)3 + K2SO4 + 7H2O
Wydzielony jod zabarwia roztwór skrobi na kolor fioletowy.
WĘGIEL - CARBO - C 2.4
Z = 6 Masa molowa = 12,011 g/mol
14 (IV) grupa układu okresowego
Stopień utlenienia: od -4 do +4
Jony węglanowe(IV) są anionami słabego, diprotonowego kwasu węglowego(IV) i jego soli, zwanych węglanami(IV). Kwas węglowy(IV) jest nietrwały, łatwo rozpada się na CO2 i H2O. Jako kwas diprotonowy tworzy sole obojętne i wodorosole. Wodorowęglany i węglany obojętne metali alkalicznych są rozpuszczalne w wodzie. Węglany berylowców i metali ciężkich są z reguły nierozpuszczalne.
Węglany występujące w organizmie ludzkim wchodzą w skład układów buforowych H2CO3/NaHCO3, których zadaniem jest utrzymanie stałego pH krwi.
Niektóre sole węglanowe są stosowane jako leki np. (NH4)2CO3 - działa wykrztuśnie. Węglany mogą być wykorzystywane również jako leki zobojętniające kwas solny w żołądku np. wodorowęglan(IV) sodu(I) NaHCO3, CaCO3 strącony, węglan(IV) magnezu(II) MgCO3.
Wykrywanie jonów węglanowych(IV) - CO32-
1. 2AgNO3 + CO32- → ↓Ag2CO3 + 2NO3-
↓Ag2CO3 - węglan(IV) srebra(I), biały
rozpuszczalny w HNO3, NH3∙H2O
Po ogrzaniu wydziela się brunatny Ag2O
Ag2CO3 → Ag2O + ↑2CO2
↓Ag2O - tlenek srebra(I), brunatny
nierozpuszczalny w nadmiarze odczynnika
2. BaCl2 + CO32- → ↓BaCO3 + 2Cl-
↓BaCO3 - węglan(IV) baru(II), biały
rozpuszczalny w HNO3
3. Kwasy /HCl, H2SO4/ rozkładają węglany z wydzieleniem CO2 powodując tzw. perlenie roztworu.
2HCl + CO32- → H2CO3 + 2Cl-
H2CO3 → H2O + ↑CO2
Wydzielający się CO2 powoduje zmętnienie wody wapiennej /roztwór Ca(OH)2/ lub wody barytowej /roztwór Ba(OH)2/ na skutek wytrącania osadów
↑CO2 + Ca(OH)2 → ↓CaCO3 + H2O
FOSFOR - PHOSPHOROS - P 2.8.5
Z = 15 Masa molowa = 30,979 g/mol
15 (V) grupa układu okresowego
Stopień utlenienia: -3 , +3, +4, +5
Jony fosforanowe(V) są anionami triprotonowego kwasu ortofosforowego(V). H3PO4 jako kwas triprotonowy tworzy sole obojętne i wodorosole. Najłatwiej zachodzi dysocjacja pierwszego etapu; kwas ortofosforowy(V) w roztworach wodnych zachowuje się jak kwas średniej mocy. Sole rozpuszczalne w wodzie: ortofosforany(V) potasowców oraz diwodorofosforany(V) wapniowców. Pozostałe fosforany(V) są nierozpuszczalne w wodzie.
Fosfor jest składnikiem organizmów żywych, zwierzęcych i roślinnych. Wchodzi w skład białka i kości. W kościach występuje fosforan(V) wapnia(II). Szczególnie bogata w fosfor jest tkanka mózgowa oraz nerwowa.
Wykrywanie jonów fosforanowych(V) - PO43-
1. 3AgNO3 + HPO42- → ↓Ag3PO4 + H+ + 3NO3-
HPO42- + H+ → H2PO4-
↓Ag3PO4 - żółty osad, rozpuszczalny w roz. HNO3, CH3COOH, NH3∙H2O
2. Ba/NO3/2 + HPO42- → ↓BaHPO4 + 2NO3-
↓BaHPO4 - biały osad, rozpuszczalny w roz. HNO3, HCl, CH3COOH.
4. Mieszanina magnezowa (MgCl2+ NH3∙H2O + NH4Cl) wytrąca z roztworów
krystaliczny osad
PO43- + Mg2+ + NH4+ → ↓MgNH4PO4
ortofosforan(V) amonowomagnezu(II) - biały
AZOT - NITROGENIUM - N2.5
Z = 7 Masa molowa = 14,006 g/mol
15 (V) grupa układu okresowego
Stopień utlenienia: -3, +1, +2, +3, +4, +5
Jony azotanowe(V) są anionami mocnego kwasu azotowego(V) i jego soli. Kwas azotowy(V) i azotany(V) są silnymi utleniaczami. Wszystkie azotany(V), z wyjątkiem niektórych tlenosoli np. BiONO3 /azotan(V) bizmutylu/ są dobrze rozpuszczalne w wodzie.
Niektóre azotany(V) znalazły zastosowanie w lecznictwie np. nitrogliceryna - bezpośrednio rozszerza naczynia krwionośne i jest wykorzystywana w leczeniu choroby wieńcowej.
Wykrywanie jonów azotanowych(V) - NO3-
AgNO3 oraz BaCl2 nie wytrącają osadów z roztworów zawierających jony azotanowe(V)
Właściwości utleniające azotanów - reakcja obrączkowa
2HNO2 + 6FeSO4 + 3H2SO4 → ↑2NO + 3Fe2(SO4)3 + 4H2O
Powstający tlenek azotu(II) łączy się z nadmiarem FeSO4
↑NO + FeSO4 → Fe(NO)SO4
brunatny
siarczan nitrozylożelaza(II)
Wykonanie
Przygotować nasycony roztwór soli żelaza(II) przez rozpuszczenie stałego FeSO4 w niewielkiej ilości wody. Ok. 0,5 cm3 tak przygotowanego roztworu przenieść do probówki i ostrożnie nawarstwić po ściance stęż. H2SO4 do uzyskania dwóch warstw. Następnie pipetką na granicę warstw wkroplić badany roztwór.
Powstanie brunatnej obrączki świadczy o obecności jonów NO3-.
Reakcja obrączkowa zachodzi również z jonami NO2-. Do wykonania próby należy jednak użyć kwasu siarkowego o stęż. 1 mol/dm3.
MANGAN - MANGANIUM - Mn2.8.13.2
Z = 25 Masa molowa = 54,930 g/mol
7 grupa układu okresowego, (VII podgrupa)
Stopień utlenienia:+2, +3, +4, +6, +7
Jony manganianowe(VII) są anionami mocnego kwasu manganowego(VII), który nie występuje w stanie wolnym; znane są natomiast jego sole trwałe, dobrze rozpuszczalne w wodzie - manganiany(VII). Wodne roztwory manganianów(VII) mają barwę fioletową. Najbardziej znaną solą kwasu manganowego(VII) jest manganian(VII) potasu(I), KMnO4 stosowany często jako środek odkażający. KMnO4 działa utleniająco w środowisku kwaśnym, obojętnym i zasadowym w stężeniach 1:1000 do 1:5000. Zewnętrznie stosowane są roztwory od 0,05 do 0,2%. W niższych stężeniach może być używany do płukania żołądka przy zatruciach cyjankami, fosforem lub alkaloidami.
Wykrywanie jonów manganianowych(VII) - MnO4-
AgNO3 oraz BaCl2 nie wytrącają osadów z roztworów zawierających jony MnO4-
Stężony HCl
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + ↑5Cl2o + 8H2O
Wykonanie
Badany roztwór odparować w probówce do sucha i ochłodzić. Następnie dodać 1-2 krople stężonego HCl. Wydziela się żółto-zielony gaz (Cl2)o nieprzyjemnym zapachu.
Właściwości utleniające jonów MnO4-
Aniony: Cl-, Br-, I-, SCN-, [Fe/(CN)6]4-, NO2-, S2-, SO32-, C2O42-, C4H4O62-, S2O32- oraz
kationy: Hg22+, Sn2+, Fe2+ a także H2O2
redukują w środowisku kwaśnym (1mol/dm3 H2SO4) jony MnO4- do Mn2+, powodując odbarwienie roztworu, np.
2KMnO4 + 14KCl + 8H2SO4 → 2MnCl2 + ↑5Cl2o + 8K2SO4 + 8H2O
Mn+7 + 5ē → Mn+2 x 2
2Cl- - 2ē → Cl2 x 5
Wykrywanie soli
Identyfikacja pojedynczej soli polega na wykryciu kationu i anionu, wchodzących w jej skład. Analizę rozpoczyna się od określenia barwy, zapachu oraz zachowania się soli podczas ogrzewania.
Do wstępnych badań należy także próba barwienia płomienia palnika gazowego przez badaną sól, wprowadzoną do płomienia na druciku platynowym. Pierwiastki alkaliczne i ziem alkalicznych barwią płomień na charakterystyczny kolor co ułatwia ich późniejszą identyfikację.
Ponieważ analizę soli przeprowadza się przede wszystkim na drodze mokrej, należy rozpuścić przygotowaną do badania sól. W tym celu dobiera się odpowiedni rozpuszczalnik. Na wstępie należy sprawdzić rozpuszczalność w wodzie. Jeżeli substancja nie rozpuszcza się w wodzie (albo rozpuszcza się częściowo) bada się kolejno działanie rozcieńczonych a następnie stężonych kwasów HCl, HNO3 oraz mieszaniny - wody królewskiej.
Przeprowadzając trudno rozpuszczalną sól do roztworu dodaje się nadmiaru odczynnika rozpuszczającego i ewentualnie ogrzewa. Jeżeli sól rozpuszcza się zarówno w HCl oraz w HNO3 korzystniej jest stosować kwas azotowy, ponieważ azotany są mniej lotne od chlorków. Po rozpuszczeniu soli w kwasach usuwa się nadmiar użytego kwasu przez odparowanie roztworu do małej objętości. Roztwór po odparowaniu kwasu rozcieńcza się wodą destylowaną.
Sole nierozpuszczalne w wodzie i kwasach /np.BaSO4/ najczęściej stapia się z nadmiarem sody. Otrzymuje się wówczas związki nierozpuszczalne w wodzie lecz rozpuszczalne w rozcieńczonych kwasach.
Studentów I roku kierunku Biotechnologii Medycznej obowiązuje wykonanie analizy soli rozpuszczalnej w wodzie.
W skład analizowanej soli mogą wchodzić tylko kationy:
Ag+, Hg2+, As3+, Fe3+, Ca2+, Mg2+, Na+, K+, NH4+ oraz aniony: Cl-, Br-, J-, CO32-, PO43-, NO3-, MnO4-.
Opracowując sposób analizy soli uwzględniono wyłącznie związki rozpuszczalne w wodzie i zawierające wymienione jony.
Do probówki zawierającej niewielką ilość soli /ok. 0,5 g/ dodaje się 15 cm3 wody destylowanej, wytrząsa i w razie potrzeby ogrzewa. Uzyskane zabarwienie roztworu może pochodzić od soli: manganu, żelaza i chromu. Następnie należy zbadać papierkiem uniwersalnym odczyn roztworu. Uzyskany odczyn zasadowy wskazuje na obecność soli pochodzącej od mocnej zasady, kwaśny - od mocnego kwasu, obojętny - od mocnej zasady i mocnego kwasu lub słabej zasady i słabego kwasu.
Biorąc pod uwagę wnioski wynikające z prób wstępnych, przeprowadza się w otrzymanym roztworze analizę anionów i kationów.
Analiza anionów:
Reakcja grupowa z KMnO4 - wykrywanie reduktorów
Ok. 1 cm3 roztworu badanej soli zakwasza się kilkoma kroplami rozc. H2SO4 i dodaje małymi porcjami rozcieńczony roztwór KMnO4. Jeżeli na zimno nie następuje odbarwienie, roztwór ogrzewa się do wrzenia. Odbarwienie roztworu KMnO4 jest spowodowane obecnością jonów Cl-, Br- lub I- /jeżeli zabarwienie manganianu(VII) potasu(I) utrzymuje się - jony te są nieobecne/.
Reakcja grupowa z roztworem KI - wykrywanie utleniaczy
Ok. 1 cm3 otrzymanego roztworu soli zakwasza się roz. HCl, dodaje 1-2 cm3 roztworu KJ i ok. 0,5 cm3 roztworu skrobi.
Otrzymane niebieskie zabarwienie roztworu świadczy o obecności anionów MnO4- lub NO3-.
Reakcja grupowa z roztworem AgNO3
Analizowany roztwór zakwasza się roz. HNO3 i dodaje nadmiaru AgNO3.
Wytrącenie osadu świadczy o obecności niżej wymienionych jonów:
Cl- - AgCl; biały
Br- - AgBr; jasno-żółty
I- - AgI; żółty
Próba na wydzielanie gazów
Do oddzielnej porcji roztworu /lub krystalicznej soli/ dodaje się kwasu solnego o stężeniu 3 mol/dm3 i lekko wstrząsa zawartość probówki. Wydzielanie się pęcherzyków gazu /CO2/ wskazuje na obecność anionu CO32-.
Wyniki powyższych prób pozwalają na sformułowanie wniosków odnośnie występowania niektórych anionów w roztworze. Po stwierdzeniu nieobecności niektórych anionów, przystępuje się do wykrywania pozostałych, wykonując reakcje charakterystyczne, podane przy identyfikacji poszczególnych jonów.
Analiza kationów:
Po przeprowadzeniu analizy anionów znana jest rozpuszczalność soli i anion wchodzący w jej skład.
Przystępując do analizy kationów należy zapoznać się z tablicą rozpuszczalności soli i wyciągnąć odpowiednie wnioski odnośnie obecności kationu. Np. jeżeli sól rozpuszcza się w wodzie i zawiera anion SO42-, to próby na obecność jonów Ba2+ i Ca2+ są zbyteczne. Kationy te nie mogą być obecne, ponieważ tworzą z anionem siarczanowym trudno rozpuszczalne w wodzie związki.
Obecność anionu chlorowca Cl-, Br- lub I- w soli łatwo rozpuszczalnej w wodzie wyklucza obecność kationu Ag+.
Analizę kationów prowadzi się w sposób systematyczny, ustalając grupę do której kation należy. W tym celu na wstępie wykrywa się kation NH4+. Następnie przeprowadza się reakcje z odczynnikami grupowymi, co umożliwia ustalenie przynależności kationu do określonej grupy. Korzystając z reakcji specyficznych wykrywa się kation wchodzący w skład soli.
Rozpuszczalność wybranych soli w wodzie.
Chlorki, bromki, jodki:
Są rozpuszczalne z wyjątkiem AgCl, AgBr i AgI.
Węglany(IV):
Są na ogół trudno rozpuszczalne. Wyjątek stanowią węglany metali alkalicznych oraz amonu. Wszystkie węglany rozpuszczają się w gorącym, roz. HCl lub HNO3.
Siarczany:
Są na ogół dobrze rozpuszczalne. Wyjątek stanowią siarczany BaSO4, Pb SO4. Ag2SO4 i CaSO4 są również solami słabo rozpuszczalnymi w wodzie.
Azotany(V)
Są dobrze rozpuszczalne w wodzie.
∗ Uwaga!
Wyjaśnienia stosowanych skrótów
↓ - osad
○ - osad rozpuszczalny
ø - osad nierozpuszczalny
1
20
jodgl


![]()

Wyszukiwarka