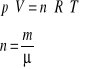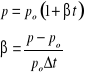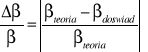Ćwiczenie nr 28
Sprawdzanie praw gazu doskonałego. Przemiana izochoryczna.
Cel ćwiczenia
Celem ćwiczenia jest badanie przemiany izochorycznej i sprawdzenie prawa
Charlesa.
Wprowadzenie
Gaz doskonały składa się z jednakowych cząsteczek o pomijalnie małej objętości, poruszających się w chaotycznym ruchu. Zakłada się, że cząsteczki gazu oddziaływają ze sobą jedynie w chwili zderzenia. Zderzenia cząsteczek ze sobą i ściankami naczynia są doskonale sprężyste. Gazy rzeczywiste tylko dla niezbyt dużych ciśnień i temperatur stosują się do tego modelu. Z kinetyczno-molekularnej teorii gazów (teoria mikroskopowa) wynika, że iloczyn ciśnienia p i temperatury bezwzględnej T jest proporcjonalny średniej energii kinetycznej cząsteczek gazu:
|
(28.1) |
gdzie: N - ilość cząsteczek gazu, Ek śr - średnia energia kinetyczna cząsteczek.
Z teorii kinetyczno molekularnej wynika również, że średnia energia kinetyczna Ek śr jest proporcjonalna do temperatury bezwzględnej T. Wynika stąd równanie:
|
(28.2) |
Dla stałej masy gazu m powyższe równania są zgodne z fenomenologicznym (makroskopowym) równaniem Clapeyrona:
|
(28.3) |
|
(28.4) |
gdzie:
R - uniwersalna stała gazowa,
n - ilość moli gazu,
m - masa,
μ - masa cząsteczkowa.
Gaz, który spełnia równanie Clapeyrona nazywamy gazem doskonałym. Makroskopowe wielkości ciśnienie p, objętość V i temperaturę termodynamiczna T nazywamy parametrami stanu gazu. Przemianami stanu gazu nazywamy procesy prowadzące do zmiany wartości ciśnienia p, objętości V lub temperatury T.
W znanych przemianach gazowych dwa parametry ulegają zmianie, a trzeci pozostaje stały. Znamy następujące przemiany:
izotermiczna (prawo Boyle`a-Mariotte`a) T = const
izobaryczna (prawo Gay-Lussaca) p = const
izochoryczna (prawo Charlesa) V = const
adiabatyczna-brak wymiany ciepła z otoczeniem
W przemianie izochorycznej stała pozostaje objętość naczynia z gazem V=const., a ciśnienie gazu jest wprost proporcjonalne do jego temperatury bezwzględnej. Stanowi to podstawę działania termometrów gazowych. Charles stwierdził, że w tej przemianie ciśnienie p rośnie wprost proporcjonalnie do temperatury w skali Celsjusza t:
|
(28.5) |
|
(28.6) |
gdzie:
p0 - ciśnienie przy t=00C,
β - współczynnik termicznej rozprężliwości.
Współczynnik β jest równy względnemu przyrostowi ciśnienia gazu przypadającego na jednostkowy przyrost temperatury. Dla gazu doskonałego współczynnik rozprężliwości termicznej β przyjmuje wartość:
|
(28.7) |
Aby zbadać przemianę izochoryczną posługujemy się przyrządem pokazanym na rysunku 28.1.
Rys. 28.1 Układ do sprawdzania prawa Charles`a
Źródło: Gabryelski, E.: Fizyka dla klasy I LO, PZWS, Warszawa 1969.
Zestaw pomiarowy składa się ze szklanej kolby umieszczonej w naczyniu z termostatująca cieczą ( najlepiej wykorzystać ultratermostat) połączoną z U-rurką cienką rurką lub elastycznym przewodem zaopatrzonym w zawór trójstronny. U-rurka składa się z dwóch rurek szklanych, o jednakowym i znanym przekroju poprzecznym, połączonych przewodem z tworzywa sztucznego. Rurki umocowane są do drewnianego statywu przy pomocy obejm, które umożliwiają podnoszenie lub opuszczanie rurek. Rurki są wypełnione rtęcią lub galistanem. Pomiędzy rurkami umieszczono linijkę, dzięki której możemy kontrolować poziom cieczy w rurkach. Na początku ustawiamy zawór trójdrożny tak, wyrównać ciśnienie powietrza w kolbie z ciśnieniem atmosferycznym. Następnie przekręcamy zawór, aby zapewnić przepływ powietrza z kolby do U-rurki. Manipulując obydwoma ramionami rurki ustawiamy poziom cieczy w obu rurkach na jednakowym poziomie i mocno przykręcamy obejmy. Od tej pory można tylko zmieniać położenie prawej rurki. Zakładamy, że wzrost temperatury w kolbie wywołuje tylko wzrost ciśnienia p. Po wzroście temperatury do t2 unosimy prawe ramię
przyrządu, aby ciecz w lewym ramieniu pozostała na pierwotnym poziomie. Przyrost ciśnienia gazu wywołany wzrostem temperatury jest równy różnicy poziomów cieczy w prawym i lewym niezmienionym poziomie cieczy h = hn - h0.
Opis stanowiska laboratoryjnego
Przyrząd wykorzystywany do sprawdzenia przemiany izochorycznej ( rysunek 1.) składa się kolby szklanej połączonej zaworem trójdrożnym U rurką czyli zestawem dwóch rurek szklanych, o jednakowym i znanym przekroju poprzecznym, połączonych przewodem z tworzywa sztucznego. Rurki umocowane są do drewnianego statywu przy pomocy obejm, które umożliwiają podnoszenie lub opuszczanie rurek. Rurki są wypełnione rtęcią lub galistanem. Pomiędzy rurkami umieszczono linijkę, dzięki której możemy kontrolować poziom cieczy w rurkach. Jedna z rurek posiada na końcu zawór służący do zamykania słupa powietrza, a druga posiada otwarty koniec. Kolba powinna zostać umieszczona w ultratermostacie umożliwiającym zmianę temperatury powietrza w kolbie i jej pomiar. Dodatkowo w pracowni należy umieścić barometr i termometr pokojowy.
Program ćwiczenia
Otworzyć zawór i ustawić poziom cieczy w rurkach na jednakowym poziomie. Najlepiej ustawić rtęć w połowie wysokości rurki. Zamknąć zawór. Zanotować wysokość położenia cieczy w lewej rurce h0.
Odczytać wartość ciśnienia atmosferycznego na barometrze pa. Jeżeli zachodzi taka potrzeba zamienić jednostki odczytanego ciśnienia na mm słupa rtęci (mm Hg).
Na początku ustawiamy zawór trójdrożny tak, wyrównać ciśnienie powietrza w kolbie z ciśnieniem atmosferycznym pa. Następnie przekręcamy zawór , aby zapewnić przepływ powietrza z kolby do U-rurki.
Manipulując obydwoma ramionami rurki ustawiamy poziom cieczy w obu rurkach na jednakowym poziomie i mocno przykręcamy obejmy. Od tej pory można tylko zmieniać tylko położenie prawej rurki.
Ogrzewać wodę w ultra termostacie. Po wzroście temperatury do tn unosimy prawe ramię przyrządu tak, aby ciecz w lewym ramieniu pozostała na pierwotnym poziomie. Wyznaczyć różnicę wysokości poziomów cieczy w lewym i prawym ramieniu hn.
Odczytywać i zapisywać temperaturę wody t co 3 0C oraz różnicę poziomów cieczy w lewym i prawym ramieniu przyrządu h.
Po osiągnięciu około 60 0C wyłączyć termostat i zakończyć pomiary.
Wyznaczyć ciśnienie powietrza w kolbie:
Zapisać niepewności pomiarowe pomiarów bezpośrednich.
Wyniki pomiarów umieścić w tabeli 28.1.
Sprawozdanie
Wykonać wykres zależności ciśnienia od temperatury w skali Celsjusza. Początek układu odniesienia przyjąć dla 0 0C.Nanieść niepewności pomiarowe. Pomiędzy prostokątami niepewności przeprowadzić prostą.
Wyznaczyć współczynnik nachylenia prostej oraz punkt przecięcia z osią ciśnienia p.
Obliczyć wartość współczynnika rozprężliwości β.
Czynności z punktu 1. i 2. wykonać także, za pomocą programu komputerowego.
Obliczyć względną różnicę wyznaczonego doświadczalnie współczynnika β i jego wartości teoretycznej:
Dyskusja wyników i niepewności pomiarowych.
Pytania kontrolne
Gaz doskonały
Podstawowy wzór kinetycznej teorii gazów
Równanie Clapeyrona
Rodzaje przemian gazowych
Gaz doskonały a gazy rzeczywiste
|
(28.8) |
Tabela 28.1.
Δpa= Δh0= Δhn= Δh= Δt= pa=
t [ 0C] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h=hn-h0 [mm Hg] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p=pa+h [mm Hg] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(28.9) |
Wyrazić ją także w procentach.
176
Wyszukiwarka