EAiE |
Jóźwik Piotr Jasek Krzysztof |
Rok I |
Grupa III |
Zespół 12 |
||||
Laboratorium Fizyczne |
Temat : Prawo Boyle'a Mariotte'a i uniwersalna stała gazowa R |
Nr ćw. 22 |
||||||
Data wykonania:
02.03.2001 |
Data oddania:
9.03.2001 |
Zwrot do poprawy : |
Data odbioru: |
Data zaliczenia: |
Ocena : |
|||
1. Cel ćwiczenia
Zapoznanie się z układem próżniowym i pomiarem ciśnienia w tym układzie, sprawdzenie prawa Boyle'a - Mariotte'a dla powietrza w temperaturze pokojowej, wyznaczenie uniwersalnej stałej gazowej.
2. Wprowadzenie teoretyczne
Ciśnienie gazu wiąże się z oddziaływaniem cząsteczek z ściankami naczynia. Zderzając się z nimi oddają swoją energię i wywierają nacisk.
Jednostką ciśnienia w układzie SI jest paskal [Pa]. Jest to ciśnienie wywierające nacisk jednego niutona na jeden metr kwadratowy. Jednostkami pochodnymi są: atmosfera techniczna, bar, atmosfera fizyczna, milimetr słupa rtęci ( tor ), etc.
Próżnią nazywamy stan, jaki panuje w obszarze wypełnionym gazami lub parami, gdy ciśnienie jest niższe od ciśnienia atmosferycznego wynoszącego około 106 Pa
Próżnię wytwarza się w tzw. układach próżniowych. Są to zespoły szklanych lub metalowych zbiorników, zaworów próżniowych, połączeń rurowych, sondy próżniomierzy i pomp próżniowych. Próżnię wytwarza się poprzez mechaniczne usunięcie cząsteczek powietrza poza obszar naczynia ( pompy przepływowe: rotacyjna i dyfuzyjna ) lub poprzez absorpcję ( pompy sorpcyjne ).
W zależności od towarzyszącego jej ciśnienia próżnię dzielimy na:
tzw. podciśnienie ( p>100 hPa)
próżnia wstępna ( 100 hPa > p > 10-4 hPa)
wysoka próżnia ( do ok. 10-8 hPa)
ultrawysoka próżnia ( do 10-11 hPa)
Technika próżniowa znajduje szerokie zastosowanie: w procesach produkcji związków o wysokiej czystości chemicznej i przyrządów półprzewodnikowych, w lampach kineskopowych, termosach i naczyniach do przechowywania skroplonych gazów. Największą jakość próżni (tzw. ultrawysoką próżnię) uzyskuje się w komorach akceleratorowych - rzędu 10-11 hPa.
Gaz doskonały
Gazem doskonałym w ujęciu teorii kinetyczno - molekularnej będziemy nazywali następujący uproszczony, wyidealizowany model gazu rzeczywistego:
a. Gaz składa się z identycznych cząsteczek
b. Cząsteczki znajdują się w ciągłym ruchu i podlegają zasadom dynamiki Newtona
c. Całkowita liczba cząsteczek jest bardzo duża
d. Objętość i rozmiary liniowe cząsteczek są zaniedbywalnie małe
e. Cząsteczki nie oddziałują między sobą za wyjątkiem samych zderzeń
f. Zderzenia są doskonale sprężyste i zachodzą w zaniedbywalnie krótkim czasie.
Równanie stanu gazu doskonałego dane jest wzorem:
pV = nRT
gdzie:
p - ciśnienie gazu
V - objętość;
n - liczba moli gazu;
R - uniwersalna stała gazowa.
Prawo Boyle`a - Mariotta:
Opisuje przemianę izotermiczną ( T = const ) gazu doskonałego. Z równania stanu gazu doskonałego otrzymujemy:
pV = const = nRT, czyli p1V1 = p2V2
We współrzędnych p, V przy stałej temperaturze i masie gazu, wykresem przemiany izotermicznej jest hiperbola.
Układ próżniowy ze zmienną objętością poprzez odpowiednie rozprężanie wyodrębnionego wcześniej powietrza, kolejno do opróżnionych z gazu zbiorników pomocniczych pozwala na sprawdzenie prawa Boyle'a - Mariotte'a dla powietrza w temperaturze pokojowej.
Uniwersalna stała gazowa
Powyższy wzór wskazuje, że w celu wyznaczenia stałej gazowej R należy znać masę gazu o znanej objętości, temperaturze i ciśnieniu. Wartość m masy gazu można znaleźć porównując masę zbiorniczka przed i po wypompowaniu gazu. Do obliczeń bierzemy temperaturę otoczenia i aktualne ciśnienie atmosferyczne.
3. Aparatura i przeprowadzenie ćwiczenia
Układ próżniowy składa się z rotacyjnej pompy próżniowej podłączonej za pomocą szklanych przewodów o łącznej objętości 400cm3 z ośmioma zbiornikami o objętości 1100 cm3 każdy. Równolegle do nich podłączony jest próżniomierz oporowy oraz manometr mechaniczny (o dokładności 0,2 kG/cm2).
Nie mamy do dyspozycji odłączanego zbiornika za pomocą którego można by wyznaczyć masę gazu w znanej objętości i temperaturze, więc posłużymy się porównaniem powietrza z gazem doskonałym w warunkach normalnych.
Aby uzyskać większą dokładność doświadczenie przeprowadzimy cztery razy, zapowietrzając kolejno jeden, dwa, trzy i cztery zbiorniki powietrzem atmosferycznym, które następnie będzie rozprężane do pozostałych zbiorników (oraz połączenia).
Przed wykonaniem właściwego pomiaru, sprawdzaliśmy charakterystykę szybkości pompowania układu oraz szczelność, która okazała się wystarczająca.
Pomiary przeprowadzone zostały dla ciśnienia atmosferycznego i temperatury:
pat = 1009 hPa
T = 21 oC
4. Obliczenia
Jeden mol gazu w warunkach normalnych ma objętość 22,4 dm3, więc liczbę moli obliczamy ze wzoru:
![]()
* 1,1 [mol]
gdzie Z oznacza ilość zapowietrzonych zbiorników użytych w kolejnych doświadczeniach (każdy ze zbiorników ma objętość 1,1 dm3)
Trzeba zaznaczyć, że użyta metoda wyznaczenia liczby moli powietrza niesie ze sobą duży przyczynek błędu i jest w zasadzie szacowaniem, gdyż należy przyjąć odchyłkę rzędu 10% wyznaczonej wartości.
Nachylenie charakterystyki p(1/V):
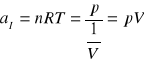
a więc stała gazowa R:
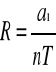
Gdzie a1 jest współczynnikiem kierunkowym prostej otrzymanej z punktów pomiarowych z użyciem metody najmniejszych kwadratów.
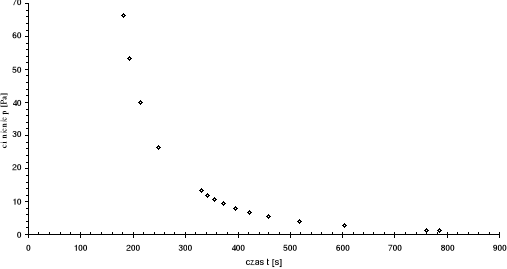
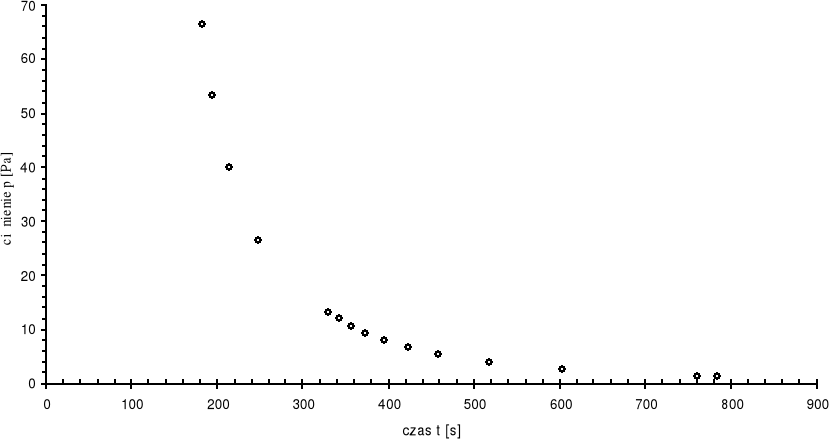
Po dokonaniu niezbędnych przeliczeń jednostkowych (skala próżniometru oporowego była opracowana w torach) i podstawieniu danych do wykresu z czasem otrzymaliśmy charakterystykę szybkości pompowania:
P |
p |
t |
[Tr] |
[Pa] |
[s] |
0,5 |
66,50 |
182,67 |
0,4 |
53,20 |
193,73 |
0,3 |
39,90 |
213,61 |
0,2 |
26,60 |
247,89 |
0,1 |
13,30 |
329,98 |
0,09 |
11,97 |
342,70 |
0,08 |
10,64 |
355,61 |
0,07 |
9,31 |
372,52 |
0,06 |
7,98 |
394,64 |
0,05 |
6,65 |
422,54 |
0,04 |
5,32 |
458,20 |
0,03 |
3,99 |
517,54 |
0,02 |
2,66 |
602,42 |
0,01 |
1,33 |
760,30 |
|
1,20 |
784,20 |
Jak należało się spodziewać, wykres przebiega po krzywej wykładniczej, co zgadza się z teoretycznym wzorem na szybkość pompowania.
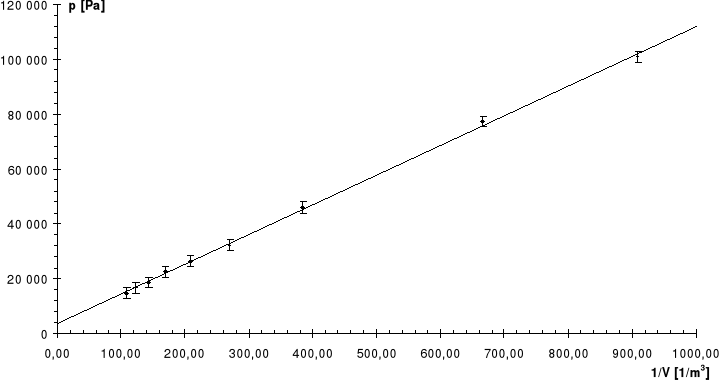
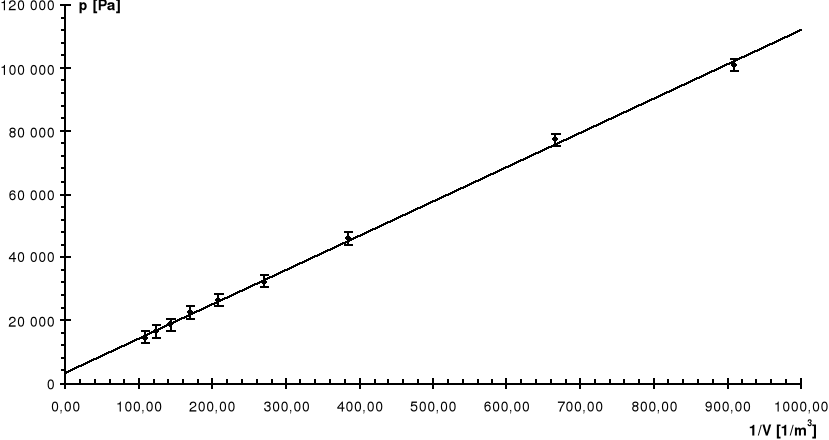
Wyniki kolejnych doświadczeń umieściliśmy w kolejnych tabelach i przedstawiliśmy na poniższych wykresach:
Nr |
V |
p |
1/V |
P |
Pomiaru |
[dm3] |
[kG/cm2] |
[1/m3] |
[Pa] |
0 |
1,1 |
0,00 |
909,09 |
100 900 |
1 |
1,5 |
0,24 |
666,67 |
77 363 |
2 |
2,6 |
0,56 |
384,62 |
45 981 |
3 |
3,7 |
0,70 |
270,27 |
32 251 |
4 |
4,8 |
0,76 |
208,33 |
26 367 |
5 |
5,9 |
0,80 |
169,49 |
22 444 |
6 |
7,0 |
0,84 |
142,86 |
18 521 |
7 |
8,1 |
0,86 |
123,46 |
16 560 |
8 |
9,2 |
0,88 |
108,70 |
14 598 |
|
|
|
|
|
|
|
|
R: |
7,52 |
|
|
|
R: |
0,76 |
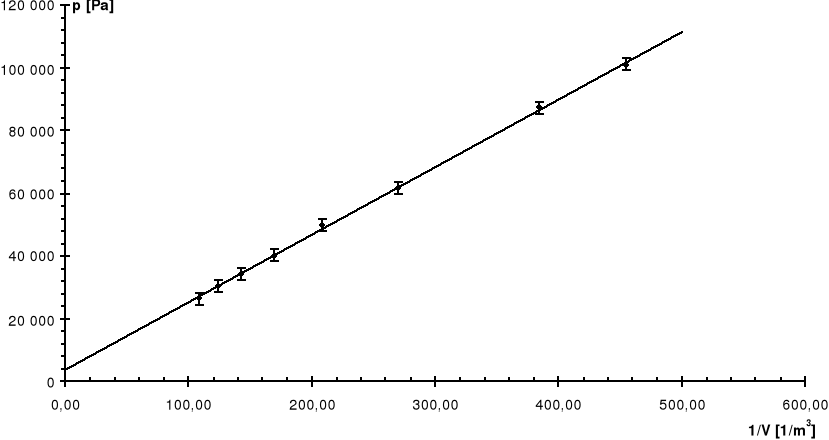
Nr |
V |
p |
1/V |
P |
Pomiaru |
[dm3] |
[kG/cm2] |
[1/m3] |
[Pa] |
0 |
2,2 |
0,00 |
454,55 |
100 900 |
1 |
2,6 |
0,14 |
384,62 |
87 170 |
2 |
3,7 |
0,40 |
270,27 |
61 672 |
3 |
4,8 |
0,52 |
208,33 |
49 904 |
4 |
5,9 |
0,62 |
169,49 |
40 097 |
5 |
7,0 |
0,68 |
142,86 |
34 212 |
6 |
8,1 |
0,72 |
123,46 |
30 290 |
7 |
9,2 |
0,76 |
108,70 |
26 367 |
|
|
|
|
|
|
|
|
R: |
7,47 |
|
|
|
R: |
0,75 |
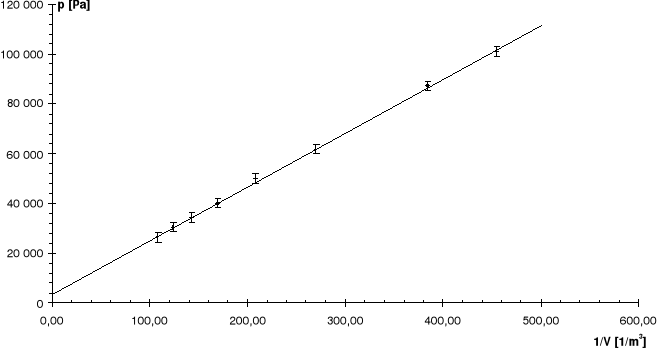
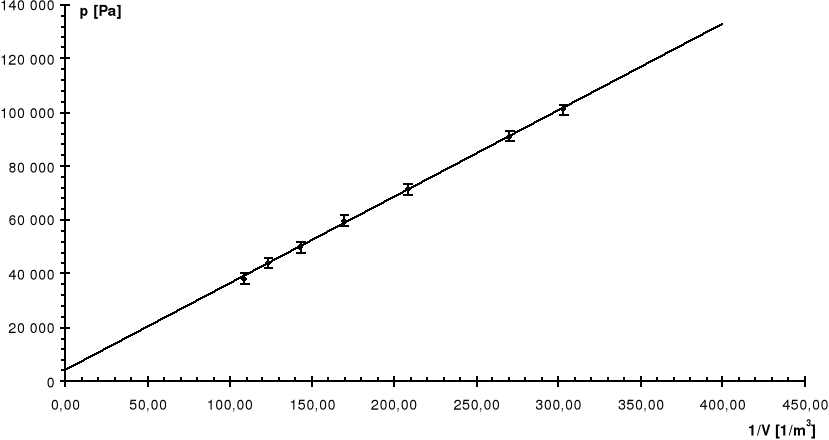
Nr |
V |
p |
1/V |
P |
Pomiaru |
[dm3] |
[kG/cm2] |
[1/m3] |
[Pa] |
0 |
3,3 |
0,00 |
303,03 |
100 900 |
1 |
3,7 |
0,10 |
270,27 |
91 093 |
2 |
4,8 |
0,30 |
208,33 |
71 479 |
3 |
5,9 |
0,42 |
169,49 |
59 711 |
4 |
7,0 |
0,52 |
142,86 |
49 904 |
5 |
8,1 |
0,58 |
123,46 |
44 019 |
6 |
9,2 |
0,64 |
108,70 |
38 135 |
|
|
|
|
|
|
|
|
R: |
7,41 |
|
|
|
R: |
0,75 |
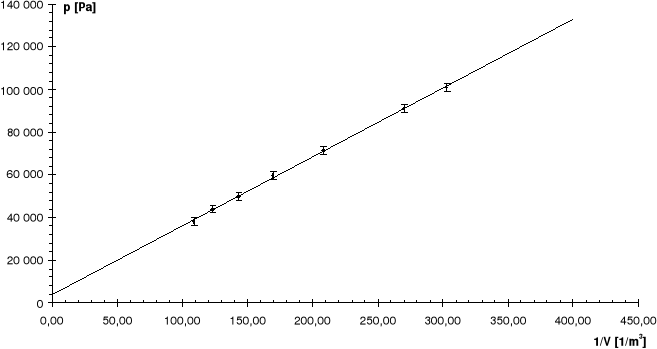
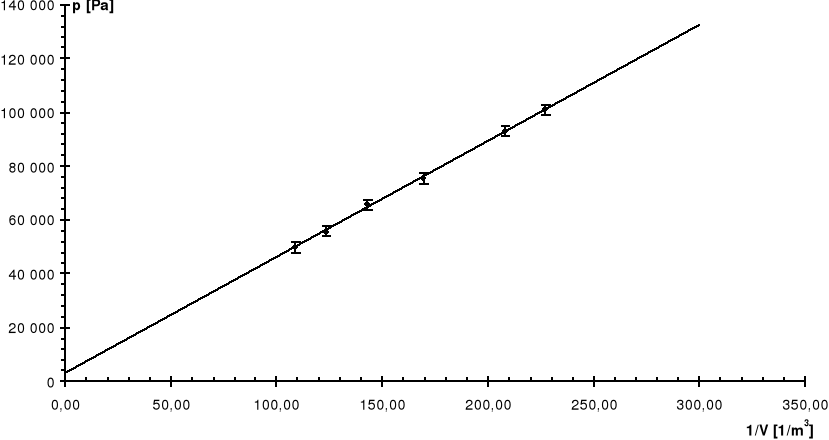
Nr |
V |
p |
1/V |
P |
Pomiaru |
[dm3] |
[kG/cm2] |
[1/m3] |
[Pa] |
0 |
4,4 |
0,00 |
227,27 |
100 900 |
1 |
4,8 |
0,08 |
208,33 |
93 054 |
2 |
5,9 |
0,26 |
169,49 |
75 402 |
3 |
7,0 |
0,36 |
142,86 |
65 595 |
4 |
8,1 |
0,46 |
123,46 |
55 788 |
5 |
9,2 |
0,52 |
108,70 |
49 904 |
|
|
|
|
|
|
|
|
R: |
7,46 |
|
|
|
R: |
0,75 |
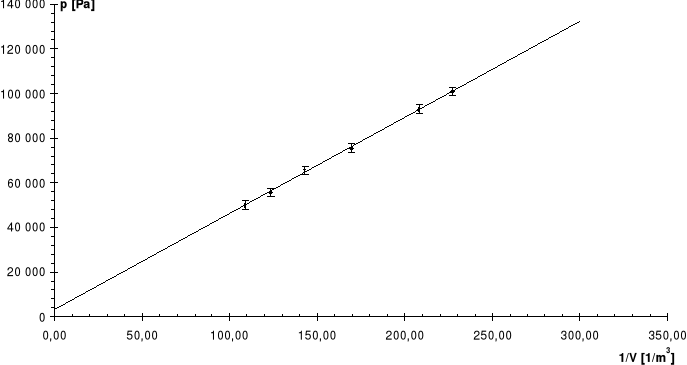
Linia ciągła jest prostą, której współczynniki zostały wyznaczone na podstawie metody najmniejszych kwadratów.
Odchyłkę R obliczamy za pomocą prawa przenoszenia błędów, podstawiając za przyczynek a obliczony błąd w metodzie najmniejszych kwadratów, odchyłkę T przyjmując jako 1oC.
Linią przerywaną zaznaczono dla porównania krzywą teoretyczną.
Wzór na kolejne wartości ΔR z prawa przenoszenia błędów:
![]()
średnia wartość wyznaczanej stałej gazowej
błąd tablicowy
Średnia wartość wyznaczonej przez nas stałej gazowej wynosi R = 7,46 (J*K-1mol-1) obarczona błędem 0,43 (J*K-1mol-1) obliczonym z wzoru na odchylenie standardowe średniej po podstawieniu kolejnych odchyłek.
Błąd tablicowy wynosi 10,2 %.
5. Wnioski
Mimo zastosowania kilku środków ograniczających błąd pojawiły się w wynikach pewne odchyłki od wartości oczekiwanych. Błędy te można złożyć na karb niskiej rozdzielczości podziałki manometru oraz nieznacznych wahań temperatury przy dehermetyzacji zbiorników ( pomimo prób redukcji tegoż błędu poprzez odczekanie pewnego przedziału czasowego ). Głównym z zasadzie jednak przyczynkiem do błędu uzyskanego przez nas wyniku jest szacowanie liczby moli gazu na podstawie porównania z warunkami normalnymi. Należałoby się spodziewać, że przy wyższej temperaturze od 0oC liczba moli w liczonej przez nas objętości powinna być zawarta w dolnym przedziale 10% błędu, co przekładałoby się na zwiększenie wyznaczona przez nas wartości stałej gazowej byłaby odpowiednio wyższa i dawałaby bardzo zbliżone do wartości tablicowych. Niestety nie dysponowaliśmy dokładnymi tabelami właściwości powietrza uzależnionymi od temperatury.
Obliczony przez nas błąd tablicowy wynosi 10,2% (co wskazuje jeszcze raz na błąd szacowania liczby moli, który wynosił 10%).
Ćwiczenie zapoznało nas z działaniem układu próżniowego oraz dało kilka cennych uwag na temat powszechnie obowiązujących praw termodynamiki.
Ćwiczenie 22
9
![]()
Wyszukiwarka