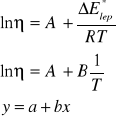Część teoretyczna
Istnienie sił przyciągania międzycząsteczkowego w cieczy powoduje, że przepływ cieczy ze stałą szybkością wymaga przyłożenia siły, która zrównoważy tarcie wewnętrzne przeciwstawiające się przepływowi cieczy. Siłę tę definiuje równanie Newtona:
![]()
(1)
Gdzie: F-siła powodująca względny ruch równoległych do siebie warstw cieczy
S - pole powierzchni warstw
dv/dx - gradient prędkości, prostopadły do kierunku przepływu cieczy
ŋ - współczynnik proporcjonalności, zwany współczynnikiem lepkości dynamicznej ośrodka
Lepkość jest to siła tarcia, która powoduje, że dwie warstwy o powierzchni jednostkowej odległe od siebie o jednostkową odległość poruszają się z gradientem prędkości dv/dx = 1s-1
Lepkość cieczy maleje ze wzrostem temperatury. Zależność płynności cieczy(płynność jest odwrotnością lepkości)od temperatury jest wykładnicza i opisuje ją równanie Arrheniusa:
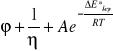
(2)
Gdzie: φ - płynność cieczy
∆E*lep - molowa energia aktywacji lepkiego przepływu cieczy
R - stała gazowa
T - temperatura w skali Kelvina
stała równania Arrheniusa
Wielkość ∆E*lep ma sens fizyczny bariery energetycznej, którą 1 mol cząsteczek musi pokonać przeciskając się do dalszego położenia w rurze. Stanowi ona w przybliżeniu 1/3 molowej energii parowania. Współczynnik ![]()
jest nazwany współczynnikiem Boltzmanna i określa ułamek cząsteczek o energii równej lub przewyższającej energię lepkiego przepływu. Logarytmując równanie Arrheniusa otrzymujemy wzór:
![]()
(3)
Gdzie: A' i B - stałe, zależne od rodzaju cieczy.
Zależność ![]()
w niewielkich przedziałach temperatury wykazuje charakter liniowy, a wyrażenie ![]()
jest współczynnikiem kierunkowym otrzymanej prostej. Pomiar lepkości cieczy w kilku temperaturach pozwala zatem na obliczenie energii aktywacji lepkiego przepływu.
Dokładniejszy opis temperaturowej zależności lepkości czystych niezdysocjowanych cieczy daje równanie Eyringa:
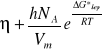
(4)
Gdzie: h - stała Plancka
NA - liczba Avogadro
Vm - objętość molowa cieczy
Molowa entalpia swobodna aktywacji lepkiego przepływu.
Równanie to zostało wprowadzone w oparciu o model cieczy zaproponowany przez Eyringa i współpracowników. W modelu tym zakłada się, ze ciecz ma strukturę dziurową. Oznacza to, że pewna ilość węzłów sieci jest nieobsadzona przez cząsteczki. Cząsteczki mogą zatem przeskakiwać ze swojego położenia równowagi do najbliższej dziury. Proces taki wymaga pokonania przez cząsteczkę bariery potencjału równej ∆G*lep (w przeliczeniu na 1 mol). Korzystając z ogólnej zależności termodynamicznej:
![]()
(5)
Równanie (4) można napisać w postaci:
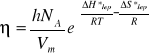
(6)
Gdzie: ∆H*lep - molowa entalpia aktywacji lepkiego przepływu,
∆S*lep -molowa entropia aktywacji lepkiego przepływu.
Wielkości Vm oraz są stałe w danej temperaturze, a zatem równanie redukuje się do postaci:
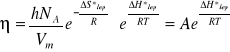
(7)
Zważywszy, ze w przypadku faz skondensowanych:
![]()
(8)
Równanie (7) jest identyczne z równaniem Arrheniusa (2). Entropia lepkiego przepływu ∆S*lep jest tym większa im struktura badanej cieczy jest bardziej uporządkowana. Zatem, dla cieczy zasocjowanych, jak np. woda i alkohole obserwuje się wyższe wartości entropii aktywacji lepkiego przepływu, niż dla cieczy niezasosjowanych. Entropię aktywacji lepkiego przepływu ∆S*lep w danej temperaturze można obliczyć z równania (5) jeśli wcześniej wyznaczy się eksperymentalnie ∆G*lep i ∆H*lep.
Wyznaczenie entalpii swobodnej aktywacji lepkiego przepływu ∆G*lep badanej cieczy
Opracowanie wyników:
Wyznaczam gęstość izopropanolu w temperaturze pomiaru tp (w skali Celsjusza) korzystając z równania:
![]()
![]()
![]()
![]()
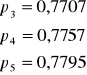
Obliczam lepkość alkoholu izoproplylowego η [P] w każdej temperaturze z równania:
![]()
![]()
Wykorzystując wartość stałej kapilary K[P cm-3 g-1s-1] oraz średni czas przepływu cieczy t

Obliczam objętość molową alkoholu izopropylowego Vm we wszystkich temperaturach na podstawie poniższej zależności, w której M jest masą molową izopopanolu:
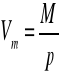
![]()
![]()

Obliczam swobodną entalpię aktywacji lepkiego przepływu ∆G*lep w badanych temperaturach ze wzoru Eyringa, przekształconego do postaci:
![]()
![]()
gdzie:R=8,314J/molK- stała gazowa
T-temperatura [K]
Η-lepkość izopropylu
Vm - objętość molowa
H - stała Plancka = 6,625 10-27
NA - liczba avogadro = 6,02 1023
![]()

Wyznaczam entalpie aktywacji lepkiego przepływu ∆H*lep cieczy badanej
|
|
|
Wyznaczam metodą graficzną współczynnik prostej Bgraf
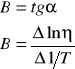
![]()
![]()
Obliczam entalpię aktywacji lepkiego przepływu ∆H*lep korzystając z zależności:
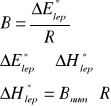
![]()
![]()
![]()
![]()
![]()
Wyznaczam entropie aktywacji lepkiego przepływu ∆S*lep cieczy badanej
Obliczam entropie aktywacji lepkiego przepływu ∆S*lep we wszystkich temperaturach wykorzystując zależność
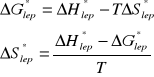

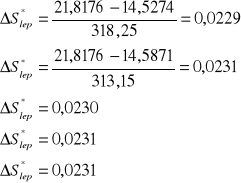
Tabela wyników obliczeń:
Tp [°C] |
Tp=T [K] |
T-1 [K-1] |
N [P] |
Ln n |
P [gcm-3] |
Vm [cm3mol-1] |
∆G*lep [KJ mol-1] |
∆S*lep [KJ mol-1] |
||
45,1 |
318,25 |
0,003142 |
0,01224 |
-4,4027 |
0,7613 |
78,9476 |
14,5274 |
0,0229 |
||
40 |
113,15 |
0,003193 |
0,01379 |
-4,2840 |
0,7662 |
78,4456 |
14,5871 |
0,0231 |
||
35,1 |
308,25 |
0,003244 |
0,01599 |
-4,1357 |
0,7707 |
77,9841 |
14,7238 |
0,0230 |
||
29,5 |
302,65 |
0,003304 |
0,01858 |
-3,9856 |
0,7757 |
77,4809 |
14,8177 |
0,0231 |
||
25,2 |
298,35 |
0,003352 |
0,02114 |
-3,8564 |
0,7795 |
77,1116 |
14,9157 |
0,0231 |
||
Bgraf |
Bnum |
∆H*lep |
||||||||
2606,51 |
2624,2 |
21,8176 |
||||||||
Wnioski:
Od temperatury zależy gęstość, objętość molowa, lepkość i swobodna entalpia lepkiego przepływu. Wraz ze wzrostem temperatury rośnie objętość molowa cieczy natomiast gęstość izopropylu, lepkość i wartość swobodnej entalpii lepkiego przepływu maleją.
Niezależna od temperatury jest entalpia . Jest ona równa w przybliżeniu molowej energii aktywacji lepkiego przepływu i nie ulega zmianie podczas zmian temperatury.
Wyszukiwarka
Podobne podstrony:
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
Sprawozdanie ćwiczenia nr 14damiana, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
iza 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
więcej podobnych podstron