Grupa |
Zespół |
Cwiczenie |
Data |
Ocena |
22 |
3 |
5 |
2008-04-07 |
|
Imię i nazwisko |
Temat cwiczenia |
|||
Katarzyna Góral Joanna Grzywacz Karolina Paśko Kinga Poźniak |
KRIOSKOPIA |
|||
1. Wstęp teoretyczny
Po rozpuszczeniu w cieczy substancji trudno lotnej, prężność pary nasyconej nad daną cieczą obniża się. Z tego względu prężność pary nasyconej nad roztworem substancji nielotnej jest zawsze niższa nad czystym rozpuszczalnikiem, przy czym tym niższa, im roztwór jest bardziej stężony. Oznaczając prężność pary nasyconej nad czystym rozpuszczalnikiem przez p0, a prężność pary nasyconej nad roztworem przez p, obniżenie prężności pary nad roztworem można określić z zależności:
![]()
Raoult wykazał, że tzw. względne obniżenie prężności pary nasyconej nad roztworem czyli ![]()
równe jest ułamkowi molowemu substancji rozpuszczonej, czyli:
![]()
m - liczba moli substancji rozpuszczonej,
N0 - liczba moli rozpuszczalnika
Przekształcając równanie i odejmując jedność z obu stron równania otrzymuje się:
![]()
Oznaczając ułamek molowy rozpuszczalnika ![]()
przez X0 otrzymamy ostatecznie:
![]()
Powyższe równanie stanowi treść prawa Raoulta: prężność pary nasyconej nad roztworem równa się prężności pary nasyconej nad czystym rozpuszczalnikiem, pomnożonej przez ułamek molowy rozpuszczalnika.
Ponieważ ciecz wrze w temperaturze, w której prężność pary nasyconej nad cieczą równa się prężności pary nasyconej nad jej fazą stałą obserwujemy zmiany temperatury wrzenia i krzepnięcia. Z tego wynikają następujące zależności: podwyższenie temperatury wrzenia jest proporcjonalne są stężenia molalnego substancji rozpuszczonej
![]()
gdzie: Δtwrz - podwyższenie temperatury wrzenia, cm - stężenie molalne, E - stała ebulioskopowa
Stężenie molalne wyraża się wzorem: ![]()
gdzie: m - masa substancji rozpuszczonej, M - masa molowa substancji rozpuszczonej, mo - masa rozpuszczalnika
Podstawiając ostatecznie równanie do poprzedniego wzoru otrzymamy:
![]()
Z równania wynika, że gdy m = M, a mo = 1000, Δtw = E.
Współczynnik proporcjonalności E wyrażony w stopniach nazywa się stałą ebulioskopową. Stała ebulioskopowa E stanowi przyrost temperatury wrzenia w stosunku do temperatury wrzenia rozpuszczalnika, gdy stężenie roztworu jest jednomolalne, czyli innymi słowy stała E jest molalnym podwyższeniem temperatury wrzenia roztworu.
Obniżenie temperatury krzepnięcia roztworu jest proporcjonalne do stężenia molalnego substancji rozpuszczonej
![]()
gdzie: Δtkrz - obniżenie temperatury krzepnięcia, cm - stężenie molalne, K - stała krioskopowa
W podobny sposób jak przy temperaturze wrzenia, możemy wyprowadzić równanie
![]()
w którym współczynnik K oznacza tzw. stałą krioskopową.
Stała krioskopowa K wyrażona w stopniach stanowi obniżenie temperatury krzepnięcia roztworu w stosunku do temperatury krzepnięcia czystego rozpuszczalnika, zawierającego jeden mol substancji rozpuszczonej w 1000 g rozpuszczalnika czyli jest molalnym obniżeniem temperatury krzepnięcia.
Wartośc stałej K można także wyliczy z równania:
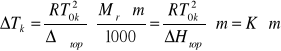
![]()
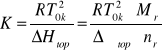
gdzie: ΔHtop jest entalpią topnienia 1 kg rozpuszczalnika, natomiast ![]()
jest jego entalpią molową
Zależność opisująca stałą kriometryczną K stanowi podstawę kriometrycznej metody wyznaczania masy molowej składnika roztworu idealnego. W metodzie tej wyznacza się wartość ΔTk dla roztworu o znanej molalności (roztworu wzorcowego), a następnie znając wartość stałej K rozpuszczalnika wyznacza się maloalnośc badanego roztworu, a z niej poszukiwaną masę molową badanej substancji.
Istotnym warunkiem poprawności oznaczenia masy molowej metodą kriometryczną jest, aby roztwór, jaki tworzy badana substancja, był roztworem idealnym. W przypadku roztworów rzeczywistych wzór kriometryczny przybiera postać ![]()
gdzie g jest współczynnikiem osmotycznym Bjerruma. Wzór w tej postaci nie nadaje się do wyznaczania masy molowej substancji rozpuszczonej, co więcej ani substancja rozpuszczona, ani rozpuszczalnik nie mogą ulega w roztworze dysocjacji.
Pomiary ebulioskopowe i krioskopowe prowadzi się w celu wyznaczenia mas cząsteczkowych M substancji rozpuszczonych w rozpuszczalnikach o znanych wartościach stałych E albo K.
2. Cel ćwiczenia
Celem ćwiczenia było zaobserwowanie zjawiska obniżenia temperatury krzepnięcia w stosunku do temperatury czystego rozpuszczalnika, a także zależność tej różnicy temperatur od stężenia molarnego temperatur.
3. Parametry pomiarowe
Temperatura: T=20°C
Ciśnienie: p=753 [mmHg]
roztwory: KCl
stężenie roztworu I: cm = 0,2270 [mol/kg]
II: cm = 0,1631 [mol/kg]
III: cm = 0,0907 [mol/kg]
4. Sposób wykonania
Do oznaczenia obniżenia temperatury krzepnięcia roztworu KCl o różnych stężeniach molarnych służy krioskop połączony z głowicą pomiarową i rejestratorem.
Ustawiamy prawidłowo aparat, na głowicę pomiarową nakładamy naczyńko pomiarowe zawierające 0,15 cm3 czystego KCl. Głowicę umieszczamy w lewym otworze krioskopu, ustawiamy stopień tłumienia na 64, obserwujemy wychylenie zaznaczone przez pisak na rejestratorze. Gdy próbka odpowiednio się przechłodzi włączamy wibrator (zamrażamy roztwór). Stopniowo zmieniamy stopień tłumienia na 2. Wyciągamy i rozmrażamy próbkę.
Czynności te powtarzamy kilkukrotnie dla każdego przygotowanego roztworu.
Iloczyn wychylenia pisaka i stopnia tłumienia to zmiana temperatury krzepnięcia.
5.Wyniki pomiarów
Nr |
molarność roztworu z naważek [mol/kg] |
stopień tłumienia |
wychylenie pisaka |
iloczyn wychylenie pisaka × stopień tłumienia (T) |
molarność wyliczona z krioskopii |
współczynnik izotoniczny |
1. wzorzec |
0,400 |
8 |
135 |
1080 |
- |
- |
2. |
0,2270 |
8 |
170 |
1360 |
0,5037 |
2,2189 |
3. |
0,1631 |
8 |
147 |
1176 |
0,4356 |
2,6708 |
4. |
0,0907 |
8 |
118,5 |
948 |
0,3511 |
3,8710 |
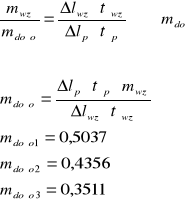
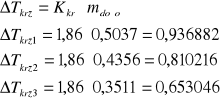
6. Wnioski
Wraz ze wzrostem stężenia wzrasta temperatura krzepnięcia. Im niższe stężenie próbki roztworu, tym mniejsze wychylenie pisaka na wykresie.
4
![]()
Wyszukiwarka
Podobne podstrony:
sprawozdanie nr 2 (2), II rok, chemia fizyczna
sprawozdanie nr 1, II rok, chemia fizyczna
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Nernst, II rok, chemia fizyczna
Ćw7.2 treść raportu, z góry, II rok, CHEMIA FIZYCZNA, CHEMIA FIZYCZNA
spr z jodu(2), II rok, chemia fizyczna
Wymagania egz.Chemia Fizyczna, biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, CHEMIA FIZYCZ
Kolo z seminarek, Płyta farmacja Poznań, II rok, chemia fizyczna
tr+gibbsa, II rok, chemia fizyczna
sprawozdanie z ćw.7, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczn
SPRAWOZDANIE Z ĆWICZENIA 4, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
napięcie nasze, II rok, chemia fizyczna
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Nernst, II rok, chemia fizyczna
SprawozdanieNr2Kevcio, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
sprawozdaniewapno2, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
sprawozdanieNR1Daras, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
więcej podobnych podstron