Wykład 16
Kinetyczna teoria gazów i termodynamika I
Prawo gazów doskonałych
Gaz doskonały:
objętość cząsteczek gazu jest o wiele mniejsza niż objętość zajmowana przez gaz,
zasięg sił działających między dwoma cząstkami jest o wiele mniejszy niż średnia odległość międzycząsteczkowa.
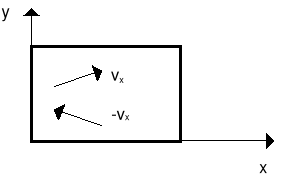
W wyprowadzeniu prawa gazów doskonałych będziemy traktować cząsteczki gazu jako N małych, twardych kulek zamkniętych w pudełku o objętości V. Kulki są twarde tzn. będą zderzały się sprężyście ze ściankami naczynia. Rozważmy jedną cząsteczkę, która zderza się z lewą ścianką naczynia (rysunek). Średnia siła jaką cząsteczka wywiera na ściankę w czasie Δt wynosi
![]()
Zmiana pędu spowodowana zderzeniem ze ścianką wynosi
Δpx = mvx - ( - mvx) = 2mvx
Ponieważ czas pomiędzy kolejnymi zderzeniami z tą ścianką wynosi
Δt = 2l/vx
gdzie l jest odległością między ściankami, to
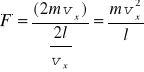
jest średnią siłą działającą na ściankę (na jedną cząstkę).
Dla N cząstek całkowita siła wynosi
![]()
gdzie ![]()
jest to ![]()
uśrednione po wszystkich cząsteczkach (średnia kwadratu). Dzieląc obie strony równania przez pole powierzchni ścianki S otrzymujemy ciśnienie
![]()
czyli
![]()
(16.1)
Jak widać iloczyn pV jest stały tak długo jak długo jest stała energia kinetyczna cząstek (prawo Boyle'a - Mariotta).
Zauważmy, że
![]()
Ponadto, ponieważ cząstki zderzają się w taki sam sposób ze wszystkimi sześcioma ściankami naczynia więc
![]()
więc
![]()
Teraz otrzymujemy równanie wyrażone przez v a nie przez vx
![]()
(16.2)
Ponieważ Nm = M (masa gazu), oraz M/V = ρ więc równanie powyższe można przepisać w postaci
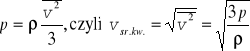
(16.3)
Temperatura
Zdefiniujmy temperaturę bezwzględną jako wielkość wprost proporcjonalną do średniej energii kinetycznej cząstek
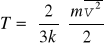
(16.4)
gdzie k jest stałą Boltzmana k = 1.38·10-23 J/K.
Eliminując ![]()
z równań (16.2) i (16.4) otrzymujemy
pV = NkT
lub
pV = nRT (16.5)
gdzie n jest liczbą moli (R = kNAV). Przypomnijmy, że stała Avogadra NAv = 6.023·1023 1/mol, określa liczbę cząsteczek w jednym molu.
Wyrażenie (16.5) przedstawia równanie stanu gazu doskonałego.
Równanie stanu gazu doskonałego zostało sformułowane w XIX w. przez Clapeyrona na podstawie trzech praw empirycznych odkrytych wcześniej przez innych badaczy:
Prawo Boyle'a-Mariotte'a stwierdza, że w stałej temperaturze iloczyn ciśnienia i objętości danej masy gazu jest stały pV = const.
Prawo Charlesa mówi, że przy stałej objętości gazu stosunek ciśnienia i temperatury danej masy gazu jest stały p/T = const.
Prawo Gay-Lussaca stwierdza, że dla stałego ciśnienia stosunek objętości do temperatury danej masy gazu jest stały V/T = const.
Termometry
Ekwipartycja energii
Zerowa zasada termodynamiki
Ekwipartycja energii
Pierwsza zasada termodynamiki
Ciepło właściwe
Ciepło właściwe przy stałej objętości
Ciepło właściwe przy stałym ciśnieniu
Rozprężanie izotermiczne
rozprężanie izotermiczne
rozprężanie adiabatyczne
Rozprężanie adiabatyczne
Aby zmierzyć temperaturę trzeba wyznaczyć energię kinetyczną cząsteczek gazu co jest bardzo trudne. Ale możemy się posłużyć równaniem stanu gazu doskonałego. Łatwo jest zmierzyć iloczyn pV np. dla układu o stałym ciśnieniu.
Jeżeli dwa ciała o różnych temperaturach zetkniemy ze sobą (i odizolujemy od innych) to po dostatecznie długim czasie ich temperatury wyrównają się. Powiemy, że te ciała są w równowadze termicznej ze sobą.
Jeżeli ciała 1 i 2 są w równowadze termicznej i ciała 2 i 3 są w równowadze termicznej to ciała 1 i 3 są w tej samej równowadze termicznej.
To jest zerowa zasada termodynamiki. Z zasad dynamiki Newtona można pokazać, że średnie energie kinetyczne ruchu postępowego (na cząsteczkę) dla dwu kontaktujących się gazów są równe.
Wiemy już, że w równowadze termodynamicznej energie kinetyczne ruchu postępowego wszystkich cząsteczek są równe. Ale co z ruchem obrotowym i drganiami? Czy cząsteczka może gromadzić energię w innej postaci niż energia ruchu postępowego?
Jeżeli tylko cząstka nie ma kształtu kuli (1 atomowa) a ma pewną strukturę wewnętrzną to może wirować i drgać. Np. dwuatomowa w kształcie hantli zacznie się obracać po zderzeniu. Na podstawie mechaniki statystycznej można pokazać, że gdy liczba punktów materialnych jest bardzo duża i obowiązuje mechanika Newtonowska to dostępna energia rozkłada się w równych porcjach na wszystkie niezależne sposoby, w jakie cząsteczka może ją absorbować. Każdy z tych sposobów absorpcji energii nazywa się stopniem swobody i jest równy liczbie niezależnych współrzędnych potrzebnych do określenie położenia ciała w przestrzeni.
Innymi słowy: średnia energia kinetyczna na każdy stopień swobody jest taka sama dla wszystkich cząsteczek. Ten wynik nazywamy zasadą ekwipartycji energii.
Średnia energia kinetyczna ruchu postępowego (z równania definiującego T) wynosi
![]()
Odpowiada to trzem stopniom swobody (współrzędne x, y, z). Stąd średnia energia na stopień swobody wynosi (1/2)kT na cząsteczkę (zależy tylko od T).
Dla cząstek obracających się potrzeba 3 dodatkowych współrzędnych do opisania ruchu (obrót względem trzech osi) więc mamy dodatkowe 3 stopnie swobody.
O ile dla N cząsteczek nie obracających się całkowita energia (wewnętrzna) U będzie energią kinetyczną ruchu postępowego U = 3/2(NkT) to dla cząstek, które mogą obracać się swobodnie we wszystkich kierunkach (wieloatomowe)
U = (3/2)(NkT) + (3/2)(NkT) = 3NkT
Natomiast dla cząstki dwuatomowej (gładkiej)
U = 3/2(NkT) + (2/2)(NkT) = (5/2)(NkT)
bo nie ma obrotu wokół osi hantli.
Zwróćmy uwagę, że mówimy tu o energii "ukrytej" (wewnętrznej) cząstek a nie o energii makroskopowej (związanej z ruchem masy). O tej energii mówiliśmy przy zasadzie zachowania energii (energia indywidualnych cząstek nie zawarta w energii kinetycznej czy potencjalnej ciała jako całości). Energię wewnętrzną oznacza się zazwyczaj przez U i takie oznaczenie będziemy dalej stosować.
To jest po prostu inna wersja zasady zachowania energii, w której mamy rozdzieloną energię ciała na część makroskopową i mikroskopową. Makroskopowa to energia ruchu masy (energia mechaniczna). Mikroskopowa to "ukryta" energia cząstek (energia wewnętrzna).
Gdy dwa układy (ciała) o różnych temperaturach zetkniemy ze sobą to ciepło ΔQ przepływa z ciała cieplejszego do chłodniejszego. Zgodnie z zasadą zachowania energii, ciepło pobrane przez układ musi być równe wzrostowi energii wewnętrznej układu plus pracy wykonanej przez układ nad otoczeniem zewnętrznym czyli
ΔQ = ΔU + ΔW (16.6a)
To jest sformułowanie I zasady termodynamiki.
Zasada ta pracuje "w obie strony" tzn., gdy nad układem zostanie wykonana praca to układ może oddawać ciepło. To równanie bardzo często przybiera postać
dU = dQ - dW (16.6b)
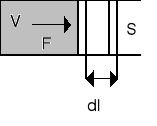
Jeżeli rozpatrujemy układ jak na rysunku obok to
dW = Fdl = (F/S)(Sdl) = pdV (16.7)
i wtedy
dU = dQ - pdV
Ciepło właściwe definiujemy jako dQ/dT na gram lub mol substancji (ciepło wagowe lub molowe).
Ponieważ dV = 0 więc dU = dQ a stąd
cv = dQ/dT = dU/dT
Dla gazu jednoatomowego (dla jednego mola) U = (3/2)NAVkT = (3/2)RT.
Zatem
cv = (3/2)R
Dla cząsteczki dwuatomowej spodziewamy się więc
cv = (5/2)R
a dla wieloatomowej
cv = 3R
Niedoskonałością modelu opartego na mechanice klasycznej jest to, że przewiduje ciepło właściwe niezależne od temperatury, a badania pokazują, że jest to prawdziwe tylko dla gazów jednoatomowych. Dla pozostałych cv rośnie z temperaturą.
Na rysunku poniżej przedstawiono cV dla wodoru (H2) w funkcji temperatury (w skali logarytmicznej).
W temperaturach niższych od 100 K, cv = (3/2)R co wskazuje, że w tak niskich temperaturach nie ma rotacyjnych stopni swobody. Rotacja staje się możliwa dopiero w temperaturach wyższych (cv = (5/2)R). Ale w temperaturach powyżej 2000 K, cv osiąga wartość (7/2)R.
Wytłumaczenie tych zjawisk nie jest możliwe na gruncie mechaniki klasycznej. Dopiero mechanika kwantowa daje wyjaśnienie tych zmian. Gdyby cząstka miała moment pędu to musiał by on być równy co najmniej Lmin = h/2π ≈ 10-34 kg m2 s-1 (analogia do modelu Bohra atomu wodoru). Energia kinetyczna ruchu obrotowego dana jest wyrażeniem
![]()
Dla cząsteczki H2 m=1.67·10-27 kg a R ≈ 5·10-11 m, więc I = 2mR2 ≈ 8.3·10-48 kg m2.
Ponieważ na jeden stopień swobody przypada energia kT/2 więc
kT/2 = L2/2I
czyli
T = L2/kI
Stąd dla Lmin otrzymujemy Tmin ≈ 90 K.
Dla niższych temperatur energia jest za mała aby wzbudzić rotacje co wymaga pewnej minimalnej energii. Podobnie jest dla ruchu drgającego, który także jest skwantowany.
Edrg,min = hv. Dla typowej cząsteczkowej częstotliwości drgań 1014 Hz (zakres widzialny) otrzymujemy energię drgań ≈ 6·10-20 J co odpowiada temperaturze około 4000 K. Tak więc z zasady ekwipartycji energii wynika, że w tak wysokich temperaturach średnia energia drgań Edrg = kT/2. Oprócz energii kinetycznej tego ruchu istnieje jeszcze jego energia potencjalna. Zatem średnia energia wewnętrzna na cząsteczkę wynosi
U = Eśr,kin,post + Eśr,kin,rot + Eśr,kin,drg + Eśr,pot,drg
U = (3/2)kT + (2/2)kT + (1/2)kT + (1/2)kT = (7/2)kT
Dla 1 mola
U = (7/2)RT więc cv = (7/2)R
Z I zasady termodynamiki mamy
dQ = dU + pdV
Ponieważ U zależy tylko od T więc mamy dU = cvdT więc
dQ = cvdT + pdV
Dla gazu doskonałego (1 mola) dV = RdT/p, więc
dQ = cvdT + RdT
skąd
dQ/dT = cv + R
Ostatecznie więc
cp = cv + R
Molowe ciepła właściwe różnych rodzajów gazów doskonałych (teoretyczne) są zestawione w tabeli poniżej.
Typ gazu |
cv |
cp |
cp/cv |
Jednoatomowy Dwuatomowy + rotacja Dwuatomowy + rotacja + drgania Wieloatomowy + rotacja (bez drgań) |
(3/2)R (5/2)R (7/2)R (6/2)R |
(5/2)R (7/2)R (9/2)R (8/2)R |
5/3 7/5 9/7 4/3 |
Działanie silnika opiera się o rozprężanie zapalonej mieszanki gazowej.
Zwykle dwa przypadki
Przy rozprężaniu izotermicznym trzeba utrzymywać stałą temperaturę ścian cylindra, czyli tłok musi poruszać się wolno, żeby gaz mógł pozostawać w równowadze termicznej ze ściankami cylindra.
Ponieważ T = const. więc dU = 0, a stąd dQ = dW
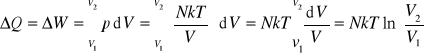
(16.8)
Zwykle w silnikach tłok porusza się bardzo szybko więc nie ma dość czasu na przepływ ciepła pomiędzy gazem a ścianami cylindra. Wtedy dQ = 0 i otrzymujemy
dU + pdV = 0
Możemy to przepisać w postaci
cvdT + pdV = 0
na 1 mol.
Z równania stanu gazu doskonałego otrzymujemy różniczkując
pdV + Vdp = RdT
Stąd obliczmy dT i wstawiamy do poprzedniego równania
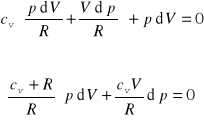
Zastępujemy teraz cv + R = cp i otrzymujemy
![]()
gdzie γ = cp/cv.
Całkując to równanie otrzymamy
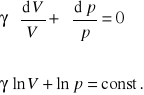
gdzie const. oznacza stałą całkowania.
Mamy więc
ln(pVγ) = const.
czyli
pVγ = const. (16.9)
co można zapisać:
p1V1γ = p2V2γ
Przykład 1
Silnik benzynowy ma stopień sprężu 9 tzn. V2/V1 = 9. Jaki jest stosunek temperatury gazów wydechowych do temperatury spalania?
p1V1γ = p2V2γ więc p2/p1 = (V1γ/V2γ)
Dla gazu doskonałego
p2/p1 = (V1T2)/(V2T1)
Porównują te równania otrzymujemy
T2/T1 = (V1/V2)γ-1
Powietrze jest głównie dwuatomowe więc γ = 1.4. Stąd otrzymujemy T2/T1 = 0.415
Z. Kąkol-Notatki do Wykładu z Fizyki
16-12
16-8
Wyszukiwarka
Podobne podstrony:
Wyklad19, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
Wyklad09, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
Wyklad22, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
Wyklad11, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
Fizyka 2, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
siuda25, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki, F
41a, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki, Fizyk
spis sciaga, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika labork
Strona, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki, Fi
KAMILP~1, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
fiza egz2 v2, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika labor
WYTLAC~1, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, Fiza-Elektronika laborki,
więcej podobnych podstron