ZAGADNIENIA (CHEMIA)
Budowa atomu, pierwiastki (Z, A), konfiguracja elektronowa, orbitale, związki
opisz budowę atomu
Atom składa się z jądra atomowego i krążących wokół elektronów. W jądrze tym są protony i neutrony. Ładunek generuje pole, tym większe im większy jest ładunek. Prawie cała masa skupiona w jądrze. Atomy tego samego pierwiastka mają takie samo własności, nie ulegną przekształceniu na drodze zwykłej reakcji, atomy tego samego pierwiastka mogą się połączyć w cząsteczki.
Proton-(+) ładunek elektryczny znajduje się na całej powierzchni, wewnątrz są kwarki różniące się między sobą, tworzą grupy cząstek różniących się właściwościami. Liczba protonów= liczbie elektronów.
Neutron- nie posiada ładunku
Elektron- (-) porusza się wokół nukleonu (proton+neutron), można je postrzegać jako chmurę, bardzo szybko się porusza, mają te same ładunku więc się odpychają. Elektrony krążące w tej samej odległości od jądra tworzą powłoki elektronowe. Jest ich narazie 7, tyle wystarczy do opisania danego pierwiastka.
2-opisz pojęcie liczby atomowej i liczby masowej
liczba masowa (ta po lewej stronie na górze przy pierwiastku) to sumaryczna ilość protonów i neutronów.
Z- liczba atomoa ( na dole), jest to liczba protonów znajdujących się w jądrze pierwiastka
3- opisz pojęcie konfiguracji elektronowej
KONFIGURACJA ELEKTRONOWA - sposób rozmieszczenia elektronów na powłokach. Powłoki oznaczamy w kolejności od jądra symbolami literowymi: K,L,M,N,O,P,Q
Ilość elektronów na powłoce: 2,8,18,32,50,72,98
Maksymalna liczba elektronów na powłoce wynosi 2n2.
Podpowłoki są zajmowane w tej samej kolejności, według której wzrasta ich energia.
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d
4- scharakteryzuj pojęcie elektronów walencyjnych, podaj przykład
Elektrony walencyjne to elektrony krążące na ostatniej powłoce elektronowej atomu. Powłokę elektronową atomu natomiast tworzą elektrony krążące od jądra atomu w tej samej odległości, ponadto powłok atomu może być maksymalnie 7. Elektrony walencyjne określają wartościowość danego pierwiastka. Wartościowość zaś, to liczba wiązań chemicznych w cząsteczce. Pierwiastki o tej samej wartościowości mają podobne właściwości chemiczne.
przykład elektronu walencyjnego: liczba atomowa chloru wynosi 17, jego konfiguracja elektronowa to 3s23p5. Na ostatniej powłoce (trzeciej) znajduje się więc 7 (2+5) elektronów walencyjnych
5- co oznacza zapis: 3d3, opisz i przedstaw schemat klatkowy
6- opisz pojęcie orbitalu
7- opisz regułę Hunda, podaj przykład
Reguła Hunda to inaczej reguła maksymalnego spinu. Według tej reguły przy zapełnianiu orbitali danego podpoziomu energetycznego istnieje dążność do osiągnięcia maksymalnej liczby elektronów niesparowanych, tzn. elektronów swobodnych, nie połączonych w parę w obrębie orbitalu. Oznacza to, że na danym podpoziomie dobudowują się najpierw elektrony o jednakowym spinie, zajmując miejsca w kolejnych orbitalach. Dopiero po obsadzeniu po jednym elektronie wszystkich orbitali danego podpoziomu energetycznego następuje dalsze zapełnienie tych samych orbitali elektronami o spinach przeciwnych.
Orbital - funkcja stosowana do opisu stanu jednego lub dwóch elektronów. Każdy orbital jest wyrażony symbolicznie kwadratem, w którym jest miejsce na dwa elektrony: jeden ze zwrotem dodatnim i drugi ze zwrotem ujemnym.
Spin - parametr charakteryzujący cząstki elementarne, określany często mianem własnego momentu pędu.
Przykład:
8- opisz zakaz Pauliego, podaj przykład
Dwa elektrony mogą zajmować ten sam orbital tylko wówczas, gdy ich spiny są przeciwne tj. zorientowane w przeciwnych kierunkach.”
Oznacza to, że nie mogą istnieć dwa elektrony mające identyczne wartości czterech liczb kwantowych (n, l, m, ms ). Pauli pierwszy zauważył, że obecność jednego elektronu na orbitalu wyklucza możliwość znalezienia się na nim innego elektronu o tej samej orientacji spinu. Z zakazu Pauliego wynika, że żaden orbital na diagramie poziomów energetycznych nie może być obsadzony przez więcej niż dwa elektorny. Na podstawie zakazu Pauliego łatwo można wyliczyć maksymalną liczbę elektronów jaka może pomieścić się na poszczególnych powłokach i podpowłokach atomu.
Przykład:
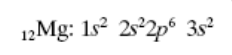
9- opisz pojęcie orbitalu zdegenerowanego, podaj przykład
Orbitale zdegenerowane - orbitale o jednakowej energii, posiadające taką samą charakterystyke energetyczną, prawdopodobieństwo osadzenia sie na każdym z nich elektronu jest dokladnie takie samo.
Np. prawdopodobieństwo zajęcia orbitalu px, py lub pz jest takie samo. Każda „ósemka” ma tę samą charakterystykę energetyczną, prawdopodobieństwo obsadzenia każdej z nich przez elektron jest dokładnie takie samo.
10- scharakteryzuj orbital typu „p”
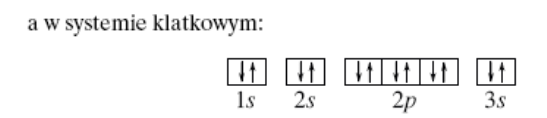
11- przedstaw konfigurację elektronową pierwiastka: 12Mg (plus wzór klatkowy).
2- przeanalizuj konfigurację elektronową atomu: 1s22s22p63s1
3- opisz pojęcie: elektrony walencyjne, podaj przykład
ELEKTORNY WALENCYJNE - elektorny krażące po ostatniej powłoce, określają wartościowość pierwiastka. Elektrony walencyjne mają słaba energię, ponieważ wszystkie inne osłaniają od siły jądra atomowego.
5 elektronów walencyjnych
Układ okresowy, struktura, grupy pierwiastków, izotopy, mieszaniny
4- opisz pojęcie: układ okresowy pierwiastków, 5- czym charakteryzuje się podział układu okresowego pierwiastków na grupy i okresy?
pierwiastki uporządkowane wg ich rosnącej liczby atomowej. Grupy wpisuje się w kolumnach ( 18) a okresy w rzędach (7).Grupy dzieli się na grupy główne i grupy poboczne. Atomy pierwiastków należących do określonej grupy mają jednakową liczbę elektronów walencyjnych. Każda grupa obejmuje pierwiastki o podobnych właściwości chemicznych i częściowo fizycznych. Atomy pierwiastków należących do określonego okresu mają jednakową liczbę powłok elektronowych, zgodną z numerem okresu. Współczesny układ okresowy wyróżnia cztery bloki pierwiastków, w których elektrony walencyjne w atomach opisywane są analogicznymi typami orbitali.
Wg wikipedi- zestawienie wszystkich pierwiastków chemicznych w postaci rozbudowanej tabeli, uporządkowanych według ich rosnącej liczby atomowej, grupujące pierwiastki według ich cyklicznie powtarzających się podobieństw właściwości, zgodnie z prawem okresowości Dmitrija Mendelejewa.
Prawo okresowości: własności pierwiastków uporządkowanych według wzrastającej liczby atomowej zmieniają okresowo.
6- scharakteryzuj pojęcie izotopów pierwiastka
odmiany tego samego pierwiastka posiadającego tę samą liczbę protonów i elektronów, ilość neutronów może się różnić.
-inna masa
-inne właściwości.
Izotopy nietrwałe- czyli promieniotwórczy i ulega samorzutnej przemianie.Dzielą się na naturalne( występujące w przyrodzie od zawsze) i syntetyczne (stworzone przez człowieka np. do reaktorów atomowych, do wytwarzania nowych pierwiastków)
Wg wikipedii- Izotopy - odmiany pierwiastka chemicznego różniące się liczbą neutronów w jądrze atomu (z definicji atomy tego samego pierwiastka mają tę samą liczbę protonów w jądrze). Izotopy tego samego pierwiastka różnią się liczbą masową (łączną liczbą neutronów i protonów w jądrze), ale mają tę samą liczbę atomową (liczbę protonów w jądrze).
Izotopy tego samego pierwiastka na ogół mają zbliżone własności fizyczne i chemiczne. Jednak im większa jest różnica mas atomowych izotopów, tym większe mogą być różnice ich własności fizycznych lub chemicznych. Izotopy danego pierwiastka mogą mieć inną gęstość, temperaturę wrzenia, topnienia i sublimacji. Różnice te występują także w związkach chemicznych tworzonych przez te izotopy.
Różnice mas atomowych izotopów powodują występowanie niewielkich różnic w reaktywności izotopów. Nie ma ona wpływu na kierunek reakcji chemicznych, w których one uczestniczą, ale wpływa na szybkość przebiegu tych reakcji. Zjawisko to nazywa się efektem izotopowym i wykorzystuje się w badaniu mechanizmów reakcji chemicznych. Te niewielkie różnice w szybkości reakcji wywołują zmiany w składzie izotopowym związków chemicznych powstających w różnych reakcjach (zjawisko to wykorzystywane jest np. do rozróżniania, czy węgiel zawarty w danym związku chemicznym brał udział w reakcji fotosyntezy).
Izotopy, ze względu na stabilność, dzieli się na:
trwałe (nie ulegające samorzutnej przemianie na izotopy tego samego lub innych pierwiastków),
nietrwałe, zwane izotopami promieniotwórczymi (ulegające samorzutnej przemianie na inne izotopy, zazwyczaj innego pierwiastka).
7- co to jest i jak jest obliczana masa atomowa pierwiastka?
Masa atomowa (niepopr. ciężar atomowy) - masa atomu. Zwykle skrótowo określa się tak względną masę atomową.
Względna masa atomowa Przez względną masę atomową rozumie się liczbę określającą ile razy masa jednego reprezentatywnego atomu danego pierwiastka chemicznego jest większa od 1/12 masy atomu izotopu 12C, przy czym pod pojęciem reprezentatywnego atomu rozumie się atom o średniej masie wyliczonej proporcjonalnie ze wszystkich stabilnych izotopów danego pierwiastka, ze względu na ich rozpowszechnienie na Ziemi.
Masa atomowa jest wyrażana w atomowych jednostkach masy [u].
Liczbowo jest równa iloczynowi masy pojedynczego atomu danego pierwiastka i liczby Avogadra
Można ją zapisać również wzorem
gdzie:
MA - względna masa atomowa,
mA - bezwzględna masa atomowa,
1,66·10−24 g - 1/12 masy jednego atomu węgla izotopu 12C.
Bezwzględna masa atomowa
Bezwzględna masa atomowa jest masą atomu wyrażoną w jednostkach masy (np. kilogramach). Wygodniejsza w użyciu jest względna masa atomowa, dlatego to ona jest zazwyczaj podawana. Znając względną masę atomową, można obliczyć bezwzględną przez podzielenie przez liczbę Avogadra.
8- opisz izotopy wodoru
Izotopy wodoru-
Trwały: Prot- 1e, 1p, 0n
Trwały deuter: 1e, 1p, 1n
Trwały tryt: 1e, 1p, 2n
Wiki- izotopy pierwiastka chemicznego wodoru (symbol H), z których trzy występują na Ziemi naturalnie. Ze względu na duże względne różnice w masach atomowych najlżejszych izotopów, różnią się one wyraźnie właściwościami chemicznymi i fizycznymi. Z tej przyczyny wodór jest jedynym pierwiastkiem, którego izotopy (naturalne) mają swoje własne nazwy: prot (1H), deuter (2H) i tryt (3H). Dwa najlżejsze izotopy są stabilne, pozostałe są radioaktywne.
Wodór posiada swoje trzy izotopy: prot, deuter oraz tryt.
Prot (1H) - W skład jądra tego izotopu wchodzi jeden proton. Izotop ten nie posiada żadnego neutronu. Jest to stabilny izotop.
deuter (2H, D) - W skład jądra tego izotopu wchodzi jeden proton oraz jeden neutron. Jest to także stabilny izotop. Ze względu na to, że deuter ma dwukrotnie większą masę od protu, różnią się one znacząco właściwościami fizycznymi, a także chemicznymi (silny efekt izotopowy). Deuter może zastąpić normalny wodór w cząsteczkach wody, tworząc ciężką wodę (D2O), mającą charakterystyczną właściwość spowalniania neutronów, dzięki której jest stosowana przy wytwarzaniu energii jądrowej.
Tryt (3H, T) - W skład tego jądra wchodzi jeden proton oraz 2 neutrony. Jest izotopem niestabilnym. Jądro to ulega rozpadowi Beta z powstaniem Helu-3. W minimalnych ilościach występuje w atmosferze, jednak głównym źródłem jego pozyskiwania są reakcje jądrowe. Używany jest jako wskaźnik izotopowy np. do określania wieku przedmiotów czy badań mechanizmów reakcji chemicznych i procesów biologicznych.
9- scharakteryzuj pojęcie: izotopy promieniotwórcze.
Izotopy promieniotwórcze- Nietrwałe izotopy ulegające samorzutnym przemianom jąder. Izotopy dzielimy na: izotopy naturalne i izotopy sztuczne. Większość izotopów naturalnych jest izotopami trwałymi (są to izotopy naturalne lub sztuczne, których jądra nie ulegają samorzutnej przemianie promieniotwórczej), a tylko niektóre ulegają przemianom promieniotwórczym. Na przykład chlor ma 9 izotopów, z których tylko 2 (35Cl i 37Cl) są trwałe, natomiast pozostałe ulegają promieniotwórczemu rozpadowi.
Większość izotopów sztucznych uzyskiwanych w reakcjach jądrowych jest izotopami promieniotwórczymi.
Zastosowanie izotopów promieniotwórczych : naświetlanie Komorek rakowych.
Szacowanie wieku za pomocą izotopu węgla: substancji organicznych i org. Martwych.
Okres połowicznego rozpadu- czas, po którym połowa jąder ulega (rozpadowi) samorzutne przemianie.
Izotopy promieniotwórcze - atomy, których jądra są niestabilne i samorzutnie ulegają przemianie promieniotwórczej, dając w wyniku tego inne atomy (cząstki elementarne) oraz wydzielając energię w postaci promieniowania gamma i energii kinetycznej produktów przemiany.
10- co to jest czas połowicznego rozpadu? Jakiej grupy związków dotyczy?
Czas połowicznego rozpadu (zaniku) (okres połowicznego rozpadu) - czas, w ciągu którego liczba nietrwałych obiektów lub stanów zmniejsza się o połowę. Czas ten, oznaczany symbolem T1/2, zgodnie z definicją musi spełniać zależność:
gdzie
N(t) - liczba obiektów pozostałych po czasie t,
N0 - początkowa liczba obiektów.
Pierwotnie czas ten dotyczył nietrwałych jąder atomowych pierwiastków (promieniotwórczych). W tym przypadku po czasie połowicznego rozpadu aktywność promieniotwórcza próbki zmniejsza się również o połowę. Okres połowicznego rozpadu dotyczy również nietrwałych cząstek. Może być wyznaczony z wykładniczego charakteru rozpadu, który w przypadku izotopów promieniotwórczych nosi nazwę prawa rozpadu naturalnego.
co to są radionuklidy, dokonaj podziału i opisz zastosowanie.
Naturalne radionuklidy syntezowane są w gwiazdach, szczególnie podczas wybuchów supernowych. Niektóre z nich (np. uran) posiadają wystarczająco długi okres półtrwania, aby nie ulegały one samorzutnemu rozpadowi w ciągu miliardów lat. Niektóre izotopy (np. 14C) są tworzone podczas zderzeń wysokoenergetycznych cząstek pochodzących z kosmosu z budulcami atmosfery ziemskiej.
Sztuczne radionuklidy są wytwarzane przez człowieka głównie w reaktorach jądrowych oraz akceleratorach.
Izotopy promieniotwórcze stosowane są w wielu dziedzinach badań technicznych (np.: w badaniach przepływów - śledząc z zewnątrz układu przemieszczanie się w nim płynu zawierającego domieszkę izotopu promieniotwórczego lub w badaniach zużycia materiałów - implantując izotop w elementy konstrukcyjne np. silnika i badając zmiany aktywności tego izotopu w oleju silnikowym w czasie pracy), znajdują zastosowanie w przemyśle (izotopowe czujniki poziomu, wagi izotopowe, izotopowe czujniki przeciwpożarowe), medycynie (radiofarmaceutyki, zasilacze izotopowe), biologii (śledzenie obiegu i roli mikroelementów), geologii (radiometryczne metody geologiczne) oraz w badaniach podstawowych (metoda atomów znaczonych, badania dyfuzji, badania strukturalne itd.). Izotopy promieniotwórcze stosuje się również do modyfikacji cech przedmiotów naświetlanych: wywoływania mutacji, sterylizacji, wywoływania zmian w strukturze polimerów, zabijania tkanek nowotworowych.
11- omów pojęcia: mieszanina i związek chemiczny, dokonaj porównania
Stężenie
3- co to jest mieszanina, dokonaj podziału i charakteryzacji
MIESZANINA - połączenie dwóch lub więcej pierwiastków albo związków chemicznych, które po zmieszaniu nadal wykazują swoje właściwości. Mieszaninę można zazwyczaj stosunkowo łatwo rozdzielić różnymi metodami mechanicznymi lub fizycznymi, takimi jak: filtracja (rozdzielenie poszczególnych składników filtrem, np.bibuła, tkanina), ekstrakcja (metoda, która powoduje usunięcie jakichś składników, pozbycie się selektywnie składnika przy pomocy innego składnika.), sedymentacja(opadanie osadu spowodowane siłą grawitacji), dekantacja (zlanie cieczy znad osadu).
Mieszaniny:
Jednorodne -( homogeniczne), składników nie można wyodrębnić nawet z pomocą mikroskopu. Składniki są równomiernie wymieszane., np. sól i woda, stopy metali, alkohol i woda
Niejednorodne - (heterogeniczne) to takie, których składniki sa nieodróżnialne wzrokiem lub z użyciem mikroskopu., np. piasek i woda, sól i siarka, siarka i żelazo
Mieszaniny mogą występować w trzech stanach skupienia. Mieszaniną gazową jest powietrze, mieszaninami ciekłymi roztwory, mieszaninami stałymi są stopy
4- co to są koloidy, opisz i podaj przykłady
Koloid to rodzaj roztworu, czyli, ogólnie mówiąc, składa się z rozpuszczalnika i substancji rozpuszczanej. W koloidzie zatem można wyodrębnić 2 fazy: ciągłą (stanowi ją substancja rozpraszająca) i rozproszoną, która nie jest rozpuszczona w fazie ciągłej, lecz w niej zawieszona. Składa się z mikroskopijnych cząstek, które rozłożone są na całej objętości ośrodka rozpraszającego. Charakterystyczną właściwością koloidów jest ich zdolność do intensywnego rozpraszania światła, co zwane jest efektem Tyndalla. Polega na przepuszczeniu przez koloid wiązki światła, którego promienie ugną się na cząstkach fazy rozproszonej. Podczas takiego zjawiska w odpowiednich warunkach można dostrzec stożek Tyndalla, który jest smugą światła w roztworze koloidalnym.
przykłady koloidów: mgła, chmury, dym, kurz, piana, mleko, białko, pumeks.
5- podziel i opisz stężenia roztworów
Wiązania (oddziaływania) chemiczne, hybrydyzacja
6- co to jest reguła oktetu, podaj przykłady
7- scharakteryzuj wiązanie jonowe, podaj przykład
8- scharakteryzuj wiązanie kowalencyjne, podaj przykład
Wiązanie kowalencyjne (atomowe) (I) jest wynikiem uwspólnienia pary elektronowej, przy czym każdy atom dostarcza jeden elektron.
Wiązanie koordynacyjne- szczególny przypadek w. kowalencyjnego, gdy uwspólniona para elektronów wiązania pochodzi od jednego atomu (NH4Cl).
Mogą powstać także tzw. wiązania podwójne lub potrójne przez uwspólnienie 4 lub 6 elektronów (np. atomy azotu o konfiguracji 1s22s2p3 - 5 elektronów walencyjnych - tworząc wspólne pary elektronowe uzyskują oktet.
Na przykład H2, O2
/pierwiastek elektroujemny - pierwiastek elektroujemny/
9- scharakteryzuj wiązanie metaliczne, podaj przykłady
Wiązanie metaliczne - występuje w kryształach o sieci metalicznej
W sieci metalicznej każdy elektron z zewnętrznych powłok znajduje się pod wpływem kilku jąder sąsiednich atomów, co powoduje rozmycie się ściśle określonych poziomów energetycznych w jedno ciągłe pasmo przewodnictwa
Elektrony walencyjne mogą się swobodnie przemieszczać.
pierwiastek elektrododatni - pierwiastek elektrododatni
brak kierunkowości
Materiały o dobrym przewodnictwie elektrycznym.
Właściwości:
*W temperaturze pokojowej są to ciała stałe o dużej wytrzymałości,
*mające specyficzny połysk,
*nie przepuszczające światła,
*plastyczne (tzn. kowalne)
*dobrze przewodzące ciepło i prąd elektryczny.
elektrony w zewnętrznych powłokach atomów metali (elektrony walencyjne) są bardzo słabo związane z resztą atomu - tworzą gaz elektronowy. Obecność tego gazu jest z kolei, podstawą wiązań międzyatomowych metalu.
Pojęcie wiązania metalicznego stosowane jest dla scharakteryzowania wiązania chemicznego istniejącego pomiędzy atomami metalu w stanie stałym kiedy mamy do czynienia z tzw. siecią metaliczną.
Tworzy się ono pod wpływem elektrycznego przyciągania między jądrami atomowymi i swobodnie poruszającymi się elektronami pochodzącymi z zewnętrznych powłok elektronowych atomów.
PRZYKŁAD:
Mechanizm powstawania wiązania metalicznego wyjaśnimy na przykładzie atomu metalu o jednym elektronie walencyjnym, np. atomu sodu.
Atom sodu w stanie podstawowym ma następującą konfigurację elektronową
Na - 1s22s22p63s1.
Z takiego zapisu wynika, że elektron walencyjny (3s1) otacza chmurą elektronową jon sodu Na+, składający się z jądra i silnie z nim związanych pozostałych elektronów w powłokach 1s, 2s, 2p. Jeżeli przez zbliżenie dwóch atomów sodu utworzymy cząsteczkę Na2, elektrony walencyjne (dzięki słabemu wiązaniu z atomem macierzystym ) będą się swobodnie poruszać "na terenie" całej cząsteczki.
Podobnie, jeżeli zbliżymy do siebie większą ilość atomów, tworząc w ten sposób kryształ sodu, elektrony walencyjne nie pozostaną zlokalizowane przy "swoich" atomach, lecz będą się poruszać w objętości całego kryształu. Tak więc metal (sód) składa się z sieci dodatnich jonów, zanurzonych w gazie swobodnie poruszających się elektronów walencyjnych, które straciły bezpośredni związek z atomami macierzystymi i stanowią niejako wspólną własność wszystkich jonów równocześnie.
Ten gaz elektronowy tworzy rodzaj kleju przenikającego przestrzeń międzyjonową, który przez oddziaływanie elektrostatyczne "wciąga" w siebie dodatnie jony, gęsto je przez to upakowując. Takie wzajemne przyciąganie jonów i i gazu elektronowego stanowi istotę wiązania metalicznego.
Przedstawiony model powstawania wiązania metalicznego jest w zasadzie zgodny z rzeczywistością ale nie wyjaśnia w pełni w właściwości elektrycznych metali, półprzewodników i izolatorów. Pełne wyjaśnienie istoty tych zjawisk możemy uzyskać na gruncie praw mechaniki kwantowej, która zakłada istnienie w krysztale poziomów elektronowych i odpowiadających im pasm stanów energetycznych.
Najwyższe zapełnione pasmo energetyczne nosi nazwę pasma walencyjnego V, następne, położone wyżej (nie zapełnione), pasma przewodnictwa L.
Jeżeli pasmo walencyjne i pasmo przewodnictwa mają zbliżone energie (nakładają się), wtedy substancja może przewodzić prąd elektryczny. Przykładem są różnego rodzaju metale.
W przypadku znacznej różnicy energii pomiędzy pasmem walencyjnym i pasmem przewodnictwa, elektrony nie są w stanie przejść do pasma przewodnictwa. Obserwujemy wtedy brak przewodnictwa elektrycznego a sama substancja jest izolatorem. Stanem pośrednim jest stan półprzewodnictwa.
10- opisz wiązanie wodorowe i van der Waalsa, podaj przykłady
Aby powstało wiązanie, spełnione muszą być poniższe warunki:
− reagujące atomy powinny się zderzyć ze sobą,
− zderzenie to musi być efektywne.
Gdy dwa atomy zbliżają się do siebie, zewnętrzne, luźno związane elektrony zostają mocno zaburzone, oddziałując na wszystkie cząstki układu (jony, elektrony). Oddziaływanie to może prowadzić do powstania wiązania, gdy jądra/jony są blisko siebie.
Wiązanie wodorowe
dwie cząsteczki/jony połączone są jonem wodorowym
szczególne znaczenie ma wiązanie −O−H.-..-..-O−
pełni istotną rolę w utrzymaniu struktury białek i kwasów nukleinowych
O istnieniu tego rodzaju wiązania świadczą wyjątkowo wysokie temperatury wrzenia wody, amoniaku i fluorowodoru. Jest ono utworzone przez atom wodoru położony między dwoma małymi, silnie elektroujemnymi atomami zawierającymi wolne pary elektronowe. Donorami wolnych par elektronowych w szczególności atomy N, O i F. Wiązanie wodorowe oznacza się kropkami, by odróżnić je od prawdziwego wiązania kowalencyjnego, np. we wzorze;
Wiązanie wodorowe tworzy się pomiędzy atomem wodoru związanym z atomem o dużej elektroujemności, a atomem z wolnymi parami elektronowymi. Aby zrozumieć powstawanie wiązania wodorowego, posłużymy się cząsteczką wody w której mamy silnie spolaryzowane wiązanie O-H. Elektroujemny atom O silnie przyciąga elektrony wiązania, co powoduje, że atom H uzyskuje duży cząstkowy ładunek dodatni. Dodatnio naładowany atom wodoru jest silnie przyciągany przez jedną z wolnych par elektronowych atomu O sąsiedniej cząsteczki wody. W wyniku silnego oddziaływania wolnej pary elektronowej o ładunku ujemnym i cząstkowego ładunku dodatniego powstaje wiązanie.
Wiązania wodorowe mogą tworzyć się pomiędzy różnymi cząsteczkami. Takie wiązanie nosi nazwę międzycząsteczkowego wiązania wodorowego. Przykładem mogą być wiązania tworzące się pomiędzy już opisanymi cząsteczkami wody.
Ten typ wiązania wpływa, między innymi na wartość temperatury wrzenia (rys.13), temperatury topnienia oraz rozpuszczalności. W wielu przypadkach jest ono silniejsze niż oddziaływania międzycząsteczkowe innych typów. Energia wiązania wodorowego zawiera około 1/10 energii wiązania kowalencyjnego, ale ponieważ w wielu strukturach występuje wiele wiązań wodorowych, w sumie mają one dużą wartość energetyczną.
Okazuje się również, że wiązania wodorowe odgrywają znaczącą rolę w budowie przestrzennej białek. To min.dzięki występowaniu wiązania wodorowego zawdzięczamy trwałość struktur białkowych. Tak samo drzewa stoją dzięki obecności wiązań wodorowych pomiędzy długimi łańcuchami cząsteczek celulozy. Łańcuchy cząsteczek celulozy (zawierają wiele grup -OH) mogą tworzyć ze sobą wiele wiązań wodorowych. Wynikiem takiego oddziaływania jest odpowiednia wytrzymałość drewna. Tak samo wiązanie wodorowe łączy ze sobą cząsteczki DNA, które są kluczem do zrozumienia istoty podziału komórek i wzrostu żywych organizmów.
Wiązanie van der Waalsa (międzycząsteczkowe)
występuje między wszystkimi cząsteczkami
związane z przyciąganiem się dipoli lub dipoli indukowanych
odpowiedzialne za właściwości fizyczne substancji (np. stan skupienia, temperatury przejść fazowych)
Wiązania van der Waalsa (międzycząsteczkowe)
To, że każdą substancję możemy skroplić, jest dowodem że między atomami i cząsteczkami występują przyciągające oddziaływania. Przykładem takiego przyciągania jest oddziaływanie występujące między atomami gazów szlachetnych, które umożliwia ich kondensację. Ten rodzaj oddziaływania nosi nazwę sił van der Waalsa i jest to jedyny rodzaj przyciągania między atomami gazów szlachetnych i między cząsteczkami niepolarnymi.
Siły van der Waalsa są wynikiem wzajemnego oddziaływania elektronów i jąder w czasteczkach. A konkretnie polegają one na przyciąganiu się szybkozmiennych albo inaczej falujących dipoli. Siły dyspersyjne działają jedynie wtedy, gdy cząsteczki znajdują się bardzo blisko siebie, tak że prawie się stykają. |
Siły van der Waalsa są stosunkowo słabe w przypadku małych cząsteczek (kilkanaście razy słabsze od sił wiazania atomów w cząsteczce), ale w przypadku dużych cząsteczek mogą nawet przewyższać siły wiązania chemicznego np. w smarach albo w tworzywach sztucznych. Prawidłowość ta również jest zauważalna dla temperatur wrzenia, gdzie zwykle substancje o dużej masie cząsteczkowej mają wysokie temperatury wrzenia a substancje o małej masie cząsteczkowej - niskie temperatury wrzenia
Jest to spowodowane większą liczbą elektronów w cząsteczce, czemu odpowiadają większe fluktuacje ładunków cząstkowych uwarunkowane oscylowaniem elektronów między różnymi położeniami. Daje się to zauważyć wśród cząsteczek fluorowców. I tak atom wodoru F2 ma tylko 9 elektronów, fluktuacje w tej chmurze elektronowej są małe i oddziaływania międzycząsteczkowe są tak słabe, że gazowy fluor wrze w temperaturze -188oC. W atomie takim jak brom Br2 mamy 35 elektronów, fluktuacje są zdecydowanie większe a efektem tego jest zmiana temperatury wrzenia, która dla bromu wynosi 59oC.
Siła oddziaływań van der Waalsa zależy również od kształtu cząsteczki. Daje się to zauważyć w różnicach temperatur wrzenia cząsteczek związków organicznych. Przykładem jest cząsteczka o wzorze C5H12, która może mieć kształt liniowy i silnie rozgałęziony. Wydaje się, że związki te powinny mieć jednakowe temperatury wrzenia. Okazuje się jednak, że struktura liniowa ma wyższą temperaturę wrzenia jak rozgałęziona. Różnicę tłumaczy się oddziaływaniem sił van der Waalsa, które są większe przy strukturze liniowej, ponieważ cząsteczki mogą ściślej przylegać do siebie.
Siły van der Waalsa są siłami typu uniwersalnego. Odnoszą się do wszystkich cząsteczek niezależnie od ich kształtu i wielkości.
scharakteryzuj wiązanie sigma (δ)
Wiązanie kowalencyjne między atomami powstają na skutek przenikania się orbitali atomowych.
Powstałe w wyniku nakładania się orbitali atomowych wzdłuż osi łączącej jądra pierwiastków. Wiązanie tego typu występuje w wiązaniach pojedynczych, oraz jako składnik wiązań wielkorotnych.
scharakteryzuj wiązanie pi (π)
jest to tzw przenikanie boczne, następuje w wyniku ustawienia się równolegle dwóch orbitali typu p pochodzących od dwóch różnych atomów. Wiązanie te nie występuje samodzielne, towarzyszy wiązaniu sigma (czyli tylko wtedy gdy w cząsteczce występuje wiązanie podwójne lub potrójne).
11- opisz pojęcie hybrydyzacji, podaj przykład
tworzenie się nowych, jednakowych orbitali atomowych w wyniku zmieszania orbitali typu s, p i d atomu centralnego.
Orientacja przestrzenna orbitali zhybrydyzowanych (hybryd), różna od orientacji wyjściowych orbitali atomowych, pozwala zminimalizować elektryczne odpychanie elektronów i wynika z ukierunkowania orbitali zhybrydyzowanych na otaczające atom centralny inne atomy i ligandy (hybrydyzacja orbitali atomowych nie występuje w izolowanych atomach).
Liczba hybryd równa jest liczbie orbitali atomowych biorących udział w hybrydyzacji. Formalnie hybrydy są kombinacją liniową tych orbitali.
Pojęcie hybrydyzacja orbitali atomowych przyczynia się do wyjaśnienia struktury związków chemicznych, trwałości wiązań między pierwiastkami, które je tworzą oraz ich wartościowości.
Hybrydyzacja - przykłady i zastosowania
• Jeżeli energie dwóch bliskich poziomów,
np. 2s i 2p są bliskie, to elektrony mogą
być "promowane" (czyli wzbudzone) w
dość niskiej temperaturze:
Przykład 1:
W stanie podstawowym
Be K2s22p0, czyli:
2s 2px 2py 2pz
W stanie wzbudzonym
Be K2s12p1, czyli:
2s 2px 2py 2p
4- opisz pojęcie: orbital zhybrydyzowany, podaj przykład
5- przedstaw graficznie i opisz konfigurację atomu węgla w stanie wzbudzonym
6- opisz hybrydyzację typu sp3
7- opisz hybrydyzację typu sp2
8- opisz hybrydyzację typu sp
Stany skupienia materii, wielkości i prawa, teoria pasmowa
9- opisz gazowy stan skupienia
Gazami nazywamy substancje, które nie mają określonego kształtu ani objętości, lecz przyjmują kształt i objętość zbiornika, w którym się znajdują.
Dążąc do zajęcia jak największej objętości gazy wywierają ciśnienie na ścianki zbiornika. Wywierając na gaz ciśnienie można zmienić jego objętość.
Gaz jest zbiorem cząsteczek lub atomów będących w ciągłym, chaotycznym ruchu, o szybkości rosnącej ze wzrostem temperatury.
gazy jednoatomowe (helowce: hel, neon, argon, krypton, xenon, radon)
gazy dwuatomowe (H2, O2, N2, Cl2, F2)
gazy nieorganiczne (NH3, CO, CO2, SO2)
gazy organiczne (metan CH4, propan C3H8, butan C4H10)
10- opisz ciekły stan skupienia
Ciecze traktuje się jako stan pośredni pomiędzy gazami i ciałami stałymi. Ciecze zachowują własną objętość, ale przyjmują kształt naczynia, w którym się znajdują. Wykazują znaczną, w porównaniu z gazami, gęstość i lepkość, niewielką ściśliwość i rozszerzalność cieplną
Lepkość cieczy jest to opór przeciwdziałający jej płynięciu.Im większa jest lepkość cieczy, tym wolniejszy jest jej przepływ. Ciecze zawierające wiązania wodorowe mają z reguły dużą lepkość. Lepkość zwykle maleje ze wzrostem temperatury.
Napięcie powierzchniowe cieczy określa działającą na jej powierzchnię siłę. Powierzchnia cieczy jest gładka, ponieważ siły międzycząsteczkowe wciągają cząsteczki do wewnątrz. Napięcie powierzchniowe jest przyczyną tworzenia przez ciecze kropelek i wykazywania przez substancje działania kapilarnego.
co to jest napięcie powierzchniowe, podaj przykład
Powstaje w wyniku wzajemnego oddziaływania cząsteczek we wnętrzu i na powierzchni cieczy.Na cząsteczki położone w warstwie powierzchniowej działają siły powietrza (zwrócone prostopadle do powierzchni cieczy) i siły wewnętrzne(międzycząsteczkowe) , wciągające cząsteczki do środka, więc mówiąc potocznie warstwa górna nie pęknie sama z siebie oraz staje się gładka. Napięcie jest przyczyną powstania kropli. Gdyby kropla była w próżni, miałaby kształt kuli, w normalnym otoczeniu na krople działają dodatkowo siły grawitacji, więc jej kształt się wydłuża.
2- opisz pojęcie oporu elektrycznego elektrycznego podziel ciała ze względu na ten parametr, przykłady
3- opisz teorię pasmową ciała stałego
.TEORIA PASMOWA CIAŁA STAŁEGO:
W zalezności od szerokości pasma rosnie lub maleje przewodnictwo. Im lepiej ciało przewodzi prąd tym bardziej pasma na siebie nachodzą, a gdy gorzej to się odpychają.
11- opisz półprzewodnik typu n
Półprzewodnik niesamoistny jest wówczas, gdy w sieci krystalicznej monokryształu zamiast atomów pierwiastka materiału półprzewodnikowego znajduje się inny atom (np. w sieci krystalicznej krzemu znajduje się fosfor).
Powstaje wówczas tzw. półprzewodnik domieszkowany, a ten inny atom nazywamy domieszką. Rozróżniamy dwa rodzaje domieszek: donorową i akceptorową.
Jeśli na skutek nieregularności sieci krystalicznej w półprzewodniku będą przeważać nośniki typu dziurowego, to półprzewodnik taki nazywać będziemy półprzewodnikiem typu p (niedomiarowy). A gdy będą przeważać nośniki elektronowe, będziemy nazywać je półprzewodnikami typu n (nadmiarowy).
Półprzewodnik typu n uzyskuje się przez dodanie - w procesie wzrostu kryształu krzemu - domieszki pierwiastka pięciowartościowego (np. antymon, fosfor). Niektóre atomy krzemu zostaną zastąpione w sieci krystalicznej atomami domieszki, zwanymi donorami
Każdy atom domieszki ma pięć elektronów walencyjnych, z których cztery są związane z sąsiednimi atomami krzemu. A piąty elektron jest wolny i może być łatwo oderwany od atomu domieszki - jonizując dodatnio. Elektron wówczas przechodzi do pasma przewodnictwa półprzewodnika. Atomy domieszki w modelu pasmowym półprzewodnika znajdują się na tzw. poziomie donorowym, który występuje w pobliżu dna pasma przewodnictwa półprzewodnika
5- opisz półprzewodnik typu p
6- opisz pojęcie: stop metaliczny
Krystalografia, alotropia
7- opisz pojęcie anizotropii i izotropii
Izotropowość jest to brak różnic we właściwościach fizycznych materiału, takich jak: rozszerzalność termiczna, przewodzenie ciepła, przewodnictwo elektryczne czy współczynnik załamania światła, niezależnie od tego w jakim kierunku są one mierzone.
Izotropowość jest cechą kryształów układu regularnego.
Anizotropia to zależność własności fizycznych ciała (ośrodka) od kierunku, w którym dana własność jest obserwowana lub mierzona. Ośrodek, w którym występuje anizotropia, nazywamy anizotropowym. Jeśli anizotropia jest taka sama w każdym punkcie ośrodka, to ośrodek ten nazywamy jednorodnym i mówimy o anizotropii jednorodnej. Występuje ona np. w kryształach, gdzie uwarunkowana jest symetrią ośrodka. Anizotropia może być także lokalna, wywołana naprężeniami lub defektami.
8- opisz pojęcie komórki elementarnej i sieci przestrzennej
Komórka elementarna - najmniejszy powtarzający się element z którego można zbudować kryształ ( atomy lub jony lub cząsteczki).
Komórka elementarna powtarza się we wszystkich trzech kierunkach, tworząc zamknięta sieć przestrzenną, której główną cechą jest symetria. Komórka elementarna ma zawsze kształt równoległościanu.
9- opisz jeden z układów krystalograficznych, podaj parametry sieciowe komórki
Układ krystalograficzny - system klasyfikacji kryształów ze względu na układ wewnętrzny cząsteczek w sieci krystalicznej. System wyróżnia siedem układów, w których wyróżnia się 32 klasy krystalograficzne. Każda klasa ma inny rodzaj symetrii w układzie atomów w krysztale.
Układ cząstek wynika po części ze struktury chemicznej cząsteczki. Większość kryształów przyjmuje formę regularnego wielościanu. Zewnętrzny kształt kryształu (monokryształu) jest odzwierciedleniem jego struktury wewnętrznej. Wewnątrz kryształu atomy, jony i cząsteczki są uporządkowane przestrzennie w określony, regularny sposób.
układ regularny, np. sól kamienna, diament, magnetyt, spinel
układ trygonalny, np. romboedr, skalenoedr, kalcyt, korund, kwarc
układ rombowy, np. siarka, baryt, oliwin, struwit, hemimorfit
układ trójskośny, np. chalkantyt, dysten = cyanit, aksynit, rodonit, albit
Układ Jednostki osiowe Kąty między osiami
regularny a = b = c α = β = γ = 90°
tetragonalny a = b ≠ c α = β = γ = 90°
rombowy a ≠ b ≠ c ≠ a α = β = γ = 90°
jednoskośny a ≠ b ≠ c ≠ a α = β = 90°; γ ≠ 90°
trójskośny a ≠ b ≠ c ≠ a α ≠ β ≠ γ ≠ α α, β, γ ≠ 90°
heksagonalny a = b ≠ c α = β = 90°; γ = 120°
trygonalny (romboedryczny) a=b≠c(a=b=c) α = β= 90°; γ=120° (α = β = γ ≠ 90°)
10- opisz rodzaje centrowania komórek elementarnych
Jest to najmniejsza jednostka, z której można zbudować kryształ, poprzez dodawanie jej
(powielanie) w trzech prostopadłych kierunkach Komórka elementarna powtarza się we wszystkich trzech kierunkach, tworząc zamkniętą sieć przestrzenną, której główną cechą jest symetria. Komórka elementarna ma zawsze kształt równoległościanu.
Poprzez translacje komórki elementarnej o wektory będące całkowitymi wielokrotnościami wektorów sieci krystalicznej otrzymuje się całą sieć krystaliczną kryształu.
Translacja - to izometria polegająca na równoległym przesunięciu figury, zbioru lub innego zwykle geometrycznego obiektu o pewien ustalony wektor na prostej, płaszczyźnie, w przestrzeni euklidesowej lub na dowolnej innej rozmaitości. Translacja nie zmienia kształtu figury ani żadnych wewnętrznych relacji pomiędzy jej elementami, natomiast zmienia położenie figury w stosunku do innych (nie podlegających translacji) figur.
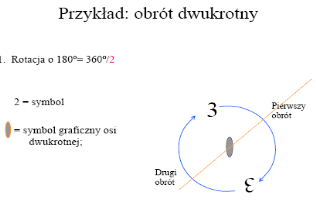
zilustruj i opisz na przykładzie pięciokrotną oś symetrii
Oś symetrii: dana figura (częśc figury) powtarza się n razy przy obrocie wokół pewnej prostej stale o ten sam kąt (mieszczący się całkowitą liczbę n razy w 360 0 ) n=3600 C nazywa się krotnością osi. Kwazikryształy posiadają pięciokrotną oś symetrii (Daniel Shechtman- schłodzony stop gliny z manganianem)
2- zilustruj i opisz na przykładzie płaszczyznę symetrii
Płaszczyzna symetrii - dwie figury (lub części jednej figury) pozostają względem siebie w takim stosuku jak przedmiot do swego obrazu w płaskim zwierciadle
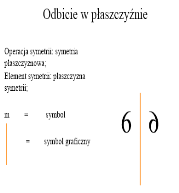
3- zilustruj i opisz na przykładzie elementy symetrii
Oś symetrii-dana figura (częśc figury) powtarza się n razy przy obrocie wokół pewnej prostej stale o ten sam kąt (mieszczący się całkowitą liczbę n razy w 360 0 ) n=3600 C nazywa się krotnością osi
Punkt symetrii - w jednakowej odległości wzdłuż dowolnej prostej przechodzącej przez środek symetrii znajdują się jednakowe części figury (jednakowy motyw)

Płaszczyzna symetrii - dwie figury (lub części jednej figury) pozostają względem siebie w takim stosuku jak przedmiot do swego obrazu w płaskim zwierciadle
4- opisz kryształy o budowie cząsteczkowej
Kryształy cząsteczkowe to grupa kryształów wyodrębniona na podstawie występowania w nich dwóch rodzajów sił wiążących - van der Waalsa (występują we wszystkich cząsteczkowych ciałach stałych) lub dipolowego (ciała stałe złożone z cząsteczek biegunowych, np. lód). Całkowite oddziaływanie międzycząsteczkowe jest słabe, co ma wpływ na ich właściwości: niska temperatura topnienia, zwykle są dość miękkie, złe przewodnictwo elektryczności.
11- zilustruj i opisz defekty punktowe w sieci krystalicznej
Punktowe:
wakansy (luki)- wolne miejsca w sieci krystalicznej,
wyjście atomu na powierzchnie kryształu,
atomy międzywęzłowe - opuszczające węzły wskutek drgań cieplnych,
6- scharakteryzuj pojęcie polimorfizmu
7- opisz pojęcie alotropii
Alotropia lub polimorfizm to występowanie tego samego pierwiastka lub związku w postaci dwóch lub kilku odmian krystalicznych, a odmiany te nazywamy alotropowymi. Przemiany alotropowe zachodzą przy stałych temperaturach i towarzyszy im wydzielanie lub pochłanianie utajonego ciepła przemiany (w zależności od kierunku jej zachodzenia).
Odmiany alotropowe nie oznaczają różnych stanów skupienia materii. To formy występowania danego pierwiastka różniące się postacią krystalograficzną (ułożeniem atomów w przestrzeni) lub budową cząsteczki. Wynika z tego zróżnicowanie właściwości fizycznych oraz aktywności chemicznych odmian alotropowych tego samego pierwiastka. Zjawisko alotropii występuje głównie dla szeregu niemetali np. węgiel, siarka, fosfor, a wśród metali dobrym przykładem jest cyna.
Polimorficzność - występowanie tej samej substancji w różnych odmianach krystalograficznych. Tę cechę mogą wykazywać zarówno pierwiastki, jak i związki chemiczne. Przykład: węgiel może występować m.in. w postaci grafitu lub diamentu, a kalcyt i aragonit to dwie odmiany krystalograficzne węglanu wapnia.
8- opisz odmiany alotropowe węgla
Diament:
struktura kubiczna przestrzennie centrowana,
każdy atom węgla otoczony jest 4 sąsiadami, z którymi tworzy wiązania kowalencyjne o tej samej długości tworząc w przestrzeni czworościan foremny (tetraedr),
najtwardszy naturalny minerał, gęstość 3,51 g/cm3,
izolator,
wiązania o charakterze kowalencyjnym,
hybrydyzacja sp3,
Grafit:
układ płaskich pierścieni heksagonalnych połączonych wiązaniami kowalencyjnymi,
w płaszczyźnie hybrydyzacja sp2 stąd są jeszcze niesmarowane, swobodne elektrony - materiał jest przewodnikiem elektrycznym,
odległość pomiędzy płaszczyznami większa niż długość wiązań - mała gęstość grafitu,
pomiędzy płaszczyznami słabe oddziaływanie typu vander Waalsa, stąd kryształ jest typu „soft”,
Fuleren:
nazwa pochodzi od nazwiska architekta amerykańskiego Richarda Buckminstera Fullera, który stosował w budownictwie bryły ograniczone pięciokątami i sześciokątami, wcześniej niż odkryto takie struktury węglowe,
każda cząsteczka zawiera parzystą liczbę atomów węgla u jego struktura składa się z 12 pierścienie pięciokątnych i „m” sześciokątnych, m= (n-20)/2
Związki nieorganiczne
9- podział i charakterystyka tlenków, przykłady
10- podział i charakterystyka wodorotlenków, przykłady
podział i charakterystyka soli, przykłady
związki chemiczne powstałe w wyniku całkowitego lub częściowego zastąpienia w kwasach atomów wodoru innymi atomami bądź grupami takimi jak:
- metale,
- NH4+,
- RO- (gdzie R - dowolna grupa organiczna) itp.
Wyróżnia się:
sole nienasycone, które dzieli się na:
hydroksosole - zawierające wolne grupy hydroksylowe pochodzące z wyjściowej zasady, zwane niepoprawnie "zasadowymi"
wodorosole - zawierające tzw. "kwaśne" atomy wodoru pochodzące z wyjściowego kwasu, które są zwane czasami niepoprawnie "kwaśnymi"
sole nasycone - w których nie występują ani grupy hydroksylowe, ani "kwaśne" atomy wodoru.
hydraty-mają w swoim krysztale cząsteczki wody.
2- podział i charakterystyka kwasów, przykłady
3- zilustruj (reakcje) dysocjacje stopniową kwasu siarkowego
dysocjacja stopniowa polega na odłączaniu po kolei po jednym protonie (w kwasach) lub po jednej grupie OH (w zasadach)
H2SO4:
Istopień: H2SO4 (H2O) H+ + HS0-4
II stopień HSO-4H20 H+ + SO2-4
H2SO3:
I stopień: H2SO3 H2O H+ +HSO3
II stopień: HSO3H2O H+ + SO2-3
4- zilustruj (reakcje) dysocjacje stopniową kwasu fosforowego
H3PO4-->H2PO4- +H+
H2PO4--->H++HPO42-
HPO42--->H++PO43-
Elektrochemia, reakcje utlenienia i redukcji, ogniwa, SEM, Nernst
5- podaj przykład i opisz reakcje utlenienia i redukcji
11- zilustruj i opisz półogniwo
7- zilustruj i opisz ogniwo chemiczne
Ogniwo chemiczne jest to układ pozwalający na zmianę energii chemicznej na elektryczną kosztem reakcji chemicznej zachodzącej w tym układzie. Składa się on z dwóch przewodników metalicznych lub węglowych, zwanych elektrodami, zanurzonych w roztworze elektrolitu, przy czym albo elektrody sporządzone są z różnych materiałów, albo składy chemiczne elektrolitu w pobliżu elektrod są różne. Ogniwo, którego elektrody nie są ze sobą połączone przewodnikiem elektrycznym, wykazuje między elektrodami określone napięcie elektryczne zwane siłą elektromotoryczną . Jeżeli elektrody połączyć poza elektrodami jakimś przewodnikiem, to zamknie się obwód i popłynie prąd - zarówno przez roztwór elektrolitu, jak i przez ten przewodnik. Napięcie między elektrodami zmniejsza się wówczas, a w pobliżu elektrod przebiegają reakcje chemiczne, których przebieg jest źródłem energii elektrycznej dostarczanej przez ogniwo chemiczne.
8- zilustruj i opisz ogniwo Daniela
9- opisz pojęcie potencjału półogniwa
10- opisz pojęcie siły elektromotorycznej
1- scharakteryzuj na przykładzie równanie Nernsta
2- opisz pojęcie standardowego potencjału elektrod, jak powstaje?
3- opisz pojęcie szeregu napięciowego metali
Jeżeli normalne potencjały różnych metali uszeregujemy w kolejności wzrastających wartości to otrzymamy szereg napięciowy metali.
Na<Mg<Al<Zn<Fe<Cd<Co<Ni<Pb<H<Cu<Hg<Ag<Au
Każdy metal tego szeregu wypiera następne metale z roztworu ich soli. Wszystkie metale występujące w szeregu przed wodorem mają ujemne potencjały normalne. Są to metale nieszlachetne, które wypierają wodór z kwasów (rozpuszczają się w kwasach z wydzieleniem wodoru). Wszystkie metale występujące w szeregu napięciowym za wodorem posiadają dodatnie potencjały normalne (metale szlachetne, które nie wypierają wodoru z kwasów).
Chemia organiczna, węglowodory, paliwa, izomeria, polimery
4- dokonaj podziału i opisz grupę węglowodorów
Węglowodory - najprostsze związki organiczne, zawierające tylko atomy węgla i wodoru. Podział:
alifatyczne (łańcuchowe)aromatyczne (pierścieniowe)
nasycone - pojedyncze wiązania pomiędzy węglaminienasycone - wielokrotne wiązania podwójne albo potrójne
Alkany - nienasycone, łańcuchowe, końcówka -an, wzór CnH2n+2Cykloalkany - nasycone, pierścieniowe, w nazwie człony początkowy i końcowy cyklo-…-an, wzór CnH2n
Alkeny - nienasycone, łańcuchowe, końcówka -en, wzór CnH2nAlkiny - nienasycone, łańcuchowe, końcówka -yn, wzór CnH2n-2
Areny - aromatyczne, wzór CnHn
5- opisz pojęcie: węglowodory nienasycone
6- opisz źródła naturalnych węglowodorów występujące w przyrodzie
11- opisz etapy przerobu ropy naftowej
8- opisz pojęcie izomerii, podaj przykłady
Izomeria - zjawisko występowania dwóch lub więcej związków o jednakowym wzorze sumarycznym, ale o różnej budowie (strukturze) oraz odmiennych właściwościach fizyko - chemicznych. Związki takie nazywamy izomerami. Istnieją dwa główne rodzaje izomerii: strukturalna, przestrzenna.
Przykłady:
BUTAN C4H10
CH3-CH(CH3)-CH3 (2 - METYLOPROPAN)
(CH3)CH-CH2-CH-CH3 (1 - METYLOPROPAN)
PENTAN C5H12
CH3-CH(CH3)-CH2-CH3 (2 - METYLOBUTAN)
CH3-CH-(CH3)C(CH3)-CH3 (3,3 - DIMETYLOBUTAN)
HEKSAN C6H14
CH3-CH2-CH(CH3)-CH2-CH3 (3 -METYLOPENTAN)
CH3-CH(CH3)-CH2-CH2-CH3 (2 - MOTYLOPENTAN)
CH3-CH(CH3)-CH(CH3)-CH3 (2,3 - DIMETYLOBUTAN)
CH3-CH(C2H5)-CH2-CH3 (2 - DIMETYLOBUTAN)
CH3-(CH3)C(CH3)-CH2-CH3 (2 - DIMETYLOBUTAN)
HEPTAN C7H16
CH3-CH(CH3)-CH2-CH2-CH2-CH3 (2 - METYLOHEKSAN)
CH3-CH2-CH(CH3)-CH2-CH2-CH2 (3 - METYLOHEKSAN)
CH3-CH(CH3)-CH(CH3)-CH2-CH3 (2,3 DIMETYLOPENTAN)
CH3-CH(CH3)-CH2-CH(CH3)-CH3 (2,4 - DIMETYLOPENTAN)
CH3-(CH3)C(CH3)-CH2-CH2-CH3 (2,2 DIMETYLOPENTAN)
CH3-CH2-(CH3)C(CH3)-CH2-CH3 (3,3 - DIMETYLOPENTAN)
CH3-(CH3)C(CH3)-CH(CH3)-CH3 (2,2,3 - TRIMETYLOBUTAN)
CH3-CH(C2H5)-CH2-CH2-CH3 (2 - ETYLOPENTAN)
CH3-CH(C2H5)CH(CH3)-CH3 (2 - ETYLO - METYLOBUTAN)
9- scharakteryzuj pojęcie i właściwości cząsteczki chiralnej, podaj przykład
10- scharakteryzuj pojęcie: polimer
Związki o budowie łańcuchowej, których cząsteczki zbudowane są z połączonych ze sobą powtarzających się elementów.
Najmniejszy powtarzający się element budowy łańcucha polimeru to mer.
Cząsteczki polimerów są bardzo długie i mają duże masy cząsteczkowe. Polimery występują w przyrodzie (białka), są też wytwarzane sztucznie.
Polimery otrzymuje się w reakcji łączenia się ze sobą pojedynczych cząsteczek prostych związków (monomerów) w długie łańcuchy
reakcje polimeryzacji
reakcje polikondensacji
dokonaj podziału i opisz reakcje otrzymywania polimerów
Podział ze względu na pochodzenie:
• polimery syntetyczne - są to polimery pochodzące w 100% z
syntezy chemicznej zaczynającej się od prostych
monomerów
• polimery naturalne - są to polimery wytwarzane w 100%
przez organizmy żywe; są to m.in. celuloza, białka, kwasy
nukleinowe.
• polimery modyfikowane - są to polimery naturalne, które
jednak zostały sztucznie zmodyfikowane chemicznie, zwykle
w celu zmiany ich własności użytkowych np.: octan celulozy,
białko modyfikowane, skrobia modyfikowana.
Wyjściowymi surowcami do otrzymywania monomerów są przede wszystkim ropa naftowa i gaz ziemny (baza petrochemiczna) oraz węgiel kamienny.
Polimeryzacja Monomery łączą się ze sobą bez powstawania produktów ubocznych. Polimer jest jedynym produktem tej reakcji.
Polimeryzacja przebiega bez zmian składu substancji reagujących. Powstający polimer różni się od monomeru tylko wielkością cząsteczki. W przedstawionym uprzednio procesie reaguje tylko jeden rodzaj monomeru. Taki proces jest nazywany homopolimeryzacją, a otrzymany produkt -homopolimerem. Jeżeli polimeryzacji ulega natomiast więcej niż jeden rodzaj monomeru, proces taki nazywa się kopolimeryzacją a powstający produkt - kopolimerem.
Przykłady polimerów :polietylen (naczynia jednorazowe), poli(chlorek winylu) [wykładziny, PCV, framuga okien], polistyren [styropian], orlon, akrylan (anilana), polipropylen (butelki), plexiglas, lucite, teflon poli(tetrafluoroetylen) [ ciuchy goretex, broń, taśmy ]
Polikondensacja jest procesem łączenia się wielu cząsteczek substancji wyjściowych w związek wielkocząsteczkowy z jednoczesnym wydzieleniem prostego związku małocząsteczkowego - jako produktu ubocznego reakcji. Skład chemiczny polimeru powstającego w wyniku polikondensacji nie jest identyczny ze składem substancji wyjściowych. Spowodowane jest to wydzieleniem się produktów ubocznych podczas procesu.
Poliaddycja ma charakter pośredni między polimeryzacją a polikondensacją. Podobnie jak polikondensacja jest to reakcja przebiegająca w sposób stopniowy, lecz nie jest procesem odwracalnym. Polimery otrzymywane w wyniku poliaddycji mają ten sam skład chemiczny co monomery, lecz różnią się od nich budową. Mechanizm omawianej reakcji reakcji polega najogólniej na przemieszczaniu atomu wodoru w cząsteczce monomeru, umożliwiając tym samym wzrost łańcucha polimeru.
10)Termodynamika, energia układu, funkcje stanu, zasady termodynamiki, kataliza
2- scharakteryzuj energię wewnętrzną układu
3- scharakteryzuj pojęcie funkcji stanu, przykład
Funkcją stanu jest energia wewnętrzna U. U układu to całkowita energia układu. energia ruchów elektronów i atomów, energia oddziaływań między elektronami, między nukleonami w jądrach, między elektronami a jądrami atomów. Funkcja stanu charakteryzuje się tym, że jej zmiany nie zależą od sposobu prowadzenia przemiany, czyli nie zależą od drogi, po której układ przeszedł od stanu początkowego do stanu końcowego. Zmiany funkcji są równe różnicy jej wartości w stanie końcowym (U2) i początkowym układu (U1):
ΔU = U2 - U1
4- przedstaw i omów zasady termodynamiki
5- opisz teorię kompleksu aktywnego
6- opisz pojęcie energii aktywacji
7- przedstaw graficznie i opisz pojęcie katalizatora i inhibitora
Katalizator - substancja, która dodana do mieszaniny reakcyjnej powoduje wzrost szybkości reakcji. Rola katalizatora polega na obniżeniu energii aktywacji reakcji, co prowadzi do wzrostu stałej szybkości reakcji. Katalizator bierze udział w reakcji chemicznej, ale nie jest w niej zużywany, tzn. że najpóźniej w ostatnim etapie reakcji zostaje odtworzony.
Schematycznie:
bez katalizatora: A + B = AB
w obecności katalizatora: A + K = AK (produkt przejściowy)
K + B = AB + K (produkt końcowy + odtworzony katalizator)
przy czym energie aktywacji reakcji z katalizatorem są mniejsze niż reakcji bez niego. Najczęściej jako katalizatory stałe używane są metale bloku d i ich związki. Bardzo popularnym katalizatorem jest np. czerń platynowa stosowana m.in. w przemysłowym utlenianiu amoniaku. Katalizatory biologiczne, które pełnią bardzo ważne funkcje w przyrodzie, zwane są enzymami. Zarówno w reakcjach katalitycznych zachodzących w przyrodzie, jak i przeprowadzanych w przemyśle, ilości dodawanych katalizatorów w stosunku do ilości substratów są bardzo małe. Należy podkreślić, ze udział katalizatora nie zmienia stałej równowagi reakcji, a jedynie wpływa na szybkość dochodzenia do stanu równowagi.
Enzym - biologiczny katalizator biorący udział w szeregu procesów przebiegających w organizmach żywych. Pod względem chemicznym są to białka złożone, w których można wyróżnić fragmenty łańcucha odpowiedzialne za aktywność enzymu, zwane centrum aktywnym. Działanie enzymu może zostać zablokowane w wyniku nieodwracalnego związania się pewnej substancji z jego centrum aktywnym. Takie zjawisko zwane jest zatruciem enzymu, a substancje blokujące działanie enzymu to trucizny enzymu lub inhibitory.
Metale bloku d - pierwiastki przejściowe. Metale rodzin pobocznych - charakteryzują się innymi cechami niż metale rodzin głównych. Np. żelazowce, manganowce, chromowce, cynkowce, miedziowce.
Energia aktywacji - najmniejsza wartość energii, jaką muszą posiadać drobiny substratów, aby mogła zajść reakcja chemiczna.
Stała równowagi reakcji - stała wielkość charakterystyczna dla danej reakcji w stanie równowagi i określonej temperaturze.
Inhibitor - substancja, która dodana do mieszaniny reakcyjnej powoduje zmniejszenie szybkości reakcji. Inhibitor podobnie jak katalizator bierze udział w reakcji chemicznej, ale nie jest w niej zużywany, tzn. że najpóźniej w ostatnim etapie reakcji zostaje odtworzony. W przeciwieństwie do katalizatora inhibitor powoduje wzrost energii aktywacji, co prowadzi do spadku stałej szybkości reakcji.
Inhibitorami są m.in. dodatki do żywności, konserwanty, substancje opóźniające korozję metali, utlenianie olejów, smarów i innych substancji wrażliwych na działanie tlenu, światła, itp.
Konserwanty - substancje chemiczne, które dodane do żywności zapobiegają jej psuciu się lub opóźniają ten proces.
Czasem mianem inhibitora określa się też truciznę katalizatora, tzn. substancję, która adsorbując się na powierzchni katalizatora stałego lub wiążąc się z enzymem blokuje jego działanie.
Adsorpcja - proces polegający na osadzaniu, gromadzeniu się na powierzchni ciała stałego lub cieczy drobin innych substancji.
11- przedstaw graficznie i opisz reakcje egzoenergetyczne
Reakcje egzoenergetyczne (egzotermiczne) - przebiegają z wydzieleniem energii na sposób ciepła (spalanie). Energia produktów będzie niższa niż energia substratów.
11- przedstaw graficznie i opisz reakcje endoenergetyczne
4)Reakcja endoenergetyczna - reakcja chemiczna , do której przebiegu konieczne jest stałe doprowadzanie energii. |
|
||
|
Przykłady: |
||
Przykłady reakcji endoenergetycznych
A) Reakcja elektrolizy chlorku miedzi II (CuCl2):
CuCl2 → Cu2+ + 2Cl-
Reakcja zachodząca na katodzie: Cu2+ + 2e →Cu
Reakcja zachodząca na anodzie: 2Cl- - 2e →Cl2
B) Reakcja fotolizy światła
AgNO3 + HCl →AgCl + HNO3
W wyniku tych reakcji ciepło jest pobierane.
11)Spektroskopia, absorpcja i emisja światła, zjawiska optyczne
11- opisz pojęcie absorpcji i emisji światła
Spektroskopia, dział fizyki atomowej i jądrowej oraz chemii atomowej badający struktury energetyczne (budowę i właściwości) cząsteczek, atomów, jąder atomowych i cząstek elementarnych (w historycznym znaczeniu nazwy) poprzez obserwację i analizę rozkładu energii (widm) promieniowania emitowanego, pochłanianego lub rozpraszanego przez dany obiekt fizyczny.
Emisja światła:
wysyłanie promieniowania świetlnego przez wzbudzoną materię;
w wyniku emisji światła układy promieniujące (atomy, cząsteczki, jony) przechodzą ze stanu o wyższej energii do stanu o niższej energii, a energia wzbudzenia jest zamieniana na energię wytwarzanej cząstki światła — fotonu; emisja światła spontaniczna i emisja światła wymuszona.
Absorpcja, w chemii proces dyfuzyjny polegający na pochłanianiu jakiejś substancji (zwany absorbatem) przez całą objętość innej substancji, która tworzy odrębną fazę (zwany absorbentem). Absorbatem jest najczęściej gaz lub ciecz, a absorbentem ciecz lub ciało stałe. Absorpcję prowadzi się często w celu wydzielenia określonego składnika z mieszaniny gazów.
opisz prawa absorpcji, podaj wzory
Prawa absorpcji.
I Prawo absorpcji (prawo Lamberta)
Wiązka promieniowania monochromatycznego po przejściu przez jednorodny ośrodek absorbujący o grubości b ulega osłabieniu wg równania:
I = I0 ∙ e -kb
w którym I0 oznacza natężenie wiązki promieniowania monochromatycznego padającego na jednorodny ośrodek absorbujący, I - natężenie promieniowania po przejściu przez ośrodek absorbujący, b - grubość warstwy absorbującej, k - współczynnik absorpcji, e - podstawę logarytmów naturalnych.
I prawo absorpcji można zatem sformułować w sposób następujący:
Absorpcja jest proporcjonalna do grubości warstwy absorpcyjnej, jeśli wiązka promieniowania monochromatycznego przechodzi przez jednorodny ośrodek absorbujący.
II Prawo absorpcji (prawo Lamberta - Beera)
Prawo to dotyczy absorpcji promieniowania przez roztwór i można je sformułować w następujący sposób: jeśli współczynnik absorpcji rozpuszczalnika jest równy zeru, to wiązka promieniowania monochromatycznego, po przejściu przez jednorodny roztwór substancji absorbującej o stężeniu c, ulega osłabieniu według równania:
I - I0 ∙ e kbc
Prawo to można sformułować w sposób następujący: Jeżeli współczynnik absorpcji rozpuszczalnika jest równy zeru, to absorbancja wiązki promieniowania monochromatycznego przechodzącej przez jednorodny roztwór jest wprost proporcjonalny do stężenia roztworu c i do grubości warstwy absorbującej b.
III Prawo absorpcji (prawo addytywności absorpcji)
Absorpcja roztworu wieloskładnikowego równa się sumie absorbancji poszczególnych składników:
A = A1 + A2 + … An
Gdzie: A1, A2, …, An są to absorbancje poszczególnych składników. W równaniu:
A = a c b
wielkość a jest właściwym współczynnikiem absorpcji, gdy stężenie wyrażamy w kg ∙ dm -3 lub g ∙ cm -3. Natomiast, gdy stężenie c wyrażamy w mol ∙ dm -3, równanie to przybiera postać:
A = ε c b
Gdzie ε jest to molowy współczynnik absorpcji, a jego wymiar podawany jest dwojako:
[dm3 ∙ mol -1].
2- scharakteryzuj różnice pomiędzy absorpcją a emisją światła
3- opisz pojęcia rozszczepienia i odbicia światła, podaj przykłady
ROZSZCZEPIENIE ŚWIATŁA spowodowane jest różną prędkością rozchodzenia się promieni świetlnych o różnych barwach. Różna prędkość rozchodzenia się światła owocuje oczywiście różnym współczynnikiem załamania światła i różnym kątem załamania.
Ponieważ zaś światło białe jest mieszaniną świateł o wielu barwach, to przepuszczenie go przez pryzmat spowoduje rozdzielenie poszczególnych składowych na paletę barw.
Przykłady: tęcza (powstaje na niebie, gdy spadające krople wody są oświetlane przez Słońce znajdujące się za obserwatorem. Kolory powstają w wyniku załamania i całkowitego wewnętrznego odbicia światła słonecznego w kroplach wody.)
Odbicie światła Światło padające na granicę dwóch ośrodków może ulec odbiciu. Dzieje się tak bardzo często, przy czym dodatkowo część wiązki świetlnej może dodatkowo ulegać załamaniu. Odbiciem rządzi dość proste prawo zwane prawem odbicia. Prawo odbicia światła
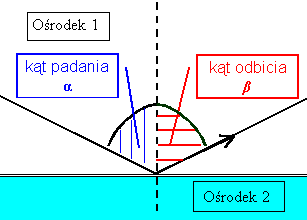
β = α
Kąt odbicia równy jest kątowi padania.
Kąty - padania i odbicia leżą w jednej płaszczyźnie.
4- opisz pojęcie rozpraszania i załamania światła, podaj przykłady
Załamanie i rozszczepienie światła
W XVII wieku angielski naukowiec Izaak Newton prowadził badania nad naturą światła. Używal on trójkątnego pryzmatu w celu rozszczepiania promieni słonecznych na widmo. Zauważył on, że przy pomocy drugiego pryzmatu, widmo może być z powrotem skupione i utworzyć wiązkę białego światła. Stanowiło to dowód na to, że białe światło składa się z wielu barwnych promieni. Pryzmat załamuje dwukrotnie promienie przechodzące przez niego - w momencie wejścia i w momencie wyjścia. Jednak promienie o różnych barwach załamują się pod różnym kątem - czerwone pod najmniejszym, fioletowe pod największym. Spowodowane jest to tym, że promienie o różnych barwach rozchodzą się z różną prędkością. Zjawisko załamania promieni świetlnych nazywa się refrakcją, natomiast zjawisko rozszczepienia dyspersją. Tęcza powstaje w wyniku dyspersji promieni słonecznych w kroplach deszczu. Zjawisko rozszczepienia powoduje także piękny poblask kamieniom szlachetnym i kryształom. Zjawisko załamania światła występuje wtedy, gdy promienie świetlne przechodzą przez ośrodki o różnej gęstości. Stwarza to wiele ciekawych efektów, jak na przykład złudzenie złamanej łyżeczki w szklance wody, miraże na pustyniach itp. Zjawisko załamania światła zostało wykorzystane w wielu urządzeniach. Najpopularniejsze z nich to soczewki, wykorzystywane miedzy innymi w aparatach fotograficznych i urządzeniach optycznych, które dzięki zjawisku załamania powodują uzyskanie odpowiedniego obrazu danego przedmiotu.
Załamanie światła (refrakcja) - zmiana kierunku rozchodzenia się fali (załamanie fali) związana ze zmianą jej prędkości, gdy przechodzi do innego ośrodka. Zmiana prędkości powoduje zmianę długości fali, a częstotliwość pozostaje stała. Występuje na granicy dwuch ośrodków (substancji) np.powietrza i wody i gdy promień światła ,,wpada" do wody zmienia kierunek czyli załamuje się.
Rozproszenie ś. - zjawisko oddziaływania światła z materią, w wyniku którego następuje zmiana kierunku rozchodzenia się światła, z wyjątkiem zjawisk opisanych przez odbicie i załamanie światła. Wywołuje złudzenie świecenia ośrodka.
Rozróżnia się rozpraszanie światła:
sprężyste - podczas rozpraszania nie następuje zmiana energii (częstotliwości) światła,
niesprężyste - podczas rozpraszania zmienia się energia (częstotliwość) światła. Gdy światło pada na nieruwną i chropowatą powierzchnie odbija się w sposóp chaotyczny czyli rozprasza się.
Podst.
Wzbudzone (przewodnicta)
Posiom e - pasmo
E1
E2
E
∆E bariera energii , pasmo energii - elektorn nie może się tam znajdować
STRUKTURA
WIĄZANIE
WIĄZANIE + STRUKTURA
Wyszukiwarka
Podobne podstrony:
Opracowanie Zagadnień na egzamin Mikroprocki
opracowane zagadnienia 2011
monopolizacja gospodarki, Opracowane zagadnienia
Opracowanie zagadnień NIK, Bezpieczenstwo Narodowe rok I
temp krytyczna, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane, za
socjologia - opracowane zagadnienia(2), Uniwerek
Opracowane zagadnienia na koło z podstaw turystyki, Notatki na koła
opracowane zagadnienia ściąga nowa
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
Drobnoustroje chorobotwórcze opracowane zagadnienia
Egzamin opracowane zagadnienia 2
Opracowanie zagadnień na prawo handlowe
Podstawy biologicznego rozwoju człowieka opracowane zagadnienia z roku 14 2015
opracowane zagadnienia na egazamin
Opracowane Zagadnienia
Socjologia organizacji socjologia organizacji opracowanie zagadnien
ChMB kolokwium I opracowane zagadnienia by Owca
METODOLOGIA opracowane zagadnienia pdf
więcej podobnych podstron