Wydział Metali Nieżelaznych |
Data wykonania ćwiczenia: 15.10.2013. |
||
KIERUNEK: Zarządzanie i inżynieria produkcji |
NR ĆWICZENIA: II |
||
TYTUŁ ĆWICZENIA: Wytop ołowiu ze szlamu z rozbiórki akumulatorów |
|||
Grupa nr:
|
Data oddania sprawozdania: |
Data zaliczenia sprawozdania: |
|
|
Data oddania sprawozdania do poprawy: |
Data zaliczenia ćwiczenia: |
|
Wytop ołowiu ze szlamu z rozbiórki akumulatorów
Wprowadzenie
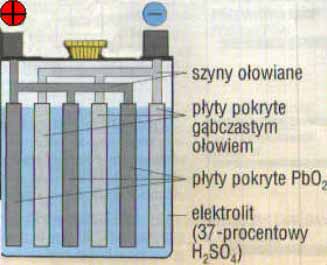
Akumulator składa dwóch rodzajów płyt ołowiowych wykonanych w postaci kraty i wypełnionych substancją czynną. Płyty dodatnie, wypełnione dwutlenkiem ołowiu i ujemne wypełnione ołowiem w postaci gąbczastej, umieszczone są w szklanym lub ebonitowym naczyniu i zalane 22-35% roztworem kwasu siarkowego o gęstości 1,18 do 1,24 g/cm3. Elektrolit pokrywa płyty całkowicie. Najczęściej w naczyniu szklanym lub ebonitowym wypełnionym elektrolitem umieszcza się kilka płyt ujemnych, przedzielonych płytami dodatnimi. Płyt ujemnych jest o jedną więcej niż dodatnich, ponieważ na obu końcach szeregu powinny być płyty ujemne, które są odporniejsze na uszkodzenia. Płyty tej samej biegunowości połączone są ze sobą za pomocą mostka ołowianego. Aby zapobiec zetknięciu się płyt o różnej biegunowości, oddziela się je od siebie rurkami szklanymi lub nie przewodzącymi przekładkami porowatymi nasiąkniętymi elektrolitem.
Podczas ładowania zachodzą następujące reakcje:
Na katodzie: PbSO4 + 2H+ + 2e- = Pb + H2SO4
Na anodzie: PbSO4 + SO42-+ 2H2O - 2e- = PbO2+ 2H2SO4
Podczas rozładowywania zachodzą następujące reakcje chemiczne:
Na płycie dodatniej: PbO2 +2H++ H2SO4+ 2e- = PbSO4+ 2H2O
Na płycie ujemnej: Pb+ SO42- = PbSO4+ 2e-
W stanie rozładowanym obydwie elektrody są więc pokryte siarczanem ołowiowym PbSO4, a stężenie kwasu siarkowego w roztworze znacznie zmalało.
Typowy akumulator do samochodu osobowego jest zbudowany z 6 ogniw ołowiowo-kwasowych połączonych szeregowo. Każde ogniwo generuje siłę elektromotoryczną (SEM) równą 2,1 V. Cały akumulator generuje zatem napięcie znamionowe równe 12,6V. Rezystancja wewnętrzna akumulatora jest bardzo mała, umożliwiając przepływ bardzo dużych prądów. Z tego powodu znalazły zastosowanie jako akumulatory rozruchowe silników spalinowych.
Część eksperymentalna
Na wadze analitycznej odmierzono:
- 100 g szlamu akumulatorowego,
- 12 g wiórów (lub proszku) żelaza,
- 4 g węglanu sodu (Na2CO3)
- 4 g koksiku.
Następnie wszystkie składniki zmieszano i wsypano do tygla. Ponownie odmierzono składniki tak aby drugi tygiel miał jak najbardziej zbliżoną wagę do pierwszego. Oba umieszczono w piecu na czas 35 i 70 minut, w temperaturze 1000°C. Po upływie 35 minut wyciągnięto pierwszy tygiel. Następnie płynny metal odlano do w formie ściętego stożka, ostudzono i zważono. Powtórzono te same operacje z drugim tyglem po następnych 35 minutach. Porównano otrzymane wyniki
Obserwacje własne
Kiedy tygle umieszczano w piecu jego temperatura spadła do około 960°C Po zamknięciu pieca temperatura wciąż spadała aż do 920°C co związane było z potrzebą ogrzania materiału umieszczonego w piecu.
Obliczenia
Szlam zawiera 70% ołowiu, który występuje w postaci PbO - 2,6 %, PbO2 - 19,9 % i PbSO4 - 43 %.
Tabela.1
|
Próbka 1 |
Próbka 2 |
masa próbki [g] |
66,393 |
68,235 |
czas przebywania w piecu [min] |
35 |
70 |
Uzysk [%] |
94,84714286 |
97,30051 |
Obliczenie Uzysku dla próbki numer 2
(66,393*100)/70=97,30051%
Obliczenia zmiany entalpii swobodnej dla reakcji:
PbSO4 + 4CO = PbS + 4CO2
PbS + Fe = Pb + FeS
PbSO4 +Na2CO3 +CO = Pb + Na2SO4 +2CO2
w zakresie zakresie temperatur 500-1500 K.
Wzory na zmianę entalpii swobodnej dla reakcji:
1. ![]()
2. ![]()
3. ![]()
![]()
dla każdego składnika odczytujemy z tablic termodynamicznych dla danych temperatur.
Przykład
Obliczamy zmianę entalpii swobodnej dla pierwszej reakcji w temperaturze 500K:
PbSO4 + 4CO = PbS + 4CO2
![]()
=-239,095 kcal*mol-1
![]()
=-50,428 kcal*mol-1
![]()
=-120,131 kcal*mol-1
![]()
= -35,579 kcal*mol-1
![]()
= -35,579+4*(-120,131)-(4*(-50,428)+(-239,095)) = -75,08 [kcal *mol-1]
Tabela.2
PbSO4 + 4CO = PbS + 4CO2
|
PbS + Fe = Pb + FeS
|
PbSO4 +Na2CO3 +CO = Pb + Na2SO4 +2CO2
|
|||
Temp. [K] |
|
Temp. [K] |
|
Temp. [K] |
|
500 |
-75,08 |
500 |
-0,741 |
500 |
-21,641 |
600 |
-75,325 |
600 |
-1,437 |
600 |
-25,702 |
700 |
-74,947 |
700 |
-2,741 |
700 |
-29,916 |
800 |
-75,233 |
800 |
-3,299 |
800 |
-34,004 |
900 |
-75,091 |
900 |
-4,266 |
900 |
-38,029 |
1000 |
-74,863 |
1000 |
-5,259 |
1000 |
-41,958 |
1100 |
-74,54 |
1100 |
-6,015 |
1100 |
-45,768 |
1200 |
-73,885 |
1200 |
-6,792 |
1200 |
-48,925 |
1300 |
-73,011 |
1300 |
-7,552 |
1300 |
-51,93 |
1400 |
-72,505 |
1400 |
-8,159 |
1400 |
-55,38 |
1500 |
-71,866 |
1500 |
-8,441 |
1500 |
-56,7 |
Wykres. 1
Obliczenie stałej równowagi lgKp
W celu wyznaczenia lgKp korzystamy ze wzoru: ![]()
= -RT lnKp
Stała gazowa R = 8,314 J/mol*K
1kcal = 4186J
1J = 1/4186 kcal = 0,000238 kcal
1J - 0,000238 kcal
8,314 J - x kcal
x = 1,978 *10-3 kcal
R = 1,978 *10 -3 kcal/mol*K
![]()
Przykład
Obliczamy dla reakcji
PbSO4 + 4CO = PbS + 4CO2
![]()
![]()
Tabela.3
PbSO4 + 4CO = PbS + 4CO2
|
PbS + Fe = Pb + FeS
|
PbSO4 +Na2CO3 +CO = Pb + Na2SO4 +2CO2
|
|||
Temp. [K] |
lg Kp |
Temp. [K] |
lg Kp |
Temp. [K] |
lg Kp |
500 |
32,98 |
500 |
0,33 |
500 |
9,51 |
600 |
27,57 |
600 |
0,53 |
600 |
9,41 |
700 |
23,51 |
700 |
0,86 |
700 |
9,39 |
800 |
20,65 |
800 |
0,91 |
800 |
9,33 |
900 |
18,32 |
900 |
1,04 |
900 |
9,28 |
1000 |
16,44 |
1000 |
1,15 |
1000 |
9,21 |
1100 |
14,88 |
1100 |
1,20 |
1100 |
9,14 |
1200 |
13,52 |
1200 |
1,24 |
1200 |
8,95 |
1300 |
12,33 |
1300 |
1,27 |
1300 |
8,77 |
1400 |
11,37 |
1400 |
1,28 |
1400 |
8,69 |
1500 |
10,52 |
1500 |
1,24 |
1500 |
8,30 |
Wykres.2
Wnioski
Na podstawie przeprowadzonego doświadczenia można stwierdzić że zwiększenie czasu przebywania próbki w piecu z 35 do 75 minut nie zwiększa wymiernie uzysku wytapianego ołowiu, gdyż po 35 minutach uzyskano 66,393g natomiast po 70 minutach 68,235g. Uzysk w naszym przypadku wynosi odpowiednio 94,84714286 i 97,30051%. W podanych temperaturach (500-1500K) entalpia swobodna reakcji jest ujemna. Dzięki czemu wiadomo że w takich warunkach reakcja przechodzi samorzutnie. Waga próbek powstałych podczas zajęć może odbiegać od prawidłowych wyników z powodu pozostałości po formie która osadzała się w niewielkich ilościach na odlanych próbkach. Można stwierdzić że proces wytapiania ołowiu ze szlamu z rozbiórki akumulatorów jest łatwy do przeprowadzenia gdyż w warunkach laboratoryjnych uzysk wynosił ponad 94% .
Literatura
Wykłady prof. Stanisława Pietrzyka
Recykling Metali Nieżelaznych Marian Kucharski
Wyszukiwarka
Podobne podstrony:
Sprawko Odsiarczanie szlamów pochodzących z rozbiórki akumulatorów, Recykling metali AGH ZiP
Harmonogram zajęć Podstawy Recyklingu Metali Nieżelaznych
Harmonogram zajęć Podstawy Recyklingu Metali Nieżelaznych
RECYKLING METALI
sprawko ze szkła
sprawko ze stereologii
stany nieustalone w obwodach RLC zasilanych ze źródła napięcia stałego, Politechnika Lubelska, Studi
05. Karta technologicza zbiorcza, Politechnika Lubelska, Studia, Studia, Sprawka 5 semestr, technolo
172. normowanie czasu wierc, Politechnika Lubelska, Studia, Studia, Sprawka 5 semestr, technologia m
Recykling odpadów sztucznych. sprawko, Mechatronika, Recykling
sprawka fizyka, Wyznaczanie ogniskowych soczewek ze wzoru soczewkowego oraz metodą Bessela., nr
36 Zbiórki i recyklingu tworzyw sztucznych w rur odpadów budowlanych i rozbiórkowych strumienia
RECYKLING ze schematem
Wpływ liniowej emisji ołowiu, cynku i niklu ze źródeł kimunikacyjnych na nanieczyszczenie małych zbi
akumulator do honda insight ze 10
Uczen ze specyficznymi trudnosciami
Układy wodiociągowe ze zb przepł końcowym i hydroforem
więcej podobnych podstron