Data: 04.03.2014 r. |
Nr ćwiczenia i tytuł: 20. Acetyloacetoniany metali bloku d
|
Ocena |
|
|
|
Asystenta: |
Sprawozdanie: |
Prowadzący: dr Ryszard Gryboś |
Wykonująca: Monika Góralik |
|
|
1. Cel ćwiczenia.
Celem ćwiczenia była synteza związku kompleksowego jednego z metali bloku d (inaczej: przejściowych), zbadanie jego właściwości magnetycznych poprzez pomiar w magnetowadze Evansa i analiza spektroskopowa w podczerwieni.
Struktury acetyloacetonianu miedzi (otrzymanego związku), acetyloacetonianu żelaza oraz dwóch form tautomerycznych acetyloacetonu:
2. Przebieg doświadczenia i wyniki.
Na wadze technicznej odważono w zlewce 0,58 g (ok. 0,0024 mola) trójhydratu azotanu(V) miedzi(II), Cu(NO3)2*3H2O, a następnie rozpuszczono w ok. 3 ml wody. W drugiej zlewce sporządzono roztwór z 0,55 cm3 acetyloacetonu (Hacac) i 1 cm3 etanolu, który przeniesiono do wcześniej otrzymanego roztworu soli miedzi. Zlewkę z mieszaniną Cu(NO3)2*3H2O, wody, Hacac
i etanolu umieszczono na płycie grzejnej mieszadła magnetycznego i ogrzewano do temperatury
ok. 40 °C. Odważono na wadze technicznej ok. 0,7 g bezwodnego octanu sodu, CH3COONa,
dodawano go małymi porcjami do roztworu i intensywnie mieszano na mieszadle magnetycznym. Podczas tej czynności zaszła reakcja:
[Cu(H2O)6](NO3)2 + 2Hacac + 2CH3COONa → [Cu(acac)2] + 2CH3COOH + 6H2O + 2NaNO3
Do dodaniu całej odważki CH3COONa ogrzewano roztwór przez krótką chwilę, a następnie odstawiono na ok. 10 minut do ochłodzenia w wodzie z lodem. Po tym czasie odsączono jasnoniebieski, drobnokrystaliczny produkt na małym lejku ze spiekiem szklanym w zestawie podłączonym do pompy próżniowej, a następnie przemyto schłodzoną wodą i małą ilością zimnego etanolu. Produkt przeniesiono na szkiełko zegarkowe, wstawiono do suszarki i suszono przez
ok. 30 minut w temperaturze 60 °C. Po wysuszeniu produktu dokonano pomiaru wagi oraz podatności magnetycznej najpierw dla pustej probówki, a potem dla probówki zawierającej próbkę produktu. Na podstawie pomiarów wyznaczono podatności magnetyczne oraz eksperymentalne spinowe momenty magnetyczne:
Tpomiaru:22 °C=295 K
m=0,0201 g
l=2,5 cm
R0=-42
R=8
C=1
M[Cu(acac)2]=261,76 g/mol
Podobnych pomiarów dokonano dla próbek [Mn(acac)3] i [Fe(acac)3], sporządzonych przez inne osoby:
[Mn(acac)3]:
m=0,0471 g
l=2,6 cm
R0=-74
R=435
C=1
M[Mn(acac)3]=325,244 g/mol
[Fe(acac)3]:
m=0,0347 g
l=3,1 cm
R0=-40
R=394
C=1
M[Fe(acac)3]=353,151 g/mol
Po dokonaniu pomiarów na magnetowadze zważono całość otrzymanego produktu na wadze analitycznej, co pozwoliło na obliczenie wydajności reakcji (wobec Cu(NO3)2*3H2O):
nCu(NO3)2*3H2O=0,0024 mol
M[Cu(acac)2]=261,76 g/mol
m[Cu(acac)2] (oczekiwana): 0,0024 mol*261,76 g/mol=0,628 g
m[Cu(acac)2] (otrzymana): 0,516 g
Wreakcji=(0,516 g/0,628 g)*100%=82,16%
Po zważeniu produktu dokonano jego analizy spektroskopowej w podczerwieni. Widmo porównano z widmem acetyloacetonu. Można zauważyć, że w widmie [Cu(acac)2] pojawiają się charakterystyczne pasma nieobserwowane w widmie Hacac.
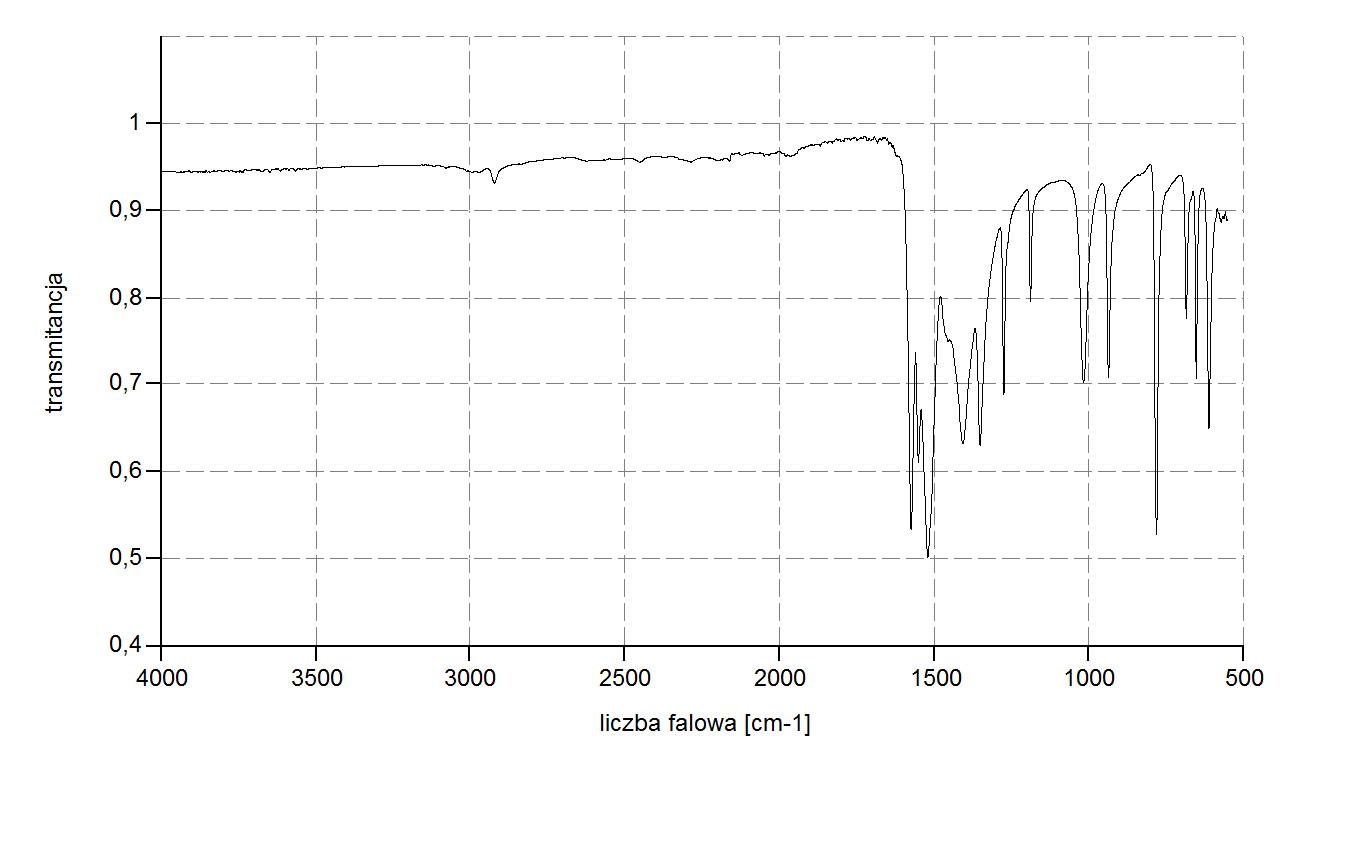
Tabela1: Wybrane pasma IR [Cu(acac)2] oraz Hacac
[Cu(acac)2] |
|
Położenie pasma [cm-1] |
Typ drgania |
1550 |
Rozciągające ν(C=O) |
1450 |
Rozciągające ν(C-O) |
750 |
Rozciągające ν(M-O) |
Hacac |
|
Położenie pasma [cm-1] |
Typ drgania |
1730-1700 |
Rozciągające ν(C=O) (forma ketonowa) |
1630 |
Rozciągające ν(C=O) (forma enolowa) |
1000-900 |
Walencyjne ν(C-O) (forma enolowa) |
Na podstawie znajomości teorii pola magnetycznego oraz geometrii opisywanych związków kompleksowych wyznaczono ich teoretyczne spinowe momenty magnetyczne. Acetyloacetonian miedzi przyjmuje geometrię płaskiego kwadratu, a jego jon centralny, Cu2+ posiada konfigurację elektronową [Cu2+]:[Ar]3d9. Ze względu na ilość elektronów na orbitalach d jest możliwa tylko jedna możliwość rozmieszczenia ich na diagramie rozszczepienia pola krystalicznego:
Teoretyczny spinowy moment magnetyczny można obliczyć ze wzoru:
gdzie N to liczba niesparowanych elektronów.
(1 niesparowany elektron)
Acetyloacetonian manganu(III), którego jon centralny ma konfigurację [Mn3+]:[Ar]3d4 oraz acetyloacetonian żelaza(III) o atomie centralnym z konfiguracją [Fe3+]:[Ar]3d5 posiadają geometrię oktaedru, ponadto można dla nich rozważyć po dwie możliwości: rozszczepienie pola krystalicznego dla kompleksu niskospinowego oraz wysokospinowego.
(niskospinowy, 2 niesparowane elektrony)
(wysokospinowy, 4 niesparowane elektrony)
(niskospinowe, 1 niesparowany elektron)
(wysokospinowe, 5 niesparowanych elektronów)
Tabela2: porównanie eksperymentalnych i teoretycznych spinowych momentów magnetycznych
związek |
μeff [μB] |
μteor niskospinowy [μB] |
μteor wysokospinowy [μB] |
[Cu(acac)2] |
1,960 |
1,732* |
|
[Mn(acac)3] |
4,823 |
2,828 |
4,899 |
[Fe(acac)3] |
5,684 |
1,732 |
5,916 |
*brak podziału na wartość dla kompleksu niskospinowego i wysokospinowego.
3. Wnioski.
Podczas ćwiczenia zsyntezowano acetyloacetonian miedzi, zbadano jego właściwości magnetyczne oraz zanalizowano w spektroskopii w podczerwieni. Związek uzyskano z dużą wydajnością 82,16%. Na jej obniżenie mogło mieć wpływ głównie częściowe rozpuszczenie związku podczas przemywania go zimnym alkoholem (acetyloacetoniany oraz acetyloaceton dobrze rozpuszczają się w rozpuszczalnikach organicznych). Z analizy IR wynika, że w reakcji syntezy produktu miała udział forma enolowa acetyloacetonu - zauważono obecność pasm rozciągających dla wiązania C-O w enolu, zauważono też pasmo dla wiązania między ligandem a atomem centralnym. Na podstawie wyników pomiaru magnetowagą Evansa wyznaczono eksperymentalne momenty spinowe dla [Cu(acac)2] oraz dwóch innych związków kompleksowych, [Fe(acac)3]
i [Mn(acac)3]. Porównując ze sobą wartości eksperymentalne i teoretyczne zauważono, że acetyloacetoniany są związkami wysokospinowymi - μeff dla dwóch ostatnich związków nieznacznie się różnią od wartości μteor dla wysokospinowego rozszczepienia pola krystalicznego. Na różnice między wartościami eksperymentalnymi i teoretycznymi mogły mieć wpływ wahania temperatury
w pomieszczeniu, w którym dokonywano pomiarów magnetowagą Evansa oraz niepewność pomiaru samego urządzenia.
Ilustracja 1: acetyloacetonian miedzi
Ilustracja 3: formy tautomeryczne acetyloacetonu
Ilustracja 2: acetyloacetonian żelaza
Ilustracja 4: Widmo w podczerwieni dla otrzymanego [Cu(acac)2]
Ilustracja 6: rozszczepienie pola krystalicznego dla Cu2+
Ilustracja 7: rozszczepienie pola krystalicznego dla Mn3+ (niskospinowe)
Ilustracja 8: rozszczepienie pola krystalicznego dla Mn3+ (wysokospinowe)
Ilustracja 9: rozszczepienie pola krystalicznego dla Fe3+ (niskospinowe)
Ilustracja 10: rozszczepienie pola krystalicznego dla Fe3+ (wysokospinowe)
Ilustracja 5: widmo w podczerwieni dla acetyloacetonu (za: http://sdbs.db.aist.go.jp/)
Wyszukiwarka
Podobne podstrony:
Alkiny. Etyn (acetylen), Chemia
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Klasyfikacja połączeń nieorganicznych - wersja 2, STUDIA
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
materialy dydaktyczne, CHEMIA NIEORGANICZNA, Laboratorium
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
ĆWICZENIE 14, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
Treści laboratorium, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratorium
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
Chemia tabelki - ściąga, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratori
lista anionow, CHEMIA NIEORGANICZNA, Laboratorium
ĆWICZENIE 11, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
program, podstawy chemii nieorganicznej, Chemia nieorganiczna laboratorium, MOJE
pytania 3 roku z nieorganów, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZ
synteza i właściwości związków kobaltu z amoniakiem, chemia nieorganiczna, laboratorium, Chemia nieo
Instrukcja V stala i stopien, Biologia UJ, Chemia nieorganiczna, laboratoria
Program 2008, Semestr I, chemia ogólna i nieorganiczna, laboratoria
Laboratorium nr 3-4, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratorium
więcej podobnych podstron