Imię i nazwisko : Tomasz Świątek
Wydział : BiNoŻ
Kierunek : Biotechnologia
Grupa : 2
Ćwiczenie nr 15
Tytuł ćwiczenia : Wyznaczanie ciepła spalania
Data wykonania ćwiczenia…………..
Data oddania sprawozdania..................
Data zwrotu sprawozdania....................
Data ponownego oddania sprawozdania..............
Cel ćwiczenia: Celem ćwiczenia jest wyznaczenie ciepła spalania krystalicznej substancji organicznej. Eksperyment przeprowadza się w tzw. bombie kalorymetrycznej umieszczonej w kalorymetrze diatermicznym.
Wstęp teoretyczny
Układ jest to część przyrody, której właściwości lub zachodzące w niej zjawiska badamy. Pozostała część przestrzeni to otoczenie.
Energia wewnętrzna układu, U [J], całkowita ilość energii w układzie, jest sumą energii kinetycznej i potencjalnej wszystkich atomów, jonów, cząsteczek w układzie. Nie można zmierzyć wartości bezwzględnej energii wewnętrznej układu, można natomiast mierzyć różnicę energii wewnętrznej układu, ΔU, w różnych stanach, np. w stanie początkowym i w stanie końcowym, czyli ΔU = U2 - U1.
Całkowitą ilość energii w układzie można scharakteryzować za pomocą entalpii, H [J], którą definiuje następujące równanie:
H = U + pV
Nie można zmierzyć bezwzględnej wartości entalpii, można natomiast zmierzyć różnicę entalpii układu ΔH, w różnych stanach, np. w stanie początkowym i w stanie końcowym, czyli ΔH = H2 - H1
Energia wewnętrzna i entalpia są funkcjami stanu, co oznacza, że ich wartość zależy tylko od stanu układu, który określają parametry stanu, takie jak temperatura, ciśnienie, objętość, liczba składników itp. Wartość funkcji stanu nie zależy od sposobu (drogi) osiągnięcia danego stanu.
Ciepło, q [J] jest jednym ze sposobów przeniesienia energii między układem a otoczeniem. Wymiana ciepła jest spowodowana różnicą temperatur pomiędzy układem i otoczeniem. Z molekularnego punktu widzenia wymiana ciepła jest skutkiem bezładnych ruchów termicznych cząsteczek. Ciepło dostarczone do układu z otoczenia oznaczamy jako dodatnie, a proces, w którym ciepło pobierane jest od otoczenia nazywamy procesem endotermicznym. Ciepło przeniesione od układu do otoczenia jest ujemne, a proces, w którym ciepło oddawane jest do otoczenia jest procesem egzotermicznym.
Praca, w [J] jest innym sposobem wymiany energii pomiędzy układem i otoczeniem. Pracę wykonaną przez układ na otoczeniu oznaczamy ją jako dodatnią. Pracę wykonanej przez otoczenie na układzie oznaczamy jako ujemną.
Ciepło i praca są funkcjami drogi, co oznacza, że ich wartości zależą od sposobu osiągnięcia przez układ danego stanu.
Pierwsza zasada termodynamiki jest specyficznym sformułowaniem zasady zachowania energii, która mówi, że zmiana energii wewnętrznej układu jest skutkiem wymiany ciepła i/lub pracy z otoczeniem. Zapisujemy to następującym równaniem:
ΔU = q - w
Jeśli w układzie możliwa jest jedynie praca zmiany objętości, zwana pracą objętościową pierwsza zasada termodynamiki przyjmuje postać:
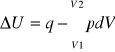
Widać stąd, że w przemianie izochorycznej (V = const) zmiana energii wewnętrznej układu jest równa ciepłu wymienionemu z otoczeniem:
ΔU = qv
Pierwszą zasadę termodynamiki można zapisać za pomocą entalpii:
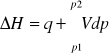
Łatwo wykazać, że ciepło wymienione z otoczeniem w przemianie izobarycznej (p=const) jest równe zmianie entalpii układu:
ΔH = qp
Pojemność cieplna jest to ilość ciepła niezbędna do ogrzania układu
jeden stopień pod stałym ciśnieniem 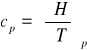
lub w stałej objętości ![]()
Ilość ciepła niezbędna do ogrzania 1 mola składnika pod stałym ciśnieniem nazywamy molową pojemnością cieplną pod stałym ciśnieniem cp [J/(mol · K)] lub w stałej objętości cV [J/(mol · K)].
Praktycznym zastosowaniem pierwszej zasady termodynamiki w chemii jest możliwość obliczania ciepła wymienionego w reakcjach chemicznych i procesach fizykochemicznych na podstawie zmierzonych doświadczalnie ciepeł innych procesów i reakcji. Możliwość taka, wynika z pierwszej zasady termodynamiki, gdyż w procesach izochorycznych lub izobarycznych ilość ciepła wymieniona pomiędzy układem i otoczeniem jest równa zmianie funkcji stanu i nie zależy od drogi procesu.
Zależność ta została zaobserwowana doświadczalnie i jest znana jako prawo Hessa, które można sformułować na przykład tak: ”Jeśli proces jest izochoryczny lub izobaryczny i gdy nie ma pracy innej niż praca zmiany objętości, wówczas efekty cieplne procesu nie zależą od drogi procesu ale tylko od stanu początkowego i końcowego”.
Pomiary ilości ciepła wydzielanego lub pobieranego podczas przemian fizykochemicznych dokonywane są w za pomocą kalorymetrów. Najczęściej stosowane kalorymetry diatermiczne składają się z izolowanego cieplnie naczynia napełnionego wodą zaopatrzonego w termometr i mieszadło. Wymianę ciepła pomiędzy naczyniem, w którym zachodzi proces, którego efekt
cieplny badamy a otaczającym medium, np. wodą, można opisać równaniem bilansu cieplnego:
q = K(ΔT + Σ![]()
)
gdzie q jest ciepłem wymienionym pomiędzy naczyniem kalorymetrycznym i otaczającym je medium, K jest pojemnością cieplną kalorymetru, natomiast (ΔT + Σ![]()
) jest różnicą temperatur, uwzględniającą poprawkę ![]()
Δ , związaną z niedoskonałą izolacją kalorymetru. W celu wyznaczenia pojemności cieplnej (kalibracji) kalorymetru należy zatem zmierzyć zmianę temperatury wraz z poprawką, (ΔT + Σ![]()
), dla znanej ilości ciepła, q, i obliczyć pojemność cieplna kalorymetru ze wzoru:
![]()
Bomba kalorymetryczna
Spalanie substancji badanej, przygotowanej w formie tabletki, przeprowadza się w ciśnieniowej bombie kalorymetrycznej w atmosferze tlenu. Schemat bomby pokazano na rysunku.
Bomba kalorymetryczna składa się ona z korpusu (k) i głowicy (g) zamkniętych pierścieniem. Z głowicą połączone są dwie elektrody (p), pomiędzy który umieszcza się w tyglu (t) pastylkę wykonaną z badanej substancji. W pastylkę wprasowany jest drut zapłonowy (d), którego wystające końce łączy się z elektroda(p). Elektrody przechodzą przez głowicę, a ich końce zaopatrzone są w gniazda do przyłączania kabla zapłonowego. Ponadto w głowicy znajdują się zawory wlotów(z1) i wylotowy (z2). Korpus, głowica i pierścień są numerowane. Przy montaż bomby należy zwrócić uwagę, by wszystkie jej części miały ten sam numer. Jak wynika z powyższego opisu spalanie w kalorymetrze przebiega w warunkach stałej objętości, czyli wydzielone w tym procesie ciepło oznaczymy - qV.
Opis ćwiczenia
Aby wyznaczyć temperaturę spalania badanej substancji należy najpierw przygotować bombę kalorymetryczną do pomiaru. Po odpowiednich czynnościach i umieszczeniu jej w kalorymetrze z wodą należy wyznaczyć pojemność cieplną kalorymetru, czyli go wykalibrować spalając tabletkę wykonaną z substancji wzorcowej i zapisywać co 10-15 sekund temperaturę przed, podczas i po zapłonie. Po kalibracji przechodzimy do badania ciepła spalania substancji nieznanej w sposób analogiczny do postępowania podczas kalibracji.
Wyniki
Substancja wzorcowa (kwas benzoesowy q=26,476 kJ/g w T=20°C)
czas [min.] |
temperatura [°C] |
0 |
24,42 |
0,5 |
24,42 |
1 |
24,43 |
1,5 |
24,43 |
2 |
24,42 |
2,5 |
24,43 |
3 |
24,43 |
3,5 |
24,42 |
4 |
24,42 |
4,5 |
24,42 |
5 |
24,60 |
5,5 |
25,05 |
6 |
25,18 |
6,5 |
25,22 |
7 |
25,26 |
7,5 |
25,26 |
8 |
25,26 |
8,5 |
25,26 |
9 |
25,28 |
9,5 |
25,29 |
10 |
25,29 |
10,5 |
25,28 |
11 |
25,29 |
11,5 |
25,30 |
12 |
25,30 |
12,5 |
25,30 |
13, |
25,30 |
13,5 |
25,30 |
14 |
25,29 |
14,5 |
25,30 |
Substancja badana
czas [min.] |
temperatura [°C] |
0 |
24,55 |
0,5 |
24,54 |
1 |
24,53 |
1,5 |
24,53 |
2 |
24,54 |
2,5 |
24,53 |
3 |
24,53 |
3,5 |
24,54 |
4 |
24,53 |
4,5 |
24,53 |
5 |
25,11 |
5,5 |
25,77 |
6 |
25,95 |
6,5 |
26,13 |
7 |
26,20 |
7,5 |
26,23 |
8 |
26,26 |
8,5 |
26,28 |
9 |
26,28 |
9,5 |
26,29 |
10 |
26,28 |
10,5 |
26,29 |
11 |
26,31 |
11,5 |
26,30 |
12 |
26,31 |
12,5 |
26,31 |
13, |
26,31 |
13,5 |
26,30 |
14 |
26,30 |
14,5 |
26,30 |
mtabl.wzorcowej =0,745 g
mtabl.badanej = 0,877 g
Wykresy
Obliczenia
Pojemność cieplna kalorymetru
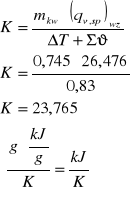
Gramowe ciepło spalania substancji badanej
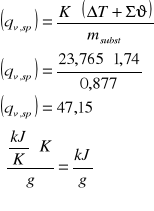
Wnioski
Na podstawie danych doświadczalnych otrzymałam ciepło spalania badanej substancji, wynosi ono 47,15 kJ/g. W porównaniu z ciepłem spalania substancji wzorcowej (kwas benzoesowy q = 26,476 kJ/g) jest prawie 2 razy większe. Odczytując z tablic ciepła spalania innych związków organicznych różniących się masą cząsteczkową można zauważyć, że wraz ze wzrostem masy cząsteczkowej zwiększa się ciepło spalania. Np. kwas glikolowy (M = 76 g/mol) q = - 697,3 kJ/mol; fenol (M = 94 g/mol) q = - 3064,6 kJ/mol; naftalen (M = 128 g/mol) q = - 5156,1 g/mol. Należy też zwrócić uwagę, że ciepło spalania zapisuje się jako ujemne. Zatem można przewidzieć, że badana substancja miała sporo większą masę cząsteczkową niż kwas benzoesowy.
4
2
Wyszukiwarka
Podobne podstrony:
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
obliczenia i wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konspekt 53, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawozdanie 45miki, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ch.f.44, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
hasz, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
SPRAWOZDANIE 54, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Cwiczenie 5, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawko 77, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ćwiczenie 45 kula, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
inż 16, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
skład, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron