Numer ćwiczenia: 18 |
Temat ćwiczenia:
Potencjometryczne pomiary pH |
Data wykonania ćwiczenia: 31.03.2014 r. |
|
|
Data oddania sprawozdania: 03.04.2014 r. |
Grupa: A2 |
Góralik Monika |
Nazwisko sprawdzającego: mgr Ewa Wierzbicka |
Uwagi: |
Ocena: |
|
1. Cel ćwiczenia.
Ćwiczenie miało na celu poznanie własności roztworów buforowych i wpływu kilku czynników na nie oraz wyznaczenie dokładnego stężenia badanego roztworu kwasu fosforowego (H3PO4) za pomocą miareczkowania potencjometrycznego.
2. Wykonanie.
Sporządzono trzy bufory octanowe poprzez zmieszanie kolejno: 50 cm3 0,1 M roztworu kwasu octowego i i 50 cm3 0,1 M octanu sodu (1:1) , 10 cm3 0,1 M CH3COOH i 90 cm3 0,1 CH3COONa (1:9) oraz przez rozcieńczenie 10 cm3 buforu 1:9 90 cm3 wody oraz zmierzono ich pH za pomocą titratora z funkcją pH-mierza i woltomierza
Do 3 zlewek na 25 cm3 przeniesiono po 24,5 cm3 każdego z buforów, dodano po 0,5 cm3 0,1 M HCl i zmierzono pH tych roztworów
Dokonano pomiaru pH 0,1 M roztworu NaOH
Zmiareczkowano bufory 1:1 i 1:9 0,1 M roztworem NaOH do momentu zmiany pH roztworów o ok. 1 w stosunku do początkowego pH (dodawano po 0,4 cm3 titranta)
Do zlewki przeniesiono 5 cm3 0,1 M roztworu H3PO4, rozcieńczono wodą do objętości ok.
50 cm3 i zmiareczkowano 0,1 M NaOH
3. Wyniki i opracowanie.
Tabela1.: doświadczalne oraz teoretyczne wartości pH badanych roztworów
bufor |
pH |
|
|
doświadczalne |
teoretyczne |
1:1 |
4,76 |
4,76 |
1:9 |
5,71 |
5,71 |
1:9 (10x rozcieńczony) |
5,79 |
5,71 |
1:1 + HCl (49:1) |
4,74 |
4,80 |
1:9 + HCl (49:1) |
5,64 |
5,82 |
1:9 (10x rozcieńczony) + HCl (1:49) |
5,24 |
5,14 |
Teoretyczną wartość pH buforów obliczono ze wzoru:
gdzie:
Ka - stała dysocjacji kwasu (CH3COOH) (1,75*10-5)
pKa=-log(1,75*10-5)=4,7569≈4,76
ckw - stężenie kwasu (CH3COOH) w buforze (0,05 M w buforze 1:1, 0,01 M w buforze 1:9)
cs - stężenie soli (CH3COONa) w buforze (0,01 M w buforze 1:1, 0,09 M w buforze 1:9)
pH roztworów po dodaniu 0,5 cm3 0,1 M HCl do buforu opisuje równanie:
gdzie cH+ to liczba moli jonów H+ wprowadzonych do roztworu w postaci HCl
Tabela2.: pojemność buforowa roztworów
bufor |
pHpoczątkowe |
pHkońcowe |
ΔpH |
VNaOH [cm3] |
VnaOH/ΔpH [cm3] |
β [mmol] |
1:1 |
4,78 |
5,80 |
1,02 |
20,4 |
20,000 |
2,0000 |
1:9 |
5,73 |
6,82 |
1,09 |
4,8 |
4,404 |
0,4404 |
Pojemność buforową roztworów obliczono ze wzoru:
gdzie:
Δn - liczba moli dodanej zasady [mmol]
ΔpH - zmiana pH roztworu po dodaniu zasady
Współczynnik aktywności (f) wodorotlenku sodu w 0,1 M roztworze obliczono, korzystając z poniższych wyrażeń przy założeniu, że aNaOH=aOH-:
-log(aOH-)=pOH=14-pH
Teoretyczną wartość współczynnika aktywności obliczono ze wzoru:
gdzie z to ładunek danego jonu, zaś I to moc jonowa roztworu obliczona z równania:
I=0,5*Σzi2ci
gdzie zi i ci to odpowiednio ładunek oraz stężenie danego jonu w roztworze (-1 dla OH-, 1 dla Na+).
I=0,5*((zNa+)2*0,1+(zOH-)2*0,1)=0,5*(0,1+0,1)=0,1
, stąd dla każdego z jonów f=10-0,1225=0,7542, a dla całego roztworu:
fteoretyczne=2*0,7542=1,5084
Tabela3.: wyniki miareczkowania kwasu fosforowego
VNaOH [cm3] |
ΔVNaOH [cm3] |
SEM [mV] |
ΔSEM [mV] |
ΔSEM/ΔVNaOH [mV/cm3] |
0,0 |
- |
239,5 |
- |
- |
0,4 |
0,4 |
237,3 |
2,2 |
5,50 |
0,8 |
|
234,8 |
2,5 |
6,25 |
1,2 |
|
231,9 |
2,9 |
7,25 |
1,6 |
|
228,7 |
3,2 |
8,00 |
2,0 |
|
225,2 |
3,5 |
8,75 |
2,4 |
|
221,1 |
4,1 |
10,25 |
2,8 |
|
216,4 |
4,7 |
11,75 |
3,2 |
|
210,8 |
5,6 |
14,00 |
3,6 |
|
203,9 |
6,9 |
17,25 |
4,0 |
|
194,9 |
9,0 |
22,50 |
4,1 |
0,1 |
191,8 |
3,1 |
31,00 |
4,2 |
|
188,7 |
3,1 |
31,00 |
4,3 |
|
185,3 |
3,4 |
34,00 |
4,4 |
|
181,2 |
4,1 |
41,00 |
4,5 |
|
176,2 |
5,0 |
50,00 |
4,6 |
|
170,6 |
5,6 |
56,00 |
4,7 |
|
163,1 |
7,5 |
75,00 |
4,8 |
|
152,7 |
10,4 |
104,00 |
4,9 |
|
136,0 |
16,7 |
167,00 |
5,0 |
|
103,6 |
32,4 |
324,00 |
5,1 |
|
67,0 |
36,6 |
366,00 |
5,2 |
|
47,9 |
19,1 |
191,00 |
5,3 |
|
36,4 |
11,5 |
115,00 |
5,4 |
|
28,2 |
8,2 |
82,00 |
5,5 |
|
21,7 |
6,5 |
65,00 |
5,6 |
|
16,3 |
5,4 |
54,00 |
5,7 |
|
11,7 |
4,6 |
46,00 |
5,8 |
|
7,7 |
4,0 |
40,00 |
5,9 |
|
4,0 |
3,7 |
37,00 |
6,0 |
|
0,8 |
3,2 |
32,00 |
6,4 |
0,4 |
-10,2 |
11,0 |
27,50 |
5,8 |
|
-19,2 |
9,0 |
22,50 |
7,2 |
|
-27,3 |
8,1 |
20,25 |
7,6 |
|
-34,9 |
7,6 |
19,00 |
8,0 |
|
-42,5 |
7,6 |
19,00 |
8,1 |
0,1 |
-44,7 |
2,2 |
22,00 |
8,2 |
|
-46,7 |
2,0 |
20,00 |
8,3 |
|
-48,6 |
1,9 |
19,00 |
8,4 |
|
-50,7 |
2,1 |
21,00 |
8,5 |
|
-52,8 |
2,1 |
21,00 |
8,6 |
|
-55,0 |
2,2 |
22,00 |
8,7 |
|
-57,2 |
2,2 |
22,00 |
8,8 |
|
-59,6 |
2,4 |
24,00 |
8,9 |
|
-62,1 |
2,5 |
25,00 |
9,0 |
|
-64,6 |
2,5 |
25,00 |
9,1 |
|
-67,3 |
2,7 |
27,00 |
9,2 |
|
-70,2 |
2,9 |
29,00 |
9,3 |
|
-73,4 |
3,2 |
32,00 |
9,4 |
|
-76,6 |
3,2 |
32,00 |
9,5 |
|
-80,4 |
3,8 |
38,00 |
9,6 |
|
-84,4 |
4,0 |
40,00 |
9,7 |
|
-89,1 |
4,7 |
47,00 |
9,8 |
|
-94,7 |
5,6 |
56,00 |
9,9 |
|
-101,1 |
6,4 |
64,00 |
10,0 |
|
-109,6 |
8,5 |
85,00 |
10,1 |
|
-120,9 |
11,3 |
113,00 |
10,2 |
|
-138,0 |
17,1 |
171,00 |
10,3 |
|
-161,6 |
23,6 |
236,00 |
10,4 |
|
-183,6 |
22,0 |
220,00 |
10,5 |
|
-200,2 |
16,6 |
166,00 |
10,6 |
|
-212,8 |
12,6 |
126,00 |
10,7 |
|
-222,8 |
10,0 |
100,00 |
10,8 |
|
-230,9 |
8,1 |
81,00 |
10,9 |
|
-237,5 |
6,6 |
66,00 |
11,0 |
|
-243,1 |
5,6 |
56,00 |
11,4 |
0,4 |
-258,7 |
15,6 |
39,00 |
11,8 |
|
-268,5 |
9,8 |
24,50 |
12,2 |
|
-275,9 |
7,4 |
18,50 |
12,6 |
|
-281,6 |
5,7 |
14,25 |
13,0 |
|
-286,2 |
4,6 |
11,50 |
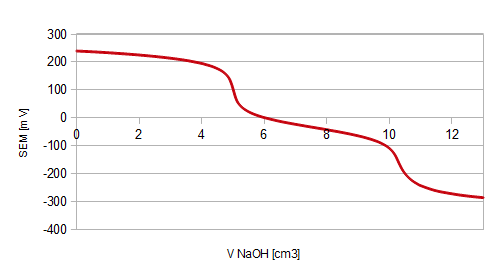
Wykres1.: zależność SEM od objętości dodanego NaOH
Wykres2.: zależność ΔSEM/ΔVNaOH od objętości dodanego NaOH
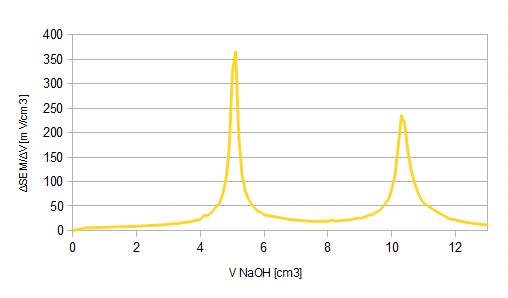
Na wykresie 2. można zauważyć 2 punkty, które można uznać za punkty końcowe miareczkowania, w których to jeden mol kwasu fosforowego przereagował z - odpowiednio - jednym lub dwoma molami zasady (trzeciego PK nie zauważono ze względu na zbyt małą objętością zastosowanego titranta):
H3PO4 + NaOH → NaH2PO4 + H2O
NaH2PO4 + NaOH → Na2HPO4 + H2O, równoznaczne z H3PO4 + 2 NaOH → Na2HPO4 + 2 H2O
Zawartość miareczkowanego kwasu w badanym roztworze (5 cm3 0,1 M H3PO4 rozcieńczone
10-krotne) obliczono dla pierwszego PK (dla którego VnaOH=5,1 cm3) ze wzoru:
gdzie:
Vtitranta - objętość NaOH [cm3]
ctitranta - stężenie NaOH [mol/dm3]
Dokładne stężenie miareczkowanego kwasu wynosi:
gdzie Vkwasu to objętość wyjściowego, nierozcieńczonego roztworu H3PO4 [dm3].
4. Wnioski.
Wykonane ćwiczenie pozwoliło zbadać właściwości kilku buforów octanowych. Zauważono, że proporcje roztworu kwasu i soli użytych do sporządzenia roztworu ma znaczny wpływ na pojemność buforową roztworu (roztwór z równymi stężeniami soli i kwasu ma pojemność wyższą niż roztwór,
w którym stężenie soli jest wyższe od stężenia kwasu) oraz jego pH (roztwór z wyższą zawartością soli ma wyższe pH). Stężenie buforu ma nieznaczny wpływ na pH roztworu, za co jest odpowiedzialna zmiana aktywności zawartych w nim jonów, jednak ma wpływ na pojemność buforową - po dodaniu odrobiny kwasu solnego do rozcieńczonego buforu spadek pH był większy niż dla nierozcieńczonego buforu (badano na przykładzie buforu 1:9). Doświadczalne wartości pH buforów nieznacznie się różniły od wartości teoretycznych, co wskazuje na poprawne sporządzenie roztworów oraz dużą dokładność pomiarów dokonywanych przez titrator.
Został wyznaczony także współczynnik aktywności wodorotlenku sodu i wynosi on 1,4454 wobec teoretycznej wartości 1,5084. Różnica może wynikać z niepewności pomiaru pH oraz wpływu warunków zewnętrznych.
Podczas ćwiczenia dokonano również dokładnego wyznaczenia stężenia badanego roztworu kwasu fosforowego poprzez miareczkowanie potencjometryczne - wynosi ono 0,102 M (deklarowane stężenie H3PO4: 0,1 M).
Wyszukiwarka
Podobne podstrony:
Potencjometryczne pomiary pH i miareczkowanie potencjometryc, Studia, Chemia fizyczna
wzor-sprawozdania-cw 1-pomiar-ph, Chemia
Potencjometryczne pomiary pH i miareczkowanie potencjometryczne własności roztworów buforowychx
Potencjometryczne pomiary pH i miareczkowanie potencjometryczne Własności roztworów buforowych
sprawozdanie 8 potencjometryczny pomiar ph LQ3AVZQUURSLZWSMF5NI3VN42RUTV7PYD3HXMYY
POTENCJOMETRYCZNE POMIARY PH I MIARECZKOWANIE POTENCJOMETRYCZNE WŁASNOŚCI ROZTWORÓW BUFOROWYCH
Potencjometryczne pomiary pH i miareczkowanie potencjometryc, POTENCJOMETRYCZNE POMIARY pH I MIAREC
POTENCJANOMETRYCZNY POMIAR pH sprawozdanie pH
wyznaczanie współczynników aktywności z pomiarów sem, Chemia fizyczna, laboratorium, Chemia fizyczna
ćw 6 - potencjał dyfuzyjny - sprawozdanie, Chemia fizyczna
Pomiar pH. hydroliza soli, Energetyka, I rok, chemia
Chemia - sprawozdanie - pomiary ph i hydroliza soli, Mechanika i Budowa Maszyn, Chemia sprawozdania
Pomiar pH metod± potencjometryczn±
ćw.4 zadania pH, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
W02s-stezenia-pH, chemia, szkolka
potencjał redoks-zadania, chemia analityczna
Pomiary wybranych właściwości fizycznych i chemicznych dielektryków, Pim c8, Politechnika Wrocławska
potencjometria nasze, PK, chemia, organiczna
CHEMIA- skala pH, CHEMIA
więcej podobnych podstron