Krzemiany to sole kwasu krzemowego.
W przyrodzie występuje około 800 znanych minerałów krzemianowych co czyni z nich najliczniejszą grupę minerałów.
Krzemiany, oprócz dominującego znaczenia skałotwórczego, mogą być także źródłem wielu cennych metali (np. krzemiany Ni, Zn, Zr, Li), tworzą również złoża wielu ważnych surowców mineralnych (kaolin, azbest, skalenie). Wśród krzemianów znaleźć można także piękne kamienie szlachetne i ozdobne (np. szmaragd, turmalin, topaz, nefryt).
Głównym motywem strukturalnym krzemianów są czworościany zbudowane z krzemu znajdującego się w środku i otoczonego czterema atomami tlenu umieszczonymi na wierzchołkach.
Te grupy krzemianowe [SiO4] mają silne wiązania co daje krzemianom dużą stabilność.
Wewnątrz tetraedru w miejscu krzemu może występować także glin. Różnice ładunków wywołane podstawieniem Si4 + przez Al3 + kompensowane są przez podstawianie dodatkowych kationów. Krzemiany, w których część anionów [SiO4]4 - zastąpiona jest anionami [AlO4]5 - , określane są jako glinokrzemiany.
Oprócz tetraedrów w sieci krystalicznej krzemianów występują też połączenia tlenowo-hydroksylowo-glinowe, tworzące oktaedry (ośmiościany foremne). Zbudowane są one z sześciu jonów tlenowych lub hydroksylowych i znajdującego się w ich wnętrzu kationu glinu
Czworościany utworzone przez grupę [SiO4] mogą łączyć się narożami, mając jeden, dwa, trzy lub cztery wspólne atomy tlenu, zależnie od tego, czy łączą się z jednym, dwoma, trzema czy czterema czworościanami (w taki sposób, że dwie grupy mają wspólny tylko jeden atom tlenu).
Złożoność struktur tetraederycznych zależy głównie od temperatury, w jakiej powstaje minerał. W wysokiej temperaturze tworzą się izolowane czworościany (oliwin) lub krótkie łańcuchy. W miarę spadku temperatury układ ten komplikuje się, tworząc w końcu trójwymiarowy szkielet (kwarc).
W zależności od sposobu łączenia tetraedrów i stopnia ich kondensacji krzemiany dzieli się na:
•krzemiany grupowe
•krzemiany łańcuchowe
•krzemiany pierścieniowe
•krzemiany przestrzenne
•krzemiany warstwowe
•krzemiany wstęgowe
•krzemiany wyspowe
W wymienionych powyżej grupach krzemianów czworościany krzemowo-tlenowe występują w sieci przestrzennej jako oddzielone od siebie jednostki strukturalne, bądź łączą się poprzez naroża, tworząc skomplikowane rodniki anionów zespolonych.
Krzemiany wyspowe
Należą do krzemianów o najprostszej budowie. Zawierają samodzielne, nie powiązane ze sobą czworościany krzemowe.
Pomiędzy czworościanami utworzonymi przez aniony [SiO4]4- rozmieszczone są kationy metali dwu- lub trójwartościowych (Mg2+ lub Fe2+) w ten sposób, że każdy z nich otoczony jest 6 atomami tlenu należącymi do różnych grup [SiO4]4-.
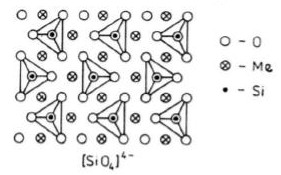
Ogólna formuła krzemianów tej grupy jest następująca: X3Y2(SiO4)3
gdzie X i Y są dwu- i trójwartościowymi kationami metali.
Stosunek krzemu do tlenu wynosi 1:4.
Minerały należące do tej grupy powstają w bardzo wysokiej temperaturze.
Do krzemianów wyspowych należą takie minerały, jak:
oliwin (Mg,Fe)2SiO4, grossular Ca3Al2(SiO4)3, cyrkon ZrSiO4, kyanit Al2(SiO4)O, topaz Al2(SiO4)F2,
Krzemiany grupowe
To rodzaj krzemianów, w których czworościany SiO4 łączą się ze sobą w odosobnione grupy jonów. Gdy dwa czworościany stykają się ze sobą wspólnym wierzchołkiem tworzy się anion (Si2O7)6-. Sześć ładunków ujemnych neutralizuje się przez połączenie jonowe szeregu kationów metali znajdujących się w przestrzeni między anionowej i grup wodorotlenowych. 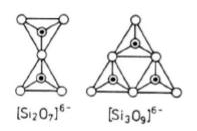
Przez połączenie trzech czworościanów tworzą się pierścienie trójczłonowe czyli grupy jonów o wzorze [Si3O9]6-.
Grupa taka występuje np. w benitoicie BaTi[Si3O9].
Pierścienie złożone z sześciu czworościanów tworzą grupę Si6O1812- np. w minerale zwanym berylem Be3Al2[Si6O18].
Stosunek Si do O w krzemianach grupowych wynosi 1:3
Do krzemianów grupowych należą także:
wezuwian Ca10Mg2Al4(SiO4)(Si2O7)2(OH)4, hemimorfit (kalamin) Zn4[Si2O7](OH)2*H2O, epidot, zoisyt, prehnit.
Krzemiany łańcuchowe
Czworościany tworzą łańcuchy w taki sposób, że każdy czworościan łączy się z dwoma innymi.
Stosunek Si : O wynosi 1:3, ponieważ z czterech atomów tlenu każdego czworościanu dwa należą tylko do jednego czworościanu, natomiast dwa pozostałe należą jednocześnie do dwóch czworościanów, czyli na każdy atom krzemu w czworościanie przypadają 2+(2/2)=3 atomy tlenu.
Odpowiadają ogólnemu wzorowi X,Y(Si2O6) gdzie X i Y są kationami metali dwu-i trójwartościowymi).
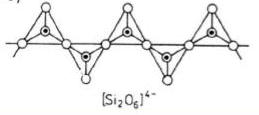
Z krzemianów o strukturze łańcuchowej najważniejsze są pirokseny.
Grupa piroksenów obejmuje wiele minerałów o dużej zmienności składu chemicznego i postaci kryształów. Zawierają one łańcuchy pojedyncze o składzie [SiO3]*2- .
Pirokseny tworzą mniej lub bardziej ciągłe szeregi kryształów mieszanych, krystalizują w układach rombowych i jednoskośnych, wykazują dobrą łupliwość w kierunkach równoległych do kierunków łańcuchów krzemotlenowych w sieci przestrzennej.
Do piroksenów należą:
enstatyt (Mg,Fe)2Si2O6, diopsyd (Ca,Mg)2Si2O6,
spodumen LiAl(Si2O6)
Krzemiany wstęgowe
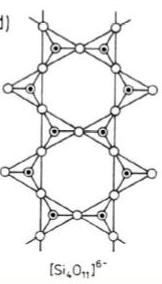
Powstają przez równoległe łączenie dwóch łańcuchów typu
piroksenów i tworzą płaskie wstęgi zbudowane z anionów [Si4O11]6-.
Krzemiany te tworzą grupę minerałów skałotwórczych potocznie określanych terminem amfibole.
Do grupy amfiboli należy duża liczba minerałów o bardzo zróżnicowanym składzie
chemicznym i różnej postaci kryształów (np. tremolit, glaukofan). Zróżnicowanie to wynika z dużych możliwości wzajemnego podstawiania jonów.
Krzemiany warstwowe
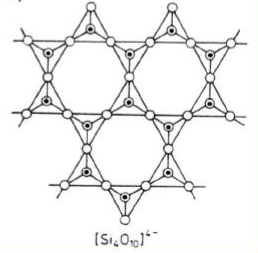
Czworościany połączone ze sobą w taki sposób, że każdy ma trzy naroża wspólne ze swoimi sąsiadami (czworościany tworzą warstwy). Siły wiązań między warstwami są bardzo słabe, dzięki czemu minerały tej grupy wykazują bardzo wyraźną łupliwość (miki).
W strukturze tego typu występują liczne luki miedzy warstwowe, pozwalające na przyłączenie grup anionowych i cząsteczek wody, które powodują uwodnienie (minerały ilaste).W tej grupie mają miejsce liczne podstawienia izomorficzne, dzięki czemu powstają różne szeregi.
Stosunek Si:O wynosi 2:5.
Do Krzemianów warstwowych należą:
serpentyn Mg3(Si2O5)(OH)4, talk Mg3(Si4O10)(OH)2, kaolinit Al2(Si2O5)(OH)4, muskowit, biotyt, illit, lepidolit, chryzokola,
montmorillonit.
Krzemiany szkieletowe (krzemiany przestrzenne)
Krzemiany o trójwymiarowych połączeniach czworościanów krzemowo-tlenowych (każdy czworościan na cztery wspólne naroża z czterema innymi czworościanami).
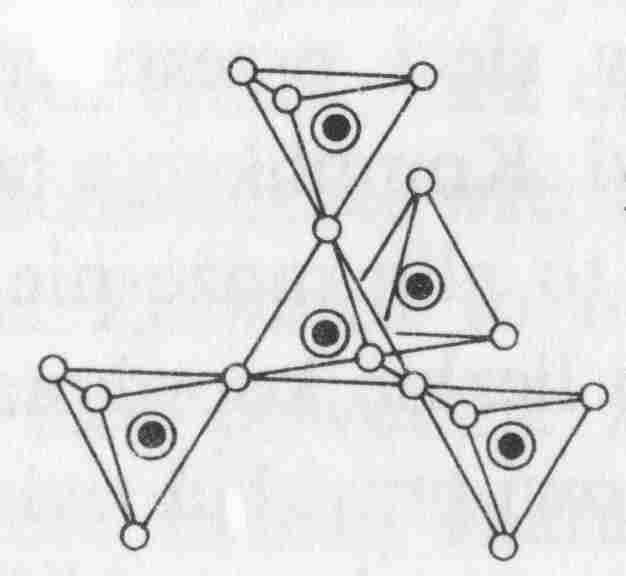
Krzemiany te charakteryzują się najwyższym stopniem kondensacji anionów [SiO4]4-, która prowadzi do utworzenia trójwymiarowych anionów przestrzennych o stosunku Si:O = 1:2.
Większość krzemianów szkieletowych stanowią glinokrzemiany, które zbudowane są z anionów [(Al,Si)xO2x]-n. Częściowe zastąpienie krzemu (Si4+) przez glin (Al3+) w niektórych tetraedrach powoduje pojawienie się dodatkowego ładunku ujemnego, który jest kompensowany przez duże kationy, takie jak Na, K, Ca i inne.
Grupa krzemianów szkieletowych obejmuje minerały występujące we wszystkich grupach skał. Są one również istotnymi komponentami materiału glebowego.
Przedstawicielami są najbardziej rozpowszechnione w skorupie ziemskiej minerały skałotwórcze - skalenie, z których najbardziej znany jest kwarc SiO2
Do krzemianów szkieletowych należą również opal, ortoklaz, plagioklazy, leucyt, nefelin, lazuryt, zeolity, natrolit, heulandyt.
Wyszukiwarka
Podobne podstrony:
Zeolity, ☆──══♦ஓ♦══──☆ MATURA, ■ Matura Chemia, Referaty i Opracowania
Chemia - Zanieczyszczenia litosfery referat, Liceum Matura, Chemia, Chemia(1)
2004-12-01 - odp, Matura, matura, Chemia - Matura, Chemia - matura testy
alkohole - zadania, Matura, Chemia, zadania z organicznej
Chemia - sód, Liceum Matura, Chemia, Chemia(1)
MOL, Matura chemia
Chemia - Mol i masa molowa, Liceum Matura, Chemia, Chemia(1)
Chemia - Krzem wypracowanie, Liceum Matura, Chemia, Chemia(1)
standarty wymagań, Matura, Chemia
Chemia - krzem, Liceum Matura, Chemia, Chemia(1)
Chemia - Wodorotlenki, Liceum Matura, Chemia, Chemia(1)
2006-11-02 - odp, Matura, matura, Chemia - Matura, Chemia - matura testy
II etap chemia zad, matura, chemia arkusze
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
Chemia podstawy 1, Chemia, Chemia arkusze maturalne, Chemia
Chemia - zanieczyszczenia litosfery, Liceum Matura, Chemia, Chemia(1)
więcej podobnych podstron