WYKŁAD 7
18.10.2009r
UKŁADY WIELOFAZOWE (NIEJEDNORODNE, HETEROGENICZNE) - KOLOIDY
FAZA TERMODYNAMICZNA - jednolita część układu fizycznego oddzielona od innych
powierzchniami międzyfazowymi, zwanymi granicami faz, na których zachodzi skokowa zmiana właściwości:
I faza II faza
Zwarta rozproszona
Ciągła nieciągła
Zewnętrzna wewnętrzna
Ośrodek faza
dyspersyjny zdyspergowana
III granica faz
powierzchnia międzyfazowa = powierzchnia graniczna
Otrzymywanie:
- z roztworów - kondensacja cząstek:
Zmniejszenie rozpuszczalności fazy wewnętrznej, polegające na przeniesieniu substancji z ośrodka, w którym jest dobrze rozpuszczalna i tworzy roztwór właściwy, do ośrodka
w którym jest praktycznie nierozpuszczalna. W ten sposób można otrzymać koloidalne roztwory siarki, czy kalafonii w wodzie wprowadzając ich nasycone alkoholowe roztwory do wody;Reakcje chemiczne takie jak:
Redox Na2S2O3 + H2SO4 → Skoloid + Na2SO4 + SO2 + H2O
Wymiana AgNO3 + KI → AgIkoloid + KNO3
Hydroliza FeCl3 + 3HOH≈100°C ↔ Fe(OH)3koloid + 3HCl
Polimeryzacja,
Zarodnikowanie,
Rozpuszczanie np. koloidalny roztwór mydła, czy kleju stolarskiego w wodzie,
- z zawiesin - dyspersja cząstek:
Metoda mechaniczna - rozdrabnianie cząstek zawiesin w specjalnych młynach koloidalnych o bardzo dużej liczbie obrotów
Metoda termiczna - rozpylanie wysokotemperaturowe
Metoda elektryczna - rozpylanie zawiesin w elektrycznym łuku Volty; metoda Brediga dotyczy w szczególności czystych metali i ich tlenków oraz otrzymywania koloidalnego grafitu
Metoda ultradźwiękowa - wykorzystująca drgania akustyczne o częstotliwości rzędu 20 MHz; metodą tą można otrzymać z zawiesin m.in. zole barwników, krochmalu czy gipsu
Przez zastosowanie peptyzatorów, czyli substancji o silnych właściwościach adsorpcyjnych rozdzielających zbite cząstki koloidalne
PODZIAŁ
BUDOWA FAZY ZDYSPERGOWANEJ:
Cząsteczkowa - pojedyncze makrocząstki składające się z tysięcy atomów - hemoglobina, polimery - koloidy liofilowe
Fazowa - małe kryształy - otrzymywane przez rozdrobnienie większych cząstek lub reakcje strącania z roztworów - AgI, AgCl, koloidy wodorotlenków metali - koloidy liofobowe
Micelarna - MICELE - po przekroczeniu pewnego stężenia, samorzutne skupianie się dużej liczby cząstek w agregaty
Roztwory mydeł i detergentów - koloidy asocjacyjne
ZJAWISKA CHARAKTERYSTYCZNE
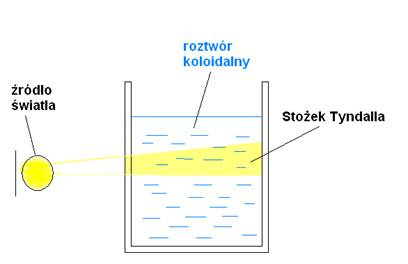
EFEKT TYNDALLA
- (1893r) zjawisko fizyczne polegające na rozproszeniu światła przez koloid z wytworzeniem charakterystycznego stożka świetlnego:
STOŻEK TYNDALLA
SOLWATACJA
SOLWATACJA - proces otaczania cząstek fazy wewnętrznej koloidu przez cząsteczki fazy
zewnętrznej (rozpuszczalnika)
Solwatacja występuje zwykle w rozpuszczalnikach silnie polarnych zwłaszcza, gdy rozpuszczany związek też ma silne właściwości polarne lub posiada wiązania jonowe.
Rozpuszczalnik ma tendencję w takich przypadkach tworzyć dość trwałą otoczkę
o grubości dochodzącej do 4-5 cząsteczek wokół cząsteczki rozpuszczonego związku.
Otoczka solwatacyjna powstaje wskutek słabych oddziaływań elektrostatycznych. Otoczka solwatacyjna może stanowić dużą przeszkodę spowalniającą reakcje chemiczne.
Z drugiej strony zjawisko solwatacji jest często wstępem do procesu dysocjacji elektrolitycznej w roztworach (zapoczątkowanie reakcji wiązania spoiw budowlanych).
PODSTAWOWE UKŁADY
Podstawowe układy koloidalne:
Zol
Żel
Emulsja
Piana
ZOL
- układ, w którym fazy: rozproszona i rozpraszająca są w różnych stanach skupienia
Ośrodek rozpraszający: gaz - gazozole (np. mgła, chmury, dym, kurz)
ciecz - lizole (np. roztwory białek, dyspensje metali i tlenków
metali)
ciało stałe - zole stałe, dirozole (np. szkła kolorowe i mleczne,
ametyst,rubin)
- zole liofobowe - brak powinowactwa międzyfazowego - cząstki koloidalne (agregaty cząsteczek) utrzymują się w stanie wielkiego rozdrobnienia dzięki elektrostatycznemu odpychaniu się jednoimiennych ładunków elektrycznych znajdujących się na ich powierzchni
- zole liofilowe - wyraźne powinowactwo międzyfazowe - cząstki koloidalne (makrocząstki) mają na swojej powierzchni zaadsorbowane cząstki fazy rozpraszającej, tzw. otoczkę solwatacyjną.
POWINOWACTWO FAZ
WŁAŚCIWOŚCI |
ZOL LIOFOBOWY |
ZOL LIOFILOWY |
Otrzymywanie |
Dyspersja lub kondensacja |
Także zwykłe rozpuszczanie |
Struktura |
Agregaty cząstek |
Makrocząstki |
Stężenie fazy rozproszonej |
Małe |
Może być duże |
Solwatacja |
Nie wykazują |
Wykazują |
Granica faz |
Wyraźna |
Niewyraźna |
Ruchy Browna |
Wyraźne |
Niewyraźne, słabe |
Efekt Tyndalla |
Wyraźny |
Niewyraźny, słaby |
Barwa układu |
Często barwne (opalescencja) |
Zwykle bezbarwne |
Lepkość |
Nieznaczna |
Znaczna |
Napięcie powierzchniowe |
Niewielka różnica między napięciem powierzchniowym faz |
Wyraźna różnica na styku faz, ułatwienie zwilżania |
Pęcznienie |
Nie pęcznieją |
Pęcznieją, zwiększając objętość |
Tworzenie piany |
Nie tworzą |
Łatwo tworzą |
Tworzenie galaret |
Nie tworzą |
Łatwo tworzą |
Ładunek elektryczny |
Cząsteczki zawsze naładowane |
Słaby lub brak ładunku |
Wrażliwość na działanie elektrolitu |
Duża |
Niewielka |
Charakter koagulacji |
Nieodwracalna |
Odwracalna |
Warunek trwałości |
Zachowanie ładunku elektrycznego na pow. fazy wewnętrznej |
Zachowanie warunków solwatacji |
ŻEL
- układ, będący efektem koagulacji zolu
Konsystencja: galaretowata lub żel sztywny
Powstawanie: tworzenie w całej objętości struktury przestrzennej uniemożliwiające swobodne przemieszczanie się cząsteczek fazy rozpraszającej
Przykłady:
Żel : galarety
Żel stały (ksero żel) : plastyfikat PCV, skóra
KOAGULACJA KOLOIDÓW
Czynniki wywołujące koagulację/dekantację (rozwarstwienie, zniszczenie) koloidów:
Ogrzewanie
Zmiana pH
Dodanie elektrolitu lub wprowadzenie zolu o odmiennym znaku ładunku elektrycznego
Działanie mechaniczne (mieszanie, wstrząsanie, działanie ultradźwiękami)
Zachodząca reakcja chemiczna prowadząca do łączenia się cząstek fazy rozproszonej
Naświetlanie radiochemiczne (np. promieniowanie β powoduje koagulację zoli dodatnich)
Dehydratacja lub de solwatacja przez dodanie środków odwadniających (np. alkoholu lub acetonu)
Odparowanie lub wymrażanie ośrodka dyspersyjnego
FLOKULACJA
FLOKULACJA - proces, w którym drobne ziarna zdyspergowane w wodzie lub innej cieczy, ulegają agregacji pod wpływem związku wiążącego, zwanego flokulantem.
O możliwości zachodzenia flokulacji decyduje zdolność adsorpcji flokulanta na powierzchni cząstek koloidalnych.
Powstałe agregaty (flokuły) mają wielkości charakterystyczne dla zawiesin → ulegają sedymentacji (opadaniu pod wpływem siły grawitacji).
OCZYSZCZANIE KOLOIDÓW
Metody oczyszczania koloidów z zanieczyszczeń wywołujących koagulację koloidów:
Dializa (elektrodializa) - wymuszenia przenikania zanieczyszczeń zoli przez błony półprzepuszczalne, na których pozostają większe cząstki koloidów
Dializa - przenikanie jest wynikiem osmozy
Elektrodializa - przenikane jest wymuszane działaniem silnego pola elektrycznego
Filtracja (ultrafiltracja) - ultra sączenie zolu przez sączki lub sita o oczkach zbliżonych do wymiarów pojedynczych cząstek koloidalnych wywołane zmniejszonym ciśnieniem
w środowisku koloidu. O procesie tym czasem mówi się jako o odwróconej osmozieElektrodekantacja - połączenie elektrodializy i dekantacji polegająca na oddekantowaniu (zlaniu) roztworu elektrolitów zanieczyszczających koloid znad powierzchni zawierającej zagęszczony, wskutek elektrodializy, roztwór zolu; czynności elektrodializy i dekantacji powtarza się aż do uzyskania czystego od zanieczyszczeń koloidu
Adsorpcja wymienna na jonitach
EMULSJE
- zdyspergowana mieszanina dwóch wzajemnie nierozpuszczalnych w sobie substancji,
z których przynajmniej jedna jest cieczą i w której występują micele. Micele emulsji
w warstwie wewnętrznej zawierają cząstki fazy rozproszonej, w której znajduje się otoczka solwatacyjna składająca się z fazy rozpraszającej lub emulgatora stabilizującego powstałą emulsję.
DWUFAZOWE UKŁADY CIECZY
EMULGOWANIE DEMULOWANIE
=
BODŹCE MECHANICZNE
+
OBNIŻENIE NAPIĘCIA
POWIERZCHNIOWEGO
O < W W < O
INWERSJA
EMULSJI
O / W W / O
Trwałość emulsji zapewnia:
Napięcie międzyfazowe < 10-4 J/m2 - układ termodynamicznie trwały
Różnica gęstości faz (im Δd ↓, tym emulsja trwalsza)
Lepkość fazy ciągłej (im ηzew ↓, tym emulsja trwalsza)
Średnica cząstek fazy wewnętrznej (im φwew ↓, tym emulsja trwalsza)
Obecność emulgatora (ułatwienie rozdrobnienia fazy wewnętrznej)
Obecność stabilizatora
Obecność koloidu ochronnego
Stosunek objętościowy cieczy:
Do 26% o trwałości decyduje ciecz, której jest mniej
30 - 50 % o trwałości decyduje emulgator
Przykłady
Spożywcze: mleko, śmietana, masło, majonez
Farmaceutyczne: mleczka i kremy lecznicze
Kosmetyczne: mleczka i kremy kosmetyczne
Budowlane:
Farby emulsyjne, farby dyspersyjne
Wodorozcieńczalne emulsje bitumiczne
Hydrofobiezujące emulsje silikonowo - siloksanowe
Stałe: kwarc mleczny, opal
PIANA
- układ, w którym faza gazowa jest rozproszona w cieczy lub ciele stałym
Ośrodek rozpraszający: ciecz - piana ciekła
ciało stałe - piana stała
powstawaniu pian sprzyja obecność środków powierzchniowo czynnych obniżających napięcie powierzchniowe, a w przypadku cieczy również zwiększających lepkość, tzw. poroforów. Obecność środków powierzchniowo czynnych zapobiega koalescencji prowadzącej do opadania piany.
Przykłady
Piana ciekła: piana mydlana
Piana stała: pumeks, szkło piankowe, kamień cementowy, tworzywa mikroporowate
TIKSOTROPIA - ODWRACALNA PRZEMIANA ŻELU W ZOL POD WPŁYWEM BODZCÓW MECHANICZNYCH
TIKSOTROPIA - (pamięć cieczy) - właściwość niektórych rodzajów płynów, w których występuje zależność lepkości od czasu działania sił ścinających, które na ten płyn działały - zjawisko odwracalne
Przyczyny na poziomie molekularnym:
Przejście żelu w zol wskutek działania sił ścinających
Zmiana kształtu i charakteru drobin tworzących mieszaninę np: mechaniczne rozbicie micel tworzących emulsję
Porządkowanie się cząsteczek wzdłuż kierunku działania sił ścinających - w stopach
i roztworach polimerów
Korzystna tiksotropia:
Przy budowie ścianek szczelinowych
Przy wbijaniu pali fundamentowych
Odpowiednie wykorzystanie farb emulsyjnych do malowania ścian pionowych oraz sufitów (dodatkiem tiksotropującym jest krzemionka koloidalna)
W technologii płaczek wiertniczych
Szkodliwa tiksotropia:
W gruntoznawstwie w przypadku iłów - częste zapadanie się podłoża w sąsiedztwie maszyn wytwarzających wibracje (np. przenośników taśmowych) lub w miejscach
o dużych zmianach obciążenia gruntu (np. nagły wjazd ciężkiego pojazdu na podporę mostu, wbijanie pali w podłoże)
REOPEKCJA (antytiksotropia) - właściwość niektórych płynów nienewtonowskich do tworzenia struktury molekularnej w wyniku oddziaływania zol → żel pod wpływem bodźca mechanicznego.
W praktyce reopekcja oznacza zastyganie substancji (zwiększenie lepkości) w wyniku np. umiarkowanego mieszania, następujące szybciej niż w innych warunkach. Przykład substancji ulegających - zawiesiny gipsu i bentonitu.
DYLATANCJA - właściwość koloidów o budowie izometrycznej - rozluźnienie szczelnego układu cząsteczek wywołane ruchem ośrodka przy działającym obciążeniu układ zwiększa jamistość, a przy tym więźliwość cieczy zewnętrznej wchłoniętej do wnętrza układu - wzrost sztywności. Niekorzystna dylatacja - wzrost gęstości gliny przez uwięzienie dużych ilości wody w rozluźnionej przez obciążenie strukturze gruntu.
PUNKT IZOELEKTRYCZNY - punkt, w którym występuje całkowity zanik składowej dyfuzyjnej podwójnej warstwy elektrycznej, czyli maksymalne stężenie jonu obojnaczego, można zaobserwować max obniżenie lepkości, najmniejszą rozpuszczalność i najmniejsze ciśnienie osmotyczne.
ŁADUNEK ELEKTRYCZNY cząstek koloidalnych jest rezultatem
selektywnej adsorpcji jonów z roztworu na powierzchni cząstki tj. utworzenia warstwy
adsorpcyjnej. Najlepiej adsorbowane są jony wchodzące w skład struktury cząstki koloidalnej
lub takie, których adsorpcja nie narusza ich struktury. Wskutek adsorpcji, na powierzchni
cząstki skupiają się jony dodatnie lub ujemne obecne w roztworze, dzięki czemu cząstka
koloidalna uzyskuje ładunek
-
- +
+
ZWARTE
ROZPROSZONE - EMULSJE
WODA
WODA
OLEJ
OLEJ
………………………………………………………………………………………….
…………………………………………………………………………………….
Wyszukiwarka
Podobne podstrony:
wyklad 1 2, PK, CHM -Chemia budowlana, chemia wyklady
wyklad 6, PK, CHM -Chemia budowlana, chemia wyklady
test chemia2, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
Zagadnienia Chemia, PK, CHM -Chemia budowlana, chemia e-mail
korozja bet, PK, CHM -Chemia budowlana, chemiaa
Test z CHEMII, PK, CHM -Chemia budowlana, chemia-internet
Matryca to, PK, CHM -Chemia budowlana, chemia EGZAMIN
sciaga chemia 1, PK, CHM -Chemia budowlana, chemia EGZAMIN
test chemia3, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
sciaga chemia, PK, CHM -Chemia budowlana, chemia EGZAMIN
Tabelka2, PK, CHM -Chemia budowlana, chemia-internet
KOLOID, PK, CHM -Chemia budowlana, chemia e-mail
ROZTWORY I KOLOIDY, PK, CHM -Chemia budowlana, chemia e-mail
test chemia2, PK, CHM -Chemia budowlana, marcin, Chemia Budowlana, fwd sciagi chemia
Zagadnienia Chemia, PK, CHM -Chemia budowlana, chemia e-mail
więcej podobnych podstron