Zadania do tematu 1
Obliczanie pH i pOH w roztworach mocnych kwasów i zasad. Iloczyn jonowy wody. Siła jonowa, aktywność i współczynnik aktywności. Stała i stopień dysocjacji elektrolitycznej.
1,2,3,5,8/130; 10,11,13,14,16/131;17,18,19,20,21,22/132
5/131
V1 = 100 cm3, c1 = 0,015 M NaCl, I1 = ?, a1(Na+) = ?
VH2O = 400 cm3
V2 = V1 + VH2O = 500 cm3, c2 = V1c1/V2 = 0,015/5 = 0,0030 M NaCl, I2 = ?, a2(Na+) = ?
ai = yici
[Na+]1 = 0,015 M, I1 = 0,015 M
[Na+]2 = 0,0030 M, I = 0,0030 M
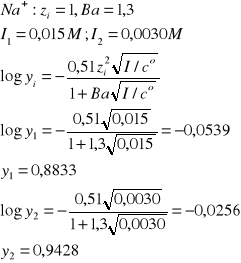
![]()
8*/131
I = 1B, pKw = 13,73 w T = 298 K
pKw = pcH + pcOH; [H+] = 10-pcH ·co
pcOH = 2,93, pcH = 13,73 - 2,93 = 10,80;
[H+] = 1.6·10-11 mol/dm3pcOH = 5,18, pcH = 13,73 - 5,18 = 8,55;
[H+] = 2,8·10-9 mol/dm3pcOH = 8,63, pcH = 13,73 - 8,63 = 5,10;
[H+] = 7,9·10-6 mol/dm3pcOH = 12,85, pcH = 13,73 - 12,85 = 0,88;
[H+] = 1,3·10-1 mol/dm3
10/131
Zmieszano roztwory NaOH i NaCl. W uzyskanym roztworze mamy dwa elektrolity mocne:
NaOH→Na+ + OH- (1)
NaCl→ Na+ + Cl- (2)
W roztworze tym stężenie jonów Na+ jest sumą stężeń obydwu elektrolitów, a stężenie jonów Cl- jest równe stężeniu NaCl:
[Na+] = cNaOH + cNaCl; [Cl-] = cNaCl
Obliczyć pcH tego roztworu, jeśli I = 2D oraz pcNa = 2,15; pcCl = 2,75
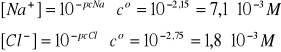
}Obliczone stężenia - dwie cyfry znaczące!
cNaOH = [Na+] - cNaCl = 7,1∙10-3 - 1,8∙10-3 = 5,3∙10-3 mol/dm3
[OH-] = cNaOH = 5,3∙10-3 mol/dm3
pcOH = 2,28
pKw = 13,88, pcH = pKw - pcOH = 13,88 - 2,88 = 11,60
13/131
Zmieszano
V1 = 275 cm3 HNO3, c1 = 0,050 mol/dm3
V2 = 325 cm3 HCl, c2 = 0,010 mol/dm3
Uzyskany roztwór zawiera dwa mocne kwasy jednozasadowe typu HX. Obliczamy sumę ich liczności:
![]()
Obydwa kwasy reagują z dodanym KOH:
HX + KOH = KX + H2O
mKOH = 5,61g
MKOH = 56,11g/mol
![]()
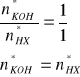
Początkowa liczność KOH jest około sześć rany większa niż sumaryczna liczność obydwu kwasów, zatem obydwa kwasy zostaną zobojętnione, a w roztworze po reakcji pozostanie nadmiar nieprzereagowanego KOH. Zatem:
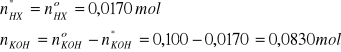
I = 3A, pKw = 14,20, pcH = ?
Obliczamy stężenie KOH w roztworze po reakcji, zakładając addytywność objętości:
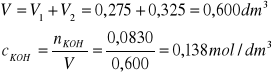
pcOH = 0,86
pcH = pKw - pcOH = 14,20 - 0,86 = 13,34
14/131
V1 = 50 cm3 KOH, pcH1 = 10,78
VNaClO4 = ?, ΔpcH = 0,38
Dodany roztwór NaClO4 nie zawiera KOH, zatem wyjściowy roztwór KOH jest rozcieńczany, w wyniku czego pcH maleje o 0,38 jednostki.
V2 = V1 + VNaClO4 , pcH2 = pcH1 - 0,38 = 10,40
I = 3A, pKw = 14,20
pcOH = pKw - pcH; [OH-] = 10-pcOH ∙co
pcOH1 = 3,42, [OH-]1 = 3,8∙10-4 mol/dm3
pcOH2 = 3,80, [OH-]2 = 1,6∙10-4 mol/dm3
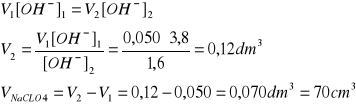
18/132
Kwas octowy, CH3COOH, dalej oznaczony jako HA
cHA = 0,020 mol/dm3, pcH = 3,13
HA ↔ H+ + A-
[H+] = 10-pcH ∙ co = 10-3,13∙ co = 7,4∙10-4 mol/dm3
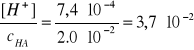
α = 3,7%
20/132
Kwas cyjanowodorowy, HCN, dalej oznaczony jako HA
cHA = 1,66 mol/m3 = 1,66∙10-3 kmol/m3
I = 2A, pKa = 8,52, Ka = 3,02∙10-9
HA ↔ H+ + A-
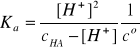
Założenie: cHA>>[H+]
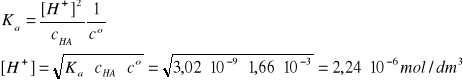
Założenie jest świetnie spełnione, bowiem cHA jest 741 razy większe od [H+].
pcH = - log[H+]/co = 6 - log 2,24 = 5,65
21/132
Roztwór NH3: p[%]NH3 = 2,7%, d = 1,15 g/cm3
MNH3 = 17,03 g/mol
V ≡ 1dm3 = 1000 cm3
![]()
Przyjmujemy, że NH3 w wodzie daje NH4OH, przy czym cNH3 = cNH4OH.
NH4OH ↔ NH4+ + OH-
I = 2A, pKb = 4,40, Kb = 3,98∙10-5, pKw = 13,97
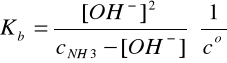
Założenie: cNH3 >>[OH-]
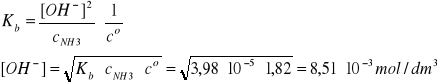
![]()
Założenie jest b. dobrze spełnione, ponieważ cNH3 jest 214 razy większe od [OH-].
pcOH = -log [OH-]/co = 3 - log 8,51 = 2,07
pcH = pKw - pcOH = 13,97 - 2,07 = 11,90
22/131
HCOOH↔H+ + HCOO-, ogólnie HA ↔ H+ + A-
I = 3A, pKa = 3,90 w T = 298 K; Ka = 1,26·10-4 (trzy cyfry znaczące)
p[%]HA = ?, Vr ≡ 1dm3, dr = 1,22 g/cm3, pcH = 1,79
[H+] = 10-pcH ∙co = 0,0162 mol/dm3 (trzy cyfry znaczące)
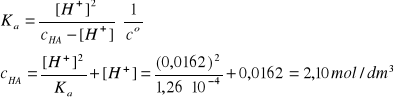
nHA = Vr∙cHA = 2,10 mol, MHCOOH = 46,03 g/mol
mHA = 2,10∙46,03 = 96,7 g
p[%]HA = 100∙mHA/mr = 100∙mHA/Vr∙dr = 100∙96,7/1220 = 7,9% (dwie cyfry znaczące)
23*/132
A - kwas solny
HCl→H+ + Cl-, pcH1 = 4,26,
pcH = -log[H+]/co = -logcHCl/co; cHCl = 10-pcH ·co = 5,50·10-5 mol/dm3
R = 25, c'HCl = cHCl/R = 2,20·10-6 mol/dm3
pcH2 = - log c'HCl/co = 5,65
B - kwas cyjanowodorowy
HCN↔H+ + CN-, pcH1 = 4,26
I = 2A, pKa = 8,52; Ka = 3,02·10-9
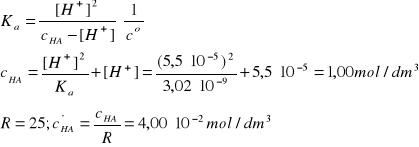
Założenie: c'HA>>[H+]'
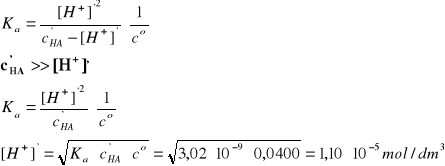
Założenie jest znakomicie spełnione, c'HA jest 3636 razy większe od [H+]'.
pcH2 = -log [H+]'/co = 4,96
28*/132
HClO2 ↔ H+ + ClO2-
I = 1A, pKa = 1,61 w T = 298 K, Ka =2,45·10-2
α = 46,0% czyli 0,460
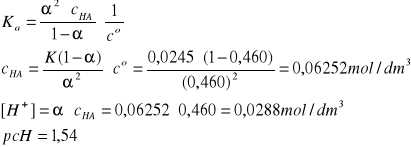
29*/132
HN3 ↔H+ + N3-
I = 3A, pKa = 4,78 w T = 298 K, Ka = 1,66·10-5
R1: V1 = 100 cm3, c1 = 0,10 M HN3
R2: V2 = 100 cm3 HN3 o pcH = 2,69
[H+]2 = 2,04·10-3 mol/dm3 (trzy cyfry znaczące)
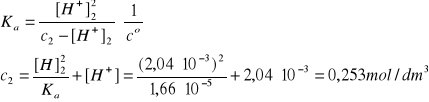
R3: Zakładamy addytywność objętości V3 = V1 + V2 = 0,200 dm3.
Obliczamy liczność kwasu azotowodorowego w uzyskanym roztworze:
nHN3 = V1c1 + V2c2 = 0,100·0,10 + 0,100·0,253 = 0,0353 mol
c3 = nHN3/V3 = 0,0351/0,200 = 0,176 mol/dm3
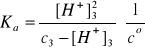
Założenie: c3 >> [H+]3; [H+]3 = (Kac3)1/2 = 1,71·10-3 mol/dm3
Powyższe założenie jest spełnione, c3 jest 103 razy większe od [H+]3. Zatem: α = [H+]3/c3 = 0,0097 lub 0,97%.
Wyszukiwarka
Podobne podstrony:
Zadania do tematu 3, PWr, chemia nieorganiczna ćwiczenia
Zadania do tematu 2, PWr, chemia nieorganiczna ćwiczenia
Zadania do tematu 4, PWr, chemia nieorganiczna ćwiczenia
Wyklad 3, PWr, chemia nieorganiczna ćwiczenia
Rozwiązania zadań - temat 11, PWr, chemia nieorganiczna ćwiczenia
Rozwiązania zadań -t. 6, PWr, chemia nieorganiczna ćwiczenia
Wyklad 5, PWr, chemia nieorganiczna ćwiczenia
Wyklad 10, PWr, chemia nieorganiczna ćwiczenia
chemia nieorganiczna ćwiczenia
zadania do tematu rynek, mikroekonomia
zadania do pierwszego kolokwium, Surowce nieorganiczne
chemia nieorganiczna ćwiczenia
aniony, farmacja I i II, chemia nieorganiczna, ćwiczenia
Zadania rachunkowe do tematu kwasy i zasady, Farmacja, Chemia ogólna i nieorganiczna
więcej podobnych podstron