Mała wielka cząstka
Niewiele jest wydarzeń, które w podobnym stopniu, co odkrycie elektronu, wpłynęły na rozwój naszej cywilizacji.
Za odkrywcę elektronu uważa się Josepha Johna Thomsona (18561940), wielkiego uczonego, laureata Nagrody Nobla, nauczyciela i wychowawcę wielu innych wybitnych fizyków, człowieka, który zapewnił Anglii priorytet w dziedzinie badań fizycznych na początku tego wieku1.
Odkrycie elektronu było rezultatem badań prowadzonych przez prawie 50 lat przez wielu uczonych nad zjawiskami przepływu prądu elektrycznego przez rozrzedzone gazy. Oprócz świecenia gazu w rurce (stąd biorą swój początek dzisiejsze neony) zaobserwowano również świecenie szkła naprzeciwko ujemnej elektrody, co uważano za efekt oddziaływania wychodzących z niej „promieni katodowych". Właśnie na tych promieniach skupiła się uwaga badaczy. Jedni, wśród nich głównie fizycy niemieccy, uważali je za pewnego rodzaju fale, inni (głównie fizycy angielscy) uważali je za cząstki niosące ujemny ładunek elektryczny.
Jednym z pierwszych badaczy promieni katodowych był brytyjski fizyk i chemik William Crookes (18321919), który w latach sześćdziesiątych ubiegłego stulecia przeprowadził wiele pomysłowych doświadczeń. Jedno z nich ilustruje rysunek z jego książki (ryc. 1). W ten sposób przekonano się, że promienie katodowe przenoszą pęd. Doświadczenie z krzyżem rzucającym ostro zarysowany cień (ryc. 2) świadczyło o prostoliniowym rozchodzeniu się tych promieni, a doświadczenie z topieniem substancji pod wpływem ich skoncentrowanej wiązki o tym, iż niosą ze sobą znaczną energię (ryc. 3).
Ryc. 1. Rurka wyładowcza Crookesa ilustrująca pęd promieni katodowych. Katoda a ma tu kształt czaszy kulistej, dzięki czemu promienie skupiają się w jednym punkcie (wiedziano już, że rozchodzą się one prostopadle do katody). Normalnie ekran c zatrzymuje promienie, lecz magnes g odchyla je tak, że, przechodząc nad ekranem, uderzają w skrzydełka wiatraczka e-f, który zaczyna się obracać. Gdy magnes odwrócić o 1800, promienie przechodzą pod ekranem c i wiatraczek obraca się w przeciwnym kierunku. W ten sposób przekonano się, że promienie katodowe przenoszą pęd
W wyścigu do poznania istoty promieni katodowych J.J. Thomson dysponował dwoma atutami: znał doskonale teorię oddziaływań elektromagnetycznych, potrafił dobrze zaplanować eksperyment i miał ulepszone pompy próżniowe pozwalające przeprowadzić doświadczenia z wyładowaniami elektrycznymi w bardziej rozrzedzonych gazach. Dzięki temu udało mu się nie tylko zmierzyć odchylenie promieni katodowych w polu magnetycznym (ten efekt był znany od dawna dzięki pracom Juliusa Plückera z 1858 roku), ale także ujawnić odchylenie w polu elektrycznym, a poprzez kompensację tych odchyleń zmierzyć stosunek masy do ładunku tych nieznanych cząstek; korpuskuł jak je nazywał. Thomson udowodnił również, że ten stosunek jest zawsze taki sam, niezależnie od użytego gazu i materiału katody. Jego odkrycie polegało w gruncie rzeczy na śmiałej konkluzji, iż mamy tu do czynienia z cząstkami będącymi składnikami wszystkich atomów, ujemnie naładowanymi i bardzo lekkimi w porównaniu z najlżejszym z atomów atomem wodoru. Tak Thomson udowodnił zarazem złożoną budowę atomu [ramka na s. 40] i odkrył elektron jako elementarną cząstkę, zapoczątkowując tym samym fizykę atomową i elektronikę.
Odkrycia Thomsona szybko zostały docenione przez międzynarodową społeczność uczonych i przyniosły mu liczne zaszczyty. Został uhonorowany tytułami doktora honoris causa przez różne uniwersytety, m.in. przez Uniwersytet Jagielloński podczas odbywających się w 1900 roku uroczystości 500-lecia odnowienia tej uczelni. W Księdze Pamiątkowej wydanej z okazji tego jubileuszu znajdujemy informację, że Józef Jan Thomson, profesor Uniwersytetu w Cambridge, otrzymał tytuł doktora honoris causa z filozofii za to, że objaśnił nowemi spostrzeżeniami ruch fluidów i szereg zjawisk termodynamicznych, za pomocą zdumiewających doświadczeń odkrył jonizm materii. Senat UJ dokonał trafnego wyboru; kilka lat później, w 1906 roku Joseph John Thomson otrzymał Nagrodę Nobla za badania nad wyładowaniami elektrycznymi w 
gazach.
Ryc. 2. Rurka wyładowcza Crookesa ilustrująca prostoliniowe rozchodzenie się promieni katodowych. Katoda a znajduje się po prawej stronie. Na drodze promieni katodowych umieszczono blaszany krzyż b, którego ostro zarysowany cień d widoczny jest na przeciwległej ściance w obszarze szkła świecącego pod wpływem tych promieni
Wspomniałem już, że Thomson odkryte przez siebie cząstki nazywał jeszcze przez wiele lat korpuskułami. Co prawda, termin elektron wprowadził George Johnstone Stoney w 1891 roku jako nazwę dla jednostkowego ładunku przenoszonego w procesach elektrochemicznych, ale dopiero po kilkunastu latach zaczęto go używać w dzisiejszym znaczeniu. Hipoteza Thomsona, że promienie katodowe są cząstkami składowymi atomu, nie zostałaby zapewne tak szybko przyjęta, gdyby nie prace dwóch holenderskich fizyków Pietera Zeemana i Hendrika Antoona Lorentza. Pierwszy z nich odkrył w 1896 roku, że linie spektralne gazów pobudzanych do świecenia w silnym polu magnetycznym ulegają rozszczepieniu (dziś nazywamy to efektem
Zeemana). Drugi, teoretyk, wyjaśnił, że takiego rozszczepienia można oczekiwać, jeśli przyjąć, że światło jest wynikiem ruchu (drgania) naładowanych cząstek znajdujących się w atomie.
Lorentz użył danych Zeemana, aby określić stosunek masy do ładunku tych cząstek i znalazł taką samą wartość, jaką rok później uzyskał Thomson w swoich doświadczeniach z promieniami katodowymi. Ta zbieżność wyników przekonała sceptyków, że ujemnie naładowane korpuskuły Thomsona są nie tylko tożsame z budzącymi tyle kontrowersji promieniami katodowymi oraz nie powstają w rurze wyładowczej w jakimś nadal tajemniczym procesie (jak niektórzy przypuszczali), lecz są składnikiem wszystkich atomów.
Pamiętajmy, iż natura elektryczności, mimo wielu znanych już jej cech, nie była jeszcze wówczas wyjaśniona. Wielki James Clerk Maxwell niechętnie odnosił się do idei istnienia jakichś „atomów elektryczności", czyli elementarnych ładunków, wolał pola oraz przepływający elektryczny fluid. A w Cambridge opowiadano sobie wtedy anegdotę o tym, jak pewnego studenta na egzaminie zapytano o naturę elektryczności. Ten zaczął się jąkać, po czym wyznał, że zapomniał. Co za szkoda, co za szkoda? powiedział jeden z egzaminatorów. Mamy tu człowieka, który już wiedział, jaka jest natura elektryczności, ale zapomniał.
W następnych latach Thomson wykonał jeszcze wiele dodatkowych doświadczeń, by określić stosunek masy do ładunku cząstek emitowanych z ciał stałych pod wpływem oświetlenia (efekt fotoelektryczny, odkryty przez Heinricha Hertza w 1887 roku) lub ogrzania do wysokiej temperatury (termoemisja, badana później dokładnie przez Owena Richardsona). Pomiary stosunku masy do ładunku dawały, w granicach błędu doświadczalnego, te same wartości, co dla promieni katodowych. W ten sposób potwierdził identyczność cząstek, które zaczęto nazywać elektronami i uznano za element budowy atomu.
Jednak zarówno Thomson, jak inni fizycy końca XIX wieku, którzy uznali korpuskuły Thomsona (elektrony) za cząstki będące składnikami atomu, napotkali nieprzezwyciężone trudności, próbując zrozumieć na gruncie fizyki klasycznej, jak te ujemnie naładowane cząstki koegzystują w atomie z czymś naładowanym dodatnio, bo przecież atomy są elektrycznie obojętne. Zaproponowano model atomu (lord Kelvin w 1902 roku) przypominający ciasto z rodzynkami: elektrony, jak rodzynki w cieście, rozmieszczone były wewnątrz substancji o dodatnim ładunku. Ponieważ poruszające się ze zmienną prędkością ładunki (np. krążące po zamkniętym torze) powinny zgodnie z teorią Maxwella emitować fale elektromagnetyczne (np. światło), sądzono, że w takim atomie, w stanie równowagi, ładunki są nieruchome. Jednak taka statyczna konfiguracja ładunków, zgodnie z tą samą teorią Maxwella, nie mogła być trwała. Trzeba było założyć, iż w atomie działają jakieś inne, nieznane siły utrzymujące ten układ w równowadze.
Przeprowadzone przez Thomsona oszacowania wielkości takiej kuli dodatniego ładunku, która drgając dawałaby częstości obserwowane w liniach widmowych rozgrzanych, świecących gazów, prowadziły do wniosku, że powinna ona mieć promień rzędu
108 cm, co dobrze zgadzało się z rozmiarami atomów wynikającymi z teorii kinetycznej gazów. Wyglądało to zachęcająco, a jednak klasycznego modelu atomu nie udało się pogodzić z doświadczeniem; trzeba było przyjąć, że w świecie atomów rządzą inne niż znane dotychczas prawa fizyki klasycznej, oparte na mechanice Newtona i elektrodynamice Maxwella.
Z licznych prób rozwikłania sprzeczności wyłoniła się po kilku latach fizyka kwantowa, której prawa zdają się często przeczyć naszemu wykształconemu w świecie klasycznych oddziaływań zdrowemu rozsądkowi, ale które zadziwiająco spójnie pozwoliły opisać nie tylko budowę atomów, lecz także siły działające pomiędzy atomami w cząsteczkach i ciałach stałych. Ilustracją paradoksalnej natury fizyki kwantowej może być nieco zabawny fakt, że Nagrody Nobla dostali dwaj Thomsonowie, ojciec i syn. Ojciec za udowodnienie, że elektrony są cząstkami, syn zaś, George Paget Thomson, za udowodnienie, iż są również falami! (Chociaż innego rodzaju niż sądzili w XIX wieku niemieccy fizycy). W latach dwudziestych naszego wieku odkryto inne cechy elektronu, takie jak jego własny moment pędu, a potem inne lekkie cząstki i elektron stał się członkiem rodziny leptonów, do której należą także miony, neutrino i pozyton.
Ryc. 3. Rurka wyładowcza Crookesa ilustrująca przekaz energii przez promienie katodowe. Katoda a ma kształt czaszy kulistej, co powoduje skupianie się promieni w środku bańki, gdzie umieszczono cienką platynową blaszkę b. Po przyłożeniu wysokiego napięcia pomiędzy elektrodami blaszka rozżarza się do białości
Znaczenie odkrycia Thomsona i rolę elektronów w nauce i technice XX wieku trudno przecenić. Poznanie budowy atomu i oddziaływań między atomami dało spójną fizyczną podstawę całej chemii. Elektrony nie tylko decydują o wiązaniach chemicznych, grają zasadniczą rolę w procesach katalitycznych: tych, którym zawdzięczamy życie, i tych decydujących o przebiegu wielu masowych procesów przemysłu chemicznego.
Poznanie praw rządzących emisją elektronów z ciał stałych, otrzymanie wiązek elektronów, którymi łatwo można było w próżni sterować, dało początek lampom radiowym i obrazowym, którym zawdzięczamy radiofonię i telewizję. Potem zrozumiano naturę procesów elektronowych w ciałach stałych, co doprowadziło do wynalazku tranzystora, obwodów scalonych i tego bogactwa urządzeń elektronicznych, jakie nas otacza. Czas pokaże, czy to bogactwo jedynie poszerza nasze ludzkie, ograniczone możliwości, jak sądzą optymiści, czy też jak sądzą pesymiści grozi odczłowieczeniem i globalnymi konfliktami2.
Dziś, gdy w perspektywie widać, z jednej strony, radykalną zmianę technologii, jaką zapowiada nanotechnologia budowanie cząsteczek, materiałów, a nawet całych wyrobów poprzez celowe manipulowanie pojedynczymi atomami, z drugiej zaś niewiarygodne możliwości miniaturyzacji urządzeń elektronicznych, jakie zapowiada technologia kwantowa, gdy widać, jak z nikomu niepotrzebnych prac nad promieniami katodowymi wyrosły dominujące w naszym świecie gałęzie przemysłu, można się jedynie zadumać nad rolą tzw. badań podstawowych (w odróżnieniu od stosowanych, mających wyraźnie określony cel praktyczny), nad relacjami pomiędzy rozwojem nauki i postępem technicznym i nad tym, jaki właściwie jest bilans tego postępu.
Z perspektywy kończącego się stulecia spójrzmy jeszcze raz na przygodę ludzkości z elektronem. Zaczęła się ona, (jeśli nie liczyć doświadczeń starożytnych Greków z „elektronem", czyli naszym bursztynem) od dosyć abstrakcyjnych badań nad wyładowaniami elektrycznymi w gazach. Jak dziś wiemy, jest to złożony proces jonizacji i transportu ładunku, którym zajmuje się obecnie cały obszerny dział fizyki fizyka plazmy mający różnorodne zastosowania techniczne. Ówczesnym badaczom udało się jednak w gąszczu obserwowanych zjawisk wyodrębnić dzięki przemyślanym doświadczeniom te istotne cechy, które doprowadziły do odkrycia elektronu. Jeśli badano wówczas pojedyncze elektrony, to jedynie pośrednio jak w doświadczeniach Roberta Millikana (pomiar ładunku elektronu), czy w komorze Wilsona (tory cząstek beta, które również okazały się elektronami).
O parametrach lamp radiowych i tranzystorów decydowały prawa ruchu strumieni elektronów, w próżni lub ciele stałym. Dopiero od niedawna można eksperymentować z pojedynczymi elektronami, które można zamknąć w ogrodzeniu z atomów na powierzchni kryształu, „oglądać" korzystając ze skaningowego mikroskopu tunelowego i badać własności takich sztucznie stworzonych przez człowieka jednoelektronowych układów SET3. Dziś wydawać się to może jedynie abstrakcyjną zabawą, ale na widnokręgu nauki rysują się już możliwe zastosowania podobnych struktur.
Powstrzymajmy się jednak od prorokowania, które w naszym szybko zmieniającym się świecie jest zajęciem tyleż nęcącym, co zwodniczym. Wystarczy przypomnieć, co w marcowym numerze „Popular Mechanics" z 1949 roku napisał dziennikarz zafascynowany możliwościami pierwszego, dużego, lampowego komputera ENIAC:, Podczas gdy kalkulator, taki jak ENIAC, wyposażony jest w 18 000 lamp i waży 30 ton, to komputery w przyszłości mogą mieć tylko 1000 lamp i ważyć, być może, tylko półtorej tony. Laptop by się uśmiał.
Poszerzanie horyzontów
Ludzie od dawna pragnęli zobaczyć więcej niż jest to możliwe za pomocą zmysłów, w które wyposażyła nas natura. Najpierw poznano działanie soczewek oraz zbudowano pierwsze mikroskopy i teleskopy. Jednak te przyrządy mają ograniczone możliwości, toteż poszukiwano jeszcze potężniejszych. W wielu współcześnie stosowanych urządzeniach poszerzających nasze horyzonty widzenia świata istotną rolę grają elektrony.
LEP
Zlokalizowany w ośrodku badawczym CERN w Szwajcarii, wielki akcelerator służący do badania zderzeń elektronów z pozytonami (LEPLarge Electron-Positron Collider) jest najpotężniejszym urządzeniem badawczym współczesnej fizyki. Potężne są nie tylko energie obowiązek (rzędu 100 GeV), także jego rozmiary: tunel, w którym poruszają się cząstki ma obwód o długości prawie 27 km. LEP przyspiesza elektrony i ich antycząstki, pozytony, poruszające się w przeciwne strony w próżniowej rurze, utrzymywane w niej przez układy elektromagnesów, zanim nie zostaną zmuszone do czołowego zderzenia. Energia wyzwalana podczas ich anihilacji porównywalna jest z istniejącą we Wszechświecie ułamki sekund po Wielkim Wybuchu. Przy analizie produktów zderzeń i testowaniu hipotez teoretycznych spotyka się tu kosmologia (nauka o procesach w bardzo wielkiej skali) z fizyką cząstek elementarnych (nauka o procesach w bardzo małej skali). W badaniach zaangażowanych jest ponad 500 fizyków z 56 uniwersytetów i instytutów badawczych z 22 państw.
TELESKOP HUBBLE'A
Umieszczony na orbicie wokół Ziemi w 1990 roku przez wahadłowiec Discovery teleskop kosmiczny Hubble'a, wyłapując fotony dochodzące do nas z odległych części Wszechświata, dostarcza obrazów odległych galaktyk. Odległych w przestrzeni, ale także, biorąc pod uwagę skończoną prędkość światła, odległych w czasie. Umożliwia, więc nie tylko badanie Wszechświata w rozległej skali, dostarcza też informacji o jego ewolucji. Fotonów tych jest jednak bardzo mało, toteż gdyby nie bardzo czułe detektory oparte na kaskadowym powielaniu elektronów, nie można by z nich utworzyć czytelnych obrazów. Dodatkowo, dzięki wstępnej selekcji energii fotonów teleskop Hubble'a umożliwia tworzenie obrazów wykorzystujących jedynie fotony o określonej energii (światło określonej barwy). Rozszerza to niezwykle możliwości badawcze astronomii, ograniczonej normalnie do wąskiego „okna" w widmie fal elektromagnetycznych przepuszczanych przez atmosferę ziemską.
MIKROSKOP ELEKTRONOWY
Długość fali elektronu, zależna od jego pędu, może być bardzo mała, znacznie mniejsza od rozmiarów atomu. Za pomocą mikroskopu nie możemy dostrzec szczegółów mniejszych od długości fali skupianej przez jego soczewki. To właśnie długość fali świetlnej ograniczała rozdzielczość mikroskopów optycznych. Mikroskopy elektronowe zaczęto budować na początku lat trzydziestych. Zastosowane w biologii, umożliwiły poznanie szczegółów budowy komórek żywych organizmów, struktury bakterii i wirusów, przyczyniając się w znaczącym stopniu do postępu medycyny. Zastosowane do badania struktury metali, minerałów i innych materiałów, stały się niezbędnym narzędziem badawczym w fizyce ciała stałego, inżynierii materiałowej i mineralogii, umożliwiając postęp współczesnej cywilizacji technicznej z jej wyrafinowanymi materiałami konstrukcyjnymi i miniaturyzacją układów elektronicznych. Dziś pozwalają nie tylko „zobaczyć" pojedyncze atomy, ale nawet umieszczać je w określonych miejscach, otwierając drogę do nanotechnologii metod tworzenia cząsteczek, materiałów, a być może, (choć to dziś jeszcze jedynie fantazja) całych urządzeń poprzez budowanie ich wprost z wyjściowych atomów.
Trzy doświadczenia Thomsona
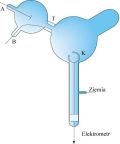
Doświadczenie pierwsze było w zasadzie powtórzeniem doświadczenia Perrina sprzed dwóch lat, w takim jednak układzie eksperymentalnym, który wykluczał postawiony mu zarzut, że ładunek ujemny wcale nie musi być przenoszony przez promienie katodowe, lecz przez coś, co im towarzyszy, tak jak odgłos wystrzału towarzyszy wylatującej kuli.
Dwa współśrodkowe walce z otworami umieszczono w rurce bocznej połączonej z rurą wyładowań. Promienie katodowe od katody A dochodzą do rurki bocznej przez otwór w korku metalowym ściśle przylegającym do szyjki rurki bocznej; ten korek jest połączony z anodą i z ziemią. W ten sposób promienie katodowe przechodzące przez korek T nie wchodzą do wnętrza cylindrów K, o ile nie są odchylone przez magnes.
Cylinder zewnętrzny połączony jest z ziemią, wewnętrzny z elektrometrem. Kiedy promienie katodowe (które zaznaczały swą drogę przez fosforescencję szkła J.K.) nie padały na otwór w cylindrach, ładu nek elektryczny zbierany przez elektrometr, kiedy uruchamiano cewkę indukcyjną wytwarzającą promienie, był mały i nieregularny. Gdy jednak promienie były zaginane przez magnes tak, że padały na otwór, to elektrometr mierzył duży ładunek elektryczności ujemnej... Gdy promienie były tak silnie zaginane przez magnes, że przebiegały poza otworem, to ładunek wchodzący do walca znów spadał do małego ułamka swej wartości poprzedniej... Tak, więc doświadczenie pokazuje, że gdy odchylamy promienie katodowe za pomocą sił magnetycznych, to elektryzacja ujemna jest nieodłącznie z nimi związana.
![]()
Doświadczenie drugie dowodziło odchylania promieni katodowych przez pole elektryczne. Obalało ono pogląd Hertza i Lenarda, że promienie katodowe są falą elektromagnetyczną w eterze (wówczas jeszcze fizycy nie dopuszczali rozchodzenia się fal elektromagnetycznych w próżni, potrzebny był im ośrodek o bardzo dziwnych własnościach, nazywany „eterem").
Hertz przepuszczał promienie pomiędzy dwiema płytami metalowymi, umieszczonymi wewnątrz rurki wyładowczej, lecz stwierdził, że promienie nie były odchylane, kiedy płyty były połączone z baterią akumulatorów. Powtarzając to doświadczenie, otrzymałem na początku ten sam wynik, lecz doświadczenia następne pokazały, że brak odchylenia jest spowodowany przewodnictwem, które nadają rozrzedzonemu gazowi promienie katodowe. Mierząc to przewodnictwo, stwierdzono, iż zmniejsza się bardzo szybko, gdy stopień rozrzedzenia wzrasta; wydawało się, zatem, że powtarzając doświadczenia Hertza przy bardzo silnych rozrzedzeniach, można by mieć dane do wykrycia odchylenia promieni katodowych za pomocą siły elektrostatycznej. Użyty przyrząd jest przedstawiony na rysunku. Promienie idące od katody C przechodzą przez szparę w anodzie A, którą stanowi korek metalowy, szczelnie przylegający do rurki i połączony z ziemią. Po przejściu przez drugą szparę w drugim korku metalowym B, połączonym z ziemią, biegną one pomiędzy dwiema równoległymi płytkami aluminiowymi, które mają około 5 cm długości, 2 cm szerokości i są odległe od siebie o 1.5 cm. Promienie, padając na koniec rurki, wytwarzają wąską fosforyzującą plamkę o ostrych konturach. Skala przyklejona na zewnętrznej stronie rurki służy do mierzenia odchylenia tej plamki. Przy silnych rozrzedzeniach promienie były odchylane, kiedy płytki aluminiowe łączono z biegunami baterii małych akumulatorów... Odchylenie było proporcjonalne do różnicy potencjału pomiędzy płytami i mogłem wykryć odchylenie nawet wtedy, gdy różnica potencjałów była niewiększa od dwu woltów.
Doświadczenie trzecie udowadniało, że cechy promieni katodowych nie zależą od rodzaju gazu wypełniającego rurę ani od materiału katody. Thomson obliczał stosunek masy (m) do ładunku (e) cząstek, które, jak sądził, były promieniami katodowymi. Stosował dwie metody. Pierwsza polegała na określeniu ładunku przenoszonego przez promienie i ich energii kinetycznej, a zarazem na obserwacji odchylenia w polu magnetycznym. Te pomiary prowadzą do dwu równań, w których występują niewiadome m/e i prędkość v. Ta metoda z uwagi na trudności doświadczalne nie dała tak dokładnych wyników jak metoda zrównoważenia odchyleń poprzez jednoczesne stosowanie pola magnetycznego i elektrycznego.
W podsumowaniu Thomson pisał: Z tych wyznaczeń widzimy, że wartość m/e nie zależy od natury gazu i że wartość tego stosunku, bliska 107, jest bardzo mała w porównaniu z wartością 104, która jest najmniejszą wartością tej wielkości, jaką znano poprzednio, a która została znaleziona w przypadku jonu wodorowego w elektrolizie... Mała wartość m/e może zależeć bądź od tego, że m jest małe, bądź od tego, że e jest wielkie, bądź od kombinacji tych dwu przyczyn... Gdyby w bardzo silnym polu elektrycznym w sąsiedztwie katody cząsteczki gazu ulegały dysocjacji, były rozszczepiane nie na zwyczajne atomy chemiczne, lecz na praatomy, które gwoli krótkości będziemy nazywali korpuskułami, i gdyby te korpuskuły były naładowane elektrycznością i wyrzucane od strony katody przez pole elektryczne, to zachowywałyby się dokładnie tak, jak się zachowują promienie katodowe. Dawałyby one oczywiście wartość m/e niezależną od natury gazu i jego ciśnienia, gdyż cząstki niosące ładunek byłyby te same, niezależnie od użytego gazu... Tak, więc, w myśl tego poglądu, mamy w promieniach katodowych materię w nowym stanie, takim, w którym podział materii doprowadzony został nierównie dalej niż w zwykłym stanie lotnym, w stanie, w którym wszelka materia, to jest materia pochodząca z różnych źródeł, takich jak wodór, tlen itp., jest jednego i tego samego rodzaju. Ta materia jest substancją, z której są zbudowane wszystkie pierwiastki chemiczne.
Historia badań nad promieniami katodowymi
b1838 Michael Faraday: pierwsze obserwacje świecenia powietrza w rurze pod obniżonym ciśnieniem pomiędzy elektrodami, do których przykładano napięcie z maszyny elektrostatycznej.
1855 Heinrich Geissler: wynalezienie pompy rtęciowej pozwalającej uzyskiwać znacznie lepszą próżnię.
1858 Julius Plücker: obserwacja zaginania się świecącej wiązki pod wpływem magnesu stałego, obserwacja fosforyzowania szkła w pobliżu katody i zmiany położenia fosforyzacji pod wpływem pola magnetycznego.
18561860 William Crookes: liczne doświadczenia z promieniami katodowymi, m.in. demonstrujące przenoszenie pędu i energii przez promienie katodowe.
1871 C.F. Varley: sugestia, że promienie katodowe to strumień cząstek.
1871 William Crookes: propozycja, że promienie katodowe to naładowane ujemnie cząsteczki odrzucane od katody.
1874 George Johnstone Stoney: oszacowanie ładunku niesionego przez jon wodoru w procesach elektrolitycznych na około 1020 kulomba, zaproponowanie dla niego nazwy „electrine", zmienionej później na „electron".
1876 Eugene Goldstein: wykazanie, że nieznane promieniowanie wychodzi z katody, wprowadzenie terminu „promienie katodowe".
1883 Heinrich Hertz: doświadczenie wykazujące brak odchylenia promieni katodowych pod wpływem pola elektrycznego, błędnie interpretowane jako dowód ich falowej natury.
1886 Eugene Goldstein: obserwacja, że w rurze wyładowczej pojawia się oprócz promieni katodowych również inne promieniowanie biegnące w przeciwnym kierunku przez otwory (kanały) wywiercone w katodzie stąd nazwa „promienie kanalikowe". Później stwierdzono, że są to jony dodatnie.
1890 Arthur Schuster: oszacowanie stosunku ładunku do masy cząstek składających się na promienie katodowe na podstawie ich odchylenia w polu magnetycznym.
1890 Joseph John Thomson: początki zainteresowania promieniami katodowymi.
1892 Heinrich Hertz: wykazanie, że promienie katodowe przechodzą przez bardzo cienką metalową folię (dziś można by to uznać za początek mikroskopii elektronowej!). Błędna konkluzja, że nie mogą one, zatem być cząstkami (tzn. atomami, bo innych cząstek nie znano!).
1894 Joseph John Thomson: ogłoszenie pierwszego pomiaru prędkości promieni katodowych (1.9x 107 cm/s) dla obalenia przewidywań Philippa Lenarda, że poruszają się one z prędkością światła (3.0x 1010 cm/s). W 1897 roku
J.J. Thomson zakwestionował ten swój pierwszy pomiar.
1895 Jean-Baptiste Perrin: wykazanie, że promienie katodowe przenoszą ujemny ładunek, są, więc cząstkami.
1896 Pieter P. Zeeman, Hendrik Antoon Lorentz: wykazanie rozszczepienia linii spektralnych gazu świecącego w polu magnetycznym i interpretacja tego zjawiska na podstawie ruchu naładowanych cząstek w atomach.
1897 Joseph John Thomson: trzy decydujące doświadczenia z promieniami katodowymi umożliwiające wysunięcie hipotezy, że są to ujemnie naładowane, lekkie cząstki będące składnikami wszystkich atomów.
Wyszukiwarka
Podobne podstrony:
IGRASZKI Z ATOMAMI I CZĄSTECZKAMI, NAUKA, WIEDZA
SZUKANIE DATY WIELKANOCY, NAUKA, WIEDZA
200001 mala wielka nauka
MEZOZOICZNE NIESPODZIANKI, NAUKA, WIEDZA
Długi wstęp, NAUKA, WIEDZA, Bazy danych
WIRUS OPRYSZCZKI NIEBEZPIECZNY W PÓŹNEJ CIĄŻY, NAUKA, WIEDZA
PLANETY SIĘ BRONIĄ, NAUKA, WIEDZA
EFEKT GREJPFRUTA WYJAŚNIONY, NAUKA, WIEDZA
SPOSÓB NA KRWIOPIJCĘ, NAUKA, WIEDZA
SPEKTROFOTOMETRYCZNE OZNACZENIE ŻELAZA W POSTACI TIOCYJANIANU ŻELAZA, NAUKA, WIEDZA
ASTRONAUTÓW OCALIŁ DŁUGOPIS, NAUKA, WIEDZA
DIALOG I SPOTKANIE JAKO MECHANIZMY KSZTAŁTOWANIA WARTOŚCI, NAUKA, WIEDZA
LUDZKA WYJĄTKOWOŚĆ, NAUKA, WIEDZA
ELEMENTY KATALIZY, NAUKA, WIEDZA
POWRÓT LODOWCÓW, NAUKA, WIEDZA
KLONOWANIE, NAUKA, WIEDZA
SPRAWNY SAMOCHÓD ALE CZY SPRAWNY KIEROWCA, NAUKA, WIEDZA
PAMIĘĆ NA ŻYCZENIE, NAUKA, WIEDZA
POLSKA LUDOWA 1944-1989, NAUKA, WIEDZA
więcej podobnych podstron