Część teoretyczna
Światło jako fala elektromagnetyczna padając z próżni na cząsteczki przeźroczystego ciała, powoduje powstanie pod wpływem szybkozmiennego pola, indukowanych dipoli o momencie dipolowym tym większym, im większa jest polaryzowalność cząsteczki. Polaryzowalność, określa zdolność do przemieszczania się ładunków elektrycznych cząsteczki pod wpływem pola elektrycznego. Powstałe w wyniku indukcji w naświetlanych cząsteczkach chwilowe momenty dipolowe zmieniają się okresowo wraz z częstością drgań fali świetlnej. Z tą samą częstotliwością drgają indukowane dipole i same stają się źródłem światła. Promieniowanie pierwotne i wyemitowane przez naświetlone cząsteczki nakładają się na siebie, dając falę wypadkową. Fala ta rozchodzi się w danym ośrodku z prędkością mniejszą od prędkości, z jaką promienie świetlne rozchodzą się w próżni. Zmiana prędkości rozchodzenia się promieniowania w danym ośrodku materialnym w porównaniu z innym ośrodkiem jest przyczyną załamania się promieniowania świetlnego na granicy obu ośrodków. Wielkość efektu załamania jest proporcjonalna do polaryzowalności cząsteczek, a zwłaszcza do deformacji powłok elektronowych.
Stosunek prędkości rozchodzenia się światła c w ośrodku I względem prędkości w ośrodku II dla światła monochromatycznego, jest wielkością stała i nazywaną względnym współczynnikiem załamania światła n. Wielkość ta opisuje również zależność pomiędzy sinusem kąta padania α, a sinusem załamania β, podczas przejścia promienia z jednego ośrodka do drugiego
![]()
Zgodnie z powyższą definicją, n oznacza współczynnik załamana światła ośrodka II względem ośrodka I. Zwykle n mierzy się dla danego materiału względem powietrza. Absolutny współczynnik załamania światła definiuje się dla przejścia promienia świetlnego w próżni do danego ośrodka. Między obu tymi wielkościami, tzw. Współczynnikiem załamania światła względem próżni i współczynnikiem załamania światła względem powietrza istnieje niewielka różnica rzędu 0,03%.
Jeżeli prędkość światła w środku I jest większa niż w ośrodku II, czyli gdy światło przechodzi z ośrodka optycznie rzadszego do gęstszego, wówczas względny współczynnik załamania światła jest większy od jedności a promień załamany odchyla się w kierunku prostej prostopadłej. W tym przypadku kąt β jest zawsze mniejszy od kąta α. Oczywiście, bieg wiązki światła można odwrócić. Jeśli promienie świetlne biegną z ośrodka II do ośrodka I (optycznie rzadsze) padną na płaszczyznę rozgraniczającą oba ośrodki pod kątem β, wówczas kąt załamania w ośrodku I będzie dokładnie równy α. Gdy w sposób ciągły zaczniemy zwiększać kąt β, zaobserwujemy coraz to większe odchylanie się od prostej prostopadłej promienia załamanego. W końcu można znaleźć taki kąt βg, dla którego promień załamany niemal ślizga się po powierzchni rozgraniczającej oba ośrodki. Dalsze zwiększenie kąta padania powoduje całkowite wewnętrzne odbicie promienia padającego. Kąt βg po przekroczeniu którego następuje całkowite odbicie , nosi nazwę kąta granicznego. Innymi słowy, kąt graniczny βg, jest to taki kąt padania z ośrodka optycznie gęstszego, dla którego kąt załamania w ośrodku rzadszym ma wartość największą równą 90°.Przy zachowaniu pierwotnego kierunku biegu promieni świetlnych, dla kąta granicznego βg mamy α=90°.
![]()
Wielkość współczynnika załamania danej substancji n, w dużej mierze zależy od długości fali świetlnej; zależność ta nosi nazwę dyspersji. Promieniowanie o fali krótszej załamuje się bardziej niż promieniowanie o większej długości fali λ:
![]()
Dla wielu cieczy organicznych , wraz ze wzrostem temperatury obserwuje się na ogół obniżenie wartości współczynnika załamania światła w granicach od ![]()
do ![]()
na 1°C. W przypadku gazów widoczna jest znaczna zależność współczynnika załamania od ciśnienia, której praktycznie brak w przypadku cieczy i ciał stałych.
Współczynnik załamania światła jest wielkością charakterystyczną dla danej substancji i może służyć do jej identyfikacji. Dzięki temu, że pomiar współczynnika załamania może być wykonany z dużą dokładnością, stanowi on dość powszechne stosowane kryterium oceny czystości związków chemicznych. W analizie ilościowej dla określenia składu mieszaniny lub roztworu wykorzystuje się często zależność współczynnika załamania światła od stężenia badanej substancji (krzywa wzorcowa). W najprostszych przypadkach otrzymana zależność ma charakter liniowy. Ponadto, jak wcześniej wspomniano, badania współczynnika załamania światła pozwalają wywnioskować na temat struktury cząsteczek.
Funkcją określającą zależność pomiędzy współczynnikiem załamania światła danej substancji n (wyznaczanym zwykle w zakresie światła widzialnego) oraz jej gęstością d, jest refrakcja właściwa r:
![]()
Refrakcja właściwą pomnożona przez masę molową M substancji prowadzi do wyrażenia opisującego refrakcję molową R:
![]()
Refrakcja molowa jest ważną wielkością charakteryzującą deformację powłok elektronowych cząsteczek i jako funkcja współczynnika załamania zależy od długości fali świetlnej.
Wartość R jest miarą objętości, jaką rzeczywiście zajmują w przestrzeni cząsteczki jednego mola substancji zatem mniejsza od objętości molowej. Ta ostatnia wielkość obejmuje zarówno przestrzeń zajmowaną przez cząsteczki, jak i przestrzeń swobodną zawarta między nimi. Wartość refrakcji molowej praktycznie nie zależy od temperatury, ciśnienia ani stanu skupienia substancji.
Ważną własnością refrakcji molowej, jako wielkości ściśle związanej ze strukturą cząsteczki, jest jej addytywny charakter. Własność ta pozwala na obliczyć refrakcję molową poprzez sumowanie udziałów przypisanych atomom oraz innych udziałów wnoszonych przez szczególne ugrupowania elektronowe. Szczególnie dla związków organicznych o znanym wzorze sumarycznym i przyjętej strukturze, obliczoną wartość refrakcji molowej często porównuje się z jej wartością wyznaczoną doświadczalnie na podstawie współczynnika załamania i gęstości. Zgodność obu wartości R może być jednym z kryterium poprawności założonej struktury związku. Niekiedy wyznaczona doświadczalnie wartość refrakcji molowej jest większa od obliczonej poprzez sumowanie udziałów. Różnica obu wartości R występuje szczególnie często w dużych cyklicznych układach sprzężonych, w których elektrony π są ruchliwe, a więc łatwo polaryzowalne. Badanie przyczyn anomalnego zwiększenia refrakcji molowej, czyli zjawiska egzaltacji optycznej, może dostarczyć pewnych informacji odnośnie do struktury elektronowej związków aromatycznych. Ujemne odstępstwo od addytywności refrakcji nosi nazwę depersji optycznej. Należy dodać, że refrakcja molowa traci addytywny charakter w przypadku związków o wiązaniach jonowych.
W wielu przypadkach refrakcja molowa wykazuje również własności addytywne również dla mieszanin, jeśli tylko wzajemne oddziaływania składników mieszaniny nie powodują istotnych zmian polaryzowalności ich cząsteczek. Wówczas refrakcja molowa układu dwuskładnikowego R1,2 wyrażona jest jako suma udziałów wnoszonych przez poszczególne składniki.
![]()
Biorąc pod uwagę równania oraz można napisać zależność:
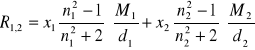
Gdzie n1 i n2 - współczynniki załamania światła składników (1) i (2) mieszaniny d1 i d2 - gęstości składników (1) i (2) mieszaniny,x1 i x2 - ułamki molowe tych składników, M1 i M2 - ich masy molowe.
Jeżeli znamy współczynnik załamania światła mieszaniny dwuskładnikowej n1,2 oraz jej gęstość d1,2 wówczas:
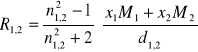
Połączone równania (7-8) wskazują na jeszcze jedno zastosowanie pomiarów współczynnika załamania światła, które mogą być wykorzystywane dla określenia składu mieszaniny (x1 i x2), gdy znana jest zarówno jej gęstość, jak i gęstości obu tworzących ją składników.
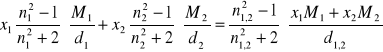
Część obliczeniowa
Obliczam objętość piknometru z zależności:
![]()
![]()
![]()
Obliczam gęstości wszystkich badanych cieczy organicznych i ich mieszanin z zależności:
![]()
![]()
Metanol
![]()
Etanol
![]()
Dioksan
![]()
Toluen
![]()
Metanol+dioksan
![]()
Metanol+toluen
![]()
Etanol+dioksan
![]()
Etanol+toluen
![]()
Obliczam refrakcję właściwą poszczególnych cieczy organicznych oraz mieszanin korzystając ze wzoru:
![]()
Metanol
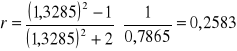
Etanol
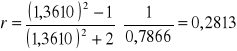
Dioksan
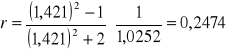
Tolunen
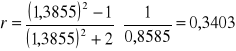
Metanol + dioksan
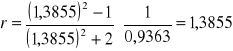
Metanol + toluen
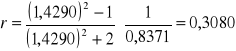
Etanol + oksan
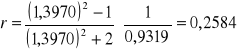
Etanol + toluen
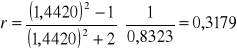
Obliczam refrakcję molową poszczególnych związków RS na podstawie wzoru:
![]()
Metanol
![]()
Etanol
![]()
Dioksan
![]()
Toluen
![]()
Obliczam wartość refrakcji molowego RD dla każdego składnika mieszaniny.
Metanol
![]()
Etanol
![]()
Dioksan
![]()
Toluen
![]()
Obliczam ułamki molowe x1 i x2 składników mieszanin. Do obliczeń wykorzystuję wzór:
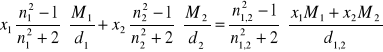
Metanol + dioksan
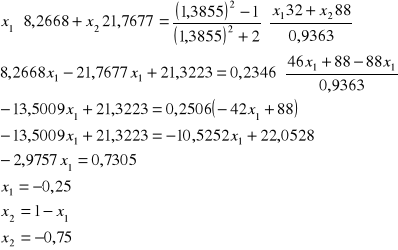
Metanol+Toluen

Etan+Dioksan

Etanol + toluen
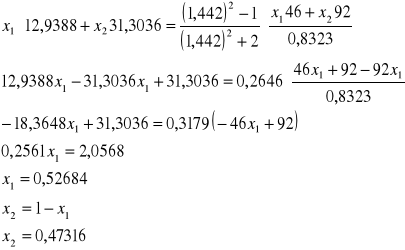
Substancja czysta |
M [g/mol] |
ms [g] |
ds [g/cm3] |
rs [cm3/g] |
Rs [cm3/mol] |
RD [cm3/mol] |
metanol |
32 |
19,4180 |
0,78645 |
0,2583 |
8,2668 |
8,343 |
etanol |
46 |
19,4212 |
0,7866 |
0,2813 |
12,9388 |
12,961 |
dioksan |
88 |
25,3126 |
1,0252 |
0,2474 |
21,7677 |
21,758 |
toluen |
92 |
21,1978 |
0,8585 |
0,3403 |
31,3036 |
30,925 |
Mieszanina |
m1,2 [g] |
d1,2 [g/cm3] |
r1,2 [cm3/g] |
x1 |
x2 |
metanol dioksan |
23,1172 |
0,8371 |
0,2506 |
0,25 |
0,75 |
metanol toluen |
20,6675 |
0,9319 |
0,3080 |
0,6298 |
0,3703 |
etanol dioksan |
23,0100 |
0,8323 |
0,2584 |
0,0902 |
0,9098 |
etanol toluen |
20,5501 |
0,9980 |
0,3179 |
0,52684 |
0,48316 |
Wnioski:
Ćwiczenie to ilustruje możliwość wyznaczenia refrakcji molowych substancji oraz ich mieszanin dwuskładnikowych na podstawie pomiaru współczynnika załamana światła i gęstości badanych związków oraz określenie składu molowego mieszanin..
Wartości refrakcji obliczone na podstawie sumowania udziałów przypisanych atomom oraz udziałów wnoszonych przez szczególne ugrupowania elektronowe są prawie równe wartości doświadczalnej refrakcji. Substancje te spełniają addytywny charakter refrakcji molowej
Wyszukiwarka