Ćwiczenie nr 9
dr Mariola Krawiecka
Koloidy i białka
Repetytorium
1. Struktura, podział i właściwości białek.
2. Biomedyczne znaczenie białek.
3. Trawienie i wchłanianie białek
4. Koloidy
5. Własności zoli liofobowych i liofilowych
6. Dializa
Część praktyczna
1. Wyznaczanie punktu izoelektrycznego kazeiny
2. Własności ochronne koloidów liofilowych
3. Wytrącanie i wysalanie białek
4. Amfoteryczny charakter białek
5. Koagulacja roztworów koloidowych
Repetytorium
Struktura, podział i właściwości białek
Białka zbudowane są z pojedynczego lub kilku łańcuchów polipeptydowych. Masy cząsterczkowe białek mieszczą się w szerokich granicach od 10 000 Da (daltonów) do kilku milionów daltonów (1 Da=1/12 masy izotopu węgla 12C). W budowie białek wyróżnia się kilka poziomów organizacji ich struktury:
Struktura pierwszorzędowa to liniowa sekwencja kolejnych aminokwasów połączonych wiązaniami peptydowymi w białkach (polipeptydach), bez uwzględnienia układu przestrzennego.
Struktura drugorzędowa - opisuje konformacje łańcuchów (helikalną i pofałdowaną) powstałe w wyniku utworzenia wiązań wodorowych między grupami karbonylowymi i amidowymi głównego łańcucha polipeptydowego oraz mostków disulfidowych.
Struktura trzeciorzędowa określa trójwymiarowe pofałdowanie danego łańcucha polipeptydowego wywołane wewnątrzcząsteczkowym oddziaływaniem łańcuchów bocznych. Strukturę tą stabilizują wiązania wodorowe, mostki disulfidowe i siły van der Waalsa.
Struktura czwartorzędowa - pojęcie to obejmuje występujące w wielu białkach asocjacje monomerów białkowych o oddzielnej strukturze drugo- i trzeciorzędowej w kompleksy oligomeryczne. Asocjacja i agregacja zachodzi w wyniku oddziaływań między polarnymi, zjonizowanymi i niepolarnymi łańcuchami bocznymi aminokwasów, są to oddziaływania: dyspersyjne, hydrofobowe, jonowe, wodorowe, w kilku wypadkach stabilizacja dzięki mostkom disulfidowym. Przykładami białek o strukturze czwartorzędowej są hemoglobina, wirus mozaiki tytoniowej, dehydrogenaza białczanowa, dehydrogenaza alkoholowa.
Podział białek
Ze względu na różnorodność budowy białek trudno dokonać ścisłej klasyfikacji białek. Najstarszy podział białek oparty został na różnicach w rozpuszczalności białek i kształcie cząsteczek.
Wyróżnia się białka:
1) fibrylarne - o strukturze włóknistej, nierozpuszczalne w wodzie
2) globularne - o strukturze kulistej, rozpuszczalne w wodzie i roztworach
soli nieorganicznych. Dzieli się je na białka proste (zbudowane tylko
z aminokwasów) i białka złożone (zawierają grupy niebiałkowe jak cukry,
tłuszcze, kwasy nukleinowe, reszty kwasu fosforowego, jony metali).
Właściwości fizyczne białek
Mają charakter wielkocząsteczkowy ( białka nie dializują ale ich roztwory wykazują cechy koloidów).
Wywierają ciśnienie koloidoosmotyczne.
Wędrują w polu elektrycznym (elektroforeza).
Ulegają wysalaniu ( (NH4)2SO4, Na2SO4, NaCl).
Skręcają płaszczyznę światła spolaryzowanego w lewo.
Pochłaniają światło przy 280 nm ( Trp i Tyr ).
Wykazują duży współczynnik załamania światła (oznaczanie białka metodą refraktometryczną).
Są wrażliwe na podwyższoną temperaturę i inne czynniki denaturujące.
Właściwości chemiczne białek
Wykazują kilka klasycznych reakcji, które wykorzystywane są do oznaczeń jakościowych białek (oparte głównie o reakcje aminokwasowe).
Ulegają denaturacji (temperatura, mocznik, guanidyny, stężone kwasy, stężone alkohole, jony metali ciężkich, detergenty, garbniki itp.).
Ulegają hydrolizie enzymatycznej (pod wpływem: pepsyny, trypsyny, chymotrypsyny), kwaśnej (następuje jednak rozpad tryptofanu, seryny, treoniny), zasadowej (następuje jednak racemizacja, dlatego rzadko stosowana).
Wykazują charakter amfolityczny, w zależności od pH środowiska, podobnie jak aminokwasy, mogą występować w trzech formach różniących się ładunkiem i co za tym idzie właściwościami.
kation białkowy białkowy jon obojnaczy anion białkowy
pH<pI pI pH>pI
-nadmiar ładunku - rozpuszczalność i hydratacja -nadmiar ładunku
dodatniego minimalne ujemnego
-wzrost rozpuszczalności - brak wędrówki w polu -wzrost rozpuszczalności
i hydratacji elektrycznym i hydratacji
Punkt izoelektryczny - wartość pH, w której liczba protonów związanych z grupami zasadowymi jest równa liczbie protonów odszczepionych przez grupy kwasowe. Zależy w pewnym stopniu od środowiska (obecności soli).
O całkowitym ładunku białka decydują wszystkie grupy funkcyjne występujące w tym białku, wpływ zaś końcowych grup aminowej i karboksylowej jest minimalny.
Biomedyczne znaczenie białek
Ze względu na funkcje biologiczne białka możemy podzielić :
1.Enzymy (dehydrogenazy, kinazy) - regulują szybkość procesów
fizjologicznych,
2. Białka zapasowe (ferrytyna, mioglobina),
3. Białka regulatorowe (hormony, białka wiążące się z DNA),
4. Białka strukturalne (kolagen, proteoglikany),
5. Białka ochronne (immunoglobuliny, czynniki krzepnięcia krwi),
6. Białka transportujące (hemoglobina, lipoproteiny osocza),
7. Białka uczestniczące w skurczu (aktyna, miozyna, tubulina).
Trawienie i wchłanianie białek
Białka są niezbędne do prawidłowego wzrostu i rozwoju organizmów. Dzienna dawka białek powinna wynosić 0,5 - 0,7 g/kg ciała. W zależności od zapotrzebowania organizmu białka można podzielić na białka pełnowartościowe (zawierające wszystkie aminokwasy egzogenne np.: białka jaja kurzego, mleka, serów, mięsa, fasoli) i niepełnowartościowe (białka pozbawione jednego lub więcej aminokwasów egzogennych np.: białko kukurydzy, żelatyna).
Najlepiej wchłaniają się albuminy, które podobnie jak białka egzogenne są w 80% wchłaniane w dwunastnicy i przednim odcinku jelita czczego. Nie strawione białko dalej dostaje się do jelita grubego gdzie jest rozkładane przez enzymy bakteryjne i wydalane.
U noworodków może wchłaniać się niewielka ilość białek z pokarmu matki- w jelicie cienkim. Ma to duże znaczenie w przyswajaniu globulin mleka matki zawierających przeciwciała, których młody organizm nie umie jeszcze wytwarzać. Zapewnia to odporność bierną noworodków. Wchłanianie to trwa zwykle 36 - 48 h po porodzie, potem zanika.
Trawienie żołądkowe
W żołądku pod wpływem pepsyn białko rozpada się na mniejsze fragmenty oligopeptydowe. Częściowemu rozszczepieniu ulegają prawie wszystkie rodzaje białek pokarmowych z wyjątkiem protamin i keratyny. Sok żołądkowy dzięki dużej zawartości jonów wodorowych powoduje ponadto denaturację, uwodnienie i pęcznienie białek trudno strawnych (kolagen, keratyna, elastyna).
Powstające pod wpływem pepsyn polipeptydy mają masę cząsteczkową od 600 do 3000. Odszczepianie wolnych aminokwasów w żołądku zachodzi zbyt wolno i nie ma większego znaczenia.
Trawienie jelitowe
Mieszanina polipeptydów - produktów trawienia żołądkowego białek przechodzi następnie do jelit, gdzie ulega dalszemu rozkładowi na coraz mniejsze peptydy i aminokwasy. Dzieje się to głównie pod wpływem soku trzustkowego. Przyjmuje się, że końcowym produktem trawienia białek przez proteazy żołądkowe i trzustkowe są krótkie peptydy zwykle 2-6 aminokwasowe. Dalszy ciąg trawienia w świetle jelita stanowi ich hydroliza.
Wchłanianie peptydów
Aminokwasy występujące w treści jelitowej wchłaniają się głównie jako składowe małych peptydów. Wchłanianie aminokwasów jest procesem czynnym zachodzącym przeciw gradientowi chemicznemu. Transport aminokwasów przez śluzówkę jelitową wymaga nakładu energii. Wyróżnia się szereg układów transportujących aminokwasy przez błonę jelitową. Prawidłowo około 10% ilości białka w pokarmach wydalane jest w stolcu. W przypadku zaburzeń trawienia białek odsetek nie wchłoniętego białka wzrasta do 22-85%.
Choroby związane z zaburzeniami przemiany białek
Pierwotny niedobór białek ustrojowych występuje od urodzenia i stanowi anomalię dziedziczną, powoduje to zaburzenia gospodarki wodnej ustroju. Ze względu na brak globulin we krwi nie dochodzi do wytwarzania przeciwciał bakteryjnych.
Znacznie ważniejsze zagadnienie stanowią wtórne niedobory białkowe, których przyczynami są:
Niedobory spowodowane nadmiernymi stratami białek (przewód pokarmowy, nerki, skóra (oparzenia)).
Niedobory spowodowane zwiększonym rozpadem białek.
Niedobory powstałe na skutek niedostatecznej podaży w pożywieniu (choroba głodowa).
Niedobory spowodowane niedostatecznym lub nieprawidłowym wytwarzaniem białek, co związane jest ze stanami chorobowymi wątroby, trzustki, niedoborem aminokwasów.
Następstwami tych niedoborów są obrzęki, zaburzenia ciśnienia koloidalnego krwi, uszkodzenia naczyń krwionośnych, a w rezultacie upośledzenie czynności wszystkich narządów oraz upośledzenie gojenia się ran.
Nadmiar białek surowiczych jest dość rzadkim zjawiskiem. Wzrost poziomu białek następuje przeważnie wskutek tworzenia się białek szpiczakowych lub innych stanów chorobowych jak np. gościec stawowy, zapalenie płuc.
(Białka szpiczakowe - są to prawidłowe frakcje białkowe występujące w nadmiarze w wyniku zwyrodnienia poszczególnych klonów komórek immunologicznych. Ciekawym zjawiskiem fizyko-chemicznym związanym z nadmiarem białek szpiczakowych jest koagulacja białka Bence-Jonesa w moczu w temperaturze 52-60°C i upłynnienie go pod wpływem dalszego ogrzewania).
4. Koloidy
Roztwory właściwe a roztwory koloidalne
Roztwory właściwe są to jednorodne mieszaniny, których składniki zatraciły część swoich indywidualnych cech, w związku z czym stały się nierozróżnialne nawet przy dużych stężeniach. Wytwarzanie roztworów właściwych jest skutkiem dyfuzji, która występuje samorzutnie i zawsze przy zetknięciu się dwu różnych ciał np. soli i wody, wody i alkoholu, powietrza i wody. Rozdział roztworu właściwego na jego składniki nie może być przeprowadzony mechanicznie np. przez sączenie - lecz można go dokonać jedynie drogą procesów fizycznych np. przez odparowanie rozpuszczalnika, wykrystalizowanie ciała rozpuszczonego, rozdestylowanie par itp.
Ciało rozpuszczone w rozpuszczalniku powoduje w nim szereg zmian fizycznych, których podstawową cechą jest ciśnienie osmotyczne, zmiany temperatur krzepnięcia i wrzenia, obniżenie prężności pary itp.
Roztwory koloidalne (koloidowe), w przeciwieństwie do roztworów właściwych, mają następujące cechy:
niezdolność do dyfuzji ciała rozpuszczonego przez błonę półprzepuszczalną,
niezdolność do krystalizacji ciała rozpuszczonego,
zmniejszone ciśnienie osmotyczne nieraz do wartości prawie niedostrzegalnej.
charakterystyczne własności optyczne
Układ koloidowy jest to niejednorodny stan materii o określonym stopniu rozdrobnienia. Stan ten jest powszechny w przyrodzie ożywionej i nieożywionej.
Układ koloidowy utworzony jest z dwóch faz:
fazy ciągłej - zwanej ośrodkiem rozpraszającym lub dyspersyjnym,
fazy rozproszonej (zdyspergowanej).
Zarówno faza rozproszona, jak i rozpraszająca może występować w stanie stałym, ciekłym i gazowym. Charakterystyczną cechą układów koloidowych jest wielkość cząstek fazy rozproszonej mających wymiary 10-9- 10-7m. Układy o rozdrobnieniu większym są roztworami właściwymi, a o rozdrobnieniu mniejszym tworzą mieszaniny.
Biomedyczne znaczenie koloidów
Układami koloidowymi są roztwory wodne białek, tłuszczów i wielocukrów. Organizm ludzki jest złożonym - dynamicznym układem wielokoloidowym. Wszystkie płyny fizjologiczne, błony komórkowe, większość tkanek są koloidami. W ustroju zachodzą ciągle procesy koagulacji, peptyzacji, denaturacji, dyspersji zoli i żeli hydrofobowych. Istnieje stałe oczyszczanie zoli na drodze dializy, pęcznienie, sensybilizacja a także ochronne działanie koloidów.
W medycynie najważniejsze układy koloidowe to takie gdzie fazą rozpraszającą jest ciecz (woda) a fazą rozproszoną ciecz lub ciało stałe. Układy takie gdzie ośrodkiem rozpraszającym jest ciecz nazywamy zolami. Szczególne znaczenie ma podział zoli na liofobowe i liofilowe oparty na różnicach w solwatacji. Jeżeli zewnętrzna część cząsteczek zawiera cząsteczki rozpuszczalnika lub chętnie je adsorbuje, to koloid ma właściwości liofilowe, w przypadku wody - hydrofilowe, przejawiające się m.in. w tym, że można uzyskać duże stężenie fazy rozproszonej roztworu, a koloid łatwo tworzy galarety i pianę. Gdy zaś zewnętrzna warstwa cząsteczki koloidalnej jest utworzona z jonów jednego znaku, wówczas cząsteczki rozpuszczalnika nie adsorbują się, koloid ma właściwości liofobowe, w przypadku wody - hydrofobowe, maksymalne stężenie wodnego roztworu jest niewielkie, trudno tworzy (lub nie) galarety i pianę. Przykładem zoli hydrofobowych są wodne roztwory metali, siarki, a także AgCl, AgI, CaS, Al2O3, V2O5. Zole hydrofilowe to wodne roztwory białek, kwasów nukleinowych, skrobi, gumy arabskiej, kauczuku, niektórych barwników.
Koagulacja i peptyzacja
Koagulacja polega na łączeniu się cząstek koloidalnych w większe zespoły widziane gołym okiem. Skoagulowany koloid opada na dno naczynia i roztwór rozwarstwia się. Koagulacja może nastąpić na skutek zobojętnienia ładunku elektrycznego cząstek koloidalnych (punkt izoelektryczny), podwyższenia lub obniżenia temperatury, mechanicznych wstrząsów, odparowania lub wymrożenia rozpuszczalnika, dodatku elektrolitu i desolwatacji (proces wysalania). Koagulacja występuje także przy wzroście stężenia fazy zdyspergowanej. Roztwór koloidalny (zol) po koagulacji przechodzi w żel. Niektóre żele można ponownie przeprowadzić w zole. Taką koagulację nazywamy odwracalną a powstałe żele galaretami. Proces przejścia żelu w zol nazywany jest peptyzacją i może nastąpić na skutek dodania rozpuszczalnika, elektrolitu, wstrząsów mechanicznych (tiksotropia) lub podgrzania. Koagulacja koloidów liofilowych (np. białek) pod wpływem czynników bardziej drastycznych jak wysoka temperatura, stężone kwasy, zasady lub sole metali ciężkich nazywa się denaturacją. Proces ten jest nieodwracalny, gdyż produkt (żel) nie da się przeprowadzić w pierwotną formę zolu. Podczas denaturacji dochodzi do uszkodzenia struktury koloidu (dla białek zniszczenie zatem struktur IV, III i II rzędowej i utrata właściwości biochemicznych).
Własności optyczne koloidów
Układy koloidowe wykazują efekt Tyndalla. Promienie świetlne przechodzące przez zole ulegają rozproszeniu na skutek uginania się na cząsteczkach koloidalnych. Obserwuje się smugę świetlną zwaną stożkiem Tyndalla, która znaczy bieg strumienia świetlnego. W wyniku absorpcji światła roztwory koloidowe zwłaszcza liofobowe wykazują barwę. Na własnościach optycznych koloidów oparte są metody analizy ilościowej (nefelometria), pomiaru ciężaru cząsteczkowego i szybkości koagulacji.
Własności elektryczne
Wszystkie cząsteczki w koloidach liofobowych są naładowane elektrycznie na skutek selektywnej adsorpcji jonów elektrolitu z ośrodka rozpraszającego na cząsteczki koloidu. W koloidach liofilowych cząsteczki mogą być naładowane elektrycznie lub nie - źródłem ładunku jest dysocjacja kwasowa lub zasadowa cząsteczki. Między takimi cząstkami występują odpychające siły kulombowskie, które zapobiegają łączeniu się ich i koagulacji koloidu. Ładunek elektryczny będący jednym z warunków trwałości i stabilizacji koloidu powstaje na skutek:
jonizacji makrocząstek na makrojony,
adsorpcji jonów z roztworu na powierzchni cząstek koloidalnych.
Ładunek elektryczny można zobojętnić dodając odpowiednią ilość elektrolitu lub koloidu o znaku przeciwnym. Obojętne cząstki łączą się w większe zespoły na skutek działania sił van der Waalsa i następuje koagulacja.
Punkt izoelektryczny - jest to stan układu koloidowego, w którym średni ładunek nagromadzony na cząsteczkach koloidalnych jest równy zero. Po osiągnięciu punkty izoelektrycznego koloidy liofobowe natychmiast ulegają koagulacji.
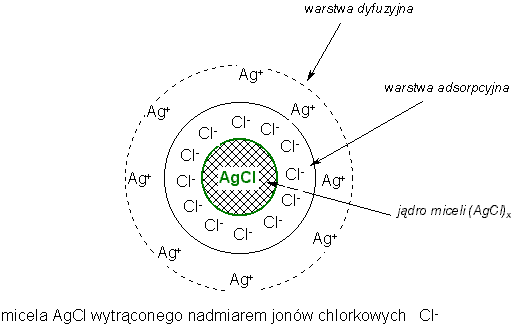
Elektroforeza i elektroosmoza
Elektroforeza polega na wędrówce cząstek koloidalnych w polu elektrycznym. Cząstki naładowane dodatnio wędrują w kierunku katody (kataforeza), naładowane ujemnie w stronę anody (anaforeza). Poddając roztwór elektroforezie można określić znak ładunku cząstek koloidalnych. Różnice w prędkości cząstek w polu elektrycznym są podstawą metody elektroforetycznego rozdziału mieszanin koloidowych. Metodą tą można oznaczać frakcje białek surowicy krwi, oczyszczać enzymy, rozdzielać aminokwasy i polipeptydy. Procesom elektroforezy może towarzyszyć zjawisko elektroosmozy. Elektroosmoza polega na wędrówce rozpuszczalnika przez ośrodek kapilarny pod wpływem sił pola elektrycznego.
Własności mechaniczne
Koloidy wykazują ruchy Browna. W ciekłym lub gazowym środowisku dyspersyjnym cząstki koloidalne znajdują się w nieustannym ruchu postępowym, obrotowym i drgającym. Ruchy Browna stanowią jedną z najbardziej charakterystycznych cech koloidów. Bardzo wyraźne ruchy Browna, odpowiedzialne za samorzutną koagulację koloidu obserwuje się w koloidach liofobowych, nieznaczne zaś w koloidach liofilowych. Stężone roztwory koloidowe są nietrwałe i szybko koagulują. Niezbyt stężone zole spełniają wzór van't Hoffa = T R i c
Własności zoli liofobowych i liofilowych
Zole liofobowe
Te zole są dobrze widzialne w ultramikroskopie, ponieważ ich cząsteczki nie mają otoczek solwatacyjnych i granica między cząsteczką koloidu i rozpuszczalnikiem jest ostra. Napięcie powierzchniowe i lepkość roztworów niewiele różni się w porównaniu z czystym rozpuszczalnikiem.
Zole liofobowe często wykazują barwę, są wrażliwe już na małe dodatki elektrolitów. Zobojętnienie ładunku elektrycznego cząstek powoduje natychmiastową koagulację. Koagulacja zoli liofobowych jest nieodwracalna. Cząstki koloidalne są naładowane dodatnio lub ujemnie w danym środowisku i nie zmieniają znaku pod wpływem zmian pH roztworu.
Zole liofilowe
Obecność otoczek solwatacyjnych wokół liofilowych cząstek koloidalnych powoduje odmienne własności takich roztworów. Widzialność cząstek liofilowych w ultramikroskopie jest słaba, a obraz granicy faz rozmyty. Lepkość roztworów jest większa niż czystego rozpuszczalnika. Napięcie powierzchniowe jest mniejsze w porównaniu z czystym rozpuszczalnikiem.
Istnienie otoczek solwatacyjnych uniemożliwia łączenie się cząstek w większe zespoły dlatego zole te nie są wrażliwe na małe dodatki elektrolitów. Desolwatacja i koagulacja może nastąpić po dodaniu dużej ilości elektrolitu (proces wysalania) lub innej substancji wiążącej cząsteczki rozpuszczalnika. Dla hydrozoli taką substancją może być etanol lub aceton. Koagulacja zoli liofilowych jest odwracalna i powstałe żele ulegają peptyzacji. Cząsteczki koloidalne mogą zmienić znak ładunku elektrycznego w zależności od zmian pH roztworu.
Działanie ochronne koloidów liofilowych
Zole liofilowe są trwalsze od liofobowych ze względu na działanie ochronne warstewek solwatacyjnych. Dodatek koloidu liofilowego do liofobowego czyni koloidy liofobowe znacznie odporniejszymi na działanie elektrolitów. Niewielka ilość cząstek liofilowych zaadsorbowana na powierzchni cząstek liofobowych nadaje im charakterystyczne własności liofilowe. Takie działanie koloidu liofilowego nazywamy działaniem ochronnym, a proces utrwalaniem koloidu. Skuteczność działania ochronnego zależy od rodzaju i ilości koloidu liofilowego. Ilościowe działanie ochronne koloidu określa tzw. „liczba złota”. Jest to ilość mg koloidu ochronnego, która dodana do 10 cm3 wzorcowego zolu złota zapobiega zmianie barwy z czerwonej na fioletową po dodaniu 1cm3 10 % roztworu NaCl. Zole złota są hydrofobowe. Roztwór wzorcowy jest koloru czerwonego, po koagulacji przyjmuje barwę niebieskofioletową. Koloidami ochronnymi są: żelatyna, skrobia, guma arabska, albuminy, dekstryny, hemoglobina. Działanie ochronne koloidów takich jak białka, tłuszcze i wielocukry ma duże znaczenie biologiczne. W płynach ustrojowych znajdują się związki bardzo źle lub zupełnie nierozpuszczalne np. kwas moczowy, barwniki żółciowe, fosforany wapnia. Są one przez koloidy utrzymywane w stanie delikatnej zawiesiny.
Sensybilizacja
Jeżeli do zolu liofobowego doda się koloidu ochronnego jednak mniej niż potrzeba aby zabezpieczyć przed koagulacją, wówczas koloidy liofobowe stają się bardziej wrażliwe na czynniki koagulujące. Ten wpływ uczulający na działanie elektrolitów nazywa się sensybilizacją.
Pęcznienie
Jest to charakterystyczne zjawisko dla koloidów liofilowych i polega na pochłanianiu rozpuszczalnika przez żel odwracalny. W wyniku pęcznienia żel zwiększa swoją objętość, ciężar, elastyczność i wytrzymałość. Cząsteczki rozpuszczalnika wnikają do wnętrza usieciowanej struktury żelu, co powoduje wzrost ciśnienia zwanego ciśnieniem pęcznienia. Przykłady układów pęczniejących: żelatyna w wodzie, kauczuk w benzenie, drewno w wodzie, groch i ryż w wodzie.
6. Dializa
Dializa jest to przenikanie cząstek lub jonów z roztworu koloidalnego przez błonę, która zatrzymuje cząsteczki fazy rozproszonej. Błona (przepona) posiada tak małe pory, że przez nie mogą przejść tylko małe cząsteczki lub jony. Oczywiście przechodzą one nie tylko na tej zasadzie, że przepona działa jak sito ale także dlatego, że małe cząsteczki poruszają się w roztworze szybciej (zgodnie z prawem Grahama). Dializa jest jedną z najstarszych metod oczyszczania zoli. W medycynie proces ten ma zastosowanie przy przewlekłej niewydolności nerek lub przy ostrych zatruciach organizmu. Dializator zastępuje lub wspomaga pracę nerek oczyszczając krew z metabolitów przemiany materii lub substancji toksycznych.
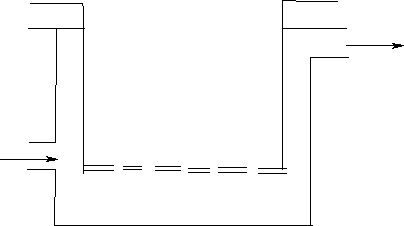
Dializator składa się z dwóch naczyń, z których wewnętrzne ma błonę półprzepuszczalną zamiast dna. Przez naczynie zewnętrzne przepuszcza się strumień wody a do naczynia wewnętrznego wlewa roztwór koloidalny. Jako błony półprzepuszczalnej używa się błony zwierzęcej lub sztucznej błony z kolodium. Takie błony mają zdolność przepuszczania cząstek roztworów rzeczywistych (jony i cząsteczki) a zatrzymują cząstki rozmiarów koloidalnych. W dializatorze cząstki roztworów rzeczywistych przechodzą do wody zawartej w naczyniu zewnętrznym. W naczyniu wewnętrznym pozostaje czysty roztwór koloidalny.Mechanizm ten ma zastosowanie przy prowadzeniu dializy otrzewnowej przy użyciu cyklera. Przez cewnik do wnętrza jamy otrzewnowej podaje się płyn dializacyjny (wnętrze jamy otrzewnowej pełni rolę zbiornika zewnętrznego, a przestrzeń pozaotrzewnowa pełni rolę zbiornika wewnętrznego). Z roztworu koloidalnego do oczyszczenia (płyn pozakomórkowy) jony i cząsteczki zanieczyszczeń przenikają przez otrzewną do jej wnętrza i zostają usunięte wraz z płynem dializacyjnym.
Metoda leczenia hemodializą pozaustrojową tzw. „sztuczną nerką” polega na przepuszczaniu krwi chorych przez długą rurę celofanową zanurzoną w elektrolicie zawierającym w odpowiednich proporcjach glukozę i elektrolity. Celofan jest błoną półprzepuszczalna stąd wszystkie substancje drobnocząsteczkowe dializują z krwi do roztworu. W ten sposób można uzyskać obniżenie stężenia mocznika, kreatyniny, kwasu moczowego, pochodnych fenoli itd. Dobierając odpowiedni skład płynu dializacyjnego można również korygować zaburzenia gospodarki elektrolitowej i kwasowo-zasadowej. Zastosowanie ultrafiltracji w warunkach ujemnego ciśnienia w pojemniku, w którym znajduje się rura celofanowa pozwala również usunąć nadmiar wody z ustroju
Część praktyczna
1. Wyznaczanie punktu izoelektrycznego kazeiny
2. Koagulacja roztworów koloidowych
3. Własności ochronne koloidów liofilowych
4. Wytrącanie i wysalanie białek
5. Amfoteryczny charakter białek
1. Wyznaczanie punktu izoelektrycznego kazeiny
Białka tworząc roztwory koloidalne wykazują charakter polijonów, jak zresztą większość koloidów liofilowych, które ulegają solwatacji. Powstałe hydraty warunkują trwałość koloidów liofilowych.
Dla każdego białka istnieje taka wartość pH zwana punktem izoelektrycznym, przy której cząsteczka jest elektrycznie obojętna. W punkcie izoelektrycznym białka są najsłabiej rozpuszczalne w wodzie, nie podlegają elektroforezie, wykazują najniższą lepkość, ciśnienie osmotyczne itp. Koagulacja białek w punkcie izoelektrycznym jest więc najłatwiejsza.
Wykonanie
Przygotować 6 suchych probówek. Do pierwszej odmierzyć 5 cm3 roztworu kwasu octowego o pH= 3,5. Do następnych probówek dodać:
do drugiej 5 cm3 wody i 5 cm3 kwasu octowego o pH=3,5; wymieszać
do trzeciej 5 cm3 wody i 5 cm3 roztworu probówki II; wymieszać
do czwartej 5 cm3 wody i 5 cm3 roztworu probówki III ; wymieszać
do piątej 5 cm3 wody i 5 cm3 roztworu probówki IV ; wymieszać
do szóstej 5 cm3 wody i 5 cm3 roztworu probówki V ; wymieszać a następnie pobrać 5 cm3 roztworu i wylać
Do każdej probówki dodać 1 cm3 roztworu kazeiny i wymieszać dokładnie. Po upływie 30 minut obserwować zawartość probówek i wyniki obserwacji umieścić w tabeli, oznaczając +, ++ itp. stopień zmętnienia lub ilość osadu:
Numer probówki |
1 |
2 |
3 |
4 |
5 |
6 |
pH |
3.5 |
3.8 |
4.1 |
4.4 |
4.7 |
5.0 |
zmętnienie |
|
|
|
|
|
|
osad |
|
|
|
|
|
|
Wyznaczyć punkt izolelektryczny kazeiny. Wyjaśnić wybór.
2. Koagulacja roztworów koloidowych
Wykonanie
Przygotować 6 probówek. Do trzech probówek odmierzyć po 2 cm3 zolu wodorotlenku żelaza, do kolejnych trzech po 2 cm3 zolu żelatyny (1%). Następnie dodać kolejno do zolu wodorotlenku żelaza:
do I probówki roztwór NaCl ( 1 molowy)- 1cm3
do II roztwór Na2SO4 (1 molowy)- 1cm3
do III roztwór nasycony (NH4)2SO4- 1cm3
Do trzech probówek zawierających zol żelatyny dodać roztwory analogicznie jak powyżej.
Porównać wyniki dla żelatyny i wodorotlenku żelaza. Wyjaśnić powstałe różnice.
3. Własności ochronne koloidów liofilowych
Dodatek koloidu liofilowego do liofobowego może zmniejszyć jego wrażliwość na czynniki koagulujące. Nieodwracalne zole mogą stać się zolami odwracalnymi. Mówimy o działaniu ochronnym koloidów. Działanie to ma znaczenie biologiczne. Koloidy (białka, wielocukry) spełniają funkcje ochronne Słabo rozpuszczające się związki, np.: kwas moczowy, barwniki żółciowe i fosforany wapnia, są utrzymywane przez koloidy w stanie delikatnej zawiesiny.
Wykonanie
Do trzech probówek odmierzyć po 1 cm3 AgNO3 i dodać kilka kropel rozcieńczonego roztworu kwasu azotowego. Do pierwszej probówki dodać 1 cm3 1% roztworu żelatyny, a do drugiej 1 cm3 1% skrobi, do trzeciej 1 cm3 wody. Zawartość probówek wymieszać i dodać do nich po 1 cm3 0,9% NaCl. Zapisać obserwacje i wnioski.
4. Wysalanie białek
Większość białek wykazuje istotne różnice w rozpuszczalności w zależności od pH roztworu, mocy jonowej, temperatury. Rozpuszczalność większość białek jest najniższa w okolicach punktu izoelektrycznego. Również dodatek soli obojętnych wykazuje wpływ na rozpuszczalność białek: niskie stężenia soli powodują zwiększenie rozpuszczalności, wysokie stężenia powodują wytrącenie białka w postaci nierozpuszczalnego osadu. Przyczyną tego zjawiska jest dehydratacja cząsteczek białka. Najbardziej efektywnie wysala białka siarczan amonowy, ze względu na bardzo dobrą rozpuszczalność w wodzie, co daje możliwość uzyskania roztworów o wysokiej mocy jonowej.
Wykonanie
Przygotować dwie probówki. Do pierwszej odmierzyć 1 cm3 roztworu kazeiny (1%) , do drugiej 1 cm3 roztworu żelatyny (1%), do każdej probówki dodać po 1 cm3 nasyconego roztworu siarczanu amonowego. Następnie do obu probówek dodać po 4 cm3 wody i dokładnie wymieszać.
Zapisać obserwacje i wyjaśnić.
5. Amfoteryczny charakter białek
Wykonanie
Przygotować trzy probówki. Do jednej probówki odmierzyć 2 cm3 1% roztworu żelatyny do drugiej 2 cm3 1% skrobi, do trzeciej 2 cm3 wody. Do probówek dodać kilka kropli zieleni bromokrezolowej i miareczkować 0.01 molowym HCl do barwy żółtej. Porównać ilości kwasu solnego zużytego w każdym przypadku.
Powtórzyć ćwiczenie dla NaOH (0.01 molowego) wobec błękitu bromotymolowego. Miareczkować do barwy niebieskiej. Porównać wyniki w obu doświadczeniach i wyjaśnić.
H2O lub
0.9 %NaCl
koloid
Wyszukiwarka