Znaczenie 11-cis retinalu (pochodnej witaminy A) w procesie widzenia można scharakteryzować następująco:
ważna jest zmiana konformacji jednego wiązania podwójnego
ważne jest utworzenie zasady Schiffa z jedną z reszt treoniny w rodopsynie
ważne jest utworzenie zasady Schiffa z jedną z reszt seryny białka opsyny
dobra rozpuszczalność w wodzie umożliwia szybkie przekazywanie impulsów do mózgu
ważna jest zmiana konfiguracji jednego wiązania podwójnego
Która z wymienionych modyfikacji zmniejsza wrażliwość łańcucha polirybonukleotydowego na alkalia (wysokie pH):
deaminacja adeniny do hipoksantyny
depurynacja
rozerwanie wiązania fosfodiestrowego
metyalcja grupy 2'-OH rybozy
przekształcenie urydyny w pseudourydynę
Z wymienionych związków: I. 2,3-butandiol, II. kwas 2-bromo-2-chloropropionowy, III. rybitol, IV. galaktoza, V. kwas mezowinowy optycznie czynne są:
II i IV
II, III i V
I
II i III
żaden
Ogrzanie układu spowoduje, że dla podanej reakcji chemicznej:
N2 + 3H2 2NH3 ΔH<0
wartość stałej równowagi nie zmieni się a wydajność reakcji wzrośnie
wartość stałej równowagi i wydajność reakcji zmaleją
wartość stałej równowagi i wydajność reakcji pozostaną bez zmian
wartość stałej równowagi i wydajność reakcji wzrosną
wartość stałej równowagi wzrośnie a wydajność reakcji zmaleje
Obniżenie pH w roztworze spowoduje wzrost rozpuszczalności następujących soli:
AgHCO3, BaSO4, Ag2HPO4, BaS2O3
Ag2C2O4, BaS2O3, Ag2HPO4, BaCl2
AgCl, AgSCN, Ba(HCO3)2, CH3COOAg, BaHPO4
AgCl, BaHPO4, AgHCO3, BaS2O3
CH3COOAg, BaHPO4, AgHCO3, BaS2O3
Dimeryczny produkt hydrolizy kwasu hialuronowego
skręca płaszczyznę światła spolaryzowanego i ma właściwości redukujące
nie wykazuje czynności optycznej i nie ma właściwości redukujących
ma właściwości redukujące, ale nie wykazuje czynności optycznej
skręca płaszczyznę światła spolaryzowanego, ale nie ma właściwości redukujących
nie ma właściwości redukujących , ale wykazuje czynność optyczną
Stan uprotonowania grupy funkcyjnej w jonie obojnaczym peptydu o nazwie waliloglutamylocysteinylolizyna (w innym teście - waliloglutaminylocysteinylolizyna) może przedstawić następująco:
COO-, COO-, SH, NH3+, NH3+
COO-, S-, NH3+, NH2
COO-, COOH, SH, NH3+, NH2
COO-, S-, NH3+, NH3+
COO-, COOH, S-, NH3+, NH3+
W ceramidzie kwas nerwonowy połączony jest ze sfingozyną wiązaniem:
glikozydowym
estrowym
amidowym
peptydowym
bezwodnikowym
Podwyższenie temperatury sprzyja destabilizacji podwójnej helisy DNA przez:
odpychanie reszt fosforanowych
niszczenie wiązań wodorowych
hydrolizę wiązań fosfodiestrowych
redukcję reszt deoksyrybozy
zmianę konfiguracji wiązań N-glikozydowych
Istnienie równowagi Gibasa-Donnana w organizmie powoduje:
wzrost stężenia tlenu w tkankach intensywnie metabolizujących
spadek pH krwi przy obniżeniu stężenia kwasów tłuszczowych
wędrówka koloidów przez błonę półprzepuszczalną w celu wyrównania ciśnień
wyrównanie liczby cząsteczek białka po obu stronach błony półprzepuszczalnej
różnice w składzie elektrolitów przestrzeni śródmiąższowej i elektrolitów osocza
Reakcji spalania glukozy w tlenie towarzyszy zmiana entalpii swobodnej równa -2872 kJ/mol. Ta sama reakcja w organizmie:
ma niższą zmianę entalpii swobodnej, ze względu na obecność enzymów
ma wyższą zmianę entalpii swobodnej, ze względu na obecność enzymów
nie jest procesem samorzutnym, jeżeli nie katalizują jej enzymy
przebiega wieloetapowo, a sumaryczna zmiana entalpii swobodnej jest taka sama
przebiega bez zmiany entropii
Po 10-krotnym rozcieńczeniu roztworu NaOH o stężeniu 0,1 mol/dm3:
pH roztworu zmaleje, a wartość iloczynu jonowego wody nie zmieni się
pH roztworu wzrośnie, a wartość iloczynu jonowego wody nie zmieni się
wartości pH i iloczynu jonowego wody wzrosną
pH roztworu zmaleje, a wartość iloczynu jonowego wody wzrośnie
pH roztworu i wartość iloczynu jonowego wody nie zmienią się
Wszystkie związki wędrowały do anody w czasie elektroforezy prowadzonej w buforze o pH=9. Dla której z grupy związków jest to zdanie prawdziew:
kwas neuroaminowy, melatonina, oligonukleotyd: 5'-ATTTAATAT-3'
dipeptyd AspGlu, cholina, kwas winowy
witamina A, guanidyna, oligonukleotyd: 5'-GCCCGCGG-3'
kwas bursztynowy, oligonukleotyd: 5'-GCAATCGG-3', kwas N-acetylonuroaminowy
2-deoksy-2-amino-N-acetylo-α-D-glukopiranoza, inozytol, kwas fumarowy
Który z podanych poniżej kwasów ma najniższą wartość pKa:
CH3CHClCH2COOH
CH3CH2CHClCOOH
CH3(CH2)3COOH
CH3CH2CH2COOH
CH3CH2CCl2COOH
Jedną z modyfikacji posttranslacyjnych łańcucha polipeptydowego, która prowadzi do zniesienia ładunku dodatniego aminokwasu jest:
fosforylacja
acetylacja
dekarboksylacja
hydroksylacja
O-glikozylacja
Stereoizomery i odmiany konformacyjne różną się energią. W której(ych) z poniższych par steroizomerów lub konformerów zaznaczono właściwe różnice energii:
1/ C2H6 odmiana naprzemianległa < naprzeciwległa
2/ glukoza odmiana łódkowa < krzesełkowa
3/ CHBr=CHBr cis < trans
w żadnej
w 2
w 1 i 3
tylko w 1
tylko w 3
Jeżeli do 1M roztworu szczawianu sodu dodamy równą objętość 1M azotanu baru, to ciśnienie osmotyczne powstałego roztworu względem wody:
będzie wyższe od ciśnienia roztworu wyjściowego
nie zmieni się, gdyż roztwory mają to samo stężenie cząsteczek osmotycznie czynnych
będzie niższe od ciśnienia roztworu wyjściowego
nie zmieni się gdyż ciśnienie osmotyczne zależy tylko od temperatury
nie można odpowiedzieć na to pytanie
Które z poniższy zdań jest prawdziwe:
inozytol jest związkiem heterocyklicznym
jest monosacharydem wchodzącym w skład fosfatydyloinozytoli
inozytol tworzy wiązanie eterowe z kwasem fosfatydowym
inozytol należy do wielowodorotlenowych alkoholi cyklicznych
płaska struktura inozytolu umożliwia interkalację pomiędzy zasady azotowe DNA
Jony obojnacze aminokwasów są jonami amfiprotycznymi, co oznacza, że w określonych reakcjach mogą odłączyć, a w innych przyłączyć proton. Dwa protony mogą zostać odłączone od jonu obojnaczego:
kwasu glutaminowego, cysteiny, tyrozyny
argininy, lizyny, histydyny
kwasu glutaminowego , kwasu asparaginowego, histydyny
tyrozyny, cysteiny, histydyny
metioniny, argininy, lizyny
Które z poniższych zdań jest prawdziwe:
acetamid w roztworze wodnym jest zawsze uprotonowany
acetamid jest uprotonowany tylko w pH poniżej 5
w acetamidzie wszystkie atomy węgla, tlenu, azotu leżą w jednej płaszczyźnie
acetamid jest amidem acetonu
acetamid należy do niebiałkowych aminokwasów
Standardowa entalpia i entropia dla procesu rozpuszczania NaCl w wodzie wynoszą odpowiednio +3,9 kJ i 42,9 J/K
proces jest samorzutny w standardowych warunkach
proces ten nie przebiega samorzutnie w warunkach 298K
proces jest endotermiczny i przez to nie jest samorzutny
proces ten jest endoergiczny i przez to nie jest samorzutny
procesowi temu towarzyszy wzrost entalpii i spadek entropii
Z podanych oligonukleotydów identyczną sekwencję komplementarną ma:
pGpCpG
pApT
pApTpT
pTpApA
pCpA
„Może powstać z glukozy w wyniku utleniania I-rzędowej grupy alkoholowej.”
Powyższe zdanie może opisywać jeden ze składników:
celulozy
amylopektyny
glikogenu
amylozy
chondroityny
Reszty asparaginy w łańcuchu polipeptydowym mogą stabilizować jego strukturę III- rzędową dzięki tworzeniu wiązań:
hydrofobowych
kowalencyjnych
jonowych
wodorowych
peptydowych
Wartość ΔG < -40 kJ/mol reakcji chemicznej oznacza, że:
stała równowagi i wydajność reakcji są niskie
w stanie równowagi substraty przeważają nad produktami
reakcja przebiega z niską wydajnością
stała równowagi reakcji ma wartość ujemną
stała równowagi ma dużą wartość i reakcja przebiega z dużą wydajnością
Które z wiązań wodorowe czy van der Waalsa powstanie między:
1/ dwoma atomami wodoru związanymi z atomami węgla
2/ atomem azotu a atomem wodoru związanym z atomem węgla
3/ atomem azotu a atomem wodoru związanym z atomem tlenu
1/ van der Waalsa 2/ wodorowe 3/ wodorowe i van der Waalsa
we wszystkich pytaniach wodorowe
1/ van der Waalsa 2/ van der Waalsa 3/ wodorowe i van der Waalsa
1/ wodorowe i van der Waalsa 2/ wodorowe 3/ wodorowe i van der Waalsa
we wszystkich przypadkach wodorowe i van der Waalsa
Strukturę cholesterolu można scharakteryzować następująco:
składa się z 4 pierścieni heterocyklicznych, z których jeden zawiera grupę alkoholową
składa się z 3 nienasyconych pierścieni, jednego pierścienia nasyconego i zawiera jedną grupę alkoholową
jest związkiem aromatycznym zawierającym grupę alkoholową
składa się z 4 pierścieni, z których jeden zawiera wiązanie podwójne, inny zawiera grupę alkoholową
składa się z 4 pierścieni leżących w jednej płaszczyźnie i wystających poza tę płaszczyznę podstawników, do których należy m.in. grupa alkoholowa
Podwójna helisa zbudowana jest 1) zbudowana jest z dwóch komplementarnych łańcuchów 2) różniących się między sobą konfiguracją wiązań N-glikozydowych. 3) Te komplementarne łańcuchy są określane jako antyrównoległe. Z podanych informacji opisujących strukturę B-DNA prawdziwe są:
1 i 2
2 i 3
1 i 3
wszystkie
żadne
Produktami organicznej (krótkotrwałej) hydrolizy substancji są oligosacharydy celobioza i glukoza. Oznacza to, że hydrolizie poddano:
glikolipid
maltozę
laktozę
celulozę
amylozę
W którym z poniższych zestawień związków organicznych znajdują się wyłącznie cząsteczki, których atomy węgla leżą w jednej płaszczyźnie:
benzen, hydrochinon, piran, 1,2-butadien
hydrochinon, pirydyna, 1,3-butadien, fenol
fenol, 1,2-butadien, benzen, piran
1,2-butadien, 1,3-butadien, pirydyna, benzen
fenol, mleczan, hydrochinon, pirydyna
W następujących reakcjach redoks: 2I- + H2O2 + 2H+ I2 + H2O
8H+ + Cr2O72- + 3H2O2 2Cr3+ + 3O2 + 7H2O
nadtlenek wodoru pełni rolę:
w obu utleniacza
w obu reduktora
katalizatora
w pierwszej utleniacza, w drugiej reduktora
w pierwszej reduktora, w drugiej utleniacza
O amidzie kwasu tioeterowego (AKT) możemy powiedzieć, że:
posiada odmiany konformacyjne i według teorii Brönsteda jest kwasem
posiada odmiany konformacyjne i według teorii Brönsteda nie jest ani kwasem, ani zasadą, ani związkiem amfiprotycznym
nie posiada odmian konformacyjnych i według teorii Brönsteda jest zasadą
posiada odmiany konformacyjne i według teorii Brönsteda jest związkiem amfiprotycznym
nie posiada odmiany konformacyjne i według teorii Brönsteda jest zasadą
W cząsteczkach peptydów można odnaleźć fragmenty zawierające atomy leżące w jednej płaszczyźnie. W peptydzie o sekwencji ProTyrLys liczba takich niezależnych płaszczyzn, z których każda zawiera przynajmniej 6 atomów, jest równa:
3
2
1
4
brak takich płaszczyzn
Układy biologiczne są układami otwartymi. Oznacza to, że:
możliwe są tylko procesy egzotermiczne
układy te wymieniają z otoczeniem zarówno masę jak i energię
możliwe są tylko reakcje które prowadzą do wzrostu nieuporządkowania układu
przy stałej temperaturze zmiana entropii nie ma znaczenia dla samorzutności procesów w nich zachodzących
układy te wymieniają energię a nie wymieniają masy
Który z wymienionych kwasów ma najwięcej izomerów optycznych :
kwas winowy
kwas mlekowy
kwas β-hydroksymasłowy
kwas jabłkowy
kwas α-ketoglutarowy
Wyższa pojemność buforu wodorowęglanowego w osoczu niż w zlewce wynika
z możliwości wytrącania nadmiaru węglanu w postaci nierozpuszczalnych soli
z odwracalnej wędrówki jonów sodowych i chlorkowych przez błonę erytrocytu
z wysokiego stężenia obu składników buforu : CO2 i H2CO3 w osoczu
z utrzymania pH osocza w pobliżu wartości pK2 kwasu węglowego
ze zdolności usuwania nadmiaru CO2 w płucach i HCO3- w nerkach
Wolne pary elektronów w orbitalach sp3 występują w cząsteczkach:
amoniaku i wody
metanu i chloroformu
acetylenu i wody
metanu i etanu
amoniaku i metanu
W roztworze znajdują się pirogronian, mleczan, acetooctan i β-hydroksymaślan w stężeniach 1 mol/dm3. Która reakcja jest termodynamicznie najbardziej prawdopodobna, jeżeli Eo (pirogronianomleczan) = - 0,19 V, Eo (hydroksymaślan) = -0,29V:
mleczan+ pirogronian acetooctan + β-hydroksymaślan
acetooctan + β-hydroksymaślan mleczan i pirogronian
mleczan + acetooctan pirogronian + β-hydroksymaślan
pirogronian + β-hydroksymaślan mleczan + acetooctan
nie jest możliwa żadna reakcja w tym roztworze
Płyn Tyrade'a o składzie 0,8% NaCl, 0,029% CaCl2, 0,02% KCl, 0,1% NaHCO3, 0,01% glukoza, 0,01% MgCl2, 0,005% NaH2PO4 w stosunku do surowicy, której ciśnienie osmotyczne mieści się w przedziale 709-810 kPa
jest hipotoniczny ale izojonowy
jest izotoniczny ale nie jest izojonowy
jest izojonowy ale nie jest izotoniczny
jest izotoniczny i izojonowy
nie jest ani izojonowy ani izotoniczny
Białko Y wiąże się z białkiem X i powstaje kompleks XY. W komórce, w stanie równowagi stężenie białka Y wynosi 1μmol, białka X 1μmol, a kompleksu XY również 1μmol. Stała równowagi reakcji X + Y XY wynosi:
1
10-6
106
½
2
Poniższy wzór przedstawia:
CH2CH2∙SO3-
|
NH3+
homocysteinę
taurynę
cytrulinę
homoserynę
kwas homocysteinsulfonowy
Wiązania hydrofobowe:
należą do silnych oddziaływań elektrostatycznych
są odpowiedzialne za dobrą rozpuszczalność etanolu w wodzie
stabilizują strukturę III-rzędową białek
powstają między cząsteczkami wody i lipidów
ulegają rozerwaniu pod wpływem soli metali ciężkich
Tkanka kostna zbudowana jest zbudowana jest z części mineralnej i organicznej zawierającej głównie kolagen. Do nierozpuszczalnych w wodzie składników nieorganicznych należy hydroksyapatyt zbudowany z:
jonów wapniowych, fosforanowych i wodorotlenkowych
jonów potasowych, wapniowych i fosforanowych
jonów sodowych, fluorkowych i wodorotlenkowych
jonów hydroniowych, wapniowych i fosforanowych
jonów wapniowych, węglanowych i szczawianowych
Rozmieszczenie cząsteczek w lipoproteinie LDL jest następujące:
trójgliceryd i wolny cholesterol znajdują się wewnątrz, a białka, estery cholesterolu i fosfolipidy na powierzchni
trójglicerydy i estry cholesterolu znajdują się wewnątrz, a białka, wolny cholesterol i fosfolipidy na powierzchni
trójglicerydy, wolny i związany cholesterol znajdują się wewnątrz, a białka i i fosfolipidy na powierzchni
wolny i związany cholesterol znajdują się wewnątrz, a białka, trójglicerydy i fosfolipidy na powierzchni
trójglicerydy, fosfolipidy i wolny cholesterol znajdują się wewnątrz, a białka i estry cholesterolu na powierzchni
Z których roztworów po wymieszaniu ich równych objętości powstanie bufor o największej pojemności buforowej:
0,1M K2HPO4 i 0,05M HCl
0,1M K2HPO4 i 0,06M KH2PO4
0,1M K2HPO4 i 0,1M KCl
0,1M K2HPO4 i 0,1M NaH2PO4
żadna z mieszanin nie będzie miała właściwości buforu
Przekształceniu mleczanu w pirogronian towarzyszy zmiana stopnia utlenienia jednego z atomów węgla:
z -1 na +1
z 0 na +2
z 0 na +1
z +1 na -1
z +2 na 0
Następujące związki są parami izomerów strukturalnych:
walina i leucyna, fenyloalanina i tyrozyna, kwas izomasłowy i kwas masłowy
izoleucyna i leucyna, cysteina i homocysteina, cytrulina i arginina
alanina i β-alanina, izoleucyna i leucyna, kwas masłowy i kwas izomasłowy
ornityna i lizyna, melatonina i tryptofan, kwas masłowy i kwas izomasłowy
walina i izoleucyna, kwas masłowy i kwas izomasłowy, alanina i β-alanina
Symetrią kulistą charakteryzuje się orbital typu:
sp2
p
sp3
s
sp
Witaminę C można scharakteryzować następująco:
uczestniczy w procesach oksydacyjnych komórki utleniając się do kwasu askorbinowego
jest kwasem L-askorbinowym, w komórce ulegającym redukcji do aldehydu L-askorbinowego
jest rozpuszczalna w tłuszczach ze względu na zdecydowaną przewagę reszt hydrofobowych
jej grupa endiolowa utlenia się, w wyniku czego powstaje kwas L-dehydroaskorbinowy
ma silne właściwości redukujące dzięki obecności wolnej grupy aldehydowej
cis-platyna jest lekiem przeciwnowotworowym. U podłoża działania tego leku leży:
powstawanie wiązań kowalencyjnych z cząsteczką DNA
tworzenie kompleksów z onkogennymi kinazami tyrozynowymi
powstawanie kompleksów interkalacyjnych z cząsteczką DNA
tworzenie kompleksów w rowku większym DNA
żaden z wymienionych mechanizmów
Który ze związków zawiera więcej niż jeden atom w stanie hybrydyzacji sp2:
leucyna
lizyna
kwas glukuronowy
kwas rybonowy
cysteina
Do związków heterocyklicznych zawierających azot w pierścieniu należą:
piran, pirol, pirydyna, puryna
imidazol, puryna, piran, pirymidyna
piran, pirymidyna, pirydyna, puryna
indol, pirol, pirydyna, pirymidyna
indol, imidazol, puryna, piran
W którym z poniższych roztworów Mg(OH)2 będzie miał największą rozpuszczalność:
0,1M NaOH
0,1M CH3COONa
woda
0,1M NH4Cl
0,1M HCl
Reszta aminokwasu w AMP jest połączona z AMP wiązaniem:
amidowym
peptydowym
estrowym
bezwodnikowym
acetalowym
Wartość potencjału redoks dla cytochromu a, a3 Eo = 0,29V dla temperatury 25°C (pH = 7) przy stosunku stężeń [Fe3+]/[Fe2+] = 10 wynosi:
0,29 V
0,231 V
0,349 V
-0,29 V
-0,12 V
„Ma wyjątkowy skład aminokwasowy o dużej zawartości glicyny (do 35%), proliny, hydroksyproliny, także alaniny, lizyny i hydroksylizyny” - jest to fragment opisu:
kolagenu
hemoglobiny sierpowatej
prionu
wazopresyny
histaminy
Dwa łańcuchy DNA można rozdzielić przez ogrzanie roztworu. W jakiej kolejności ulegną denaturacji termicznej następujące trzy fragmenty DNA (podano sekwencję tylko nici kodującej):
1/ 5'-ATAGGTCGTAAGGCC-3'
2/ 5'-ATAGGTCGTAAGGAA-3'
3/ 5'-GCAGGTCGTGAGCGA-3'
3, 1, 2
1, 2, 3
3, 2, 1
1, 3, 2
2, 1, 3
Redukcja D-galaktozy prowadzi do sześciowodorotlenowego alkoholu, który jest:
mieszaniną dwóch enancjomerów
identyczny z produktem redukcji L-galaktozy
mieszaniną dwóch ano merów
optycznie czynnym diastereoizomerem D-glukozy
związkiem, w którym wszystkie grupy -OH znajdują się w konfiguracji D
Rysunek obok przedstawia:
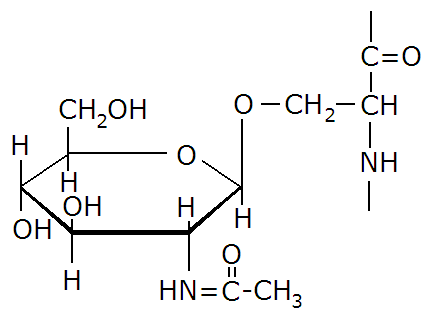
resztę seryny połączoną wiązaniem O-glikozydowym z heparynąacetalowi połączenie seryny i glukozaminy
resztę seryny zmodyfikowaną w procesie glikozylacji
resztę alaniny zmodyfikowaną w procesie glikozylacji
acetalowi połączenie seryny i N-acetyloglukozaminy
Przenośniki elektronów w łańcuchu oddechowym: cytochrom a, a3 (o,29 V), cytochrom b (0,10 V), cytochrom c (0,23 V), cytochrom c1 (0,23 V) (w nawiasach podano wartości Eo) uszeregowane są następująco wg kolejności, w której przyłączają elektrony:
cytochrom a, a3, cytochrom b, cytochrom c, cytochrom c1
cytochrom c, cytochrom a, a3, cytochrom b, cytochrom c1
cytochrom a, a3, cytochrom c, cytochrom c1, cytochrom b
cytochrom c1, cytochrom a, a3, cytochrom b, cytochrom c
cytochrom b, cytochrom c, cytochrom c1, cytochrom a, a3
Dla reakcji H2 (g) + I2 (g) 2HI (g) wzrost ciśnienia:
spowoduje przesunięcie stanu równowagi w kierunku substratów i wzrost stałej równowagi
nie wywoła zmian w wydajności reakcji i nie zmieni stałej równowagi
spowoduje przesunięcie stanu równowagi w kierunku produktów i wzrost stałej równowagi
zmniejszy wydajność powstawania HI, ale nie zmieni wartości stałej równowagi
zmniejszy wydajność powstawania HI i spowoduje wzrost wartości stałej równowagi
Wartości ΔH i ΔS dla reakcji chemicznej wynoszą odpowiednio -94,5 kJ i -189,1 J/K. Stąd ΔG dla tej reakcji w temperaturze 300 K wyniesie:
około -37,8 kJ
około -56,8 kJ
około -151,2 kJ
około 94,6 kJ
około 37,8 kJ
Poniższy wzór przedstawia:
CH2(CH2)2CHCOO-
| |
NH3+ NH3+
homocysteinę
taurynę
ornitynę
homoserynę
cytrulinę
Warunkami koniecznymi do wystąpienia czynności optycznej są:
1/ obecność asymetrycznego atomu węgla
2/ brak symetrii wewnętrznej
3/ obecność węgla o hybrydyzacji sp
Prawdziwe jest:
tylko (?)
2 i 3
Wszystkie
1 i 2
1 i 3
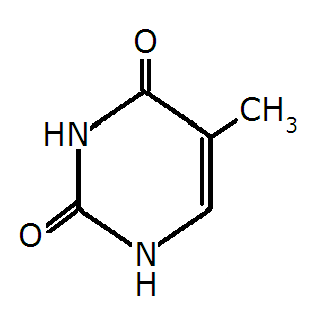
Wzór przedstawia jedną z form tautomerycznych:
cytozyny
adeniny
guaniny
uracylu
tyminy
Wszystkie samorzutne reakcje chemiczne cechuje dążność do:
maksymalnej entropii i minimalnej energii
minimalnej energii i entropii
wzrostu uporządkowania i wzrostu energii
maksymalnej entalpii swobodnej
redukcji energii i wzrostu uporządkowania
Kwasy winowe powstają w wyniku utlenienia aldotetroz. Liczba możliwych stereo izomerów kwasu winowego wynosi:
2
4
5
6
3
Interkalacja wielopierścieniowego układu aromatycznego do podwójnej helisy DNA powoduje m.in.
denaturację DNA
rozerwanie wiązań fosfodiestrowych
zmiany w strukturze helisy
rozerwanie wiązań wodorowych
alkilację zasad w DNA
Po dodaniu 10 cm3 amoniaku do 10 cm3 nasyconego roztworu AgCl nad osadem tej soli:
rozpuszczalność i iloczyn rozpuszczalności soli wzrosną
rozpuszczalność soli zmaleje, iloczyn rozpuszczalności nie zmieni się
rozpuszczalność i iloczyn rozpuszczalności soli zmaleją
rozpuszczalność i iloczyn rozpuszczalności soli nie zmienią się
rozpuszczalność soli wzrośnie, iloczyn rozpuszczalności nie zmieni się
Wyznaczone doświadczalnie wartości Rr dla dwóch różnych substancji poddanych chromatografii bibułowej w solwencie n-propanol : woda (3:1) są takie same i wynoszą 0,5. Który z wniosków jest prawdziwy:
obie substancje pozostają w miejscu startu
szybkość wędrówki jednej jest równa połowie szybkości wędrówki drugiej
obie substancje przesuwają się wraz z czołem rozpuszczalnika
zastosowany sol went nie pozwala na rozdział tych substancji
obie substancje są nierozpuszczalne w wodzie i n-propanolu
Wiązanie β-N-glikozydowe występuje w:
guanozynie
laktozie
N-acetylo-β-D-galaktozaminie
sacharozie
we wszystkich wymienionych związkach
Długość rozwiniętego łańcucha DNA z chromosomu 22 człowieka wynosi ok. 1,5 cm. Zmniejszenie liniowych wymiarów cząsteczki DNA i upakowanie jego łańcucha w chromosomie jest możliwe dzięki interakcjom z:
komplementarnym RNA
albuminami
hialuronianem
histonami
glikoproteinami
Wartości pK lizyny wynoszą: pK1 = 2,2; pK2 = 9,0; pK3 = 10,5. Forma jonowa aminokwasu opisana poniższym wzorem występuje w przewadze nad innymi formami w pH równym:
COO-
|
+H3N - C - H
|
(CH2)4
|
NH3+
2,0
10,5
2,4
9,0
9,75
Który z podanych kwasów jest związkiem mezo:
glukuronowy
galaktarowy
galakturonowy
glukonowy
galaktonowy
Reszty kwasu fosforowego w ATP połączone są ze sobą wiązaniem:
eterowym
estrowym
N-glikozydowym
bezwodnikowym
jonowym
Dla reakcji redukcji Fe3+ + e- Fe2+ Eo wynosi 0,77 V,
a dla reakcji redukcji MnO4- + 8H+ + 5e- Mn2+ + 4H2O Eo wynosi 1,51 V. Oznacza to, że w mieszaninie tych układów w warunkach standardowych:
jony żelaza utleniają się
jony żelaza ulegają redukcji
jony Mn (II) utleniają się
w obu przypadkach zachodzi redukcja, gdyż Eo jest dodatnie
w obu przypadkach zachodzi utlenianie, gdyż Eo jest dodatnie
Do biologicznie ważnych aminokwasów niebiałkowych należą m.in.:
ornityna, homocysteina, cytrulina, glutation
β-alanina, trijodotyronina, histamina, serotonina
adrenalina, ornityna, homocysteina, cyrtulina
tauryna, histamina, homocysteina, cytrulina
ornityna, homoseryna, cytrulina, dijodotyrozyna
Moment dipolowy cząsteczki CO2 jest równy zero, ponieważ cząsteczka ta:
jest zbudowana z atomów o jednakowej elektroujemności
charakteryzuje się liniowym i symetrycznym ułożeniem centrów atomowych
składa się z atomów o różnej elektroujemności
zawiera atomy o bliskich liczbach atomowych
zawiera atomy pierwiastków należących do tego samego okresu
W czasie działania glutationu, dzięki któremu możliwe jest m.in. odtwarzanie grup tiolowych (-SH) w białkach, w cząsteczce tego peptydu następuje:
redukcja grupy karboksylowej kwasu glutaminowego
redukcja siarki w cysteinie
utlenienie siarki w cysteinie
cyklizacja peptydu
hydroliza do aminokwasów
Denaturację białka przez zniszczenie wiązań wodorowych wywołują:
mocznik lub sole metali ciężkich
guanidyna lub benzen
silne reduktory lub etanol
mocznik lub silne reduktory
guanidyna lub etanol
Wskaż grupę funkcyjną, która sąsiadując w cząsteczce z grupą karboksylową obniża jej właściwości kwasowe:
-CH3
-C6H5
-NH3+
-OH
-C=O
Która z grup aminokwasów wymienionych poniżej powinna występować najczęściej w pobliżu środowiska pofałdowanego białka globularnego?
Ile, Trp, Leu, Phe, Val
Val, His, Lys, Ser, Cys
Phe, Arg, Asp, Ile, Val
Val, Leu, Ser, Arg, His
Glu, Ala, Trp, Asn, Tyr
DNA różni się od RNA wrażliwością na działanie zasad. Jest to przede wszystkim spowodowane tym, że:
DNA występuje w konformacji A, a RNA w konformacji B
DNA jest nierozpuszczalny w wodzie
DNA tworzy podwójną helisę
duże fragmenty RNA występują w formie jednoniciowych łańcuchów
deoksyryboza nie zawiera grupy -OH przy węglu 2'
Za równowagę kwasowo-zasadową osocza krwi odpowiedzialne są bufory: wodorowęglanowy, wodorofosforanowy i białczany o składzie:
H2CO3/CO2 H2PO4-/HPO42- H-białczan/białczan-
H2CO3/CO2 H3PO4/PO43- H-białczan/białczan-
H2CO3/HCO3- H3PO4/HPO42- H-białczan/białczan-
H2CO3/HCO3- H2PO4-/HPO42- H-białczan/białczan-
HCO3-/CO2 H2PO4-/HPO42- H-białczan/białczan-
Wiązania N-glikozydowe występujące w glikoproteinach łączą reszty cukrowe z rodnikami bocznymi:
fenyloalaniny
asparaginy
seryny
glicyny
tyrozyny
Zmydlanie tłuszczów można określić jako proces ich:
utleniania
redukcji
uwodornienia
estryfikacji
hydrolizy
Układ opisany równaniem: A + B AB; ΔH < 0 znajduje się w stanie równowagi. Jeżeli podwyższymy jego temperaturę, to nowy stan równowagi będzie się charakteryzował:
zmniejszeniem stężeń substratów
taką samą stałą równowagi
zwiększeniem stężenia produktów
wyższą stałą równowagi
niższą stałą równowagi
Struktura pierwszorzędowa DNA stabilizowana jest przez wiązania:
estrowe
amidowe
eterowe
wodorowe
disiarczkowe
Z równowagi Gibbsa-Donnana wynika, że:
rozmieszczenie białka po obu stronach błony półprzepuszczalnej nie wypływa na pH i rozkład jonów
pH roztworu buforowego zależy od stężenia buforu
osmoza jest wędrówką koloidów przez błonę półprzepuszczalną w celu wyrównania ciśnień
następuje wyrównanie liczby cząsteczek białka po obu stronach błony półprzepuszczalnej
rozkład jonów i pH zależy od stężenia białka po obu stronach błony półprzepuszczalnej
Katalizator:
przyśpiesza osiągnięcie stanu równowagi i zwiększa stałą równowagi
obniża stałą szybkości reakcji i stałą równowagi
obniża energię aktywacji i zwiększa szybkość reakcji chemicznej
przyśpiesza osiągnięcie stanu równowagi i zwiększa entalpię swobodną
obniża energię aktywacji i zwiększa stałą równowagi
Wiązania chemiczne łączące dwie komplementarne nici DNA określamy jako:
kowalencyjne
glikozydowe
jonowe
metaliczne
wodorowe
Wzór przedstawia:
O
||
CH3 - CH2 - C - NH2
kwas amino propionowy
amid kwasu propionowego
etyloaminoketon
eter etyloaminowy
żaden z powyższych związków
W którym szeregu prawidłowo wymieniono kwasy wg wzrastających wartości pK:
kwas masłowy, pirogronowy, acetooctowy, szczawiowy
kwas szczawiowy, acetooctowy, masłowy, pirogronowy
kwas masłowy, acetooctowy, pirogronowy, szczawiowy
kwas szczawiowy, pirogronowy, acetooctowy, masłowy
kwas szczawiowy, pirogronowy, masłowy, acetooctowy
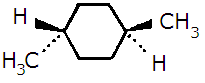
Wzór przedstawia:
trans-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której obie grupy metylowe są w pozycji aksjalnej
trans-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której obie grupy metylowe są w pozycji ekwatorialnej
cis-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której obie grupy metylowe są w pozycji ekwatorialnej
cis-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której obie grupy metylowe są w pozycji aksjalnej
cis-1,4-dimetylocykloheksan, który ma dwie równocenne konformacje, z których każda posaida jedną grupę metylową w pozycji aksjalnej i jedną w pozycji ekwatorialnej
Odmiany konformacyjne etanu różnią się między sobą:
sposobem połączenia atomów w cząsteczce
stanem hybrydyzacji atomów węgla
różną ilością wiązań typu sigma
konfiguracją cząsteczek
ułożeniem atomów wodoru w przestrzeni
Wiązanie typu δ (sigma)
jest jedynym typem wiązania występującym w cząsteczce C2H4
może powstać jedynie w wyniku przenikania się orbitali typu s
może powstać jedynie w wyniku przenikania się orbitali typu p
jest jedynym typem wiązania występującym w cząsteczce F2
nie może powstać w wyniku nałożenia się orbitali typu s i orbitali typu sp3
Wśród produktów hydrolizy siarczanu chondroityny występują:
kwas glukuronowy, N-acetyloglukozamina i kwas siarkowy
kwas glukuronowy i siarczan N-acetylogalaktozaminy
kwas galakturonowy, N-acetyloglukozamina i kwas siarkowy
siarczan kwasu glukuronowego i N-acetyloglukozamina
kwas galakturonowy, N-acetylogalaktozamina i kwas siarkowy
Glutation jest nietypowym peptydem ponieważ:
zawiera cysteinę
ulega redukcji z wytworzeniem mostków -S-S-
jest tri peptydem
zawiera glicynę
wiązanie peptydowe tworzy grupa COOH w pozycji γ kwasu glutaminowego
Aminokwas, w którego cząsteczce występuje więcej niż jeden atom węgla o hybrydyzacji sp2 to:
leucyna
lizyna
tryptofan
walina
cysteina
Reszta aminoacylowa wiąże się z grupą hydroksylową w pozycji 3' rybozy końca pCpCpA cząsteczki tRNA wiązaniem:
estrowym
eterowym
laktonowym
amidowym
peptydowym
Jedną z modyfikacji łańcucha polipeptydowego, która prowadzi do zniesienia ładunku dodatniego jest:
N-acetylacja
fosforylacja
O-glikozylacja
hydroksylacja
dekarboksylacja
Posttranslacyjna modyfikacja białek może polegać np. na:
acetylacji fenyloalaniny lub fosforylacji seryny
glikozylacji seryny lub metyzacji histydyny
hydroksylacji proliny lub fosforylacji glutaminy
acetylacji lizyny lub γ-karboksylacji alaniny
utlenianiu cysteiny lub fosforylacji metioniny
Kwas nerwonowy można opisać następująco:
18 : 1, Δ9
24 : 1, Δ15
18 : 3, Δ9,12,15
20 : 3, Δ5,8,11,14
18 : 2, Δ9,12
Który z podanych związków jest najlepiej rozpuszczalny w wodzie:
kwas palmitynowy
cholesterol
witamina A
kwas octowy
butan
Amfipatyczny charakter lipidów wynika przede wszystkim z występowania w ich cząsteczkach obok siebie:
grup o charakterze anionu (np. fosforanowa) i kationu (np. cholina)
fragmentów o charakterze hydrofobowym i hydrofilowym
reszt nasyconych i nienasyconych kwasów tłuszczowych o różnym stopniu „sztywności”
wiązań o konfiguracji cis i trans
grup tworzących wiązania wodorowe
Poniższy wzór przedstawia
CH3
|
CH3 - C - NH2
|
H
aminę drugorzędową
aminę trzeciorzędową
aminę czwartorzędową
amid
aminę pierwszorzędową
Synteza wiązania peptydowego wymaga przeprowadzenia aminokwasu w pochodną o wyższej zawartości energii. Taką pochodną w przypadku glicyny może być:
H3+NCH2COCl
H3+NCH2COOH
H2NCH2COOH
H3+NCH2COO-
H2NCH2COO-
Bufor wodorowęglanowy w osoczu działa w układzie otwartym. Oznacza to, że
pojemność tego buforu jest wyższa niż w układzie zamkniętym
w zależności od potrzeb organizmu bufor wodorowęglanowy może być zastąpiony przez bufor węglanowy
bufor ten skutecznie przeciwdziała podwyższaniu pH, które jest wynikiem metabolizmu tkankowego
stężenia obu składników buforu: CO2 i H2CO3 pozostają stałe wskutek wymiany CO2 z otoczeniem
zdanie to jest nieprawdziwe, gdyż krwioobieg jest układem zamkniętym
Przekształcenie bursztynianu w fumaran towarzyszy zmiana stopnia utlenienia atomów węgla:
z -1 na 0
z -2 na -1
z -2 na 0
z -1 na +1
z 0 na -1
Epimerami D-glukozy są:
kwas glukonowy i kwas glukuronowy
α-D-glukopiranoza i β-D-glukopiranoza
α-D-glukopiranoza iα-L-glukopiranoza
D-mannoza i D-fruktoza
D-glukoza i L-glukoza
LDL i HDL zawierające m.in. cholesterol należą do:
glikoprotein
lipoprotein
heteroglikanów
sufatydów
nukleoprotein
Jeżeli rozpatrujemy sfingomieliny (1), chondroitynę (2), peptydy (3), to wiązanie amidowe występuje w:
wszystkich wymienionych związkach
tylko 1 i 2
tylko 1 i 3
tylko 2 i 3
tylko 3
Według wzrastających właściwości zasadowych uszeregowane są związki:
dimetyloamina, cholina, anilina, amoniak
amoniak, cholina, etyloamina, dimetyloamina
anilina, amoniak, etyloamina, dimetyloamina
anilina, etyloamina, dimetyloamina, cholina
amoniak, etyloamina, dimetyloamina, cholina
Które ze stwierdzeń dotyczących miareczkowania argininy mocną zasadą jest nieprawdziwe:
w pH = pK pojemność buforowa jest najwyższa
w punkcie równoważnikowym 1 (PR1) występuje wyłącznie jon obojnaczy
pomiędzy PR1 i pK2 kation amfiprotyczny jest w przewadze nad jonem obojnaczym
w pK2 kation amfiprotyczny i jon obojnaczy są w równowadze
pomiędzy PR2 i pK3 jon obojnaczy jest w przewadze nad zasadą anionową
![]()
Wzór przedstawia
produkt redukcji witaminy C
kwas L-askorbiniwy
kwas D-dehydroaskorbinowy
produkt utlenienia witaminy C
kwas L deoksyaskorbinowy
Wartości pK kwasu glutaminowego wynszą odpowiednio: 2,2; 4,2 i 9,7. Dla tego aminokwasu możliwe są m.in. następujące układy buforowe:
Glu0/Glu- w pH ok. 2 oraz Glu-/Glu2- w pH ok. 10
Glu+/Glu0 w pH ok. 2 oraz Glu-/Glu2- w pH ok. 4
Glu+/Glu0 w pH ok. 4 oraz Glu-/Glu2- w pH ok. 10
Glu0/Glu- w pH ok. 4 oraz Glu-/Glu2- w pH ok. 2
Glu0/Glu- w pH ok. 4 oraz Glu-/Glu2- w pH ok. 10
Które z poniższych zdań jest prawdziwe:
kwas D-glukuronowy nie ma właściwości redukcyjnych
D-fruktoza ma właściwości redukcyjne
L-fruktoza ma właściwości redukcyjne
L-glukoza nie ma właściwości redukcyjnych
D-glukoza ma właściwości redukcyjne
Substancji o nazwie 1,2-dimetylocyklopenten odpowiadają dwa:
epimery
izomery cis-trans
konformery syn-anty
ano mery
(?)
Jony wapniowe wchłaniają się w górnych odcinkach jelita cienkiego. Które twierdzenie jest prawdziwe:
zmiana pH zupełnie nie wpływa na wchłanianie soli wapnia z przewodu pokarmowego
zasadowa terść przewodu pokarmowego powoduje obniżenie rozpuszczalności soli wapnia, a zatem gorsze wchłanianie
podwyższenie pH w tym odcinku jelita powoduje wzrost rozpuszczalności soli wapnia, a zatem lepsze wchłanianie
obniżenie pH w tym odcinku jelita powoduje obniżenie rozpuszczalności soli wapnia, a zatem gorsze wchłanianie
kwaśna treść przewodu pokarmowego powoduje obniżenie rozpuszczalności soli wapnia, a zatem gorsze wchłanianie
W reakcji MnO4- + 8H+ + 5Fe2+ Mn2+ + 5Fe3+ + 4H2O nadmanganian
jest utleniaczem ze względu na niższy potencjał redoks
jest reduktorem ze względu na niższy potencjał redoks
jest utleniaczem ze względu na wyższy potencjał redoks
jest reduktorem ze względu na niższy potencjał redoks
nie uczestniczy w reakcji redukcji i utlenienia
Zasada Schiffa
powstaje w wyniku reakcji grupy aldehydowej z aminową
tworzy parę sprzężoną z kwasem Schiffa
jest płaska ze względu na hybrydyzację atomów węgla
powstaje w wyniku hydrolizy rodopsyny
jest produktem kondesacji aldolowej
Przedstawiony na rysunku obok związek jest:
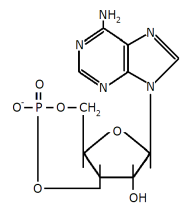
produktem pośrednim hydrolizy alkilowej/alkalicznej (?) RNAcyklicznym nukleotydem o nazwie cAMP
produktem pośrednim hydrolizy alkilowej/alkalicznej DNA
produktem pośrednim hydrolizy kwasowej RNA
cyklicznym nukleotydem istotnym w procesie (…)
Obniżenie siły jonowej sprzyja destabilizacji podwójnej helisy DNA ze względu na:
odpychanie reszt fosforanowych
zrywanie wiązań wodorowych
hydrolizę wiązań fosfodiestrowych
zmianę konfiguracji wiązań N-glikozydowych
redukcję reszt deoksyrybozy
Wskutek istnienia równowagi Gibbsa-Donnana w organizmie:
następują zaburzenia w transporcie tlenu
w skład elektrolitów przestrzeni śródmiąższowej różni się od składu elektrolitów w osoczu
koloidy wędrują przez błonę półprzepuszczalną w celu wyrówania ciśnień
następuje wyrównanie liczby cząsteczek białka po obu stronach błony półprzepuszczalnej
spada pH krwi przy obniżeniu stężenia kwasów tłuszczowych
Podczas elektroforezy mieszaniny kwasu glutaminowego (pI = 5,2) i lizyny (pI = 9,7) w buforze o pH = 8, aminokwasy te:
pozostają w miejscu startu
kwas glutaminowy wędruje do katody, a lizyna do anody
oba aminokwasy wędrują do katody
oba aminokwasy wędrują do anody
kwas glutaminowy wędruje do anody, a lizyna do katody
Następująca modyfikacja zwiększa ujemny ładunek cząsteczki białka (?)
fosforylacja
acetylacja
dekarboksylacja
metylacja
częściowa proteoliza
Wiązania wodorowe decydują o dobrej rozpuszczalności w wodzie wszystkich wymienionych poniżej grup związków z wyjątkiem:
chlorków alkilowych
alkoholi
amin
kwasów karboksylowych
monosacharydów
Lakton kwasu D-galaktonowego
posiada wiązanie podwójne (?)
zawiera atom węgla o hybrydyzacji sp2
jest nieczynny optycznie
występuje w postaci odmian anomerycznych
ulega (…)
Reszty glutaminy w łańcuchu polipeptydowym mogą stabilizować strukturę trzeciorzędową dzięki tworzeniu wiązań:
hydrofobowych
peptydowych
jonowych
kowalencyjnych
(?)
Do opisu położenia pierścienia zasady azotowej w stosunku do pierścienia furanozowego (detoksy)rybozy w cząsteczkach kwasu rybonukleinowego używa się określenia:
cis i trans
syn i anty
anomer α i β
forma łódkowa i krzesełkowa
forma (?)
Opisówka
Co to jest tautomeria? Wyjaśnij to zjawisko pisząc wzory odmian tautomerycznych cytozyny. Która z odmian występuje w DNA?
Narysuj wzór półstrukturalny cerebrozydu, w skład którego wchodzi reszta kwasu cerebronowego. Określ rodzaje wiązań, które łąćzą poszczególne składniki oraz zaznacz fragmenty, które mają charakter hydrofilowy lub hydrofobowy.
Napisz równanie syntezy amoniaku z wodoru i azotu, równanie kinetyczne reakcji prostej oraz wyrażenie na stałą równowagi dynamicznej (ΔH < 0). Czy i jak zmieni się stała równowagi i szybkość reakcji chemicznej, jeżeli:
podwyższymy temperaturę
obniżymy ciśnienie?
Narysuj wzór D-galaktozy oraz wszystkich produktów utleniania tego cukru (bez zmiany liczby atomów węgla). We wzorach zaznacz asymetryczne atomy wegla. Które z narysowanych związków są czynne optycznie? Podaj nazwę jednego diastereoizomery oraz jednego enencjomeru D-galaktozy.
Co to jest struktura III-rzędowa białek. Podaj 3 rodzaje oddziaływań, które ją stabilizują oraz przykłady aminokwasów, które mogą uczestniczyć w tych oddziaływaniach. Jeden z przykładów zilustruj odpowiednimi wzorami.
Zadania rachunkowe
Ile mg NaH2PO4 potrzeba na przygotowanie 130 g 0,0065 molowego roztworu tej soli o gęstości
d = 1,02 g/cm3 (masa at.: Na = 23, O = 16, P = 31)
Ile cm3 1M roztworu CH3COOH należy dodać do 150 cm3 0,1M roztworu CH3COONa, aby otrzymać roztwór buforowy o pH = 4. Stała dysocjacji Ka = 1,8 ∙ 10-5
Oblicz masę molową pewnego nieelektrolitu, którego 1,5% roztwór (d = 1,04 g/cm3) w temperaturze 20°C wykazuje ciśnienie osmotyczne 258,2 kPa (R = 8,313 kPa∙dm3/K∙mol)
O ile jednostek zmieni się pH Zn(OH)2 po dodaniu do 1 dm3 nasyconego roztworu 82 mg ZnSO4 (bez zmiany
Wyszukiwarka