Wstęp teoretyczny
Równowagę dysocjacji słabego elektrolitu - kwasu octowego rozpuszczonego w wodzie można przedstawić za pomocą równania:
CH3COOH + H2O ↔ CH3COO- + H3O+
Stałą równowagi tego procesu zwaną termodynamiczną stałą dysocjacji Ka wyraża wzór:
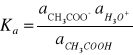
gdzie; ![]()
![]()
- równowagowe molowe aktywności jonów oraz niezdysocjowanych cząsteczek kwasu octowego
W roztworach rozcieńczonych wartości aktywności można zastąpić odpowiednimi stężeniami. Uzyskuje się wówczas stężeniową stała dysocjacji:
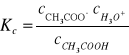
Stężenia jonów powstałych w procesie dysocjacji kwasu octowego są sobie równe i wynoszą: ![]()
, gdzie ![]()
oznacza stopień dysocjacji elektrolitu, natomiast c - całkowite stężenie roztworu. Stężenie niezdysocjowanego kwasu wynosi: ![]()
.Podstawienie powyższych wartości do wyrażenia na stałą dysocjacji prowadzi do wzoru zwanego prawem rozcieńczeń Ostwalda:
![]()
Zgonie z teorią Arrheniusa, stopień dysocjacji słabego elektrolitu ![]()
można wyrazić poprzez stosunek przewodnictw:
![]()
gdzie: ![]()
- przewodnictwo molowe słabego elektrolitu o stężeniu c, ![]()
- przewodnictwo molowe graniczne tego elektrolitu.
Jak wiadomo, przewodnictwo molowe roztworu elektrolitu ![]()
opisuje zależność:
![]()
gdzie: ![]()
- przewodnictwo właściwe, c- stężenie molowe
Przewodnictwo właściwe![]()
można opisać zależnością:
![]()
gdzie: ![]()
- przewodnictwo roztworu, l odległość między elektrodami, A - powierzchnia elektrod, Kn stała naczyńka
Stała dysocjacji kwasu octowego jest funkcją temperatury. Zgodnie ze statyką chemiczną , znajomość
Zależności Ka=f(T) pozwala wyznaczyć efekt energetyczny, czyli entalpię procesu ΔH opisanego przez daną stała równowagi. Rozważmy na wstępie dowolną równowagę chemiczną. W celu uzyskania temperaturowej zależności stałej równowagi reakcji, należy zróżniczkować względem temperatury T (przy stałym ciśnieniu) jedno z najważniejszych równania statyki chemicznej, przytoczone poniżej:
![]()
gdzie: ![]()
- standardowa entalpia swobodna reakcji, R- stała gazowa.
Zatem:
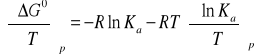
Z ogólnie słusznych zależności termodynamicznych wynikają następujące równania:
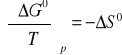
![]()
Przyrównanie stronami powyższych równań prowadzi do zależności zwanej izobarą vant`Hoffa:
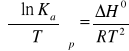
Z ostatniego równania wynika, że zmienność stałej równowagi reakcji wraz z temperatura jest ściśle związana ze standardową entalpia reakcji. Dogodniejsza w stosowaniu jest scałkowana postać tego równania:
![]()
Ostatnie równanie może być stosowane do wyznaczania entalpii reakcji, jeśli znane są wartości Ka w różnych temperaturach
Jak wcześniej wspomniano, dysocjacja elektrolityczna słabego kwasu jest procesem, któremu również towarzyszy efekt energetyczny - entalpia dysocjacji- ΔHdys. W roztworach rozcieńczonych termodynamiczna stała równowagi dysocjacji Ka jest w przybliżeniu równa stałej stężeniowej Kc Otrzymuje się wówczas:
![]()
Część obliczeniowa
Obliczam przewodnictwo właściwe roztworów κ we wszystkich temperaturach na podstawiie zależności:
![]()

Obliczam przewodnictwo molowe Λ korzystając z równania:
![]()

Na podstawie empirycznej zależności przewodnictwa granicznego kwasu octowego od temperatury obliczam wartość przewodnictwa granicznego Λ0 w badanych temperaturach.
![]()

Obliczam stopień dysocjacji α badanego roztworu kwasu octowego w każdej temperaturze korzystając ze wzoru:
![]()
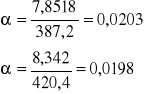
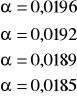
Obliczam stałą dysocjacji kwasu octowego Kc w każdej temperaturze na podstawie wzoru:
![]()
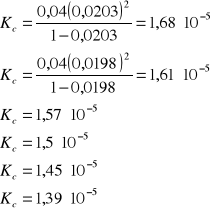
![]()
Wyznaczam metodą najmniejszych kwadratów współczynnik kierunkowy Bnum
prostej lnKc=f(1/T) a następnie entalpię dysocjacji ΔHdys.
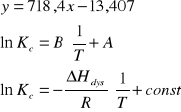
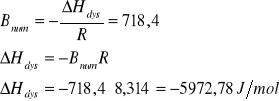
Wyznaczam metodą graficzną współczynnik prostej Bgraf
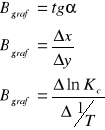
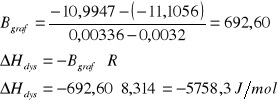
Wnioski:
Ćwiczenie to ilustruje, że pomiar stałej dysocjacji kwasu octowego w kilku temperaturach pozwala uzyskać wartość ![]()
tego kwasu . Entalpia dysocjacji jest sumarycznym efektem towarzyszącym procesowi rozpadu słabego elektrolitu na jony w wodzie oraz tworzeniu otoczek hydratacyjnych wokół jonów. Są to dwa główne efekty towarzyszące temu procesowi . Rozpad elektrolitu na jony jest procesem endotermicznym, podczas gdy hydratacji towarzyszy wydzielenie znacznej ilości ciepła. Sumaryczna wartość entalpii dysocjacji może być dodatnia lub ujemna, w zależności od wzajemnego stosunku obu wymienionych efektów. W przypadku przeprowadzonego doświadczenia wartość entalpii dysocjacji kwasu octowego wynosi ΔHnum =-5972,78 J/mol i ΔHnum= -5758,3Wartości te są ujemne co świadczy że w przypadku dysocjacji kwasu octowego większy udział wnosi proces hydratacji.
Na podstawie wykresów można zaobserwować że przewodnictwo molowe i stopień dysocjacji zależą liniowo od temperatury. Przewodnictwo molowe powoli rośnie wraz ze wzrostem temperatury natomiast stopień dysocjacji maleje gwałtowniej wraz ze wzrostem temperatury.
t [oC] |
λ [S] |
T [K] |
1/T [K-1] |
κ [Scm-1] |
Λ [Scm2mol-1] |
Λ0 [Scm2mol-1] |
α |
Kc 10-5 |
-LnKc |
24,5 |
0,000913 |
297,65 |
0,00336 |
0,000314 |
7,8518 |
387,2 |
0,0203 |
1,68 |
10,9947 |
29,5 |
0,00097 |
302,65 |
0,00330 |
0,000334 |
8,342 |
420,4 |
0,0198 |
1,61 |
11,0385 |
34,5 |
0,001033 |
307,65 |
0,00325 |
0,000355 |
8,8838 |
453,6 |
0,0186 |
1,57 |
11,0649 |
39,4 |
0,001085 |
312,55 |
0,0032 |
0,000373 |
9,331 |
586.1 |
0,0192 |
1,5 |
11,1056 |
44,3 |
0,001138 |
317,45 |
0,00315 |
0,000391 |
9,7868 |
518,6 |
0,0189 |
1,45 |
11,1401 |
49,2 |
0,001183 |
322,35 |
0,00310 |
0,000407 |
10,1738 |
551,2 |
0,0185 |
1,39 |
11,1846 |
Bnum [K] Bgraf [K] |
718,4 692,60 |
ΔHnum [J/mol] ΔHnum [J/mol] |
-5972,78 -5758,3 |
||||||
Wyszukiwarka