POMIAR AKTYWNOŚCI DROBNOUSTROJÓW
Każda żywa komórka musi nieustannie - zarówno podczas wzrostu, jak i w czasie spoczynku - pobierać energię, którą zużywa nie tylko na procesy związane z budową swego organizmu, ale również na utrzymanie swego uporządkowanego stanu materii. Aby żywy organizm mógł funkcjonować, zużywana przez ten organizm energia musi być więc w sposób ciągły uzupełniania. Ilość tej energii zależy od aktualnego stanu fizjologicznego tego organizmu, czyli jego aktywności. Uniwersalnym źródłem tej energii są procesy biologiczne utleniania związków organicznych, których ostatnim etapem są przemiany zachodzące w łańcuchu oddechowym. Inaczej - szlaki metaboliczne podstawowych procesów prowadzonych przez drobnoustroje zbiegają się w łańcuchu oddechowym. Procesy te przy udziale dehydrogenaz dostarczają substratów - atomów wodoru- wykorzystywanych podczas utleniania biologicznego zachodzącego w łańcuchu oddechowym. Dlatego pomiar szybkości transportu atomów wodoru w łańcuchu oddechowym może być miarą ogólnej aktywności mikroorganizmów. Albowiem zahamowanie któregokolwiek procesu życiowego, na przykład pod działaniem substancji toksycznej, spowoduje zmniejszenie tej szybkości.
1. Określenia aktywności drobnoustrojów przy pomocy pomiarów poboru tlenu
Dostarczycielami substratów (atomy wodoru) wykorzystywanymi w procesie utleniania przy pomocy łańcucha oddechowego są produkty pośrednie głównych procesów metabolicznych prowadzonych przez drobnoustroje. Natomiast ostatecznym akceptorem elektronów organizmów tlenowych są atomy tlenu, tworzące cząsteczki wody. Szybkość zużycia tlenu jest więc miarą intensywności procesów oddychania zachodzących w komórce. Szybkość ta jest jednocześnie miarą ogólnej aktywności drobnoustrojów, gdyż zahamowania któregokolwiek z głównych procesów życiowych spowoduje zmniejszenie zużycia tlenu.
Do pomiarów oddychania materiału biologicznego używany był w przeszłości powszechnie aparat Warburga. Istota metody Warburga jest wyznaczanie ubytku O2 poprzez bezpośredni pomiar zmian ciśnienia wywołanego w układzie zamkniętym przez jego wykorzystanie w procesach życiowych. Obecnie metoda Warburga została powszechnie zastąpiona wygodniejszymi metodami bezpośredniego pomiaru zmian stężenia rozpuszczonego tlenu w układzie zamkniętym.
2. Określanie aktywności drobnoustrojów przy pomocy sztucznych akceptorów elektronów
W warunkach fizjologicznych ostatecznym akceptorem atomów wodoru przenoszonych w łańcuchu oddechowym - jest tlen. Elektrony i protony przenoszone przez biologiczne układy oksydoredukcyjne, mogą być także przyłączane przez wprowadzone sztucznie do środowiska związki chemiczne. Etapy, w których sztuczne akceptory elektronów ulegają redukcji, zależą od potencjału oksydoredukcyjnego naturalnych przenośników i wprowadzonych związków.
Najwcześniej i powszechnie stosowanym związkiem chemicznym do oceny aktywności dehydrogenaz był błękit metylenowy, który w środowisku beztlenowym odbarwiał się po przyłączeniu atomów wodoru.
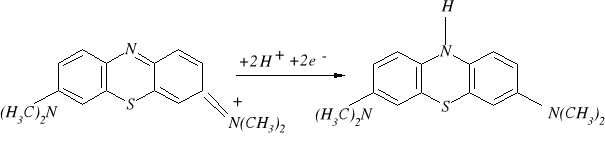
utleniona forma błękitu forma zredukowana
metylenowego (niebieska) (bezbarwna)
Jednakże ze względu na to, że błękit metylenowy nie reaguje wybiórczo z dehydrogenazami, wykazuje właściwości bakteriobójcze i wymaga odtleniania środowiska, zaczęto stosować inne, wygodniejsze w użyciu związki chemiczne, głównie sole tetrazolowe.
Najszersze zastosowanie znalazła metoda testu TTC. Pomiar polega na wprowadzaniu do układu oddechowego chlorku 2,3,5-trójfenylotetrazolowego (TTC), który przyłącza atomy wodoru tworząc trójfenyloformazan (TF).
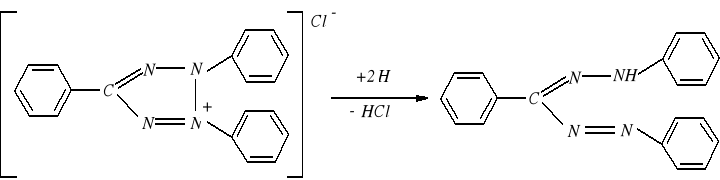
Zasadniczą zaletą stosowania TTC do oznaczania aktywności dehydrogenaz polega na tym, że jest on w postaci utlenionej bezbarwny i rozpuszczalny w wodzie, natomiast forma zredukowana posiada czerwone zabarwienie i jest słabo rozpuszczalna w wodzie. Ta ostatnia cecha powoduje, że TTC znalazł zastosowanie także przy lokalizacji wewnętrzkomórkowej dehydrogenaz.
Jakkolwiek test TTC stosowany jest od dość dawna, metodyka oznaczenia nie jest jednolita. Metoda określania aktywności dehydrogenaz przy pomocy tego związku przechodziła kolejne ewolucje i ciągle jeszcze wprowadzane są modyfikacje. Stosowana przez różnych autorów metodyka badań różni się odczynem, temperaturą, warunkami tlenowymi, stężeniem roztworu TTC, wprowadzeniem egzogennego substratu, czasem inkubacji, rodzajem substancji przerywającej reakcję, ekstrahentem używanym do wymycia formazonu itd.
2.1. Wyznaczanie optymalnego stężenia chlorku 2,3,5 _ trójfenylo- tetrazolowego podczas oznaczania aktywności dehydrogenaz za pomocą testu TTC.
Podstawowym czynnikiem wpływającym na wiarygodność uzyskiwanych rezultatów oznaczania aktywności dehydrogenaz, jest stężenie TTC w inkubowanej próbce. Wielkość optymalnego stężenia TTC jest bowiem zmienna i zależna od aktualnego składu, morfologii oraz stanu fizjologicznego badanej biocenozy. Stężenie to wynika z kompromisu pomiędzy sprzecznymi wymogami: zapewnienia z jednej strony takiej koncentracji TTC, aby związek ten mógł wniknąć w odpowiedniej ilości do wewnątrzkomórkowych miejsc aktywności oksydoredukcyjnej, a z drugiej strony - nie działał jeszcze toksycznie. Niekiedy nie można spełnić obydwu tych wymogów i stężenie TTC nie gwarantujące odpowiedniego nadmiaru tego związku w miejscach aktywności oksydoredukcyjnej komórek, działa już toksycznie. Taki przypadek wyklucza możliwość oznaczania za pomocą testu TTC rzeczywistej aktywności mikroorganizmów. Dlatego przed przystąpieniem do oznaczania aktywności mikroorganizmów należy każdorazowo wyznaczyć optymalne stężenie TTC w inkubowanych próbkach.
2.2. Wyznaczanie zakresu wprost proporcjonalnego przyrostu trójfenyloformazanu podczas oznaczania aktywności dehydrogenaz za pomocą testu TTC
Ważnym czynnikiem decydującym o prawidłowości wykonywanego oznaczenia, jest stosowanie takiego czasu inkubacji próbek, w którym przyrost TF jest liniowy. Jedynie wówczas można podawać uzyskany wynik oznaczenia aktywności w przeliczeniu na jednostkę czasu.
W przypadku gdy wykres zależności aktywności dehydrogenaz od czasu inkubacji nie przecina początku układu współrzędnych, należy zmodyfikować oznaczenie zwiększając dwukrotnie ilość inkubowanych próbek. Inkubację połowy próbek kończyć po krótkim czasie (najczęściej 5÷10 minut), a inkubację pozostałych prowadzić dalej przez 15÷30 minut. W takim przypadku aktywność dehydrogenaz wyznacza się na podstawie stosunku ilości powstałego TF do czasu, w którym ten przyrost nastąpił:
![]()
2.3. Wpływ warunków tlenowych na wynik testu TTC
Pomimo wyższego potencjału oksydoredukcyjnego, rozpuszczony tlen jest konkurencyjnym w stosunku do TTC akceptorem atomów wodoru przenoszonych w łańcuchu oddechowym. Powoduje to zaniżanie wyników oznaczania aktywności dehydrogenaz za pomocą testu TTC. Ze względu na różną ilość rozpuszczonego tlenu w analizowanych próbkach, zmieniającą się także w czasie inkubacji próbek, jego wpływ na wynik analizy jest zmienny w każdym doświadczeniu i trudny do jednoznacznego ustalenia. Bardziej wiarygodny obraz stanu fizjologicznego mikroorganizmów uzyskuje się więc przy pomiarach aktywności w warunkach anaerobowych, gdy TTC jest jedynym akceptorem atomów wodoru. W warunkach tych zmniejsza się także rozrzut uzyskiwanych wyników. Ten korzystny wpływ odtleniania próbek na dokładność testu TTC, jest stosunkowo łatwy do wytłumaczenia. Wynika on ze stworzenia jednolitych warunków doświadczenia (w całej próbce warunki beztlenowe), podczas gdy w próbkach nieodtlenionych warunki te są zmienne, nieustalone, gdyż w niektórych miejscach np. wewnątrz kłaczków osadu czynnego, panować mogą warunki beztlenowe, podczas gdy w innych rejonach, rozpuszczony tlen będzie konkurował z TTC jako akceptor atomów wodoru.
Potwierdzeniem wzrostu powtarzalności wyników oznaczania aktywności w próbkach inkubowanych w warunkach anaerobowych są także wyniki uzyskane przez Lenharda, który jednakże nie zwrócił uwagi na ten fakt. Tymczasem wyliczony współczynnik zmienności dla tych doświadczeń wykazuje ponad dwukrotnie zmniejszenie rozrzutu wyników wokół średniej arytmetycznej w próbkach odtlenionych.
Wyszukiwarka