ZESTAW 7
inhibicja - rodzaje Zahamowanie reakcji biochemicznej w wyniku działania inhibitorów nazywamy inhibicja, zaś substancje, które hamuja działanie enzymów określamy mianem inhibitorów. Ze względu na ich podział wyróżniamy inhibicję współzawodniczącą i niewspółzawodnicząca. INHIBICJA WSPÓŁZAWODNICZĄCA polega na współzawodnictwie pomiedzy inhibitorem a substratem o miejsce w centrum aktywnym enzymu. Inhibitory biorące udział w tej inhibicji mają podobną strukture do substratu. Stopień zahamowania reakcji przez inhibitory współzawodniczące zalezy od stężenia inhibitora i stężenia substratu oraz od powinowactwa enzymu do inhibitora i substratu. Inhibicja ta ma charakter odwracalny i może być częściowo zniesiona przez zwiekszenie stężenia substratu. Związki o strukturze niepodobnej do struktury substratu hamują działanie enzymów, ponieważ tworzą nieaktywne połączenia łączac się z enzymem lub kompleksem enzym-substrat. W INHIBICJI NIEWSPÓŁZAWODNICZACEJ hamowanie reakcji może zachodzić na skutek blokowania grup funkcyjnych aminokwasów kontaktowych w centrum aktywnym, lub może wiązać się ze zmianami w konformacji białka wywołanymi przyłączeniem inhibitora. Łączenie z enzymem lub kompleksem enzym-substrat utrudnia powstawanie aktywnych kompleksów. Stopień zahamowania reakcji zalezy od stężenia inhibitora oraz powinowactwa enzymu do inhibitora, a nie zalezy od stężenia substratu. Ten rodzaj inhibicji ma charakter nieodwracalny, ponieważ hamowanie nie jest znoszone przez nadmiar substratu.
przebieg i rola cyklu mocznikowego Cykl mocznikowy jest sekwencją reakcji enzymatycznych, w toku których grupy aminowe aminokwasów ulegają przemianie w mocznik. Mocznik powstaje w następstwie reakcji enzymatycznych z dwutlenku węgla - CO2 oraz amoniaku - NH3. Mechanizm tworzenia się tego związku ma charakter cykliczny, kolejnymi ogniwami są ornityna cytrulina i arginina.Głównym miejscem, gdzie zachodzi cykl mocznikowy jest wątroba. Przekształcenie L-ornityny do L-cytruliny i synteza karbamoilofosforanu zachodzi w matriks mitochondrialnej, a pozostałe reakcje w cytoplazmie. Reakcja sumaryczna cyklu mocznikowego: HCO3- + NH4+ + NH3 → H2N - C - NH2 + 2H2O
Z połączenia CO2 i amoniaku przy udziale energii ATP powstaje karbomylofosforan, który łączy się z cząst. Aminokwasu ornityny tworząc cytrulinę. Następnie cytrulina przyłącza cząst. Kw. asparginowego, z którego pochodzi druga grupa aminowa w wyniku czego powstaje argininobursztynian, który rozpada się na cząsteczkę argininy i fumarynu. Grupy aminowe przenoszone są do argininy i fumaranu. Grupy aminowe przenoszone są do argininy. Arginina ulega rozpadowi na cząst. Ornityny, która wejdzie do kolejnego cyklu.ZNACZENIE Cykl ten ma na celu usunięcie z organizmu szkodliwego amoniaku, ze względu na jego znaczną toksyczność nawet w małych stężeniach. Wynikiem obrotu całego cyklu z organizmu wydzielone zostają dwie cząsteczki NH3. Jedna z nich pobierana jest ze środowiska, zaś druga pochodzi w grupy aminowej asparaginianu. Związanie 2 cząsteczek amoniaku odbywa się kosztem 3 cząsteczek ATP.
budowa FAD oraz reakcje z jego udzialem
FAD to dinukleotyd flawinoadeninowy spokrewniony z witaminą B2. jest koenzymem oksydoreduktaz złożonym z kwasu adenozynomonofosforowego i nukleotydu flawinowego, przenosi dwa protony i dwa elektrony, w efekcie czego utleniona forma FAD przechodzi odwracalnie w formę zredukowaną FADH2
.
Koenzymy flawinowe współdziałają z reduktazami i dehydrogenazami. Grupą czynną przy przenoszeniu protonów i elektronów jest układ izolloksazyny.. Przyjęte przez układ flawinowy atomy wodoru przekazywane są na przenośniki łańcucha oddechowego i za ich pośrednictwem na tlen. PROCES OKSYDOREDUKTACJI FLAWINY
Przy bezpośrednim przeniesieniu atomów wodoru z flawiny na tlen, produktem końcowym jest nadtlenek wodoru H2O2
fosforylacja cykliczna w fotosyntezie przebieg i znaczenie
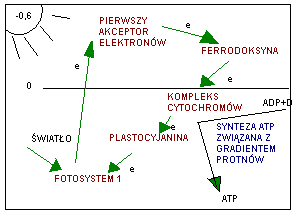
w procesie tym światło wybije elektron z chlorofilu będącego w centrum reakcji fotosystemu 1. elektron poprzez przekaźnik e (pierwszy akceptor, ferodoksyna) wraca z protonem na chlorofil znajdujący się w centrum reakcji. W trakcie wędrówki e wzdłuż łańcucha uwalnia się energia, która wykorzystywana jest do syntezy ATP, nie zachodzi fosfoliza wody-> nie uwalnia się O2 i nie powstaje NADPH. Fosforylacja cykliczna nie może być podstawa fazy ciemnej, ponieważ nie powstaje NADPH niezbędny do redukcji CO2. przebiega ona w komórce wówczas gdy za mało jest NADP by przyjąć elektrony z ferrodyksyny. W wyniku tego procesu powstaje 1 mol ATP, nie powstaje NADPH, nie powstaje O2. II etap - faza ciemna, która może przebiegać w drugi sposób. Jako fotosynteza C2 i fotosynteza c 4.
Synteza kw. Tłuszczowego na dowolnym przykładzie Biosynteza kwasów tłuszczowych odbywa się w cytoplazmie komórek tłuszczowych. Do procesu potrzebny jest acetylokoenzym A. W biosyntezie kwasów tłuszczowych wyróżnić można kilka etapów:
1. acetylokoenzym A ulega karboksylacji do malonylokoenzymu A (malonylo-CoA).
2. Synteza kwasów tłuszczowych na kompleksie enzymatycznym - syntetazie kwasów tłuszczowych. W skład syntetazy wchodzi ACP, ktrory przenosi acyle. ACP zawiera z kolei panteteinę Tworzony kwas tłuszczowy jest związany kowalencyjnie z enzymem. reszta acetylowa jest przeniesiona na ACP. Następnie dochodzi do połączenia reszty malonylowej z resztą acetylową, powstaje 4-węglowa cząsteczka acetoacetylo-S-ACP. Wydzielony wówczas jest CO2 i HS-ACP. CO2 jest uwolniony w wyniku działania syntazy 3-oksoacylo-ACP.
3. Etap redukcji odbywa się przy udziale NADPH i reduktazy 3-oksoacylo-ACP. Dochodzi do redukcji grupy -okso. Powstaje reszta beta-hydroksyacylowa, która poddana jest dehydratacji przy udziale dehydratazy 3-hydroksy-ACP. Powstaje reszta alfa, beta-dehydro-acylowa, która zostaje poddana redukcji przy udziale NADPH i reduktazy enoilo-ACP. Powstaje 4-węglowy rodnik butyrylowy. W następnym obrocie reakcji powstaje kolejna jego cząsteczka, przy czym reszta acylowa z wcześniej wytworzonego rodnika jest przeniesiona na tę następna, wydzielony jest wówczas dwutlenek węgla i powstaje reszta beta-ketoacylowa. Ta znów podlega kondensacji z kolejną. W ten sposób tworzony kwas ulega wydłużaniu do odpowiedniej masy.
4. Uwalnianie gotowego łańcucha kwasu tłuszczowego odbywa się przy pomocy deacylazy. Odłącza ona kwas od HS-ACP,
CH3CO ~ S-CoA + 7HOOC-CH2CO~S-CoA + 14 NADPH + 14 H+ CH3(CH2)14CO~S-CoA + 7 CO2 + 7 HS-CoA + 14 NADP+ + 6H2O
Powstałe kwasy tłuszczowe są gromadzone w komórkach w postaci estrów glicerolu.
MODEL SYNTEZY KW. TŁUSZCZOWYCH
dekarboksylacja aminokwasów Reakcje dekarboksylacji aminokwasów polegają na rozerwaniu wiązania między grupą karboksylową -COOH i resztą cząsteczki aminokwasu, w wyniku czego wydziela się CO2 i powstaje odpowiednia amina. Reakcję katalizują dekarboksylazy aminokwasowe. Dekarboksylacja aminokwasowa jest źródłem amin biogennych - substancji o dużej aktywności fizjologicznej, np. histamina (po dekarboksylacji histydyny), tyramina (po dekarboksylacji tyroksyny), tryptamina (po dekarboksylacji tryptofanu), serotonina = 5-hydroksytryptamina (po dekarboksylacji 5-hydroksytryptofanu). W Wyniku dekarboksylacji niektórych aminokwasów tworzą się ważne części składowe koenzymów, np. 2-propanolamina (składnik koenzymu B12), cysteamina (składnik koenzymu A). Z kwasu glutaminowego powstaje kwas gamma-aminomasłowy.
W wyniku dekarboksylacji aminokwasów obojętnych i zasadowych powstają aminy biogenne, które z wyjątkiem histaminy zwężają naczynia krwionośne i podwyższają ciśnienie krwi. Produkt dekarboksylacji histydyny - histamina rozszerza naczynia krwionośne, powodując spadek ciśnienia krwi oraz wywołując objawy alergiczne. Histamina jest stosowana do wydzielania soku żołądkowego w próbach czynnościowych. Natomiast produktem dekarboksylacji 5-hydroksytryptofanu jest serotonina. Serotonina zwęża naczynia krwionośne, powodując zwiększenie ciśnienia krwi, wywołując skurcz mięśni gładkich. Działa pobudzająco na ośrodkowy układ nerwowy.
5-hydroksytryptofan Serotonina
Rys. 16 Dekarboksylacja aminokwasów
Aminy biogenne można podzielić na aminy alifatyczne (monoaminy i poliaminy), katecholowe (fenolowe, o pierścieniach aromatycznych) i heterocykliczne. Aminy katecholowe (tyramina, dyzamina, adrenalina), imidazolowe (histamina) i indolowe (tryptamina, serotonina) powodują zmiany ciśnienia krwi. Aminy te są też neuroprzekaźnikami, odgrywają ważną role w przenoszeniu impulsów nerwowych przez zakończenia nerwowe (noradrenalina, a jako inhibitor dopamina) oraz poprzez synapsy komórek nerwowych (serotonina). Nadmiar serotoniny w krwi powoduje stany halucynacyjne, a niedobór depresje.
rola translacji w biosyntezie Translacja - to w biologii proces syntezy łańcucha polipeptydowego białek na matrycy mRNA. Proces ten katalizowany jest przez rybosomy. Translacja polega na interpretacji informacji zawartej w kolejności ułożenia nukleotydów mRNA, zgodnie z zasadami kodu genetycznego, na kolejność ułożenia reszt aminokwasowych w białku. Translacja odbywa się w kierunku od 5' do 3' mRNA, a syntetyzowane białko powstaje od końca aminowego do karboksylowego. Proces składa się z trzech etapów: inicjacji, elongacji i terminacji. Zakończenie odbywa się gdy w mRNA zostanie napotkany nonsensowny (stop) kodon nie odpowiadający żadnemu tRNA.
Etap translacji (odczytania, przetłumaczenia) - zachodzi w rybosomach.- biorą w nim udział cząsteczki tRNA. - aminokwas łącząc się z cząsteczką tRNA ulega uaktywnieniu:
tRNA + aminokwas = aminoacylo tRNA
- cząsteczki mRNA umiejscawiają się między dwiema podjednostkami rybosomu.- cząsteczki tRNA dostają się do rybosomu i jeśli maja antykodon komplementarny do kodonu w mRNA to zostawiają tam transportowany aminokwas.- między aminokwasami powstają wiązania peptydowi, rybosom przesuwa się wzdłuż nici mRNA, a łańcuch peptydowy wydłuża się.- translacja zaczyna się kodonem startowym- metionina (AUG), a kończy kodonem nonsensownym (UAA, UAG, ULG).- translacja wymaga: udziału rybosomów, mRNA, dostatecznej ilości aminokwasów, energii, tRNA. translacja jest zatem kluczowym procesem warunkujacym zycie organizmow
rola w metabolizmie jonu amonowego
Cykl ornitynowy, zwany też cyklem mocznikowym lub mocznikowym cyklem Krebsa to cykl przemian biochemicznych (reakcji enzymatycznych) trzech aminokwasów: ornityny, cytruliny i argininy. Do cyklu wprowadzany jest karbamoilofosforan powstały z amoniaku i dwutlenku węgla. Cykl przebiega w mitochondriach i cytoplazmie komórek wątroby (hepatocytów) i wymaga dostarczenia energii w postaci ATP, a jego produktem końcowym jest mocznik.
Reakcje zużywania aminokwasów rozpoczynają się od odłączenia grupy aminowej w procesie deaminacji. Produktami tych reakcji są łańcuchy węglowe (tzw. ketokwasy) oraz jon amonowy. W komórkach człowieka łańcuchy węglowe po przemianach mogą być włączone w glikolizę lub do cyklu Krebsa. Jon amonowy jest silnie toksyczny. W organizmie człowieka jest więc szybko przekształcany w substancję mniej toksyczną i dobrze rozpuszczalną w wodzie - mocznik. W ciągu doby człowiek wydala średnio kilkanaście gramów mocznika w postaci stężonego moczu.
Glukoneogeneza, zespół przemian biochemicznych zachodzących w wątrobie, prowadzący do wytworzenia glukozy lub glikogenu z substancji niecukrowych: aminokwasów, kwasu mlekowego, pirogronowego i in. Glukoneogeneza pobudzana jest i kontrolowana przez glikokortykoidy. Głównym substratem jest pirogronian. Glukoneogeneza ma miejsce głównie w komórkach wątroby, częściowo również w nerkach. W wyniku glukoneogenezy wydzielają się duże ilości energii.
Jest to proces syntezy glukozy z mleczanu i związków nie cukrowych. W warunkach tlenowych, pod wpływem dehydrogenazy mleczanowej, mleczan przechodzi w pirogronian. Właściwy proces glukoneogenezy rozpoczyna się pirogronianu i jest w dużej mierze odwróceniem procesu glikolizy. Jednak nie wszystkie etapy glikolizy można w prosty sposób odwrócić. Do takich etapów należy przejście:
- glukozy w glukozo-6-fosforan,
- fruktozo-6-fosforanu we fruktozo1,6-dwufosforan,
- fosfoenolopirogronianu w pirogronian,
to enzymatyczny proces tworzenia przez organizm glukozy z metabolitów nie będących węglowodanami. Większość czynników wpływających na aktywność szlaku glukoneogenezy to substancje powodujące zmniejszenie czynności wykorzystywanych w nim enzymów, jednak zarówno acetylo-CoA jak i cytrynian działają na nie aktywująco. Glukoneogeneza rozpoczyna się od wytworzenia α-ketoglutaranu przez karboksylację pirogronianu kosztem jedej cząsteczki ATP. Reakcja jest katalizowana przez odpowiednią karboksylazę. α-ketoglutaran jest następnie dekarboksylowany i równocześnie fosforylowany do fosfoenolopirogronianu przez odpowiednią karboksykinazę. W czasie tej reakcji jedna cząsteczka GTP jest hydrolizowana do GDP. Obie reakcje zachodzą w mitochondriach.
Wyszukiwarka