Część teoretyczna
Ebuliometrią nazywamy fizykochemiczną metodę badawczą opartą na zjawisku podwyższenia temperatury wrzenia roztworu w porównaniu z temperaturą wrzenia czystego rozpuszczalnika. Para nad rozcieńczonym roztworem nielotnego składnika (2) w nielotnym rozpuszczalniku (1) składa się praktycznie z cząsteczek rozpuszczalnika p1. Rozpuszczalnik w roztworze rozcieńczonym stosuje się do prawa Raoulta, co oznacza, że prężność pary nad roztworem wyrazi w tym wypadku wzór:
![]()
(1)
gdzie p1* - prężność pary czystego rozpuszczalnika, x1 -jego ułamek molowy.
Prężność pary nad roztworem substancji nielotnej jest więc zawsze niższa od prężności pary czystego rozpuszczalnika. Wielkość obniżenia prężności pary ∆p wynosi:
![]()
(2)
Z równania (2) otrzymujemy:
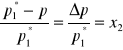
(3)
gdzie:x2 - ułamek molowy substancji rozpuszczonej:
![]()
(4)
Występujące w równaniu (4) wielkości: m1,m2 oznaczają masy rozpuszczalnika i substancji rozpuszczonej, zaś M1,M2 ich masy molowe.
Z równania (3) wynika, ze względne obniżenie prężności pary nad roztworem ![]()
jest równe ułamkowi molowemu substancji rozpuszczonej i nie zależy od jej rodzaju. Z uwagi na to, że roztwory stosujące się do prawa Raoulta to roztwory rozcieńczone, w mianowniku równania (4) można pominąć m2/M2 i otrzyma się wówczas:
![]()
(5)
Ciecz wrze e temperaturze, w której prężność jej pary zrówna się z ciśnieniem atmosferycznym. Jeżeli więc prężność pary ulega obniżeniu, to dla osiągnięcia wartości ciśnienia zewnętrznego np. 1 atm, ciecz musi być ogrzana do temperatury nieco wyższej. Zatem, efekt obniżenia prężności pary nad roztworem substancji nielotnej w porównaniu z czystym rozpuszczalnikiem, prowadzi do podwyższenia temperatury wrzenia roztworu.
Stwierdzono doświadczalnie, że w zakresie stężeń, w których słuszne jest prawo Raoulta, różnica ∆tw między temperaturą wrzenia roztworuT1,2 a temperaturą wrzenia rozpuszczalnika T1 jest proporcjonalna do molalności m:
![]()
(6)
Współczynnik proporcjonalności Ke występujący w powyższym równaniu nosi nazwę stałej ebulioskopowej. Jest to wielkość charakteryzująca dany rozpuszczalnik, niezależna od rodzaju substancji rozpuszczonej. Molalnosć m określa liczbę moli n2 substancji rozpuszczonej w 1000g rozpuszczalnika:
![]()
(7)
Zależność (5) można powiązać z równanie Clausiusa- Clapeyrona, które w przypadku procesu parowania przyjmuje następującą postać:
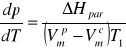
(8)
gdzie:![]()
- temperaturowy współczynnik prężności pary (nachylenie krzywej prężności pary rozpuszczalnika w temperaturze T1), ![]()
- objętości molowe rozpuszczalnika w stanie pary i cieczy, ∆Hpar - molowa entalpia parowania rozpuszczalnika. Jeżeli pominie się Vmc jako dużo mniejsze od Vmp i skorzysta z równania stanu gazu doskonałego dla Vmp, to przy zachowaniu przyjętych symboli, dla 1 mola gazu otrzymuje się:
![]()
(9)
oraz
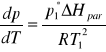
(10)
Nachylenie krzywej prężności pary roztworu jest w przybliżeniu takie samo, jak w przypadku rozpuszczalnika, ponieważ obie krzywe prężności pary są do siebie praktycznie równoległe. Dla niezbyt dużego przedziału temperatury ![]()
można zapisać:
![]()
(11)
Po przekształceniach otrzymujemy ostatecznie:
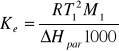
(12)
Jest to stałą ebulioskopową, wiążącą pewne parametry fizykochemiczne rozpuszczalnika. Są to: jego masa molowa M=1, temperarura wrzenia T=1 oraz molowa entalpia parowania R jest stałą gazową. Wyprowadzone powyżej równanie (15) dotyczy ciśnienia normalnego p1* = 1 atm =1,013 105 Pa, a więc temperatura wrzenia rozpuszczalnika T1 jest normalną temperaturą wrzenia Tntw.
Ze względu na to, że podwyższenie temperatury wrzenia roztworu w stosunku do rozpuszczalnika ∆Tw jest proporcjonalne do molalności (6), na podstawie pomiaru przyrostu temperatury wrzenia można wyznaczyć masę molową substancji rozpuszczonej M2 z zależności:
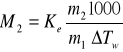
(13)
Podstawowe równanie ebuliometrii (6) jest spełnione jedynie przy idealne roztwory nieelektrolitów. W przypadku, gdy substancja rozpuszczona ulega dysocjacji elektrolitycznej, podwyższenie temperatury wrzenia roztworu jest wyższe, niż wynikało ze wzoru (6), ponieważ wskutek dysocjacji wzrasta liczba niezależnych elementów w roztworze. Van't Hoff wyprowadził, w przypadku takich roztworów, empiryczny wspólczynnik i zwany współczynnikiem izotonicznym, przez który należy pomnożyć stężenie m we wzorze (6), aby uzyskać stężenie efektywne roztworu elektrolitu:
![]()
(14)
Wyznaczona na podstawie takiego oznaczenia masa cząsteczkowa Mdośw różni się od wartości Mteor, uzyskanej ze wzoru chemicznego substancji. Łatwo zauważyć, że doświadczenie oznaczenia masy cząsteczkowej substancji ulegającej dysocjacji jest i razy niższa od wartości teoretycznej:
![]()
![]()
(15)
Ostatni wzór może być stosowany do wyznaczenia współczynnika izotonicznego i, jeżeli wcześniej wyznaczy się doświadczalnie Mdoś na podstawie pomiaru podwyższenia temperatury wrzenia ∆Tw. Arrheniusa zaproponował powiązanie współczynnika izotonicznego ze stopniem dysocjacji elektrolitu, wychodząc z założenia, że współczynnik i powinien być równy stosunkowi sumy stęzeń jonów i cząsteczek niezdysocjowanych do analitycznego stężenia roztwory elektrolitu c.
![]()
(16)
Gdzie c - stężenie roztworu elektrolitu, γ - stężenie jonów, α - stopień dysocjacji
Opracowanie pomiarów
Obliczam masę cząsteczkową substancji rozpuszczonej M2 na podstawie równania:
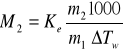
![]()
Ponieważ substancja nie jest elektrolitem nie obliczam współczynnika izotonicznego oraz stopnia dysocjacji
Obliczam wartość błędu wiedząc że masa cząsteczkowa substancji wynosi 78 g/mol
Błąd bezwzględny:
![]()
Błąd względny:
![]()
Obliczam błąd:
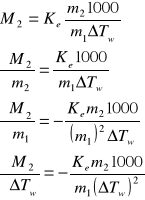
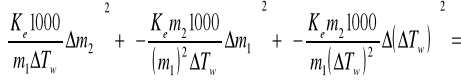
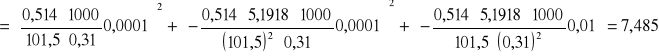
Masa cząsteczkowa substancji rozpuszczonej M2 = 84,81±7,485 [g/mol]
Wnioski:
Masa cząsteczkowa substancji rozpuszczonej otrzymana doświadczalnie jest równa M2 = 84,81±7,485 [g/mol] natomiast masa tej substancji obliczona na podstawie jej wzoru chemicznego jest równa 78 [g/mol] a więc wyniki zgadzają się ze sobą. Błąd pomiaru wynika z pewnej niedokładności przyrządu pomiarowego (waga i termometr) oraz z ograniczeń oka ludzkiego.
Wyszukiwarka
Podobne podstrony:
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
iza 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
sprawozdanie 35 wstep, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i ana
więcej podobnych podstron