Oznaczanie masy molowej metodą krioskopową |
|
|
Marcin Górski |
Data: |
|
Mirosław Dziergowski |
Zaliczenie: |
|
Cel ćwiczenia.
Celem ćwiczenia jest oznaczenie masy molowej substancji metodą krioskopową.
Zasada pomiaru.
Pomiar prowadzi się metodą porównawczą, co prowadzi do wyeliminowania błędów pomiaru np. błąd przestrzeni szkodliwej, stosowanie niezbyt rozcieńczonych roztworów) i oznaczenie masy cząsteczkowej substancji, która nie tworzy z rozpuszczalnikiem roztworów doskonałych.
Stosując tę metodę trzeba pamiętać aby substancja badana i substancja wzorcowa były podobne che-micznie i miały podobne właściwości fizyczne. Wówczas możemy z oznaczenia różnicy temperatur krzep-nięcia substancji wzorcowej o znanej masie cząsteczkowej obliczyć wartość stałej krioskopowej Kkr i przy-jąć założenie, że nie ulega ona zmianie w przypadku rozpuszczalnia oznaczanie substancji o podobnych właściwościach do substancji wzorcowej.
Schemat automatycznego kriometru.
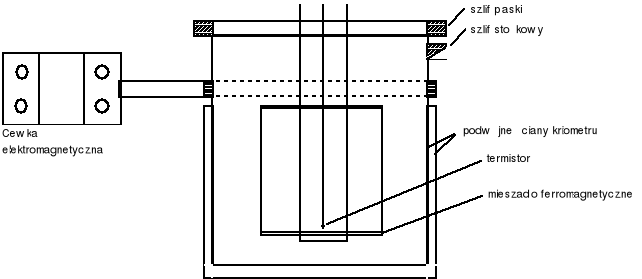
Wyniki pomiarów.
|
|
|
1 |
Rozpuszczalnik |
4,02 [oC] |
2 |
Roztwór substancji wzorcowej |
3,65 [oC] |
3 |
Roztwór substancji badanej |
3,69 [oC] |
4 |
Różnica temp. krzep. rozp. i roztworu substancji wzorcowej (ΔTw) |
0,37 [oC] |
5 |
Różnica temp. krzep. rozp. i roztworu substancji badanej (ΔTb) |
0,33 [oC] |
6 |
Masa rozpuszczonej substancji wzorcowej |
0,25895 [g] |
7 |
Masa rozpuszczonej substancji badanej |
0,27355 [g] |
8 |
Masa rozpusczalnika użytego do rozpuszczenia substancji wzorcowej |
28,0885 [g] |
9 |
Masa rozpusczalnika użytego do rozpuszczenia substancji badanej |
28,3638 [g] |
Obliczenia.
Substancja wzorcowa - naftalen (M = 128,173 [g/mol])
Substancja badana - acenaften (M = 154,211 [g/mol])
1. Różnica temperatur krzepnięcia rozpuszczalnika i roztworu substancji wzorcowej (ΔTb) oraz rozpu-szczalnika i roztworu substancji badanej (ΔTb).
ΔTw = Tr - Tw = 4,02 - 3,65 = 0,37 [oC],
ΔTb = Tr - Tb = 4,02 - 3,69 = 0,33 [oC].
2. Obliczenie masy molowej substancji badanej wg. wzoru:
,gdzie:
Mw - masa molowa substancji wzorcowej,
a - masa rozpuszczonej substancji badanej,
aw - masa rozpuszczonej substancji wzorcowej,
g - masa rozpuszczalnika użytego do rozpuszczenia substancji badanej,
gw - masa rozpuszczalnika użytego do rozpuszczenia substancji wzorcowej,
ΔTb - różnica temperatur krzepnięcia rozpuszczalnika i roztworu substancji badanej,
ΔTw - różnica temperatur krzepnięcia rozpuszczalnika i roztworu substancji wzorcowej.
3. Porównanie masy molowej wyznaczonej teoretycznie i doświadczalnie.
Wnioski.
Temperatura krzepnięcia i stała krioskopowa benzenu odczytane z tablic wynoszą odpowiednio:
5,46 [oC], 5,12 [kg⋅K/mol].
Wielkości te wyznaczone doświadczalnie wynoszą:
4,02 [oC], 5,064 [kg⋅K/mol].
Obliczenie stałej krioskopowej dla benzenu:
gdzie: R - stała gazowa,
TK - temperatura krzepnięcia czystego benzenu (doświadczalna; w skali Kelvina),
M - masa molowa benzenu,
ΔHkrz. - ciepło molowe krzepnięcia benzenu (równe 9,837 [kJ/mol]).
Obliczenie stałej krioskopowej dla benzenu z użyciem substancji badanej:
Obliczenie stałej krioskopowej dla benzenu z użyciem substancji wzorcowej:
W metodzie krioskopowej wyznaczania masy molowej wykorzystane jest zjawisko obniżenia prężności pary nasyconej rozpuszczalnika (benzenu), po rozpuszczeniu w nim substancji nielotnej. Konsekwekcją tego jest obniżenie temperatury krzepnięcia.
Stała krioskopowa stosuje się do rozpuszczalnika (w naszym przypadku benzenu). Różnica temperatur krzepnięcia czystego rozpuszczalnika i roztworu zawierającego 1 mol substancji rozpuszczonej w 1 kg rozpuszczalnika nosi nazwę stałej krioskopowej (KK).
Pomiar prowadzi się metodą porównawczą, co prowadzi do wyeliminowania błędów pomiaru np. błąd przestrzeni szkodliwej, stosowanie niezbyt rozcieńczonych roztworów i oznaczenie masy cząsteczkowej substancji, która nie tworzy z rozpuszczalnikiem roztworów doskonałych.
Stosując tę metodę trzeba pamiętać aby substancja badana i substancja wzorcowa były podobne che-micznie i miały podobne właściwości fizyczne. Wówczas możemy z oznaczenia różnicy temperatur krzep-nięcia substancji wzorcowej o znanej masie cząsteczkowej obliczyć wartość stałej krioskopowej KK i przy-jąć założenie, że nie ulega ona zmianie w przypadku rozpuszczenia oznaczanej substancji o podobnych właściwościach do substancji wzorcowej.
Masę molową substancji można także wyznaczyć metodą ebuliometryczną, albo z pomiarów ciśnienia osmotycznego.
Wyszukiwarka
Podobne podstrony:
Adsorpcja jodu na wŕglu, technologia chemiczna, chemia fizyczna, srawozdania
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
Punkt izoelektryczny, technologia chemiczna, chemia fizyczna, srawozdania
Liczby przenoszenia, technologia chemiczna, chemia fizyczna, srawozdania
Ciep-o spalania, technologia chemiczna, chemia fizyczna, srawozdania
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
Szeregi Hoffmeistera, technologia chemiczna, chemia fizyczna, srawozdania
Napiŕcie powierzchniowe, technologia chemiczna, chemia fizyczna, srawozdania
Si-a jonowa, technologia chemiczna, chemia fizyczna, srawozdania
SEM ogniwa, technologia chemiczna, chemia fizyczna, srawozdania
Ciep-o rozpuszczania, technologia chemiczna, chemia fizyczna, srawozdania
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
5.5L, technologia chemiczna, chemia fizyczna, sprawozdania z chemi fizycznej, 5.5
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
Zadania sem.2, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
więcej podobnych podstron