POMIAR NAPIĘCIA POWIERZCHNIOWEGO CIECZY METODĄ STALAGMOMETRYCZNĄ
Ciecze rzeczywiste mają własną objętość, podobnie jak gazy nie mają własnego kształtu i wykazują w zasadzie właściwości izotropowe. Ich właściwości wynikają z ich struktury wewnętrznej, która odznacza się bardzo małymi (w porównaniu do gazów)
odstępami między cząsteczkami oraz stosunkowo dużymi siłami oddziaływania między
cząsteczkowego. Siły te zazwyczaj mniejsze niż w ciałach stałych są szczególnie duże, gdy cząsteczki są spolaryzowane lub zawierają wiązania atomowe. W tych przypadkach ciecze wykazują znaczny stopień asocjacji cząsteczek.
Warunki panujące we wnętrzu cieczy różnią się od warunków panujących na jej
powierzchni. Siły działające na wybraną cząsteczkę we wnętrzu cieczy są we wszystkich
kierunkach jednakowe, tak iż siła wypadkowa równa jest zeru. Na cząsteczki znajdujące się na powierzchni działają natomiast przede wszystkim siły skierowane w kierunku wnętrza
cieczy nie skompensowane od strony fazy gazowej. Dlatego też ciecze wykazują tendencję do zmniejszania liczby cząsteczek znajdujących się na ich powierzchni. Dzięki temu
powierzchnie cieczy kurczą się ściągane znacznymi siłami, a zwiększenie powierzchni
wymaga pokonania tych sił.
Dana ilość cieczy o określonej objętości ma minimalną powierzchnię wtedy, gdy ma kształt kuli. Wszystkie ciecze wykazują tendencję do przyjmowania tego kształtu, jeżeli nie działają na nie zaburzająco siły grawitacji lub też inne siły.
Napięcie powierzchniowe cieczy γ definiujemy za pomocą równania: ![]()
, gdzie:
F - oznacza siłę, z jaką pas o szerokości l ściąga powierzchnię w kierunku równoległym do długości pasa.
W celu zwiększenia powierzchni należy wykonać pracę równą iloczynowi napięcia powierzchniowego i przyrostu powierzchni. Wytworzenie przyrostu S wymaga nakładu pracy γS. Ilość energii mechanicznej zmagazynowanej w ten sposób nazywamy energią
powierzchniową. Iloraz energii powierzchniowej i powierzchni jest równy napięciu
powierzchniowemu, które uważa się za powierzchniową energię właściwą.
Wynikiem istnienia napięcia powierzchniowego na granicy fazy ciekłej jest zjawisko wznoszenia się cieczy w rurkach kapilarnych. Jeżeli powierzchnia kapilary zwilżana jest przez ciecz, wówczas tworzy się warstwa powierzchniowa. Wznoszeniu się cieczy
towarzyszy zmniejszanie powierzchni.
Siła, która powoduje wznoszenie cieczy, jest równa iloczynowi napięcia
powierzchniowego i długości krzywej, wzdłuż której działa, tj. 2πr , gdzie 2r to średnica
kapilary.
Ciecz wznosi się dotąd, dopóki nie nastąpi zrównanie siły napięcia powierzchniowego z siłą ciężkości słupa cieczy w kapilarze: 2πrγ = πr2hdg, gdzie: d - gęstość cieczy;
g - przyspieszenie ziemskie; h - wysokość, na którą wzniesie się ciecz.
Napięcie powierzchniowe zależy w dużym stopniu od temperatury. Zależność ta jest zazwyczaj liniowa: γt = γo - at, gdzie: a - stała, t - temperatura.
Molowa energia powierzchniowa θ definiowana jest jako energia napięcia
powierzchniowego 1 mola cieczy pod postacią kuli. Pochodna molowej energii
powierzchniowej powinna być stała dla wszystkich cieczy i niezależna od temperatury.
Parachora: P = Vγ1/4, gdzie: V - objętość molowa. Parachora to wielkość addytywna, tzn. że można ja obliczyć jako sumę tzw. parachor atomowych, charakterystycznych dla
atomów wchodzących w skład cząsteczki, oraz tzw. parachor strukturowych,
charakterystycznych dla rodzajów wiązań w cząsteczce.
WYKONANIE ĆWICZENIA
Do badań otrzymujemy trzy ciecze. Najpierw wykonujemy pomiar dla wody, a
następnie dla badanych cieczy (każdy pomiar wykonujemy minimum trzy razy).
Stalagmometr napełniamy powyżej górnej kreski i liczymy liczbę kropel wypływającą z danej objętości. Wyniki pomiarów umieszczamy w tabeli.
ZESTAWIENIE WYNIKÓW
Tabela 1. Wyniki pomiarów.
Liczba kropel wody nw |
Liczba kropel cieczy I nI |
Liczba kropel cieczy II nII |
Temperatura cieczy t [oC] |
105,5 105,0 105,3 |
220,0 218,0 222,0 |
250,0 252,0 255,0 |
25 |
Do ćwiczenia otrzymaliśmy wzory sumaryczne, masy molowe (M.) oraz gęstości (d)
badanych ciecz odpowiednio:
ciecz I C7H8O, M. = 108,14 g/mol, d = 1,0453 g/cm3,
ciecz II C4H10O, M. = 74,12 g/mol, d = 0,8098 g/cm3,
Na podstawie wzorów sumarycznych możemy zaproponować następujące wzory strukturalne:
dla ciecz II
dla cieczy I
Tabela 2. Wartości literaturowe gęstości i napięcia powierzchniowego oraz obliczone wartości parachory (P) dla wariantów strukturalnych badanych cieczy.
Badana substancja |
d [g/cm3] |
Pobl [10-4kg1/4m3/s1/2kmol] |
Plit. [10-4kg1/4m3/s1/2kmol] |
γlit. [10-3N/m] |
Ciecz I |
||||
alkohol butylowy |
0,8115 |
327,7 |
360,8 |
24,6 |
Alkohol secbutylowy |
0,8071 |
327,7 |
- |
23,47 |
alkohol tertbutylowy |
0,8054 |
327,7 |
- |
19,56 |
butan-2-ol |
0,8152 |
327,7 |
359,3 |
22,8 |
eter dietylowy |
0,8138 |
373,6 |
- |
- |
eter metylowo-propylowy |
0,8050 |
373,6 |
- |
- |
eter metylowo-izopropylowy |
0,8160 |
373,6 |
- |
- |
Ciecz II |
||||
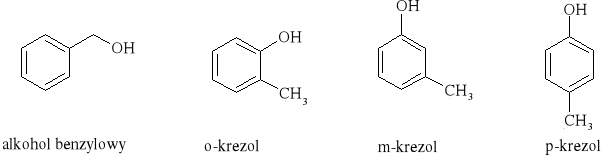
alkohol benzylowy |
1,0454 |
427,1 |
- |
29,96 |
anizol |
0,9893 |
427,1 |
- |
35,45 |
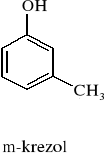
m - krezol |
1,0302 |
427,1 |
457,1 |
37,4 |
o - krezol |
1,1350 |
427,1 |
457,8 |
- |
p - krezol |
1,0178 |
427,1 |
- |
36,7 |
Ciecz III |
||||
kwas masłowy |
0,9532 |
383,9 |
371,8 |
26,8 |
kwas izo-masłowy |
0,9682 |
383,9 |
369,5 |
25,2 |
octan etylu |
0,9010 |
383,9 |
386 |
23,9 |
propionian metylu |
0,9151 |
383,9 |
382,5 |
24,9 |
Parachory zostały obliczone na podstawie: „Ćwiczenia z chemii fizycznej z programami do obliczeń na EMC”, Z.S. Hippe, A. Kerste, M. Mazur; str.233 Tbela II-20, PWN, W - wa 1987.
Wartości podkreślone są najbardziej zbliżone do otrzymanych w doświadczeniu.
WNIOSKI
Ćwiczenie polega na wyznaczeniu napięcia powierzchniowego nieznanej czystej cieczy metodą stalagmometryczną, obliczeniu wartości parachory cieczy oraz zasugerowaniu wzoru strukturalnego na podstawie znanej gęstości ciecz, masy molowej oraz wzoru sumarycznego
Na postawie wykonanych pomiarów możemy ustalić wzory strukturalne badanych związków.
Ciecz I:
Ciecz II:
Wartości literaturowe parachory nieznacznie różnią się od otrzymanych w ćwiczeniu, ale są najbardziej zbliżone. I jeszcze podane gęstości też wskazują na wymienione wyżej związki.
Wymienione różnice są wynikiem między innymi niedokładnym wyznaczeniem liczby kropel, niedoskonałością aparatury pomiarowe oraz w trudności wyznaczenia momentu oderwania się pierwszej i ostatniej kropli wypływającej z danej objętości stalagmometru.
Wyznaczanie struktury związku organicznego tą metodą nie jest zbyt dokładne lepiej można to osiągnąć stosując metody IR, 1NMR, UV-Vis lub analizę jakościową związków organicznych.
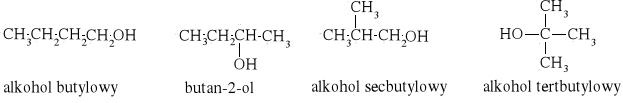
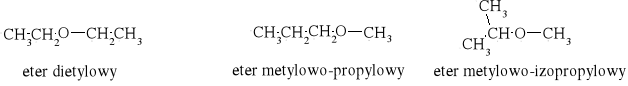
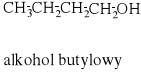
Wyszukiwarka
Podobne podstrony:
Pomiar napięcia powierzchniowego cieczy metodą stalagmomet, Technologia chemiczna, Chemia fizyczna
Parachora 1, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
8.3 wykres', Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
cwiczenie 91-93, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
Parachora 2, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
Wyznaczanie napięcia powierzchniowego cieczy metodą stalagmometryczną, Technologia chemiczna, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
8.1 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
szybkość i mechanizm reakcji 6.1L(1), Technologia chemiczna, Chemia fizyczna, laboratorium
więcej podobnych podstron