3
numer studenta
DOROTA BARTCZAK
imię i nazwisko
nr indeksu 116201
Wydział BIOTECHNOLOGII I NAUK O ŻYWIENIU
Semestr TRZECI
Rok akademicki 2003/2004
Laboratorium chemii fizycznej
Ćwiczenie nr 13
Wyznaczanie ciepła krzepnięcia.
Tytuł ćwiczenia
ocena z kolokwium___________
ocena ze sprawozdania________
-1-
CZĘŚĆ TEORETYCZNA
I POJĘCIA PODSTAWOWE.
1. Energia wewnętrzna - to część energii układu zależna od jego stanu wewnętrznego.
Składają się na nią wszystkie oddziaływania wewnątrz i międzycząsteczkowe.
2. Ciepło - to część energii, która przepływa z jednego ciała do drugiego na skutek istnienia
różnic temperatur.
II I ZASADA TERMODTNAMIKI.
W układzie odizolowanym całkowita ilość energii pozostaje stała, mogą natomiast
przechodzić jeden w drugi rodzaje energii.
ΔU = q + W,
gdzie:
ΔU - zmiana energii układu,
q - ciepło,
W - praca.
III PRAWO HESSA.
W procesie izochorycznym lub izobarycznym, w którym nie występuje praca nieobjętościowa, efekty cieplne, odpowiednio ΔU lub ΔH (zmiana entalpii), nie zalezą od drogi przemiany, a tylko od jej stanu początkowego i końcowego.
IV PRAWO KIRHCHOFFA.
Zmiana efektu cieplnego ( ΔH lub ΔU ) reakcji związana za zmianą temperatury wyraża się różnicą sumarycznej pojemności cieplnej ( odpowiednio cp lub cv ) produktów i substratów tej reakcji.
ΔHT = ΔHo + ![]()
V TERMISTORY.
Termistory - to specyficzne rezystory, których oporność elektryczna zmienia się wraz z temperaturą. Zależność rezystancji od temperatury ma charakter wykładniczy. Aby obliczyć temperaturę termistora korzysta się ze wzoru:
T = 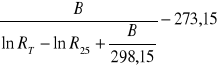
-2-
gdzie:
B - stała materiałowa [deg],
RT - rezystancja termistora w temperaturze T [kΩ],
R25 - rezystancja termistora w temperaturze 25 oC [kΩ].
VI POMIAR KALORYMETRYCZNY.
Ilość ciepła wydzielonego (względnie pochłoniętego) w kalorymetrze przez 1 mol reagenta obliczamy ze wzoru:
Q = ![]()
,
gdzie:
K - pojemność cieplna układu kalorymetrycznego,
Δt - zmiana temperatury układu kalorymetrycznego,
Συ -poprawka uwzględniająca wymianę ciepła z otoczeniem podczas pomiaru,
m - odważka substratu wziętego w nadmiarze stechiometrycznym,
M - masa molowa tego substratu.
Jeżeli w kalorymetrze zachodzi jednocześnie kilka procesów o różnych efektach cieplnych to oznaczona wielkość jest ich sumą:
Q = q1 + q2 + q3 + ... + qn
CZĘŚĆ PRAKTYCZNA
I CEL I METODA ĆWICZENIA.
Celem ćwiczenia jest wyznaczenie efektu cieplnego krzepnięcia tiosiarczanu sodu, wyznaczając najpierw pojemność cieplną układu, mając dane molowe ciepło rozpuszczania kwasu siarkowego (VI) w wodzie.
II SPRZĘT UŻYTY W ĆWICZENIU.
Kalorymetr.
Termistor.
Ampułka z kwasem siarkowym.
Ampułka ze stopionym tiosiarczanem sodu.
-3-
III TABELE Z WYNIKAMI WARTOŚCI MIERZONYCH.
1. Wyznaczanie pojemności cieplnej układu kalorymetrycznego (pomiary podczas
rozpuszczania kwasu siarkowego H2SO4).
Oznaczenia:
mkw. - masa kwasu H2SO4 znajdującego się w ampułce [g],
R - rezystancja odczytana z termistora [kΩ],
t - czas [min],
Mkw. - masa molowa kwasu H2SO4 [g/mol].
mkw. = 6,38 g
Mkw. = 98 g/mol
a) Faza początkowa.
Lp |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
R [kΩ] |
39,80 |
39,80 |
39,80 |
39,80 |
39,80 |
39,80 |
39,80 |
39,80 |
39,80 |
39,80 |
t [min] |
0,0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
b) Rozpuszczanie się kwasu H2SO4 w wodzie (zbicie ampułki pomiędzy 10, a 11
punktem).
Lp |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
R [kΩ] |
39,60 |
32,70 |
33,25 |
34,40 |
34,95 |
35,46 |
36,21 |
36,78 |
37,24 |
37,60 |
t [min] |
5,0 |
5,5 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
c) Stabilizowanie się temperatury w kalorymetrze - faza końcowa.
Lp |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
R [kΩ] |
37,87 |
38,21 |
38,58 |
38,94 |
39,30 |
39,75 |
41,20 |
41,20 |
41,20 |
41,20 |
t [min] |
10,0 |
10,5 |
11,0 |
11,5 |
12,0 |
12,5 |
13,0 |
13,5 |
14,0 |
14,5 |
2. Wyznaczanie ciepła krzepnięcia roztopionego tiosiarczanu sodu Na2S2O4.
Oznaczenia:
mts. - masa tiosiarczanu sodu Na2S2O4 znajdującego się w ampułce [g],
R - rezystancja odczytana z termistora [kΩ],
t - czas [min],
Mts. - masa molowa tiosiarczanu sodu Na2S2O4 [g/mol].
mts. = 2,54 g
Mts. = 248,18 g/mol
-4-
a) Faza początkowa.
Lp |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
R [kΩ] |
40,07 |
41,20 |
41,60 |
41,80 |
41,90 |
42,00 |
42,00 |
42,10 |
42,30 |
42,40 |
t [min] |
0,0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
b) Krzepnięcie tiosiarczanu sodu w wodzie (wrzucenie kryształka pomiędzy 10, a 11
punktem).
Lp |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
R [kΩ] |
42,40 |
42,40 |
42,50 |
42,50 |
42,50 |
42,50 |
42,60 |
42,60 |
42,60 |
42,70 |
t [min] |
5,0 |
5,5 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
c) Stabilizowanie się temperatury w kalorymetrze - faza końcowa.
Lp |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
R [kΩ] |
42,70 |
42,60 |
42,60 |
42,60 |
42,50 |
42,50 |
42,40 |
42,40 |
42,40 |
42,30 |
t [min] |
10,0 |
10,5 |
11,0 |
11,5 |
12,0 |
12,5 |
13,0 |
13,5 |
14,0 |
14,5 |
IV WYKRESY ZALEŻNOŚCI REZYSTANCJI OD CZASU.
.
1. Wykres 1 - Wyznaczanie pojemności cieplnej układu kalorymetrycznego (pomiary
podczas rozpuszczania kwasu siarkowego VI), str. 6.
Oznaczenia:
A - koniec okresu początkowego,
B - początek reakcji,
C - początek okresu końcowego,
Δt + Συ - zmiana temperatury i poprawka na promieniowanie.
Uwagi:
Przy wyznaczaniu Δt + Συ biorę pod uwagę początek reakcji B i początek okresu
końcowego C.
2. Wykres 2 - Oznaczanie ciepła krzepnięcia tiosiarczanu sodu, str. 7.
Oznaczenia:
A - początek krzepnięcia,
B - koniec krzepnięcia (10 pomiarów),
Δt + Συ - zmiana temperatury i poprawka na promieniowanie.
Uwagi:
Przy wyznaczaniu Δt + Συ biorę pod uwagę początek procesu A i jego koniec B. Proces ten
powinien rozpocząć się po 10 pomiarach (po wrzuceniu kryształka), ale rozpoczął się
praktycznie od razu (woda w kalorymetrze była zbyt zimna).
-5-
V OBLICZENIA.
1. Wyznaczanie pojemności cieplnej układu kalorymetrycznego.
Korzystam ze wzoru:
K = ![]()
,
gdzie:
K - pojemność cieplna układu,
Q - efekt cieplny rozpuszczania odczytany z danych w instrukcji,
mkw. - masa kwasu,
Mkw. - masa molowa kwasu.
Δt + Συ - zmiana temperatury i poprawka na promieniowanie, którą obliczam ze wzoru:
Δt + Συ = 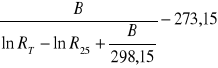
,
gdzie:
B - stała materiałowa [deg],
RT - rezystancja termistora w temperaturze T [kΩ] odczytana z wykresu 1 str. 6,
R25 - rezystancja termistora w temperaturze 25 oC [kΩ].
Dane do obliczeń;
Q = 76,38 kJ/mol,
mkw. = 6,38 g,
Mkw. = 98 g/mol,
B = 3814 deg,
R25 = 14,29 kΩ,
RT = 4,3 kΩ.
Wstawiam do wzorów:
Δt + Συ = 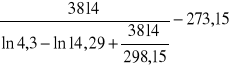
= 55,9 K
K = ![]()
=0,09 kJ/K
2. Oznaczanie ciepła krzepnięcia tiosiarczanu sodu.
Korzystam ze wzorów:
Q = ![]()
,
gdzie:
K - pojemność cieplna układu kalorymetrycznego,
mts -masa tiosiarczanu,
Mts - masa molowa tiosiarczanu,
Δt + Συ - zmiana temperatury i poprawka na promieniowanie.
QK = Q + ( Cs - Cc) (321 K - T pomiaru) M,
-8-
gdzie:
Cs - ciepło właściwe tiosiarczanu stałego,
Cc - ciepło właściwe tiosiarczanu ciekłego,
M - masa molowa tiosiarczanu
Dane do obliczeń;
mts. = 2,35 g,
Mts. = 248,18 g/mol,
B = 3814 deg,
R25 = 14,29 kΩ,
RT = 2,4 kΩ.
Cs = 1,8415 kJ/kg · deg
Cc = 2,3815 kJ/kg · deg
Wstawiam do wzorów:
Δt + Συ = 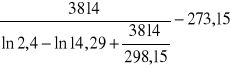
= 70,49 K
Q = ![]()
= 669,99 kJ/mol
QK = 669,99 + ( 1,8415 - 2,3841) (321 - 316,42) 248,18 = 53,25 kJ/mol
VI WNIOSKI.
Ciepło krzepnięcia tiosiarczanu sodu obliczone z ćwiczenia:
QK = 53,25 kJ/mol
Wartość ciepła krzepnięcia tiosiarczanu sodu odczytana z tablic:
QK = 47,42 kJ/mol.
Błędy w wyniku mogą być spowodowane głównie tym, że temperatura wody w naczyniu pomiarowym była zbyt niska i proces krzepnięcia rozpoczął się praktycznie od razu po zanurzeniu w wodzie ampułki (w chwili wrzucenia kryształka tiosiarczan już dawno był w stanie stałym), przez co nie udało się poprawnie odczytać zmian rezystancji. Błąd mogło zwiększyć również niedokładność w graficznym wyznaczaniu Δt + Συ.
-9-
Wyszukiwarka
Podobne podstrony:
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
Część teoretyczna do kolokwium C, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, se
Fizyczna 43, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
wykresy15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
moje ChF 54, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
Wykres zaleznosci temperatury kalorymetru od czasu, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywi
sprawko15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
22 wstęp teoretyczny 2015, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4
Moje Ćw 24, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizycz
chemia zywnos, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia Żyw
ChZywnosci - sciaga, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chem
chem zyw sciagi 2003, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Che
13.KONDUKTOMETRIA, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV, Chemi
9.RÓWNOWAGI FAZOWE W UKŁADACH TRÓJSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywieni
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
0.WSTĘP, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV, Chemia fizyczna
więcej podobnych podstron