WSTĘPNE POJĘCIA CHEMICZNE
Chemia jako dziedzina nauki
Materia to cały makrokosmos, na którego budowę składają się wszelkie ciała "mikrokosmosu" jak cząstki elementarne, różne rodzaje promieniowania, itp.
Materia składa się z:
- substancji prostych czyli pierwiastków chemicznych
(np. wodór, siarka, złoto),
- substancji złożonych czyli związków chemicznych
(np. sól kuchenna, gips),
- mieszanin dwu lub więcej substancji prostych lub złożonych
(np. powietrze, skały, węgiel kopalny, cement).
Budowa atomu
Atom jest zbudowany z:
- jądra atomowego,
- chmury elektronowej.
Średnice atomów pierwiastków 37 - 133 pm
Średnica jądra 1 - 7 fm
Gęstość materii w jądrze ~ 1017 kg/m3
1 cm3 jądra ma masę 100 mln ton !
Jądra składają się z :
- protonów (cząstki dodatnie)
- neutronów (cząstki obojętne)
Chmura elektronowa: elektrony
Masa atomowa
Masy atomów, jąder atomowych, cząstek elementarnych (mikrokosmos) wyraża się za pomocą ATOMOWEJ JEDNOSTKI MASY:
1 u = 1,661⋅10-27 kg |
||||||
ATOMOWA JEDNOSTKA MASY (u) jest równa 1/12 masy atomu nuklidu węgla 126C JEST TO JEDNOSTKA SKALI ATOMOWEJ |
||||||
Cząstki podstawowe |
Masa (g) |
Masa (u) |
Ładunek elektryczny |
Symbol |
||
elektron proton neutron |
9,1093897⋅10-28 1,672649⋅10-24 1,674954⋅10-24 |
0,00054857 1,007272 1,008665 |
-1 +1 0 |
e p n |
||
Model standardowy (opis uproszczony):
pierwotnymi składnikami materii są kwarki i leptony;
patrz: (fizyka jądrowa).
NUKLID to zbiór atomów o jednakowym składzie jądra. Nuklidy opisuje się ogólnie:
A - liczba masowa, Z - liczba atomowa, X - symbol pierwiastka
LICZBA MASOWA (A) jest równa liczbie protonów i neutronów w jądrze. LICZBA ATOMOWA (Z) jest równa liczbie protonów w jądrze |
Przykłady nuklidów: ,
Inny (uproszczony) zapis: 1H, 60Co, 137Cs,
Jeszcze inny zapis nuklidów: H-1, Co-60, Cs-137.
A - liczba masowa, Z - liczba atomowa, X - symbol pierwiastka
Nuklidy tego samego pierwiastka nazywają się IZOTOPAMI. Izotopy danego pierwiastka różnią się liczbą neutronów w jądrze.
Np. nuklidy wodoru: są to 3 znane izotopy wodoru.
W przypadku izotopów wodoru mamy odpowiednio 0, 1 i 2 neutrony w jądrze.
Izotopy mogą być:
trwałe
nietrwałe, czyli promieniotwórcze.
Po 1 izotopie trwałym posiadają: F, P, Sc, Mn, As, Y, Nb, I, Cs, Au, Bi
Najwięcej izotopów trwałych posiada cyna (10)
Brak trwałych izotopów dla pierwiastków występujących w przyrodzie:
- ciężkie pierwiastki o 84 < Z < 92
Skład izotopowy dla wybranych pierwiastków
Liczba atomowa |
Symbol |
Liczby masowe izotopów (w nawiasach podano zawartość w procentach masowych) |
1 2 4 6 19 50
53 55 57
75 79 83 |
H He Be C K Sn
I Cs La
Re Au Bi |
1(99,985), 2(0,015) 4(99,99987), 3(0,00013) 9(100), 10(0,0002) 12(98,89), 13(1,11) 39(93,2), 41(6,8), 40*(0,0119) 112(1,02), 114(0,69), 115(0,38), 116(14,3), 117(7,6) 118(24,1), 119(8,5), 120(32,5), 122(4,8), 124(6,1) 127(100) 133(100) 138(0,089), 139(0,097), 134(2,42), 135(6,6), 136(7,8) 137(11,3), 138(71,7) 185(37,1), 187*(62,9) 197(100) 209(100) |
* Nuklidy nietrwałe wykazujące bardzo długi okres półtrwania i z tego powodu zwyczajowo uwzględniane przy określaniu składu izotopowego pierwiastków.
MASĄ ATOMOWĄ nazywamy masę atomu pierwiastka wyrażoną w atomowych jednostkach masy.
Jak się ma masa atomowa pierwiastka do mas izotopowych poszczególnych izotopów tego pierwiastka ?
Pierwiastek występujący w przyrodzie jest w większości przypadków mieszaniną izotopów.
MASĘ ATOMOWĄ PIERWIASTKA obliczamy jako średnią ważoną z mas izotopowych naturalnej mieszaniny izotopów.
Przykład - węgiel:
12C 98,89 % 12,000000 u
13C 1,11 % 13,003355 u
masa atomowa węgla:
(98,89 ⋅ 12,000000 + 1,11 ⋅ 13,003355) / 100 = 12,011 u
MASĄ CZĄSTECZKOWĄ nazywamy masę cząsteczki pierwiastka lub związku chemicznego wyrażoną w atomowych jednostkach masy. Masę cząsteczkową obliczamy sumując masy atomowe wszystkich atomów wchodzących w skład cząsteczki.
W chemii używamy też tzw. względnej masy atomowej (cząsteczkowej).
WZGLĘDNA MASA ATOMOWA (CZĄSTECZKOWA) jest to stosunek masy atomu danego pierwiastka (cząsteczki danego pierwiastka lub związku chemicznego) do 1/12 masy atomu nuklidu C-12. Jest to wielkość bezwymiarowa.
4. Mol
Jakie jest przejście pomiędzy makro- i mikrokosmosem?
To przejście umożliwia wielkość zwana LICZNOŚCIĄ.
Jest to wielkość tego samego rodzaju co tuzin (12 sztuk) czy kopa (60 sztuk). Jednostką liczności jest MOL.
1 MOL zawiera liczbę cząstek (cząsteczek, atomów czy jonów) równą liczbie atomów zawartych w 12 gramach nuklidu węgla C-12
|
Liczba cząstek chemicznych* zawartych w 1 molu jest nazywana
LICZBĄ AVOGADRO i wynosi 6,022045 ⋅1023
*cząstki chemiczne to elementy struktury materii: atomy, cząsteczki, jony, rodniki, pary jonowe. Inna nazwa cząstki to indywiduum chemiczne.
WIELKOŚCI PODSTAWOWE UKŁADU SI* i ich jednostki:
Wielkości |
Zalecane oznaczenia wielkości |
Jednostki
|
Oznaczenia jednostek |
długość masa czas natężenie prądu elekt. temperatura światłość liczność |
l m t I T I n |
metr kilogram sekunda amper kelvin kandela mol |
m kg s A K cd mol |
* Międzynarodowy Układ Jednostek Miar zatwierdzony w 1960 r. (w Polsce od 1966 r.). Skrót pochodzi z j. franc. Systeme Internatond d'Unites
MASA MOLOWA jest to masa 1 mola wyrażona w g/mol.
Zależność masy atomowej, masy molowej i względnej masy atomowej:
np. dla wodoru:
1,0079 u → 1,0079 g/mol → 1,0079
Jak obliczyć masę 1 atomu wodoru?
masa 1 atomu wodoru =
= (1,0079 g/mol) / 6,022⋅1023 /mol = 1,6736⋅10- 27 kg.
Jaka jest objętość 1 mola pierwiastka lub związku chemicznego w stanie gazowym?
W warunkach normalnych, tj. w 273,15 K (0 0 C) i pod ciśnieniem 1,10035⋅105 Pa
(1 atm), objętość ta wynosi: 22,41 dm3/mol.
Zadanie - definicja mola:
Obliczyć liczbę atomów miedzi znajdującej się w płytce tego metalu
o grubości 1 μm i powierzchni 1 mm2
Rozwiązanie:
Gęstość miedzi d = 8,92 kg/dm3
Objętość płytki:
V = 1⋅10- 6 m ⋅ (1⋅10- 3)2 m2 = 1⋅10-12 m3 = 1⋅10- 9 dm3
Masa płytki :
m = d ⋅ V = 8,92 kg/dm3 ⋅ 1⋅10- 9 dm3 = 8,92⋅10- 6 g
1 mol - 63,55 g
x - 8,92⋅10- 6g
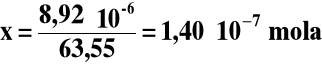
1 mol - 6,022⋅1023 atomów
1,40⋅10- 7 mola - y
y = 6,022⋅1023 ⋅ 1,40⋅10-7 = 8,43⋅1016 atomów
5. Trwałość jądra
Miarą trwałości jądra jest wartość energii wydzielonej podczas jego hipotetycznej syntezy z protonów i neutronów |
Rozpatrzmy atom izotopu berylu ![]()
:
4 protony 4 x 1,0073 u = 4,0292 u
5 neutronów 5 x 1,0087 u = 5,0435 u
4 elektrony 4 x 0,0005 u = 0,0020 u
9,0747 u
Faktyczna masa izotopu ![]()
wynosi 9,0122 u
Ubytek masy (defekt masy) Δm = 0,0625 u
Odpowiada to energii ( E = mc2 ):
0,0625 u ⋅ 1,49⋅10-10 J/u = 9,31⋅10-12 J
Na 1 nukleon: 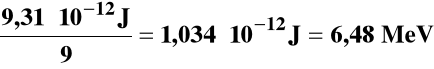
Na 1 mol: 1,034⋅10-12J ⋅ 6,022⋅1023 = 6,22⋅1011 J/mol
Energia jądrowa ~ 6⋅1011 J/mol
Energia chemiczna ~ 105 J/mol
Energia jądrowa >> Energia chemiczna |
Siły jądrowe są zupełnie innego rodzaju niż siły grawitacyjne czy też siły
elektrostatyczne.
Jądra lekkie → synteza jądrowa → energia termojądrowa
Jądra ciężkie → reakcje rozszczepienia jąder → energia jądrowa
Koniec Rozdziału I-go.
Władysław Walkowiak - Chemia Ogólna, kurs WPC 1002w
8 z Roz. I
Rozdział I. Wstępne pojęcia chemiczne
nukleony
}
60 100 200 liczba masowa
8
6
4
2
MEDYCYNA
MIKROBIOLOGIA
BOTANIKA ZOOLOGIA
ASTRONOMIA GEOLOGIA METEOROLOGIA BIOLOGIA INŻYNIERIA
FARMACJA
ORGANICZNA NIEORGANICZNA FIZYCZNA ANALITYCZNA BIOCHEMIA
CHEMIA
FIZYKA
MATEMATYKA
CHEMIA jest nauką zajmującą się:
badaniem budowy
właściwościami materii
przemianami
Max. dla 60Ni (8,75 MeV)
Energia wiązania nuklidów przypadająca na 1 nukleon w zależności od liczby masowej (A)
INŻYNIERIA
E
↑
Wyszukiwarka