Egzamin z chemii fizycznej
Równanie van der Waalsa i znaczenie stałych w nim występujących. 3 punkty
Pewien układ wymienił pewną ilość energii w postaci pracy z otoczeniem Układ ten może być :
a) układem izolowanym
b) układem zamkniętym
c) układem otwartym
Które z wielkości są funkcjami stanu :
a) energia wewnętrzna
b) praca
c) entalpia
d) ciepło
Omówić pierwszą zasadę termodynamiki. 4 punkty
Pewna ilość gazu doskonałego uległa odwracalnemu, adiabatycznemu rozprężeniu.
Energia wewnętrzna gazu : wzrosła zmalała
Końcowa temperatura gazu była : wyższa niższa od początkowej.
Dla których substancji standardowa entalpia tworzenie będzie równa zero :
a) ![]()
b) ![]()
c) ![]()
d) ![]()
Wyprowadzić i omówić prawo Kirchoffa. 5 punktów
Proces zachodzi samorzutnie, jeśli :
a) ![]()
(dla procesu adiabatycznego)
b) ![]()
(dla dowolnego procesu)
c) ![]()
(dla dowolnego procesu)
d) ![]()
(przy V,S = const)
e) ![]()
(przy V,T = const)
Obliczyć standardową entalpię swobodną reakcji w temperaturze 25°C na podstawie tablicowych wartości standardowych entalpii tworzenia i standardowych entropii. 3 punkty
![]()
Zdefiniować pojęcie fazy, składnika niezależnego i stopni swobody. 3 punkty
Wytłumaczyć, dlaczego temperatura topnienia wody maleje, gdy ciśnienie rośnie. 3 punkty
Na rysunku przedstawiony jest wykres fazowy dla równowagi ciecz-para dla układu dwuskładnikowego.
Czy dwie ciecze tworzące układ azeotropowy można rozdzielić przez destylację na składniki ?
tak nie
Mamy 0,1 mol/kg wodny roztwór glukozy i 0,1 mol/kg wodny roztwór NaCl. Czy dowolna wielkość koligatywna będzie :
a) jednakowa dla obu roztworów
b) większa dla roztworu glukozy
c) większa dla roztworu NaCl
Zapisać stałe równowagi Kp dla reakcji. 2 punkty
a) ![]()
b) ![]()
Dana jest reakcja :
![]()
(reakcja egzotermiczna)
a) Wzrost temperatury powoduje przesuniecie równowagi reakcji w lewo.
tak nie
b) Wzrost ciśnienia powoduje przesuniecie równowagi reakcji w lewo.
tak nie
Dlaczego wprowadzono pojęcie średniej aktywności jonowej ? 2 punkty
Siła jonowa pewnego roztworu wynosi 0,015. Współczynniki aktywności jonów
a) można obliczyć z granicznego prawa Debye'a-Hückla
b) można obliczyć z rozszerzonego prawa Debye'a-Hückla
c) trzeba wyznaczać doświadczalnie
Co to jest atmosfera jonowa ? 2 punkty
Zdefiniować przewodnictwo właściwe i molowe roztworu elektrolitu. 2 punkty
Mostek Wheatstone'a do pomiarów przewodnictwa właściwego roztworów elektrolitów jest zasilany prądem zmiennym, gdyż :
a) tak jest wygodniej
b) aby zapobiec polaryzacji elektrod
c) aby uniknąć elektrolizy roztworu
d) bez określonej przyczyny
Obliczyć na podstawie tablic graniczne przewodnictwo molowe i równoważnikowe w temperaturze 25°C wodnego roztworu FeCl3. 2 punkty
Po co potrzebna jest znajomość liczb przenoszenia jonów ? 2 punkty
Co to jest ogniwo galwaniczne i jego siła elektromotoryczna ? 2 punkty
Zapisać reakcje połówkowe, reakcję całkowitą i wzór Nernsta dla ogniwa : 3 punkty
![]()
Reakcja w ogniwie przebiega w sposób samorzutny w kierunku z lewa na prawo, jeśli :
a) E > 0
b) E < 0
c) 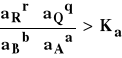
d) 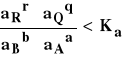
Jednostka szybkości reakcji :
a) jest taka sama dla wszystkich reakcji
b) zależy od stechiometrii reakcji
c) zależy od rzędu reakcji chemicznej
Dla pewnej reakcji czas połowicznej przemiany jest odwrotnie proporcjonalny do stężenia początkowego. Reakcja ta jest :
a) zerowego rzędu
b) pierwszego rzędu
c) drugiego rzędu
d) trzeciego rzędu
e) nie można powiedzieć
Równanie Arrheniusa i definicja energii aktywacji. 3 punkty
Jaki jest mechanizm działania katalizatorów ? 3 punkty
Maksymalna liczba punktów 71
0 - 35 = 2
36 - 42 = 3
43 - 49 = 3 ½
50 - 56 = 4
57 - 63 = 4 ½
64 - 71 = 5
T = const
p
p
0
1
x1 →
Zaznaczyć na rysunku obszar występowania fazy gazowej, ciekłej i współistnienia obu faz w równowadze. 3 punkty
Jeśli mamy ciecz o danym składzie x1, to para będzie zawierała :
a) więcej składnika 1
b) mniej składnika 1
c) nie można powiedzieć
Temperatura wrzenia składnika 1 jest :
a) wyższa niż składnika 2
b) niższa niż składnika 2
c) nie można powiedzieć
Wyszukiwarka