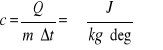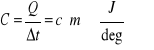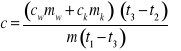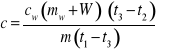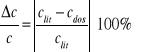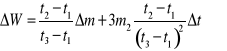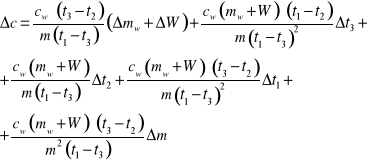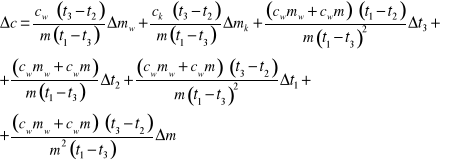Ćwiczenie nr 23
Wyznaczanie ciepła właściwego
ciał stałych
Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie ciepła właściwego ciał stałych.
Wprowadzenie
Przedmiotem kalorymetrii jest mierzenie ilości ciepła i wyznaczanie ciepła właściwego ciał. Aby zwiększyć o Δt temperaturę ciała o masie m należy dostarczyć ciepło Q:
|
(23.1) |
gdzie:
c - ciepło właściwe
m- masa ciała
Zmiana temperatury Δt=ΔT jest taka sama w przypadku gdy wyrazimy ją w stopniach Celsjusza lub Kelvina,.
U podstaw kalorymetrii leży założenie spełnienia zasady zachowania energii. Przyjmujemy, że ilość ciepła Q1 oddana przez badane ciało jest równa ilości ciepła Q2 pobranej przez otoczenie Q1=Q2.Również zakładamy, że ilości ciepła potrzebne do uzyskania określonej zmiany temperatury Δt są inne dla różnych ciał.
Ciepłem właściwym nazywamy ilość ciepła Q potrzebną do ogrzania (oziębienia) jednostki masy m=1kg danego ciała o jeden stopień:
|
(23.2) |
gdzie: deg oznacza temperaturę w stopniach Celsjusza lub Kelvina.
Pojemnością cieplną danego ciała nazywamy ilość ciepła potrzebną do ogrzania całej masy ciała m o jeden stopień:
|
(23.3) |
Ciepło właściwe zależy od stanu skupienia substancji np. dla lodu jest dwukrotnie mniejsze niż dla wody. W dużym przedziale temperatur można również zauważyć zależność ciepła właściwego od temperatury. Również ciepło właściwe zależy od sposobu ogrzewania ciała.
Ciepło właściwe mierzone przy stałym ciśnieniu cp jest większe niż ciepło właściwe przy stałej objętości cv. Ta różnica jest niewielka dla ciał stałych i cieczy, staje się istotna dla gazów. Dla gazów doskonałych z równania Mayera otrzymujemy:
|
(23.4) |
gdzie:
R - uniwersalna stała gazowa,
μ - masa cząsteczkowa gazy.
Ciepło właściwe cieczy i ciała stałego mierzy się w naczyniach kalorymetrycznych, które zmniejszają straty ciepła. Obecnie rolę kalorymetrów często pełnią termosy lub kubki termiczne. Kubek termiczny jest wykonany ze stali nierdzewnej o podwójnych ściankach, pomiędzy którymi panuje obniżone ciśnienie. Wymienione cechy kubka lub termosu minimalizują wymianę ciepła z otoczeniem na skutek promieniowania, konwekcji i przewodnictwa cieplnego.
Aby wyznaczyć ciepło właściwego ciała stałego należy badane ciało o masie m
ogrzać do temperatury t1.Następnie umieszczamy je w kalorymetrze o masie mk i cieple właściwym ck zawierającym wodę o masie m2 w temperaturze t2.Po pewnym czasie ustala się temperatura równowagi termodynamicznej t3.
Korzystając z równań bilansu cieplnego możemy wyznaczyć ciepło właściwe ciała stałego.
Ciepło oddane przez ciało o masie obliczamy ze wzoru Q1:
|
(23.5) |
Kalorymetr o masie mk z wodą o masie mw pobiera ciepło Q2:
|
(23.6) |
Przyjmując że ciepło oddane równa się ciepłu pobranemu Q1=Q2 otrzymamy:
|
(23.7) |
Jeżeli uprzednio wyznaczyliśmy równoważnik wodny kalorymetru możemy zapisać:
|
(23.8) |
We wszystkich wyprowadzonych wzorach zmiana temperatury w stopniach Celsjusza jest taka sama jak zmiana wyrażona w Kelvina ΔT czyli Δt = ΔT i nie ma potrzeby zamiany temperatur ze skali Celsjusza na temperaturę bezwzględną T.
Opis stanowiska laboratoryjnego
Kalorymetr (kubek termiczny), termometr elektroniczny, mieszadełko, elektroniczna waga laboratoryjna lub kuchenna, woda destylowana, pojemnik na wodę, elektryczny czajnik do podgrzewania wody ciała stałe do pomiaru ciepła właściwego, szczypce do przenoszenia ogrzanych ciał.
Program ćwiczenia
Wyznaczyć masę ciała stałego m i jej niepewność pomiarową.
Ciało stałe o masie m podgrzać do temperatury wrzenia wody t1 umieszczając je w czajniku elektrycznym o płaskim dnie. Jeżeli woda zacznie wrzeć potrzymać jeszcze wrzenie przez około 5 minut, aby temperatura ciała była równa temperaturze wrzenia wody. Jeżeli ciśnienie atmosferyczne odbiega od wartości normalnych ustalić, korzystając z tablic fizycznych aktualną temperaturę wrzenia wody t1 przy uprzednio zmierzonym ciśnieniu atmosferycznym.
Zważyć pusty kalorymetr wraz z termometrem i mieszadełkiem - masa mk.
Nalać zimnej wody do kalorymetru. Zmierzyć jej temperaturę t2.
Zważyć ponownie kalorymetr wraz z termometrem i mieszadełkiem masa m1, aby ustalić masę wody mw:
Ostrożnie umieścić badane ciało w kalorymetrze z wodą. Zamknąć naczynie pokrywką, przez którą przełożyć termometr i mieszadełko.
Zmierzyć końcową temperaturę t3.
Ustalić i zapisać niepewności pomiarów bezpośrednich..
Powtórzyć procedurę z punktów 1-8. dla kolejnego ciała stałego.
Sprawozdanie
Obliczyć wartość ciepła właściwego badanego ciała c.
Znaleźć w tablicach ciepło właściwe badanych ciał i obliczyć względną różnicę tablicowych clit i doświadczalnie mierzonych wartości ciepła właściwego cdoś. ze wzoru:
Jeżeli wcześniej wyznaczono równoważnik wodny kalorymetru W skorzystać ze wzoru na bezwzględną maksymalną niepewność systematyczna pomiaru ΔW:
Wyznaczyć maksymalną niepewność systematyczna pomiaru ciepła właściwego Δc metodą różniczki zupełnej korzystając ze wzoru:
Jeżeli nie wyznaczono równoważnika wodnego kalorymetru posłużyć się wzorem:
Przeprowadzić dyskusję wyników i niepewności pomiarowych.
Pytania kontrolne
Wzór na ciepło pobrane lub oddane.
Ciepło właściwe, ciepło molowe, pojemność cieplna.
Zasady układania bilansu ciepłego.
Sposoby przenoszenia ciepła.
|
(23.9) |
Ze względu na duże różnice pojemności cieplnych ilość wody należy dobrać tak, aby tylko przykrywała ciało stałe.
|
(23.10) |
|
(23.11)
|
|
(23.12) |
|
(23.13) |
jeżeli posługujemy się jedną wagą i termometrem wszystkie niepewności pomiaru masy I pomiaru temperatury. będą jednakowe.
147
Wyszukiwarka