Czyste metale są rzadko stosowane w technice, częściej stosuje się stopy metali. Stopy są substancjami dwu i wieloskładnikowymi. Składniki stopów są substancjami prostymi lub złożonymi. Skład chemiczny stopów jest wyrażony przez: stężenie masowe składników, stężenie atomowe składników. Faza jest to jednorodna część stopu, oddzielona od pozostałej jego części granicą międzyfazową. Zbiór faz znajdujący się w stanie równowagi termodynamicznej nazywamy układem. Stopy metali wytwarzane są najczęściej przez krystalizację i topnienie ze stanu ciekłego. W wyniku tego otrzymujemy: roztwory stałe, fazy międzymetaliczne, mieszaniny faz. Roztwór stały stanowi jednorodną fazę o wiązaniu metalicznym i strukturze krystalicznej o własnościach typowo metalicznych. Metal którego atomy przeważają w sieci jest rozpuszczalnikiem, drugi pierwiastkiem rozpuszczonym. Roztwory stałe mogą być: podstawowe (rozpuszczalnikiem pierwiastek będący składnikiem stopu), wtórne (rozpuszczalnikiem faza międzymetaliczna). Roztwory stałe: graniczne (stężenie składnika rozpuszczonego jest ograniczona w pewnym zakresie), ciągłe (nieograniczona rozpuszczalność obu składników w całym zakresie stężeń). Roztwory stałe międzywęzłowe atomy pierwiastka rozpuszczonego są usytuowane w przestrzeni międzywęzłowej sieci metalu rozpuszczalnika. Roztwory stałe różnowęzłowe atomy metalu rozpuszczonego zajmują dowolne węzły sieci metalu rozpuszczalnika. Nadstruktura reakcja nieporządek⇔porządek stosunek atomowy A i B 1:1,1:3,3:1. Fazy międzymetaliczne są połączeniami metalu lub metali i niemetalu i wykazują własności metaliczne ze względu na całkowity lub częściowy udział wiązania metalicznego między atomami wchodzącymi w skład fazy. Fazy międzymetaliczne występują w ściśle określonych stężeniach składników stopu, chociaż mogą występować w pewnym zakresie stężeń i tworzyć roztwory stałe wtórne. Roztwory te mogą wyć: różnowęzłowe, międzywęzłowe, pustowęzłowe. Fazy międzymetaliczne można dzielić w zależności od: stężenia elektronowego lub czynnika elektrochemicznego, wielkości atomów. Fazy elektronowe to roztwory stałe wtórne o wyraźnych własnościach metalicznych. Strukturę tych faz warunkują trzy wartości stężeń elektronowych: 21/14,21/13,21/12. Składnik B zajmuje węzły dwuwymiarowe siatki kagome złożonej z trójkątów i sześcianów. Składnik A umieszczony jest w środku geometrycznym tych figur. Warstwy o takim ułożeniu atomów nakładają się na siebie. Fazy międzywęzłowe o strukturach: prostych, złożonych(znaczna liczba atomów w komórce strukturalnej). O mieszaninie faz mówi się wtedy, gdy w stopie znajdują się co najmniej dwie fazy w stanie rozdzielenia oddzielone od siebie granicami międzyfazowymi. Mają one lepsze własności wytrzymałościowe i gorsze plastyczne. Dwa typy mieszanin faz: eutektyczna i podeutekt. W przypadku równowagi w dowolnym układzie, w którym temperatura i objętość są ustalone, funkcja energii swobodnej Helmholza F osiąga swoje minimum: F=S-TS. Gdy układ znajduje się w stałej temperaturze i działa na niego stałe ciśnienie, po ustaleniu się równowagi energia swobodna Gibbsa G jest minimalna: G=E+pV-TS. Stosunek udziału obu faz mieszaniny , przy danym stężeniu składników i stężeniu składników w poszczególnych fazach odpowiednia c i c, dla każdej temperatury T z zakresu dwufazowego T1 do T2 określa reguła dźwigni (odcinków). a+b=1, bc+ac=c Udział faz: 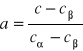
, 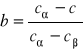
. Praktycznie analiza układu wieloskładnikowego sprowadza się do rozważania zmian składu chemicznego, gdyż zakłada się, że temp i ciśnienie są stałe. Do tego celu wykorzystuje się pojęcie simpleksu. Simpleks bezwymiarowy s0 jest punktem (reprezentuje określony składnik), simpleks jednowymiarowy s1 jest prostą, simpleks dwuwymiarowy s2 jest trójkątem równobocznym (stężeń Gibbsa), trójwymiarowy s3 jest objętością czworościanu foremnego.
Wyszukiwarka