Ćwiczenie nr 20
JONITY
Celem ćwiczenia jest wyznaczenie zdolności wymiennej kationu w stosunku do jonów sodu.
Aparatura i szkło: Odczynniki:
PH-metr HCl 1 : 4
Kolumna kationitowa HCl 1 : 9
Mieszadło magnetyczne NaCl 1 M
Biureta poj. 100 cm3 NaOH 2 M
Zlewka o poj. 400 cm3
Cylinder miarowy - 100 cm3
Kolba stożkowa - 1 szt.
WYKONANIE ĆWICZENIA:
Regeneracja kolumny:
Przed rozpoczęciem oznaczenia zdolności wymiennej jonitu należy kolumnę jonowymienną zregenerować, tzn. otrzymać jonit w formie wodorowej. Regeneracja polega na powolnym przepuszczaniu przez kolumnę kwasu solnego. W tym celu kolumnę przemyć 100 cm3 roztworu HCl rozcieńczonego w stosunku 1:4; szybkość przepływu - 8 cm3/min (160 - 170 kropli/min). Następnie przepuścić 150 cm3 wody destylowanej i ponownie 100 cm3 kwasu solnego 1 : 9 (szybkość przepływu 8 cm3/min). Kolumnę przemyć wodą destylowaną aż do całkowitego usunięcia niezwiązanego kwasu. Kwasowość wycieku badać papierkiem wskaźnikowym.
Oznaczanie zdolności wymiennej kationitu:
Przez kolumnę jonitową przepuścić 150 cm3 1M NaCl tak, by szybkość przepływu wynosiła 2,5 cm3/min (70 kropli/min). Jony Na+ wypierają z grup czynnych jony wodorowe, które przechodzą do wycieku. Ponieważ pierwsze partie wycieku zawierają jeszcze czystą, wypartą z kolumny wodę, należy badać jego odczyn. Właściwy etap ćwiczenia rozpocznie się w chwili, gdy z kolumny zacznie wyciekać kwas. Po przepuszczeniu przez kolumnę 150 cm3 NaCl przepuszczać przez kolumnę wodę destylowaną, a eluat zbierać w zlewce o poj. 400 cm3do momentu, aż wyciek będzie miał odczyn obojętny.
Należy pamiętać, że jonit ani przez chwilę nie może być „suchy”. Nad jego powierzchnią stale musi znajdować się 1-2 cm warstwa płynu (tak w czasie wykonywania ćwiczenia, jak i po jego zakończeniu).
Do oznaczenia stężenia kwasu w eluacie stosujemy metodę miareczkowania potencjometrycznego. W tym celu zlewkę z badanym roztworem umieścić na podstawie mieszadła magnetycznego, zanurzyć w roztworze elektrodę kombinowaną oraz mieszalnik. Miareczkować 2 M NaOH, wprowadzając do eluatu po 1 cm3 zasady do chwili, gdy pH cieczy w zlewce przekroczy wartość 10 jednostek.
Opracowanie wyników:
Sporządzić dwa wykresy krzywej miareczkowania:
pH = f(V),
gdzie: V - objętość dodanej zasady,
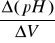
= f(V),
gdzie: Δ(pH) - zmiana pH spowodowana dodaniem V objętości zasady.
Z wykresu b) określić punk końcowy miareczkowania. Znając stężenie zasady wyznaczyć całkowitą ilość gramorównoważników kwasu w eluacie. Zdolność wymienną jonitu (kationitu) obliczyć ze wzoru:
Z = ![]()
,
gdzie: a - ilość gramorównowazników kwasu w wycieku,
q - masa jonitu w kolumnie (q = 50 g).
Wyszukiwarka