Laboratorium z biochemii
Ćwiczenie 9
Temat:
Enzymatyczna hydroliza pektyn
Data wykonania ćwiczenia: 19.12.2008r.
1. Wstęp teoretyczny
Pektyny - mieszanina węglowodanów występująca w ścianach komórkowych wielu roślin. Pektyny są generalnie polisacharydami i oligosacharydami o zmiennym składzie. Są to przede wszystkim poliuronidy składające się z połączonych ze sobą wiązaniami α-1,4-glikozydowymi jednostek kwasu D-galakturonowego, w znacznej części zestryfikowanych alkoholem metylowym. Pektyny dla ludzi, pod względem odżywczym są ciałami balastowymi. Pod względem żywieniowym stanowią jedną z frakcji rozpuszczalnego włókna pokarmowego (błonnika). Wiele mikroorganizmów jest w stanie rozkładać pektynę.
Wyróżniamy dwie frakcje pektyn, w zależności od stopnia estryfikacji:
wysokometoksylowane (WM), w których zestryfikowanych jest >50% grup karboksylowych reszt kwasu galakturonowego;
niskometoksylowane (NM), w których stopień estryfikacji jest mniejszy od 50%.
Wspólną cechą pektyn jest zdolność do tworzenia żeli w kwaśnych warunkach. Zdolność żelowania zależna jest od stopnia zmetoksylowania pektyn. Pektyny wysokometoksylowane żelują przy pH 3,0, stężeniu cukru 65% oraz zawartości pektyn 0,3 - 2%. Żele pektyn niskometoksylowanych powstają przy niższym stężeniu cukru (30-40%) oraz w szerszym zakresie pH (3-6). Jednak niezbędnym czynnikiem utworzenia trójwymiarowej siatki żelu jest obecność jonów wapnia, w stężeniu 0,01 - 0,1%. Zawartość pektyn wynosi wtedy 1,5 - 3,0%. Z tego względu są one wykorzystywane w przemyśle spożywczym jako środek zagęszczający. Pektyny między innymi odpowiedzialne są za zestalanie się dżemów i powideł.
Enzymy pektynolityczne - enzymy degradujące substancje pektynowe, wytwarzane przez rośliny i wiele drobnoustrojów. Należą do nich enzymy deestryfikujące i depolimeryzujące.
Pektynoesterazy (PE) - hydrolizują wiązania estrowe w pektynie z uwolnieniem alkoholu metylowego.
Endopoligalakturonazy - zwane potocznie poliglakturonazami, hydrolizują wewnętrzne wiązania 1,4-ၡ w kwasi pektowym w sposób nieuporządkowany, wytwarzając oligopoligalakturonidy. Enzymy te rozszczepiają jedynie wiązania glikozydowe sąsiadujące z wolna grupa karboksylową.
Egzopoligalakturonazy - wyróżnia się 2 grupy: jedna z nich uwalnia od nieredukującego końca kwasu pektowego reszty kwasu D-galakturonowego, druga odszczepia od nieredukującego końca digalakturonidy.
Liazy pektynianowe - rozszczepiają na drodze transeliminacji wewnętrzne wiązania 1,4-ၡ-glikozydowe w pektynie, nie działają na kwas pektowy.
Liazy pektatowe - rozszczepiają wewnętrzne wiązania glikozydowe w kwasie poligalakturonowym, lecz nie działają na pektyny.
2. Cel ćwiczenia
Poznanie metod oznaczenia najważniejszych aktywności charakteryzujących preparaty pektynolityczne:
aktywność pektynoesterazy (PE)
ogólna aktywność pektynolityczna wyrażoną w oPM
aktywność poligalakturonazy (PG)
3. Część praktyczna
3.1. Oznaczenie ogólnej aktywności pektynolitycznej.
Wykonanie ćwiczenia:
Mierzymy czas wypływu przez kapilarę wiskozymetru wody destylowanej o temperaturze 20ºC - tH2O
tH2O = 118[s]
Do 20 ml 0,5% roztworu pektyny w 0,01M buforze octanowym o pH 3,8 o temperaturze 20ºC wprowadzamy 0,2 ml wody destylowanej i dokładnie mieszamy. Następnie odpowiednią ilość roztworu wlewamy do wiskozymetru i mierzymy czas wypływu - ta
ta = 193[s]
Do 20 ml 0,5% roztworu pektyny w 0,01M buforze octanowym o pH 3,8 o temperaturze 20ºC wprowadzamy 0,2 ml odpowiednio rozcieńczonego tym buforem enzymu, mieszamy i inkubujemy w temperaturze 20ºC w ciągu 30 minut. Po tym czasie wlewamy odpowiednią ilość próby do wiskozymetru i mierzymy czas wypływu - t.
t = 162[s]
Obliczenia:
Wyliczam lepkość początkową roztworu pektyny Va z wzoru:
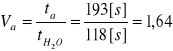
Wyliczam lepkość roztworu pektyny V po określonym czasie działania enzymu ze wzoru:
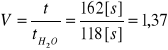
Obliczam procentowy spadek lepkości roztworu pektyny A :
![]()
V0 = 1,1 - lepkość graniczna, czyli po całkowitej hydrolizie pektyn
Wyliczam ogólną aktywność pektynolityczną, wyrażoną w ºPM
Obliczam CE - stężenie preparatu enzymatycznego w roztworze pektyny
Ponieważ reakcja prowadzona jest w roztworze zawierającym 20 ml pektyny i 0,2 ml rozcieńczonego preparatu enzymatycznego (=100ml pektyny + 1ml roztworu enzymu) ilość g preparatu w 1 ml rozcieńczonego roztworu enzymu jest równoznaczna z jego stężeniem % w roztworze pektyny. Obliczam więc ilość g wyjściowego preparatu enzymatycznego w 1 ml użytego do reakcji roztworu enzymu. Do reakcji użyto 450 x rozcieńczonego preparatu enzymatycznego pektynazy.
![]()
CE = 0,005%
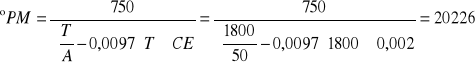
T - czas, w którym nastąpił właściwy spadeklepkości [s]
oPM - określają, w ilu litrach w 0,5% roztworu pektyny nastąpi spadek lepkości o 85% w ciągu 5 godzin w temperaturze 20oC pod działaniem 1 kg preparatu pektynolitycznego.
Wnioski:
Spadek lepkości jest wynikiem sumarycznego działania kompleksu enzymów pektynolitycznych zawartych w preparacie. Na podstawie oznaczenia ogólnej aktywności nie możemy określić, z jakimi konkretnie enzymami mamy do czynienia. Mogą to być pektynoesterazy, poligalakturonazy i liazy.
3.2. Oznaczanie aktywności poligalakturonazy metodą kolorymetryczną.
Wykonanie ćwiczenia:
Próba właściwa Ew
Do 0,5% roztworu pektyny w 0,01M buforze octanowym o pH 3,8 dodajemy 0,5ml odpowiednio rozcieńczonego wodą enzymu ( pektopolu 4000x rozcieńczonego) i inkubujemy w czasie 10 minut w temperaturze 30ႰC. Po upływie tego czasu dodajemy 1ml DNS. Następnie mieszaninę umieszczamy we wrzącej łaźni wodnej na okres 5 minut. Po ostudzeniu mieszaniny w strumieniu bieżącej wody dodajemy 3ml wody destylowanej, mieszamy i odczytujemy absorbancję na fotokolorymetrze przy 530 nm wobec próby ślepej.
Ew = 0,475
Próba kontrolna Ek
Do 0,5% roztworu pektyny w 0,01M buforze octanowym o pH 3,8 dodajemy 1ml DNS i 0,5ml odpowiednio rozcieńczonego wodą enzymu. Dalej postępujemy tak samo jak dla próby właściwej.
Ek = 0
Obliczenia:
၄E = Ew - Ek = 0,475 - 0 = 0,475
Z krzywej wzorcowej wiadomo, że:
၄E = 0,1 - A=220 [ၭg/ml]
၄E = 0,475 - A
________________________
A = 1045 [ၭg/ml]
Obliczam aktywność poligalakturonazy:
![]()
Gdzie:
A - odczyt z krzywej wzorcowej [ၭg/ml]
rozc. - rozcieńczenie enzymu
t - czas reakcji enzymatycznej[min]
212 - masa 1 μmola kwasu D - galakturonowego [μg / μmol]
2 - przeliczenie na 1 ml enzymu
Ogólna aktywność pektynolityczna w ºPM |
Aktywność poligalakturonazy [ၭmol/ml*min] |
||
Pektopol |
Pektynaza |
Pektopol |
Pektynaza |
11179 |
|
2906 |
|
9377 |
39787 |
3373 |
4732 |
7662 |
20226 |
1826 |
4436 |
6339 |
|
1909 |
|
Wnioski:
Aktywność poligalakturonazy oznaczamy na podstawie przyrostu stężenia cukrów redukujących. Poligalakturonazy zawarte w obu preparatach hydrolizują wewnętrzne wiązania ၡ-1,4 w kwasie pektowym wytwarzając oligopoligalakturonidy, następuje przyrost stężenia cukrów redukujących. Większą aktywność poligalakturonazy wykazuje preparat „pektynaza”.
Większą ogólną aktywność pektynolityczna obserwujemy w przypadku pektynazy.
3.3. Oznaczenie aktywności pektynoesterazy
Wykonanie ćwiczenia:
Próba właściwa
Do zlewki o pojemności 200ml wlać 50ml roztworu pektyny w 0,1M NaCl ogrzanej do temperatury 30ႰC. Przy pomocy 0,1M NaOH doprowadzić pH pektyny do 4. Dodać 50ml wodnego roztworu preparatu pektynolitycznego podgrzanego do tej samej temperatury. Po wymieszaniu mieszaninę inkubować na łaźni wodnej o temperaturze 30ႰC w czasie 30 minut. Następnie za pomocą 0,1M NaOH doprowadzić pH mieszaniny do 7,5.
Zużycie ługu: V = 11[ml] + 13,7 [ml] = 24,7[ml]
Próba ślepa
W przygotowaniu próby ślepej postępujemy podobnie jak przy przygotowaniu próby właściwej tylko, że do roztworu pektyny należy dodać roztwór preparatu pektynolitycznego po uprzedniej inaktywacji przez ogrzanie we wrzącej łaźni wodnej w czasie 25 minut.
Zużycie ługu: V0 = 10,6 [ml]+ 6,3 [ml] = 16,9 [ml]
Obliczenie aktywności pektynoesterazy:
![]()
Gdzie:
V, Vo - ilość ml 0,1 M NaOH, zużytych na miareczkowanie grup karboksylowych, uwolnionych w próbach: właściwej (V) i ślepej (Vo)
100 - ilość mikrorównoważników wiązań estrowych, odpowiadająca 1 ml 0,1 M NaOH
t - czas hydrolizy [min]
v - ilość preparatu pektynolitycznego [ml]
Wnioski:
Aktywność pektynoesterazy oznacza się na podstawie ilości grup karboksylowych uwolnionych w wyniku enzymatycznej hydrolizy wiązania estrowego w pektynie. Można ją oznaczyć poprzez miareczkowanie roztworu pektyny poddanego działaniu enzymu w określonych warunkach pH, temperatury i po określonym czasie działania enzymu roztworem NaOH. Różnica w objętościach NaOH zużytych na odmiareczkowanie próby właściwej i ślepej odpowiada ilości ługu potrzebnej do związania uwolnionych w czasie reakcji grup karboksylowych.
Wyliczona aktywność pektynoesterazy wynosi 52 ![]()
2
Wyszukiwarka
Podobne podstrony:
Sprawozdanie aminokwasy, studia, bio, 3rok, 5sem, biochemia, laborki
ZEBRANE PYTANIA OD WACHOWICZA, studia, bio, 3rok, 5sem, technologia i analiza żywności, laborki
wymagania, studia, bio, 3rok, 5sem, technologia i analiza żywności, laborki
mikrobiologia laborki, studia, bio, 3rok, 5sem, mikrobiologia
TiAZ- produkcje, studia, bio, 3rok, 5sem, technologia i analiza żywności, wykład
w14, studia, bio, 3rok, 5sem, technologia i analiza żywności, wykład
Sprawko 7, studia, bio, 3rok, 6sem, biotechnologia, lab
TiAZ- pojecia nr1, studia, bio, 3rok, 5sem, technologia i analiza żywności, wykład
TiAZ- produkcje, studia, bio, 3rok, 5sem, technologia i analiza żywności, wykład
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie końcowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprawko 6 Rafała, studia, bio, 3rok, 6sem, biotechnologia, lab
sprEnzymyII, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Sprawko 31, studia, bio, 2rok, chemia fizyczna, laborki, 3-
sprawko 3 automatyka, studia, bio, 2rok, pomiary i automatyka, laborki
bialka spr(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprKwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
więcej podobnych podstron