Molekularne paliwo
Każda komórka dysponuje milionami miniaturowych silników tworzących siłę napędową dla jej procesów życiowych. Dzięki niej pompy molekularne mogą ustawicznie przepompowywać jony przez błonę komórkową, co jest gwarantem m.in. sprawnego działania układu nerwowego i mięśni.
W ciągu ostatnich 30 lat mniej więcej, co trzecia Nagroda Nobla z chemii przyznawana była nie „czystym" chemikom, lecz badaczom chemii życia, czyli biochemikom. Tak też stało się w 1997 roku, kiedy to Paul D. Boyer, 79-letni emerytowany profesor Uniwersytetu Kalifornijskiego w Los Angeles (USA), John E. Walker (56 lat) z Laboratorium Biologii Molekularnej Medical Research Council w Cambridge (Wielka Brytania) i Jens C. Skou (79 lat), emerytowany profesor Uniwersytetu w Aarhus (Dania), wyróżnieni zostali za badania procesów leżących u podstaw komórkowych przemian energetycznych, związanych z biosyntezą i wykorzystaniem związku chemicznego o nazwie adenozynotrifosforan, w skrócie ATP.
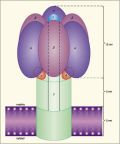
Ryc. 1. Schemat kompleksu enzymatycznego syntetyzującego ATP w mitochondriach (syntazy ATP). Kompleks osadzony jest na wewnętrznej stronie wewnętrznej błony mitochondrialnej. Centra katalityczne, z którymi wiążą się czasteczki ADP i kwasu fosforowego i gdzie zachodzi synteza ATP, znajdują się na podjednostkach b. Podjednostka g, zajmująca centralne położenie w kompleksie, zostaje wprawiona w ruch obrotowy przez strumień jonów H+ płynący przez część błonową kompleksu.
Aby zrozumieć istotę tych odkryć, wyjaśnijmy na początek znaczenie i rolę biologiczną tego związku. Cząsteczka ATP składa się z tzw. zasady azotowej adeniny, cukru rybozy i trzech połączonych szeregowo reszt kwasu fosforowego. Dla biochemika szczególnie interesujące są owe trzy reszty fosforanowe, a ściślej ostatnia z nich, bowiem jej odszczepieniu przy udziale wody, czyli hydrolizie, towarzyszy wyzwolenie znacznych ilości energii. Jeśli reakcja zachodzi w probówce, energia ta uwalnia się w postaci ciepła. Żywa komórka natomiast potrafi wykorzystać ją jako siłę napędową wszystkich prawie procesów życiowych, takich jak ruch i zmiana kształtu komórki, transport substancji przez błony komórkowe, a więc na przykład pobieranie składników pokarmowych i wydalanie produktów przemiany materii, i wreszcie wszystkie procesy syntez biologicznych potrzebnych m.in. dla wzrostu i rozmnażania się. Również dzięki energii wyzwolonej z ATP kurczą się mięśnie, nerwy przewodzą bodźce, a mózg... myśli.
O tym, jak znaczny jest to nakład energii, niech świadczy fakt, że dorosły człowiek w stanie spoczynku zużywa w ciągu doby około 40 kg ATP, przy czym ilość ta może wzrosnąć nawet kilkakrotnie na skutek wysiłku fizycznego. Tymczasem faktyczna zawartość ATP w naszym ciele wynosi kilkadziesiąt gramów. Wynika z tego, że intensywnemu zużyciu ATP musi towarzyszyć jego równie intensywne odtwarzanie, czyli resynteza. Za wyjaśnienie mechanizmów tej resyntezy wyróżnieni zostali dwaj pierwsi z wymienionych badaczy, Paul D. Boyer i John E. Walker.
Fot. 1. Fragment komórki wątroby. Zdjęcie z mikroskopu elektronowego pokazujące trzy przekroje mitochondriów. Widoczne są dwie błony otaczające każdą organellę. Błona wewnętrzna tworzy wypustki do wnętrza mitochondrionu. Z pracowni autora
Skoro hydrolizie ATP towarzyszy wyzwolenie energii, to proces odwrotny może zajść tylko w przypadku dostarczenia, co najmniej takiej samej, a w istocie znacząco większej jej ilości. Od kilkudziesięciu lat wiemy, że zapewniają to przede wszystkim reakcje utleniania biologicznego, czyli oddychania komórkowego. Zachodzą one w wewnątrzkomórkowych organellach, mitochondriach, tak małych, że strukturę ich poznaliśmy dopiero dzięki mikroskopowi elektronowemu (fot. 1). Pozostawało tajemnicą, w jaki sposób przekształcone substancje pokarmowe, ulegając „spaleniu" w komórkach naszego ciała, dostarczają energii umożliwiającej resyntezę ATP z produktów jego rozpadu, czyli adenozynodifosforanu, w skrócie ADP, i kwasu fosforowego w procesie zwanym oksydacyjną fosforylacją.
Do wyjaśnienia tej zagadki znacznie przybliżyły nas badania Petera Mitchella (Wielka Brytania) i Efraima Rackera (USA). Ten pierwszy wykazał, że w wyniku oddychania komórkowego na wewnętrznej błonie mitochondriów powstaje potencjał elektryczny, a wnętrze mitochondriów ulega alkalizacji, czyli pojawia się nadmiar jonów OH w stosunku do jonów H+. To właśnie oraz różnica stężenia jonów H+ po obu stronach błony dostarczają energii dla syntezy ATP. Za badania te Mitchell został wyróżniony Nagrodą Nobla w 1978 roku. Racker natomiast zidentyfikował w błonie mitochondriów enzym katalizujący tę syntezę. Jest on dużym kompleksem białkowym, składającym się z kilkunastu mniejszych peptydowych podjednostek (ryc. 1). Strumień jonów H+ wywołany potencjałem elektrycznym i różnicą ich stężeń po obu stronach błony, przepływając przez wnętrze tego kompleksu, pobudza go do „pracy", czyli do produkcji ATP.
Wiedzieliśmy już, zatem, gdzie synteza ATP zachodzi, i co bezpośrednio dostarcza jej energii. Pozostawało do wyjaśnienia, jak ten proces przebiega. Zadania tego podjął się jeden z ubiegłorocznych laureatów Nagrody Nobla, Paul D. Boyer. Badając przy użyciu radioaktywnych izotopów fosforu i tlenu zarówno syntezę ATP, jak i jego hydrolizę oraz stosując syntetyczne analogi ATP i ADP, które wiązały się z enzymem, lecz nie ulegały dalszym reakcjom chemicznym, Boyer sformułował tzw. teorię konformacyjną.
Zgodnie z nią, proces syntezy odbywa się etapowo. Najpierw do odpowiedniego miejsca katalitycznego enzymu przyłącza się cząsteczka ADP i kwasu fosforowego. W następnym etapie zachodzi zmiana kształtu enzymu, tzw. zmiana konformacji, prowadząca do odpowiedniego zbliżenia obu mających ze sobą przereagować cząsteczek, co niejako wymusza ich chemiczne połączenie i utworzenie ATP. Powstała w ten sposób cząsteczka ATP pozostaje jednak dalej związana z białkiem kompleksu enzymatycznego. Aby ją odczepić, konieczna jest dalsza zmiana struktury enzymu, a więc następna zmiana konformacji. Powoduje ona powrót do stanu wyjściowego, to jest takiego, przy którym możliwe staje się przyłączenie następnej cząsteczki ADP i kwasu fosforowego, po czym cykl zaczyna się od nowa. Zgodnie z tą teorią, energia potrzebna do syntezy, ATP zużywa się nie tyle w samej reakcji chemicznego wiązania ADP z kwasem fosforanowym, co w procesie zmiany kształtu cząsteczki kompleksu enzymatycznego, a także, co ciekawe w odłączeniu już powstałego ATP od enzymu.
Teoria Boyera, sformułowana już na przełomie lat sześćdziesiątych i siedemdziesiątych, stanowiła bodziec do dalszych badań zmian konformacyjnych enzymu na poziomie molekularnym. Wyróżniał się w nich zespół kierowany przez Johna E. Walkera. Znając skład i kolejność aminokwasów w łańcuchach peptydowych poszczególnych podjednostek syntazy ATP, Walker zbudował przestrzenny model enzymu, co pozwoliło mu dokładnie przyjrzeć się kształtowi jego głównych elementów. Stwierdził następnie, że kształt ten ulega zmianie wtedy, gdy do odpowiednich centrów katalitycznych enzymu przyłączają się cząsteczki ADP lub ATP.
Badania te, prowadzone najnowocześniejszymi metodami „podglądania" molekuł, jak spektrofluorymetria, rentgenowska analiza krystalograficzna i mikroskopia elektronowa w niskich temperaturach, nie tylko potwierdziły teorię konformacyjną Boyera, ale ponadto pokazały niejako naocznie, na czym te zmiany konformacyjne polegają.
Okazało się mianowicie, że w czasie przepływu jonów, H+ przez enzym, (co, jak powiedzieliśmy wcześniej, wynika z różnicy potencjałów elektrycznych po obu stronach błony mitochondrialnej) centralna podjednostka enzymu, oznaczana literą g, zostaje wprawiona w ruch obrotowy. Ponieważ jest ona asymetryczna, jej wirowanie powoduje odpowiednie odkształcenia w otaczających ją podjednostkach b, co jest istotą zaproponowanych przez Boyera zmian konformacyjnych. W wyniku tego zasocjowane z podjednostkami b cząsteczki ADP wiążą się chemicznie z kwasem fosforowym, dając ATP. Obrazowo, choć może niezbyt ściśle, można by porównać cały ten system z turbiną wodną. Tak jak w turbinie strumień wody wprawia w ruch obrotowy wirnik turbiny, a ten z kolei napędza generator prądu elektrycznego, tak w błonie mitochondrialnej strumień jonów H+ powoduje wirowy ruch podjednostki g, co jest źródłem energii dla syntezy ATP.
Prace trzeciego z ubiegłorocznych laureatów, Jensa C. Skou, przyczyniły się do rozwikłania mechanizmu jednego z głównych procesów zużywających ATP, a mianowicie utrzymywania na stałym poziomie wewnątrzkomórkowego stężenia jonów sodu i potasu. W tym miejscu należy przypomnieć, że zawartość tych dwóch podstawowych kationów nieorganicznych w komórce zwierzęcej jest nie tylko stała, ale zasadniczo różna od ich zawartości w środowisku pozakomórkowym. O ile w komórce przeważa jon potasowy (K+), to w cieczach pozakomórkowych, takich jak krew, limfa i inne, głównym kationem jest jon sodowy (Na+). A zatem na błonie komórkowej utrzymuje się gradient stężeń tych dwóch kationów. Jest on niezbędny do prawidłowego funkcjonowania komórki. W tkance nerwowej stanowi źródło powstawania i przenoszenia bodźców, w mięśniu umożliwia zaistnienie skurczu, w innych komórkach niezbędny jest do pobierania substancji pokarmowych, jak aminokwasy i glukoza.
Wszystkie te procesy, zwiększając przewodnictwo błony komórkowej dla tych dwóch kationów, doprowadziłyby bardzo szybko do wyrównania stężeń Na+ i K+ między wnętrzem komórki i środowiskiem zewnętrznym, co nieuchronnie pociągnęłoby za sobą zanik wszelkich funkcji komórki i jej śmierć. Dlatego tak ważną życiową funkcję spełnia mechanizm enzymatyczny utrzymujący gradient tych jonów. Polega on na stałym wypompowywaniu z komórki napływających do niej jonów Na+ i wprowadzaniu do komórki uciekających z niej jonów K+. Oba procesy odbywają się wbrew gradientowi stężeń i dlatego wymagają nakładu energii. Dostarcza jej ATP, a ściślej hydroliza tego związku do ADP i kwasu fosforowego. O intensywności procesu niech świadczy fakt, że zużywa on około jednej trzeciej całego ATP syntetyzowanego przez organizm człowieka w stanie spoczynku.
Odkrycie białka transportującego poprzez błonę komórkową jony K+ i Na+ i wyjaśnienie mechanizmu jego działania stało się udziałem Jensa C. Skou. Białko to okazało się identyczne z enzymem występującym w błonie otaczającej komórkę zwierzęcą i hydrolizującym ATP w obecności jonów Na+ i K+. Hydrolizie tej towarzyszy transport Na+ z wnętrza komórki do przestrzeni zewnętrznej, a jonów K+ w kierunku przeciwnym. Dalsze badania pozwoliły wyjaśnić molekularny mechanizm tego procesu.
Ryc. 2. Schemat działania pompy sodowo-potasowej w błonie plazmatycznej komórki zwierzęcej. Objaśnienie w tekście. Reprodukcja z podręcznika Textbook of Biochemistry T.M. Devlina za zgodą wydawcy Wiley Liss, New York
Wykazały one, że białko enzymatyczne ulega pod wpływem ATP fosforylacji, tzn. reszta kwasu fosforowego odszczepiona od ATP przyłącza się do białka. Ta reakcja powoduje zmianę kształtu cząsteczki białkowej, przez co jony Na+ uprzednio związane z białkiem odczepiają się, a na ich miejsce przyłączają jony K+. Następnie grupa fosforanowa odłącza się od enzymu, co sprawia, że z kolei jony K+ odczepiają się, a przyłączają jony Na+ (ryc. 2). Na skutek zmiany konformacji cząsteczki białkowej odłączenie jonów zachodzi po przeciwnej stronie błony niż ich przyłączenie, co prowadzi do ich przemieszczenia, każdego w inną stronę, poprzez błonę komórkową.
Wspólnym momentem w badaniach wszystkich trzech uczonych jest nowe spojrzenie na cząsteczkę enzymu biorącego udział w procesach energetycznych jako swojego rodzaju „silnik molekularny". Dotyczy to zarówno przypadku, kiedy to energia strumienia jonów wodorowych (H+) przekształca się w energię wiązania chemicznego, jak to ma miejsce w syntezie ATP, jak i sytuacji, gdy energia chemiczna hydrolizy ATP zostaje wykorzystana do aktywnego transportu jonów, jak w przypadku pompy sodowo-potasowej.
Wyszukiwarka
Podobne podstrony:
NEANDERTALCZYK MOLEKULARNY, NAUKA, WIEDZA
GAZ ZIEMNY-PALIWOWA PRZYSZŁOŚĆ, NAUKA, WIEDZA
MEZOZOICZNE NIESPODZIANKI, NAUKA, WIEDZA
Długi wstęp, NAUKA, WIEDZA, Bazy danych
WIRUS OPRYSZCZKI NIEBEZPIECZNY W PÓŹNEJ CIĄŻY, NAUKA, WIEDZA
PLANETY SIĘ BRONIĄ, NAUKA, WIEDZA
EFEKT GREJPFRUTA WYJAŚNIONY, NAUKA, WIEDZA
SPOSÓB NA KRWIOPIJCĘ, NAUKA, WIEDZA
SPEKTROFOTOMETRYCZNE OZNACZENIE ŻELAZA W POSTACI TIOCYJANIANU ŻELAZA, NAUKA, WIEDZA
ASTRONAUTÓW OCALIŁ DŁUGOPIS, NAUKA, WIEDZA
DIALOG I SPOTKANIE JAKO MECHANIZMY KSZTAŁTOWANIA WARTOŚCI, NAUKA, WIEDZA
LUDZKA WYJĄTKOWOŚĆ, NAUKA, WIEDZA
ELEMENTY KATALIZY, NAUKA, WIEDZA
POWRÓT LODOWCÓW, NAUKA, WIEDZA
KLONOWANIE, NAUKA, WIEDZA
SPRAWNY SAMOCHÓD ALE CZY SPRAWNY KIEROWCA, NAUKA, WIEDZA
PAMIĘĆ NA ŻYCZENIE, NAUKA, WIEDZA
POLSKA LUDOWA 1944-1989, NAUKA, WIEDZA
LEGENDY MOTORYZACJI, NAUKA, WIEDZA
więcej podobnych podstron