Paytrycja Krzaczyńska 10
197834
Biotechnologia
wtorek 815-1200
Ćwiczenie 38
Oznaczanie ciepła parowania
1. Cel ćwiczenia:
Celem ćwiczenia jest obliczenie ciepła parowania na podstawie temperaturowej zależności prężności cieczy.
2. Wstęp teoretyczny
Ciepło parowania- ilość energii potrzebnej do odparowania jednostki masy danej substancji, przy stałym ciśnieniu i temperaturze. W układzie SI jednostką ciepła parowania jest J/kg. Stosuje się też jednostkę J/Mol. Ciepło parowania zależy silnie od ciśnienia (temperatury) zmiany stanu skupienia, malejąc wraz ze wzrostem temperatury i osiągając 0 w punkcie krytycznym.
Równanie ogólne Clausiusa opisuję równowagę fazową w układach jednoskładnikowych, czyli współistnienie dwóch lub trzech faz jednego składnika.
Gdzie:
- entalpia przemiany;
- temperatura przemiany;
- zmiana objętości przemiany
Równanie Claudiusa opisujące równowagę pomiędzy fazą skondensowaną, ciałem stałym lub cieczą a fazą gazową można przekształcić uwzględniając znaczne różnice w objętości molowych składników.
Można przyjąć że para spełnia równanie stanu gazu doskonałego gdyż ciśnienie pary w równowadze z cieczą jest małe.
Uwzględniając te 2 zależności otrzymujemy
Można przyjąć że dal niewielkiego zakresu temperatur
jest stała i nie zależy od temperatury, wówczas po scałkowaniu powyższego równani otrzymamy
Z równania wynika że mierząc prężność cieczy pc w różnych temperaturach T można obliczyć entalpię parowania ΔHpar
3. Tabela pomiarowa
t(°C) |
T(K) |
h1(mmHg) |
H2(mmHg) |
pc=h2-h1 |
103/T |
lnpc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Część doświadczalna:
Przy temperaturze pokojowej 24,9oC za pomocą katetometru wykonałam trzy pomiary poziomu rtęci w ramionach manometru i zanotowałam jako wartości h1 i h2. . Następnie włączyłam termostat zanurzeniowy i ustawiłam termometr kontaktowy na najniższą temperaturę z ustalonego zakresu. Po 15 minutach dokonałam pomiaru poziomu rtęci i zwiększyłam temperaturę o ok.3oC. Kolejne pomiary odbywały się co 10minut. Wyniki zebrałam w tabeli.
5. Opracowanie wyników:
Wykres zależności logarytmu z różnic pozimów rtęci (p) od 103 /T dla toluenu.
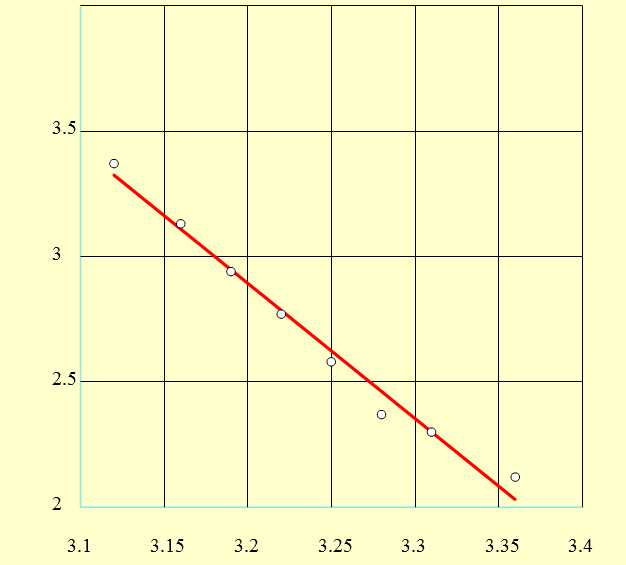
Równanie prostej:
y= -5,3888x + 20,1371
Współczynnik załamania światła odpowiada współczynnikowi kierunkowemu prostej i wynosi:
a= -5,3888[K]
Δa=0,2811[K]
a±Δa=(-5,39±0,28)[K]
Obliczam entalpie parowania korzystając ze wzoru:
Gdzie,
R= 8,314
( stała gazowa)
a1= a*103 (współczynnik kierunkowy)
ΔHpar = -(- 5,39* 103) * 8,314
Δhpar= 44,81
Obliczam błąd względny oznaczenia:
gdzie:
x-wartość doświadczalna entalpii parowania.
xt- wartość teoretyczna entalpii parowania.
δ = Δx= 35,30%
Wnioski:
Określona przeze mnie wartość entalpii parowania wynosi ΔHpar= 44,81
. Różni się ona znacznie od literaturowej równej ΔHpar= 33,12
. Błąd pomiaru wynosi 35,30%, może on wynikać z niedokładności odczytu temperatury, bądź wysokości słupa rtęci w ramionach manometru.
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 36 Patrycja, laboratorium chemia fizyczna
sprawozdanie - Entalpia zobojętniania, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, L
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
sprawozdanie nr 2 (2), II rok, chemia fizyczna
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
Ćwiczenie 2 - liczby przenoszenia i ruchliwosc jonow, Biotechnologia PWR, Semestr 3, Chemia fizyczna
badanie równowag fazowych, Chemia fizyczna, laboratorium, Chemia fizyczna
wyznaczanie współczynników aktywności z pomiarów sem, Chemia fizyczna, laboratorium, Chemia fizyczna
wpływ ph na pęcznienie żelatyny, Chemia fizyczna, laboratorium, Chemia fizyczna
współczynnik podziału, Chemia fizyczna, laboratorium, Chemia fizyczna
efekt solny Brönsteda, Chemia fizyczna, laboratorium, Chemia fizyczna
Zależność stałej równowagi reakcji od temperatury sprawozdanie, Politechnika Poznańska, Laboratorium
sprawozdanie nr 1, II rok, chemia fizyczna
42Pati, laboratorium chemia fizyczna
Ćw 36 1, laboratorium chemia fizyczna
ogniwo Clarka, Chemia fizyczna, laboratorium, Chemia fizyczna
więcej podobnych podstron